Význam testování termických prahů v detekci neuropatie tenkých vláken u diabetiků 1. typu
The Importance of Thermal Threshold Testing in Detecting of Small Fiber Neuropathy in Type 1 Diabetes Mellitus
Background:
Thermal threshold testing represents an integral part of neurophysiological diagnostics of small fiber neuropathy. Diabetes mellitus is the most common cause of SFN. The aim of our study was to evaluate changes of thermal thresholds depending on the duration of diabetes.
Material and methods:
45 patients with type 1 diabetes mellitus (27 women, 18 men, mean age 45,1 years) were enrolled in the study. The group was divided into two subgroups according to the duration of diabetes (≤ 25 years, > 25 years). We used a thermal stimulator (Somedic) and determined cold detection thresholds (CDT) and warm detection thresholds (WDT) in thenar, tibia and dorsum of the foot. Non-randomized method of reaction time was used as an investigative algorithm.
Results:
We demonstrated a statistically significant difference between the thermal thresholds in lower extremities/tibia (CDT p < 0.001, WDT p = 0.002), dorsum of the foot (CDT, WDT p < 0.001). In diabetics, CDTs are lower and WDTs are higher in comparison with controls. An abnormality of CDT occurs earlier and more frequently. We proved statistically significant difference for the mean values of CDT (p = 0.024) and for the mean values of WDT (p = 0.049) in the dorsum of the foot between the two subgroups. Linear regression demonstrated a statistically significant relationship between the thermal thresholds in the dorsum of the foot and the duration of diabetes and determined individual regression equations.
Conclusion:
Thermal threshold testing in the distal part of the leg appears to be a good screening tool for detection of small fiber neuropathy in type 1 diabetic patients, especially in diabetics with neuropatic symptoms and normal nerve conduction studies and needle electromyography.
Key words:
type 1 diabetes mellitus – small fiber neuropathy – cold detection threshold – warm detection threshold
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
V. Potočková 1; Š. Malá 2; A. Tomek 1; D. Baumgartner 1; R. Mazanec 1
Authors‘ workplace:
2. LF UK a FN v Motole, Praha
Neurologická klinika
1; 2. LF UK a FN v Motole, Praha
Interní klinika
2
Published in:
Cesk Slov Neurol N 2016; 79/112(6): 692-697
Category:
Original Paper
Overview
Úvod:
Testování termických prahů je nedílnou součástí neurofyziologické diagnostiky neuropatie tenkých vláken, jejíž nejčastější příčinou je diabetes mellitus. Hlavním cílem bylo stanovit, existují-li signifikantní rozdíly termických prahů mezi diabetiky 1. typu a kontrolní skupinou a zhodnotit vývoj termických prahů v závislosti na délce trvání diabetu.
Soubor a metodika:
Vyšetřeno bylo 45 diabetiků 1. typu (27 žen, 18 mužů, průměrný věk 45,1 let). Soubor jsme rozdělili do dvou skupin podle doby trvání diabetu do 25 let a nad 25 let. Termické prahy byly stanoveny teplotním stimulátorem firmy Somedic na horních a dolních končetinách metodou „Limity“.
Výsledky:
Mezi kontrolní skupinou a diabetiky byl prokázán statisticky významný rozdíl mezi termickými prahy na dolních končetinách/ tibie (práh pro detekci chladu: p < 0,001, práh pro detekci tepla: p = 0,002), nárt (prahy pro detekci chladu, tepla: p < 0,001). Mezi dvěma podskupinami diabetiků jsme zjistili statisticky významný rozdíl pro průměrné hodnoty prahů v oblasti nártu (chlad: p = 0,024, teplo: p = 0,049). Prokázán byl statisticky významný vztah mezi hodnotami termických prahů na nártu a délkou trvání diabetu, stanoveny byly jednotlivé regresní rovnice.
Závěr:
Pro skríningové vyšetření má význam vyšetřovat termické prahy zejména distálně na dolních končetinách v situacích, kdy diabetik popisuje neuropatické symptomy a elektromyografické vyšetření neprokazuje abnormitu.
Klíčová slova:
diabetes mellitus 1. typu – neuropatie tenkých vláken – termický práh pro detekci chladu – termický práh pro detekci tepla
Úvod
Kvantitativní stanovování termických prahů pro teplo a chlad pomocí teplotního stimulátoru je jednoduchá neinvazivní metoda, která umožňuje testovat funkci tenkých nervových vláken typu C a Aδ. Vlákna typu C se podílejí na vnímání teplých podnětů a jejich poškození se odráží v hodnotách termických prahů pro vnímání tepla (Warm Detection Threshold; WDT). Vlákna typu Aδ se účastní na vnímání chladových podnětů a jejich poškození se odráží v hodnotách termických prahů pro vnímání chladu (Cold Detection Threshold; CDT). Metoda je psychofyzikální, což znamená, že vyšetření vyžaduje velmi těsnou spolupráci pacienta, zatímco jednotlivé termické podněty jsou jasně definované fyzikální stimuly [1]. Je nedílnou součástí neurofyziologické diagnostiky neuropatie tenkých vláken (Small Fiber Neuropathy; SFN), která je definována jako strukturální abnormita tenkých nervových vláken s patologickou degenerací axonových terminál nervových vláken [2,3]. SFN je standardními elektrofyziologickými metodami (kondukční studie, jehlová EMG) nedetekovatelná. Těmito v praxi běžně používanými metodami lze stanovit pouze poškození silných nervových vláken typu Aδ. Celosvětově je nejčastější příčinou SFN diabetes mellitus 1. i 2. typu (Type 1 Diabetes Mellitus; T1DM; Type 2 Diabetes Mellitus; T2DM) [4]. V České republice mezi další časté příčiny patří hypercholesterolemie a chronický etylizmus [5]. V praxi používaná diagnostická kritéria SFN jsou založena na přítomnosti alespoň dvou abnormálních výsledků z následujících tří parametrů:
- klinické známky poškození tenkých nervových vláken na dolní končetině (DK),
- abnormální termické prahy pro chlad a/ nebo pro teplo na DK pomocí kvantitativního testování,
- snížená intraepidermální hustota tenkých nervových vláken v kožní biopsii z distální části DK [6].
Stanovení termických prahů je součástí kvantitativního testování senzitivity (Quantitative Sensory Testing; QST) a protokolu DFNS (German Research Network on Neuropathic Pain) [7]. První články o kvantitativním testování termických prahů byly publikovány v 70. letech 20. století [8,9]. Přesto u nás stále nepatří mezi rutinně používanou elektrofyziologickou metodu. Důvodem je poměrně vysoká pořizovací cena přístroje a nízká informovanost o existenci metodiky. Dříve provedené studie zjistily, že s délkou trvání T1DM postupně narůstají prahové hodnoty pro detekci tepla (WDT) a klesají prahové hodnoty pro detekci chladu (CDT). Vysoce senzitivním parametrem pro poruchu termického čití je dle některých autorů rozdíl mezi WDT a CDT tzv. Temperature Sensitivity Limen (TSL) [10], přičemž časnější a častější je abnormita CDT [11].
Cílem naší práce bylo zhodnotit:
- existují-li signifikantní rozdíly termických prahů mezi diabetiky 1. typu a kontrolní skupinou;
- změnu termických prahů v závislosti na délce trvání diabetu;
- význam vyšetření horní končetiny (HK) v rámci skríningového testu k detekci SFN, když převážná většina neuropatií u diabetu je tzv. length dependent, tedy závislá na délce nervu [4];
- senzitivitu CDT a WDT pro detekci termické poruchy čití.
Soubor a metodika
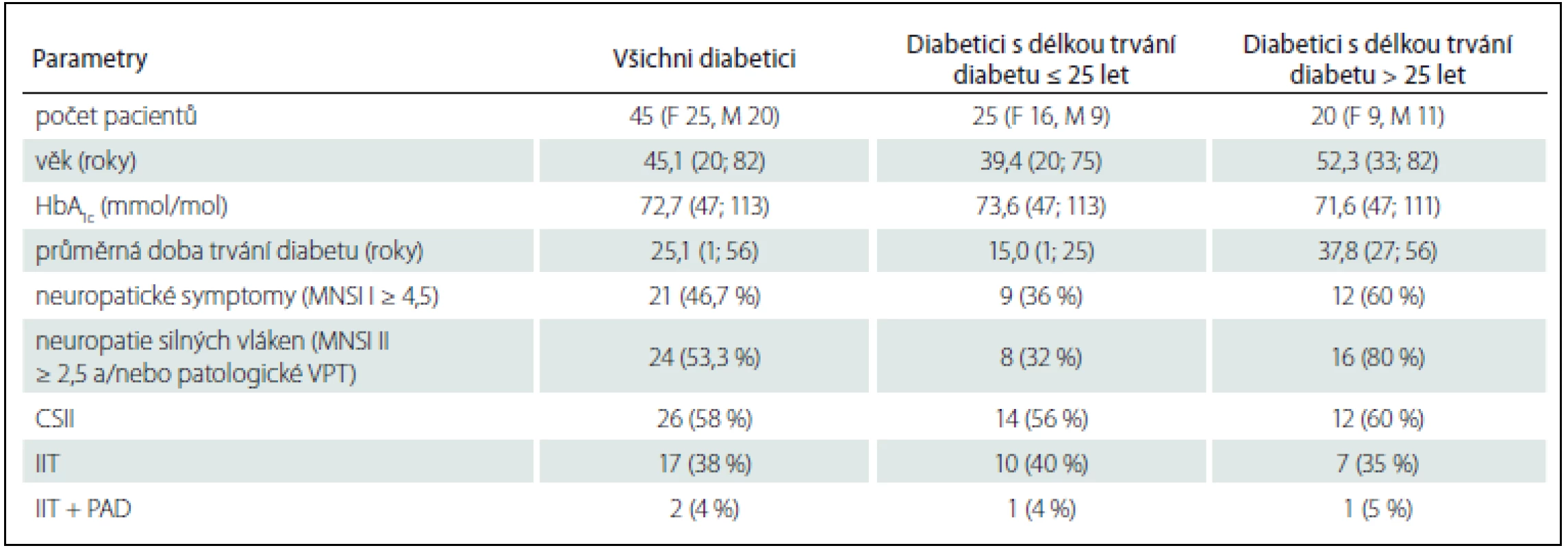
Do studie bylo zařazeno 45 diabetiků 1. typu (27 žen, 18 mužů). Průměrný věk pacientů byl 45,1 let v rozmezí od 20 do 82 let, průměrná délka trvání diabetu od stanovení diagnózy byla 25,1 let v rozmezí od 1 do 56 let, průměrná hodnota glykovaného hemoglobinu v době vyšetření byla 72,7 mmol/ mol v rozmezí od 47 mmol/ mol do 113 mmol/ mol, kdy cut-off hodnota je 42,00 mmol/ mol. Neuropatické symptomy (Michigan Neuropathy Screening Instrument I; MNSI I ≥ 4 body) [12] vykazovalo 21 (46 %) pacientů a poškození silných nervových vláken (Michigan Neuropathy Screening Instrument II; MNSI II ≥ 2,5 bodu a/ nebo patologické hodnoty vibračních prahů na distálním článku palce DK – použita normativní data České diabetologické společnosti) [12,13] zachyceno u 24 (53,3 %) diabetiků.
Ve sledovaném souboru je 26 pacientů léčeno inzulinovou pumpou, zbylých 19 diabetiků na intenzifikovaném inzulinovém režimu. Vylučujícím kritériem pro zařazení do studie byly komorbidity ovlivňující funkci periferního nervového systému, které by vedly k periferní neuropatii.
Soubor jsme rozdělili do dvou skupin podle délky trvání diabetu od stanovení diagnózy, kdy hranicí byla délka trvání do 25 let vč. a nad 25 let. Toto kritérium jsme zvolili na základě recentní práce Zieglera et al [14]. Základní charakteristiky souboru vč. hodnot HbA1c a terapie diabetu shrnuje tab. 1. Sledovaní pacienti jsou pravidelně dispenzarizováni na diabetologii Interní kliniky 2. LF UK a FN v Motole, Praha. Vyšetření termických prahů proběhlo v Laboratoři klinické neurofyziologie Neurologické kliniky 2. LF UK a FN v Motole mezi roky 2013 a 2015. Všichni pacienti podepsali před zařazením do studie informovaný souhlas s vyšetřením. Vyšetření bylo provedeno při kožní teplotě nad 32 °C na obou nártech, která byla měřena pomocí digitálního kontaktního teploměru (Lékařská elektronika, MU Dr. Pavel Čelakovský).
Jednotlivé termické prahy jsme vyšetřili pomocí teplotního stimulátoru SENSELab – TERMOTEST MSA od firmy Somedic s termodou o kontaktní ploše 25 × 50 mm vyrobenou z nealergického stříbra (obr. 1). Stanovovali jsme termické prahy pro detekci tepla (WDT) a pro detekci chladu (CDT) celkem na šesti místech. Měření proběhlo na thenaru, tibii (bérci) a na nártu bilaterálně. Jako vyšetřovací algoritmus jsme použili nerandomizovanou metodu reakčního času „Limity“. Termoda se v tomto případě z výchozí adaptační teploty 32 °C nejprve pětkrát po sobě ochlazuje a následně pětkrát po sobě otepluje rychlostí 1 °C/ 1 s. Po každém termickém stimulu se teplota termody vrací zpět na výchozí adaptační teplotu 32 °C. Mezi jednotlivými stimuly je časová prodleva 4– 6 s, která je softwarem náhodně vybrána. Pacient je instruován, že pokud ucítí změnu teploty ve smyslu plus nebo minus vzhledem k výchozí teplotě, musí co nejrychleji stisknout tlačítko na zařízení podobné propisovací tužce, které po celou dobu vyšetření drží v ruce. Teplotní práh je následně určen jako průměrná hodnota z daných pěti pokusů.

Naměřené hodnoty tepelných prahů byly porovnány s našimi normativními daty, která byla získána v průběhu roku 2014 v souboru 50 zdravých kontrol (25 mužů, 25 žen, pět osob v každé věkové dekádě od 20 do 70 let vč.). Vylučovací kritéria kontrol zahrnovala absenci nejčastějších příčin SFN v populaci České republiky, tj. DM, hyperlipidemii, chronický etylizmus [5] a jiných známek poškození periferního či centrálního nervového systému (cerebrovaskulární, autoimunitní, infekční, metabolické a toxické).
Poškození silných nervových vláken jsme hodnotili pomocí dotazníků MNSI I, II a stanovením vibračních prahů na distálním článku palce obou DK za použití Biothesiometru – Vibratron II. Vyšetřovací algoritmus a normativní data jsme převzali z doporučených postupů diagnostiky diabetické neuropatie České diabetologické společnosti [13].
Statistická analýza
Porovnání parametrů jednotlivých definovaných podskupin souboru bylo provedeno s využitím χ2-testu, T-testu a Mannova-Whitneyova U testu podle charakteru proměnných. Pro stanovení vztahu termických prahů a délky trvání diabetu byla použita vícerozměrná regresní analýza. Výsledky byly považovány za statisticky signifikantní v případě p < 0,05. Statistické analýzy byly provedeny v softwaru GraphPad Prism, v.6.0 (GraphPad Software, La Jolla, California, USA) a IBM SPSS Statistics 23 (IBM Corporation, Armonk, New York, USA).
Výsledky
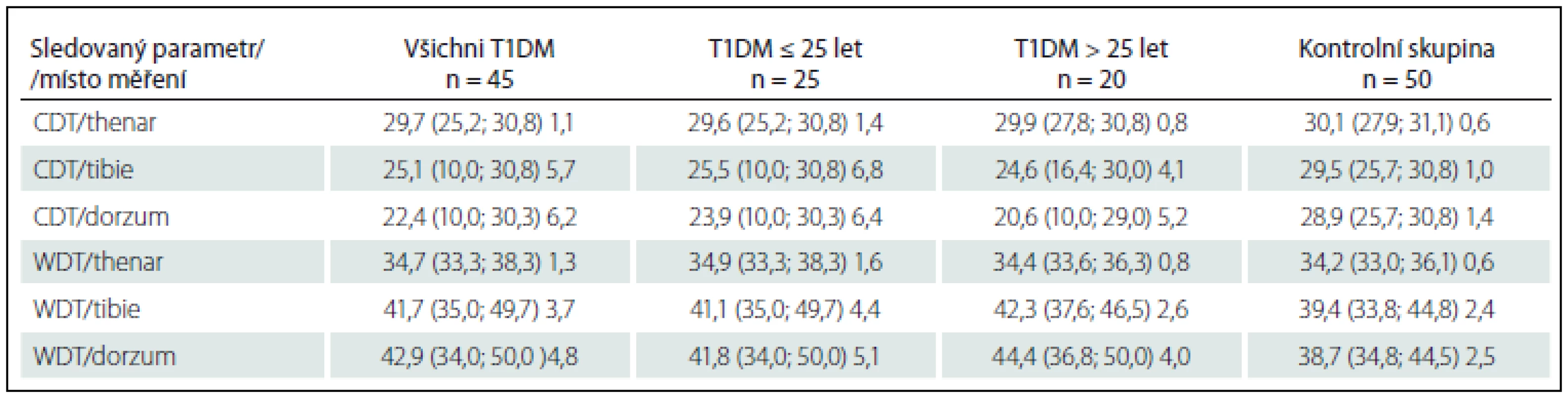
Vyšetření dokončili všichni zařazení pacienti. Skupina diabetiků a kontrol se shoduje věkem (p = 0,768) i pohlavím (p = 0,41). Mezi kontrolní skupinou a diabetiky jsme prokázali statisticky významný rozdíl mezi termickými prahy pro obě tepelné modality pouze na DK, a to jak v oblasti tibie (CDT p < 0,001; WDT p < 0,002), tak na nártu (CDT, WDT p < 0,001).
Dále jsme prokázali, že s délkou trvání diabetu postupně narůstají termické prahy pro detekci tepla (regresní koeficient 1,018 °C/ rok, 95% CI 0,226– 1,811; p = 0,013) a naopak postupně klesají termické prahy pro detekci chladu (regresní koeficient – 0,809 °C/ rok, 95% CI – 1,420 až – 0,199; p = 0,011) (graf 1).

Věk pacientů ve vícerozměrném regresním modelu nevyšel ve srovnání s délkou trvání diabetu jako statisticky významný prediktor termických prahů (p = 0,11 pro CDT a p = 0,08 pro WDT, obojí pro oblast nártu).
Zjistili jsme, že v souboru diabetiků je časnější abnormita pro CDT. Jako cut-off prahy jsme použili hodnoty naměřené u kontrolní skupiny na nártu. Pro WDT jsme vzali 95. percentil, což odpovídá hodnotě 44,1 °C, pro CDT naopak 5. percentil, což odpovídá hodnotě 26,2 °C.
Lineární regresí jsme prokázali statisticky významný vztah mezi CDT na nártu a roky trvání diabetu, F (1, 43) = 7, 154; p = 0,011, vysvětlující 14,3 % variability. Tento vztah jsme formulovali regresní rovnicí: délka trvání T1DM = 43,257 + (– 0,809 × CDT na nártu), tj. pro CDT 5. percentil 26,2 °C = 43,257 + (– 21,1958) = 22,0612 let. To znamená, že u diabetiků začínají nabývat CDT v oblasti nártu patologických hodnot přibližně po 22 letech od stanovení diagnózy. Obdobně jsme stanovili statisticky významný vztah mezi WDT na nártu a roky trvání diabetu, F (1, 43) = 6,710; p = 0,013, vysvětlující 13,5 % variability. Formulovali jsme opět regresní rovnici: délka trvání T1DM = – 18,613 + (1,018 × WDT na nártu), tj. pro WDT 95. percentil 44,1 °C = – 18,613 + (1,018 × 44,1) = 26,28 let.
Což znamená, že u diabetiků začínají nabývat WDT v oblasti nártu patologických hodnot přibližně po 26 letech od stanovení diagnózy.
Dále jsme stanovili Temperature Sensitivity Limen (TSL), který reprezentuje výše zmiňovaný rozdíl mezi WDT a CDT. Signifikantní rozdíl tohoto parametru jsme zjistili mezi kontrolní skupinou a skupinou všech diabetiků pouze v oblasti nártu (p < 0,001), ale nikoli mezi skupinami diabetiků rozdělených dle délky trvání diabetu (p = 0,12) (graf 2). V těchto dvou skupinách jsme však stanovili statisticky významný rozdíl pro průměrné hodnoty CDT (p = 0,024) i pro WDT (p = 0,049) na nártu. V oblasti thenaru ani tibie rozdíl nebyl významný. Naměřené hodnoty CDT, WDT u diabetiků a kontrolní skupiny shrnuje tab. 2.

Diskuze a závěr
Naše studie prokázala významné rozdíly v hodnotách termických prahů (tj. CDT, WDT i TSL) mezi skupinou diabetiků a kontrol, avšak pouze na DK. Čím distálněji na DK bylo měření provedeno, tím byl rozdíl mezi skupinami signifikantnější. Mezi podskupinami diabetiků rozdělených dle délky trvání diabetu jsme prokázali signifikantní rozdíl WDT i CDT pouze v oblasti nártu. Tyto výsledky podporují teorii, že poškození tenkých nervových vláken u T1DM je závislé na délce nervového vlákna, tedy tzv. lenght dependentní [4], a proto je relevance vyšetření prahů na HK u diabetiků v rámci skríningového vyšetření nízká.
Podobně jako někteří autoři [10,14] jsme zjistili, že s délkou trvání diabetu narůstají abnormity pro termické prahy. Časnější a častější abnormitu tepelných prahů jsme prokázali pro vnímání chladových podnětů (CDT). Obdobné výsledky zjistily vědecké týmy Zieglera a Hendriksena [11,15]. Identický vývoj abnormit termických prahů pro detekci tepla i chladu v závislosti na délce trvání diabetu zjistili např. Vinik et al [16].
Určitou limitaci naší práce představuje skutečnost, že měření proběhlo jen jednorázově. V roce 2015 publikovaná práce Krøigårda et al však neprokázala statisticky významný rozdíl jednotlivých měření v odstupu 2– 26 týdnů od prvního měření [17]. V další práci, Vlčkové et al, sice zjistili intraindividuální variabilitu u dvou měření v průběhu jednoho týdne mezi 15 a 30 %, ale vzhledem k tomu, že vyšetřovací metoda je psychofyzikální, nepovažují tuto variabilitu za relevantní [18].
Testování termických prahů je jednoduché, časově nenáročné a u diabetiků 1. typu se jeví jako vhodný skríningový nástroj k detekci SFN. Citlivější a časnější abnormitou, vztaženo k délce trvání diabetu, je stanovení termického prahu pro vnímání chladu. Poněvadž je relevance měření prahů na HK u diabetiků nízká, má pro skríningové vyšetření význam stanovovat termické prahy zejména na obou nártech. Testování termických prahů lze doporučit pro klinické situace, kdy diabetik popisuje neuropatické symptomy na končetinách a standardně provedené elektromyografické vyšetření nevykazuje abnormní nález. Naše práce prokázala, že postižení tenkých vláken Aδ a C je pozdní komplikací T1DM a pomocí neurofyziologických metod lze detektovat abnormity pro termické čití přibližně za 22 let pro chladové podněty a za 26 let pro teplé podněty. Pro srovnání, u pacientů s T2DM lze zachytit abnormity termických prahů mnohem dříve od stanovení diagnózy než u diabetiků 1. typu. Příčinou je, že diabetici 2. typu mají většinou řadu dalších komorbidit (hypertriglyceridemie, arteriální hypertenze apod.), které vznik polyneuropatického syndromu urychlí nebo přímo způsobí. Názorným příkladem je práce Chao et al z roku 2007, ve které vyšetřili téměř 500 diabetiků 2. typu. Po 12 letech od stanovení diagnózy prokázali patologické hodnoty prahů pro vnímání tepla již u 60 % pacientů a patologické hodnoty prahů pro vnímání chladu u 40 % pacientů [19].
Práce byla podpořena OPPK CZ.2.16/ 3.1.00/ 24022 a MZ ČR RVO, FN v Motole 00064203.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Veronika Potočková
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: veronipot@gmail.com
Přijato k recenzi: 15. 3. 2016
Přijato do tisku: 23. 5. 2016
Sources
1. Shy ME, Frohman EM, So YT, et al. Quantitative sensory testing: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2003;60(6):898– 904. doi: 10.1212/ 01.WNL.0000058546.16985.11.
2. Hoeijmakers JG, Faber CG, Lauria G, et al. Small-fibre neuropathies – advances in diagnosis, pathophysiology and management. Nat Rev Neurol 2012;8(7):369– 79. doi: 10.1038/ nrneurol.2012.97.
3. Hovaguimian A, Gibbons CH. Diagnosis and Treatment of Pain in Small-fiber Neuropathy. Curr Pain Headache Rep 2011;15(3):193– 200. doi: 10.1007/ s11916-011-0181-7.
4. Lauria G, Merkies ISJ, Faber CG. Small fibre neuropathy. Curr Opin Neurol 2012;25(5):542– 9. doi: 10.1097/ WCO.0b013e32835804c5.
5. Bednarik J, Vlckova-Moravcova E, Bursova S, et al. Etiology of small-fiber neuropathy. J Peripher Nerv Syst 2009;14(3):177– 83. doi: 10.1111/ j.1529-8027.2009.00229.x.
6. Devigili G, Tugnoli V, Penza P, et al. The diagnostic criteria for small fibre neuropathy: from symptoms to neuropathology. Brain 2008;131(7):1912– 25. doi: 10.1093/ brain/ awn093.
7. Maier C, Baron R, Tölle TR, et al. Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS): somatosensory abnormalities in 1,236 patients with different neuropathic pain syndromes. Pain 2010;150(3):439– 50. doi: 10.1016/ j.pain.2010. 05.002.
8. Fruhstorfer H, Lindblom U, Schmidt WC. Method for quantitative estimation of thermal thresholds in patients. J Neurol Neurosurg Psychiatry 1976;39(11):1071– 5.
9. Dyck PJ, Zimmerman IR, O‘ Brien PC, et al. Introduction of automated systems to evaluate touch-pressure, vibration, and thermal cutaneous sensation in man. Ann Neurol 1978;4(6):502– 10.
10. Navarro X, Kennedy WR. Evaluation of thermal and pain sensitivity in type I diabetic patients. J Neurol Neurosurg Psychiatry 1991;54(1):60– 4.
11. Ziegler D, Mayer P, Gries FA. Evaluation of thermal, pain, and vibration sensation thresholds in newly diagnosed type 1 diabetic patients. J Neurol Neurosurg Psychiatry 1988;51(11):1420– 4.
12. Herman WH, Pop-Busui R, Braffett BH, et al. Use of the Michigan Neuropathy Screening Instrument as a measure of distal symmetrical peripheral neuropathy in Type 1 diabetes: results from the Diabetes Control and Complications Trial/ Epidemiology of Diabetes Interventions and Complications. Diabet Med 2012;29(7):937– 44. doi: 10.1111/ j.1464-5491.2012.03644.x.
13. Lacigová S, Rušavý Z, Jirkovská A, et al. Doporučený postup diagnostiky a léčby diabetické neuropatie. [online]. Dostupné z URL: http:/ / www.diab.cz/ standardy.
14. Ziegler D, Behler M, Schroers-Teuber M, et al. Near-normoglycaemia and development of neuropathy: a 24-year prospective study from diagnosis of type 1 diabetes. BMJ Open 2015;5(6):e006559. doi: 10.1136/ bmjopen-2014-006559.
15. Hendriksen PH, Oey PL, Wieneke GH, et al. Subclinical diabetic polyneuropathy: early detection of involvement of different nerve fibre types. J Neurol Neurosurg Psychiatry 1993;56(5):509– 14. doi: 10.1136/ jnnp.56.5.509
16. Vinik AI, Suwanwalaikorn S, Stansberry KB, et al. Quantitative measurement of cutaneous perception in diabetic neuropathy. Muscle Nerve 1995;18(6):574– 84.
17. Krøigård T, Sothynathan I, Sindrup SH. Intraindividual Variability and Long-Term Changes of Thermal Quantitative Sensory Testing. J Clin Neurophysiol 2015;32(4):352– 6. doi: 10.1097/ WNP.0000000000000193.
18. Vlčková-Moravcová E, Bednařík J. Počítačem asistované stanovení termického prahu. Cesk Slov Neurol N 2003;66/ 99(4):263– 9.
19. Chao CC, Hsieh SC, Yang WS, et al. Glycemic control is related to the severity of impaired thermal sensations in type 2 diabetes. Diabetes Metab Res Rev 2007;23(8):612– 20.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2016 Issue 6
Most read in this issue
- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Deprese u vybraných neurologických onemocnění
- Autoimunitní encefalitidy – kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
