Využití zolpidemu v neurorehabilitaci pacienta ve stavu minimálního vědomí – kazuistika
Zolpidem in Neurorehabilitation of Minimally Conscious Patient – a Case Report
Neurorehabilitation also has to address the needs of patients in minimally conscious state (MCS). Zolpidem, a short acting non-benzodiazepine hypnotic, has been shown to induce paradoxical responses in some patients with MCS. We assessed zolpidem-induced changes using PET (pozitron emission tomography) in a patient with traumatic brain injury. The patient had PET at baseline and then 24 hours later after administration of zolpidem 10 mg, followed by a radioactive substance. After zolpidem, we observed significantly more intensive activity in the healthy temporal cortex of the right hemisphere. We attempted to utilize this transitory patient activity for training of new skills during a 3-month physiotherapy and occupational therapy programme. However, no development was seen. Similar experience has been described by several authors but they all advocate further research in the mechanism of action of zolpidem and appropriate diagnosis of MCS patients who might profit from its use.
Key words:
minimally conscious state – zolpidem – positron emission tomography – neurorehabilitation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
K. Kotková 1; Y. Angerová 1; J. Kořenek 1; K. Kupka 2; O. Švestková 1
Authors‘ workplace:
Klinika rehabilitačního lékařství, LF UK a VFN v Praze
1; Ústav nukleární medicíny, LF UK a VFN v Praze
2
Published in:
Cesk Slov Neurol N 2016; 79/112(3): 347-350
Category:
Case Report
Overview
V neurorehabilitaci se setkáváme i s pacienty ve stavu minimálního vědomí (Minimally Conscious State; MCS), ve kterém je nutné využít veškeré možnosti rehabilitace vč. medikamentózní podpory. Zolpidem je krátkodobé nebenzodiazepinové hypnotikum. Byl pozorován jeho paradoxní povzbuzující efekt u pacientů s MCS. Zajímalo nás, zda tento efekt má i korelát v PET (pozitronové emisní tomografii). Pacient s vícečetným poškozením mozku byl poprvé vyšetřen za bazálních podmínek, po 24 hod dostal před podáním radiofarmaka 10 mg zolpidemu. Po jeho aplikaci byla statisticky významně zvýšena aktivita v nepoškozené horní temporální kůře pravé hemisféry. Pokoušeli jsme se využít přechodné aktivity pacienta k nácviku nových dovedností, ale během tří měsíců, kdy měl pravidelné terapie, se nám nepodařilo dosáhnout žádného pokroku. Nikomu z dalších autorů se nepovedlo zlepšit dlouhodobě stav pacientů s MCS, ale všichni se shodují v nutnosti pokračovat ve výzkumu mechanizmu působení zolpidemu a správné diagnostice pacientů, kteří by mohli z jeho efektu profitovat.
Klíčová slova:
minimálně odpovídající pacient – zolpidem – pozitronová emisní tomografie – neurorehabilitace
Úvod
Masivní fokální či difuzní postižení CNS z různých příčin přežívá stále větší počet pacientů, jejich následky však bývají závažné. Tito pacienti mívají nejen poruchy hybnosti, se kterými jsme v rehabilitaci běžně zvyklí pracovat, ale především poruchy vědomí. Rehabilitace poruch vědomí zejména u pacientů v chronickém stadiu není v České republice zatím běžná. Touto kazuistikou bychom chtěli ukázat, že v dalším vývoji neurorehabilitace bude nutné hledat nové cesty v přístupu k diagnostice a terapii těchto obtíží.
Někteří pacienti přecházejí z vegetativního stavu do stavu minimálního vědomí, který je podle anglického originálu označován jako Minimally Conscious State (MCS) [1]. MCS je definován jako syndrom, ve kterém má člověk přechodně, ale opakovaně, viditelné známky uvědomování si sebe sama nebo svého okolí. Pacienti v tomto stavu jsou schopni např. přechodně plnit určité jednoduché příkazy, gestikulují adekvátně situaci či dotazu, mohou být schopni i krátkodobé verbalizace [2]. Právě tento stav je považován za důležité období, kdy je nutné využít veškeré možnosti rehabilitace a pokusit se zlepšit celkový stav vědomí. Hledají se nejen možnosti aktivizačních technik, ale i medikamentózní podpora.
Zolpidem (N,N-dimetyl-2-(6-metyl-2-p-tolylimidazo[1,2-a]pyridin-3-yl)acetamid) je krátkodobé nebenzodiazepinové GABA (kyselina gama-aminomáselná) agonistické hypnotikum. Má krátký eliminační poločas (2–3 hod). V minulých letech byl u některých pacientů s poruchou vědomí zjištěn paradoxní efekt, kdy jeho podání vedlo naopak ke zvýšené bdělosti a aktivitě. Zejména v neodborné literatuře je proto označován jako „probouzecí lék“ (z anglického „awakening drug“) [3].
Byla publikována řada odborných studií popisujících tyto efekty. Například Thonnardová et al publikovali v roce 2013 prospektivní otevřenou studii se 60 pacienty s poruchami vědomí, kterým aplikovali zolpidem a sledovali jeho vliv na změny chování [4]. U pacientů, kteří byli různou dobu po poškození mozku, nedošlo po podání zolpidemu k signifikantní změně úrovně vědomí, aby bylo možno překvalifikovat diagnózu MCS. Individuálně však 12 pacientů zlepšilo své chování, čtyři pacienti se přechodně funkčně zlepšili. Pouze jediný pacient dosáhl viditelného zlepšení – vyhověl příkazům a rozeznával předměty. Dvojitě zaslepená studie se stejnými pacienty však tento efekt dlouhodobě nepotvrdila a ani u výše zmiňovaného pacienta nedošlo ke změně diagnózy MCS [4]. Podobné výsledky získali i Whyte a Myers v roce 2009 [5]. Tito autoři doporučili využít k verifikaci změn a lepšímu porozumění efektu zolpidemu i funkčních zobrazovacích metod a elektrofyziologických studií [5].
V naší kazuistice jsme se pokusili zjistit, zda markantní objektivně pozorovatelné funkční zlepšení pacienta po zolpidemu má korelát v zobrazovacích metodách a hlavně, zda by bylo možné v období efektu zolpidemu trénovat projevy funkčního zlepšení.
Kazuistika
Devětatřicetiletý pacient po polytraumatu s kraniocerebrálním traumatem byl v 9/2008 nalezen po pádu z rogala beze svědků v bezvědomí, Glasgow Coma Scale (GCS) 3. Vitální funkce zachovány, intubován, převezen na akutní traumatologické oddělení. Na počítačové tomografii (CT) a magnetické rezonanci (MR) zjištěno kontuzní ložisko v celé levé polovině splenia corporis callosi a frontobazálně vlevo, difuzní axonální poškození. Během 9/2008 přechod do coma vigile GCS 6–7, 11/2009 implantace ventrikuloperitoneálního (VP) shuntu pro čtyřkomorový posttraumatický hydrocefalus. V době příjmu na Kliniku rehabilitačního lékařství (KRL) Všeobecné fakultní nemocnice byl v domácí péči u rodičů.
Dlouhodobá medikace: Piracetam 1 200 mg 1–0–0, Citalec 20 mg 1–0–0, Sirdalud 2 mg 0–0–0–1/2, Helicid 20 mg 1–0–0, Baclofen 25 mg 1–0–0.
MR: Vyšetření bylo provedeno v T2 váženém obraze, T1 váženém obraze, DWI a FLAIR v transverzálních i sagitálních 3,0/0,3 a 6,0/0,6mm řezech, nativně a po intravenózní aplikaci gadolinium (Gd)-dietylentriaminpentacetátu (DTPA).
Závěr: Posttraumatická pseudocysta vpravo frontálně z části komunikující s levou postranní komorou. Čtyřkomorový hydrocefalus, bez známek transependymální resorpce likvoru. Ložiska posttraumatické gliózy vlevo frontálně.
CT s využitím pozitronové emisní tomografie mozku (PET/CT CNS) – pacientovi podáno 300 MBq 2-deoxy-2 [18F]fluoro-D-glukózy (18F-FDG) za bazálních podmínek (s elimenací nadhraničních světelných a zvukových podnětů do předem nitrožilně zavedené kanyly). Vyšetření zopakováno za 24 hod, kdy bylo 15 min před podáním radiofarmaka perorálně aplikováno 10 mg zolpidemu (Stilnox Sanofi). Snímání na PET skeneru GE Discovery 690 za použití iterativní rekonstrukce dat s transmisní korekcí na zeslabení záření gama pomocí CT bylo v obou případech zahájeno za 60 min po podání radiofarmaka. Obrazy byly jednak hodnoceny kvalitativně ve třech základních systémech řezů, jednak vzájemně srovnány pomocí statistického programu Statistical Parametric Mapping (SPM).
Výsledky: Bazální studie: Absence aktivity v bazálních partiích mediální frontální, orbitofrontální a částečně i laterální frontální kůry a v přilehlých podkorových oblastech levé hemisféry. Difuzní hypometabolizmus glukózy i v temporální a primární senzorické a motorické kůře levé hemisféry a levém striatu.
Po podání zolpidemu: Perzistující absence aktivity ve frontobazální kůře a přilehlých podkorových strukturách levé hemisféry. Lehce zvýšená aktivita v horní temporální kůře hemisféry pravé (obr. 1, 2).
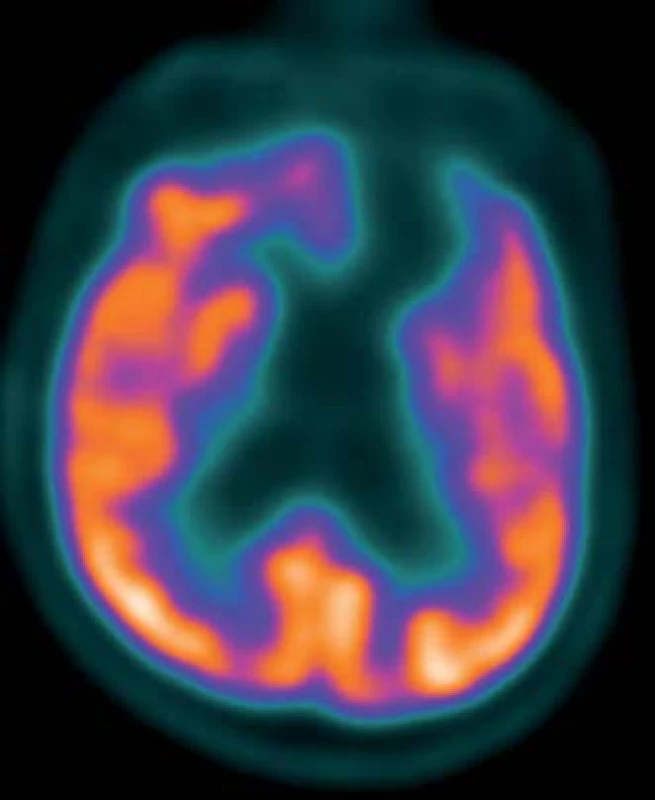
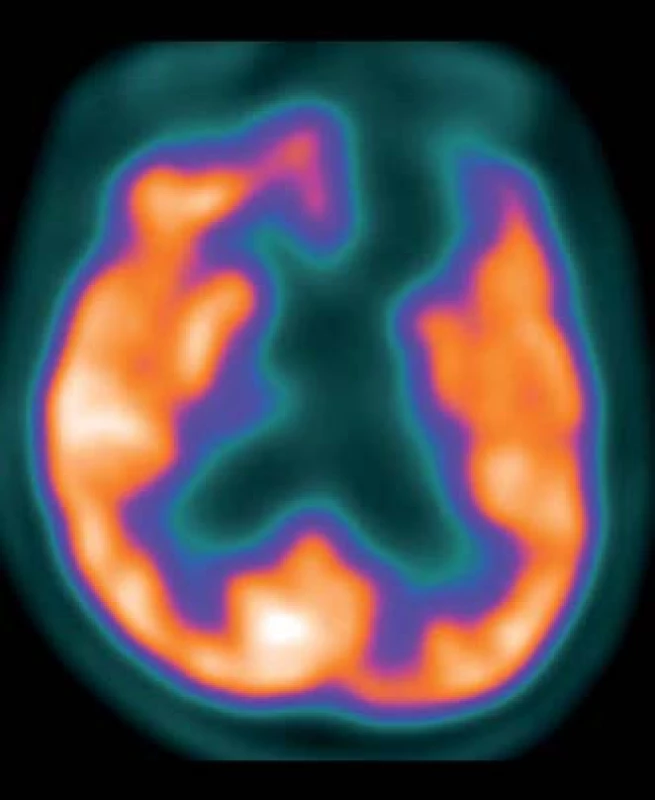
Na KRL byl pacient přijat 1,5 roku po traumatu, byl vyšetřen lékařem, psychologem (nevyšetřitelný klasickými testy, bez cílených reakcí), fyzioterapeutem (ležící, spontánní motorika minimální, necílená), ergoterapeutem (Functional Independence Measure; FIM 0 – celková závislost). Krátkodobě fixoval předměty, motorická reakce na bolestivý podnět, občas spontánní pohyby končetinami a hlavou, na povely nereaguje. Při druhém vyšetření s odstupem šesti měsíců rodina referovala motorickou i psychickou aktivaci pacienta po aplikaci zolpidemu (Stilnox Sanofi), který pacientovi podali na usnutí. Další půlrok byl mimo Prahu a nedocházel na žádné terapie.
Dva a půl roku po traumatu byl proveden na KRL první pokus o aktivaci aplikací zolpidemu (Stilnox Sanofi): bez podání léku pacient pouze leží, fixuje očima osobu, která k němu promlouvá, jiné aktivity nebyly zaznamenány. Po podání léku je cca po 5 min schopen sedět, je-li posazen, vzít si podávaný předmět a vrátit ho, nehlasně opakovat slovo. Nepojmenuje viděný předmět, není schopen samostatné aktivity, komunikuje na úrovni elementární dotaz – elementární odpověď (kývnutím hlavy, nehlasnou řečí). Následovala tříměsíční systematická každodenní stimulace rodinou dle podrobné instruktáže terapeutů s 10 terapiemi na naší klinice. Hlavním cílem bylo zjistit, zda během „bdělého“ stavu navozeného zolpidemem je možné s pacientem pracovat na nácviku některých základních denních činností, zjistit jeho schopnosti učení. Ergoterapie byla zaměřena na trénink kognitivních funkcí (pozornosti, paměti…), fyzioterapie na stabilizaci postury, postupnou vertikalizaci a chůzi. Reakce na podání léku byly nekonstantní, někdy byl pacient schopen reagovat na výzvu pohybem a plnit elementární úkoly, např. posadit se, zvládnout prvky z Bobath konceptu (Neuro-Developmental Treatment; NDT), pojmenovat, seřadit obrázkové karty dle posloupnosti dějové linie. Zadávané úkoly mu musely být vždy znovu vysvětleny, protože aktivity nefixoval a při další terapii si je nevybavil. Celková aktivizace pacienta nevedla k dalšímu zlepšení a její výsledky nebyly využitelné v běžném životě. V Addenbrookském kognitivním testu ani v testu FIM nedošlo k žádnému zlepšení.
V polovině série terapií byl pacient v bdělém stavu po podání zolpidemu kontrolně psychologicky vyšetřen, pojmenoval ukazované předměty, jednoslovně reagoval na výzvu k rozvedení či upřesnění. V Barevném Ravenově testu odpověděl správně jen v lehčích částech, těžší části nezvládl. Výkon nebyl validně hodnotitelný, nedosahoval normy ani pro mentálně subnormní populaci a malé děti, ale v kontextu předchozích neúspěšných pokusů představoval pokrok. Abstraktní myšlení bylo hodnoceno jen orientačně, s výsledkem na hranici hlubokého podprůměru a lehké mentální retardace. Pacient si zapamatoval a reprodukoval tři z 30 obrázků + jedna konfabulace, tedy těžký defekt krátkodobé paměti. Pacient zopakoval jen čtyři jmenované číslice, tj. defekt krátkodobé akustické paměti. Test dlouhodobé paměti konstatoval těžký defekt. Pacient sčítal a násobil jednociferná čísla. Pomalu přečetl běžný text s dysartrií. Obdobné výsledky byly po podání zolpidemu i po ukončení terapií po třech měsících.
Diskuze
Popisovaný pacient pozitivně reagoval na aplikaci 10 mg zolpidemu. Zlepšení vigility bylo vždy v přímé souvislosti s aplikací zolpidemu. V té době nebyla podána žádná jiná látka, konstantní bylo i prostředí. Vzhledem k tomu, že pozorované změny byly opakované a jiným způsobem nebyly vyvolány podobné reakce, domníváme se, že příčinou byl zolpidem. Změna vědomí byla provázena statisticky významnou změnou v FDG PET/CT. Po podání zolpidemu došlo ke zvýšení regionálního metabolizmu glukózy v důsledku zvýšení neuronální aktivity ložiskově v horní temporální kůře pravé (nepostižené) hemisféry. Aktivita postižené hemisféry zůstala beze změn.
Autoři, kteří se zabývali obdobným vyšetřením FDG PET [3,6], zjišťovali spíše oboustranné zvýšení regionální aktivity v prefrontálních oblastech. Z tohoto hlediska se domnívají, že zolpidem by mohl desinhibovat globus pallidus internus (GPi), a tím nahrazovat normální inhibici GPi striatem. Vycházejí z teorie, že v normálním kognitivním procesu striatum desinhibuje centrální thalamus přes GPi, zatímco centrální thalamus podporuje (zvyšuje) aktivitu prefrontální kůry [6]. Striatum, především jeho GABAergní buňky, je podle mnoha autorů, např. [7], jednou z nejcitlivějších oblastí mozku na hypoxii. Zolpidem tedy popsanou desinhibicí zvýší thalamický excitační vliv na prefrontální kůru [8]. Někteří pacienti s danými účinky měli prefrontální oblasti intaktní a po zolpidemu došlo k relativnímu snížení mozkového metabolizmu v levém gyrus temporalis superior, pravděpodobně na úkor zvýšení aktivity frontálních oblastí [7].
U našeho pacienta je vpravo frontálně posttraumatická pseudocysta zčásti komunikující s levou postranní komorou, vlevo frontálně jsou ložiska posttraumatické gliózy. Efekt zolpidemu by tedy mohl spíše odpovídat další teorii podle Pistoii et al z roku 2014 [9], která je někdy označována jako teorie poruchy činnosti GABAergních okruhů. Dle této teorie je návrat vědomí důsledkem obnovení rovnováhy mezi synaptickou excitací a inhibicí a převáží poškození GABA synapsí, které nastalo po poranění mozku. U některých pacientů s poruchou rovnováhy kortiko-subkortikálních a kortiko-kortikálních spojení se využitím GABA agonistů sníží nepřiměřená excitace a nastolí se rovnováha mezi různými mozkovými oblastmi. Tuto teorii se však zatím nepodařilo prokázat [6].
U pacientů s poruchami vědomí se pokoušíme zlepšit vnímání a podpořit schopnost naučit se znovu některé základní činnosti. Přestože zolpidem je krátkodobé nebenzodiazepinové GABA agonistické hypnotikum, zlepšuje vědomí a vigilitu u malého procenta pacientů v MCS. Umožňuje tím pacientovi validní komunikaci i určitou aktivitu, která by mohla být využita pro funkční trénink. Vzhledem k tomu, že učení je velmi složitý proces skládající se z řady etap a využívající různé mozkové oblasti, nedaří se zatím tato krátkodobá zlepšení trvale fixovat. Ani u popisovaného pacienta se nám nepodařilo dosáhnout žádných stálejších funkčních změn a naučit ho trvale některým základním dovednostem. Příčinou může být samozřejmě nízká intenzita či samotná délka intervencí, ale k podobným výsledkům došli i další výše jmenovaní autoři.
Závěr
Rehabilitace pacientů s těžkou poruchou vědomí neměla dlouhodobě žádné pozitivní výstupy. Správnou diagnostikou se podařilo vyčlenit pacienty, kteří mají alespoň přechodná období vigility, která by mohla být využita k dalšímu rozvoji funkčního vnímání. Zatím jsme na počátku terapie těchto pacientů, ale již samotné krátkodobé přechodné změny vědomí a komunikace jsou velkou podporou pro pečovatele a rodinu při další péči o chronické pacienty po poškození mozku.
Většina dosud publikovaných studií se zolpidemem nevedla k výsledkům, které by zlepšily dlouhodobě psychosenzomotorický potenciál pacientů s poruchou vědomí. Není ani jasné, kteří pacienti pozitivně zareagují. Všechny studie se však shodují v nutnosti pokračovat ve správné diagnostice pacientů s MCS (vč. ověření reaktibility CNS podáním zolpidemu), která umožní vytipovat pacienty vhodné a perspektivní k dalším možnostem podpory plasticity mozku a systematickému sledování účinků různých druhů neurostimulace.
Poděkování Ing. J. Trnkovi, Ph.D., za technické a statistické zpracování PET/CT.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Yvona Angerová, Ph.D., MBA
Klinika rehabilitačního lékařství
1. LF UK a VFN v Praze
Albertov 7
128 00 Praha 2
e-mail: angerova.yvona@vfn.cz
Přijato k recenzi: 15. 7. 2015
Přijato do tisku: 15. 1. 2016
Sources
1. Giacino J, Ashwal S, Childs N, et al. The minimally conscious state: definition and diagnostic criteria. Neurology 2002;58(3):349–53.
2. Bruno MA, Vanhaudenhuyse A, Thibaut A, et al. From unresponsive wakefulness to minimally conscious PLUS and functional locked-in syndromes: recent advances in our understanding of disorders of consciousness. J Neurol 2011;258(7):1373–84. doi: 10.1007/s00415-011-6114-x.
3. Williams ST, Conte MM, Goldfine AM, et al. Common resting brain dynamics indicate a possible mechanism underlying zolpidem response in severe brain injury. Elife 2013;2:e01157. doi: 10.7554/eLife.01157.
4. Thonnard M, Gosseries O, Demertzi A, et al. Effect of zolpidem in chronic disorders of consciousness: a prospective open-label study. Funct Neurol 2013;28(4):259– 64. doi: 10.11138/ FNeur/2013.28.4.259.
5. Whyte J, Myers R. Incidence of clinically significant responses to zolpidem among patients with disorders of consciousness: a preliminary placebo controlled trial. Am J Phys Med Rehabil 2009;88(5):410–8. doi: 10.1097/PHM.0b013e3181a0e3a0.
6. Chatelle C, Thibaut A, Grosseries O, et al. Changes in cerebral metabolism in patients with a minimally conscious state responding to zolpidem. Front Hum Neurosci 2014;8:917. doi: 10.3389/fnhum.2014.00917.
7. Calabresi P, Centonze D, Bernardi G. Cellular factors controlling neuronal vulnerability in the brain: a lesson from the striatum. Neurology 2000;55(9):1249–55.
8. Schiff ND. Recovery of consciousness after brain injury: a mesocircuit hypothesis. Trends Neurosci 2010;33(1):1–9. doi: 10.1016/j.tins.2009.11.002.
9. Pistoia F, Sara M, Sacco S, et al. Silencing the brain may be better than stimulating it. The GABA effect. Curr Pharm Des 2014;20(26):4154–66.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2016 Issue 3
Most read in this issue
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Validační studie české verze Bostonského testu pojmenování
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
