MikroRNA u cerebrovaskulárních onemocnění – od patofyziologie k potenciálním biomarkerům
MicroRNAs in Cerebrovascular Diseases – from Pathophysiology to Potential Biomarkers
Small non-coding molecules of ribonucleic acid are important regulators of gene expression and translation. One group of non-coding RNAs is represented by microRNA – 22-24 nucleotides long RNA molecules with effects on regulation of proteins synthesis. Many of them are tissue or organ specific (e. g. miR-206 in striated muscles or miR-122 in hepatocytes). These molecules are enzyme-resistant and detectable in both intracellular and extracellular space. Currently, these molecules are intensively studied as potential markers in many diseases including cerebrovascular diseases. In this review we provide insight into the recent knowledge from animal to human studies concerning miRNAs, with the special emphasis put on diagnostic, therapeutic and prognostic potentials in ischemic stroke (let-7, miR-7, miR-21, miR-29, miR-124, miR-181, miR-210, miR-223), intracranial aneurysms (miR-21, miR-26, miR-29, miR-143/145), and brain arterio-venous malformations (miR-18a).
Key words:
microRNA – ischemic stroke – intracranial aneurysma – cerebral arterio-venous malformations
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
O. Volný 1,2; L. Kašičková 3; D. Coufalová 2,3; P. Cimflová 2,4; J. Novák 5,6
Authors‘ workplace:
I. neurologická klinika LF MU a FN u sv. Anny v Brně
1; ICRC – Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
2; Lékařská fakulta MU, Brno
3; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně
4; II. interní klinika LF MU a FN U sv. Anny v Brně
5; Fyziologický ústav, LF MU, Brno
6
Published in:
Cesk Slov Neurol N 2016; 79/112(3): 287-293
Category:
Review Article
Overview
Malé nekódující molekuly ribonukleových kyselin (RNA) jsou důležité regulátory genové exprese. Jednu ze skupin nekódujících RNA představují tzv. mikroRNA – 22-24 nukleotidů dlouhé úseky RNA, jež ovlivňují překlad RNA do bílkovin. Řada z nich vykazuje tkáňovou specifitu, tj. vyskytují se ve zvýšeném množství dominantně v buňkách jedné tkáně (např. miR-206 v kosterním svalu, miR-122 v hepatocytech). Kromě intracelulárního prostoru je možné identifikovat miRNA také extracelulárně, přičemž v extracelulárním prostoru vykazují miRNA vysokou stabilitu proti působení štěpících enzymů. V současné době jsou studovány jako potenciální biomarkery u řady onemocnění vč. onemocnění cerebrovaskulárních. V tomto souhrnném článku se proto cíleně věnujeme specifickým skupinám mikroRNA, které by na základě výsledků dosud publikovaných animálních a humánních studií mohly mít diagnostický, terapeutický a prognostický potenciál u akutního mozkového infarktu (let-7, miR-7, miR-21, miR-29, miR-124, miR-181, miR-210, miR-223), intrakraniálních aneuryzmat mozkových tepen (miR-21, miR-26, miR-29, miR-143/145) a mozkových arterio-venózních malformací (miR-18a).
Klíčová slova:
mikroRNA – akutní mozkový infarkt – intrakraniální aneuryzmata – mozkové arterio-venózní malformace
Úvod – objev, biogeneze a funkce mikroRNA
Malé nekódující RNA (small non-coding RNAs; sncRNA) představují početnou skupinu různých molekul, které se významně podílejí na regulaci genové exprese. Oproti messengerovým RNA (mRNA), které jsou delší a jsou podkladem pro vznik řady různých proteinů v procesu proteosyntézy (tj. „kódují strukturu proteinu“), neslouží sncRNA jako matrice pro vznik proteinů. V celém procesu genové exprese, od DNA přes RNA k proteinu, hrají regulační úlohu. Existuje řada skupin sncRNAs, které se od sebe odlišují mechanizmem účinku, místem působení, biogenezí a mnoha dalšími parametry [1]. Jednu z intenzivně zkoumaných skupin sncRNA představují mikroRNA (miRNA, miR), což jsou 21–24 nukleotidů dlouhé molekuly RNA podílející se na negativní posttranskripční regulaci genové exprese (viz dále) [2].
První miRNA, konkrétně produkt genu lin-4, byla identifikována v roce 1993 při studiích hlístice, háďátka obecného (Caenorhabditis elegans) [3]. Mutace v lin-4 způsobovaly, že byl narušen vývoj larev háďátka tím, že došlo k abnormálnímu opakování některých larválních stadií. Skupina vedená Viktorem Ambrosem pak prokázala, že gen lin-4 kóduje sncRNA, která se na podkladě komplementarity bází (adenin – uracil, guanin – cytosin, tj. A-U, C-G) váže s produktem genu lin-14 a takto tlumí jeho překlad do proteinu. V roce 2000 byla popsána další miRNA, produkt genu let-7, která u háďátka odpovídá za přechod z posledního larválního stadia do stadia dospělého [4]. V témž roce Pasqiunelli et al zjistili, že let-7 je možno detekovat nejen u hlístice, ale i u dalších živočichů vč. člověka [5]. V roce 2002 Calin et al prokázali, že exprese miR-15a a miR-16-1, jejichž geny jsou uloženy na 13q14, je snížena u pacientů s chronickou lymfocytární leukemií (CLL). U těchto pacientů je krátký úsek 13q14 deletován. Snížení hladin těchto dvou miRNA se podílí na patogenezi CLL [6]. Další studie pak prokázaly vztah miRNA k jiným nemocem zahrnujícím i onemocnění neurologická (cévní mozková příhoda, Alzheimerova demence, amyotrofická laterální skleróza, epilepsie a řada dalších).
Kromě vlastní negativní posttranskripční regulace genové exprese, která se odehrává uvnitř buněk (intracelulárně), se brzy ukázalo, že se miRNA vyskytují i v prostoru extracelulárním [7]. Bylo opakovaně prokázáno, že miRNA jsou v extracelulárním prostoru chráněny před štěpením tělu vlastních RNáz (enzymů štěpících RNA) tím, že se zde nacházejí v komplexu s proteiny anebo jsou uschovány do exozomů, mikrovezikul nebo lipoproteinových částic (HDL či LDL) [8]. Zatímco miRNA vázané s proteiny se do krve uvolňují spíše při poškození buněk, miRNA uložené v různých transportních váčcích by se mohly podílet na mezibuněčné komunikaci, jak na úrovni lokální (např. v rámci nádorové tkáně zprostředkovávají miRNA parakrinní komunikaci mezi jednotlivými typy buněk) [9], tak na úrovni systémové (existují důkazy o tom, že by se miRNA mohly podílet na systémovém účinku ischemického remote conditioning, kdy vzdálená ischemie končetiny vede k protekci myokardu) [10]. Protože hladiny extracelulárních miRNA jsou u jedinců téhož druhu reproducibilní a stabilní, stávají se miRNA kandidáty pro nové biomarkery (některé miRNA jsou tkáňově specifické a při poškození dané tkáně či orgánu se jejich hladiny v extracelulárním prostoru zvyšují, např. u infarktu myokardu [11] anebo u poškození jater [12]). Nalezení specifických miRNA nebo skupin (profilů) několika miRNA najednou, které by sloužily jako diagnostické či prognostické sety, je nyní jedním z dílčích cílů výzkumu v této oblasti.
V neposlední řadě je nutné se zmínit i o možném terapeutickém potenciálu, který se v malých RNA molekulách skrývá. V případě, že u pacientů nalézáme snížené hladiny některé miRNA, můžeme je doplnit s využitím tzv. „miRNA-mimics“. V případě, že nalézáme hladiny zvýšené, je možné tyto miRNA vyblokovat s užitím „antago-miRNA“ nebo „anti-miRNA“ [13]. Nalezení vhodných kandidátních miRNA, jejichž hladiny bychom tímto způsobem mohli cíleně ovlivnit, by v budoucnu mohlo přinést celou řadu zajímavých terapeutických přístupů šitých na míru konkrétnímu pacientovi.
Na příkladu aterosklerózy bylo opakovaně prokázáno, že zablokování některých miRNA zapojených do lipidového metabolizmu (např. miR-33) zmenšuje aterosklerotické pláty a zlepšuje lipidový profil (a to nejen na myších modelech, ale i na primátech [14,15]). Inhibice miR-25 by v budoucnu mohla být využita v terapii srdečního selhání, jelikož vede ke zvýšení kontraktility [16]. Na příkladu hepatitidy C, která byla ještě donedávna považována za chronické a zcela nevyléčitelné onemocnění, se nyní již v klinických zkouškách na úrovni 2a používá terapeutikum miRavirsen – oligonukleotid (krátký úsek nukleotidů), který se váže na jaterně specifickou miR-122 [17]. Virus hepatitidy C (HCV) tělu vlastní miR-122 využívá k zefektivnění své replikace – podání miRavirsenu vede k blokádě miR-122 a ke zpomalení replikace HCV. Dosavadní výsledky ukazují, že 14 týdnů po podání miRavirsenu není HCV RNA detekovatelná u pěti z 36 zapojených jedinců, přičemž u všech ostatních byla virová nálož statisticky významně snížena [17].
V následujícím textu prezentujeme, jaký potenciál skrývají miRNA pro pacienty s cerebrovaskulárními onemocněními. V rámci tohoto souhrnného článku poskytujeme detailní přehledy animálních i humánních studií, které se věnují roli miRNA u akutního mozkového infarktu, intrakraniálních aneuryzmat a mozkových arteriovenózních malformací.
miRNA u mozkového infarktu
Cévní mozková příhoda (CMP) reprezentuje jednu z hlavních příčin invalidity a druhou nejčastější příčinu úmrtí ve vyspělých zemích (za kardiovaskulárními onemocněními). V posledních letech bylo dosaženo významného pokroku v prevenci CMP (primární a sekundární). Rovněž došlo k rozvoji v oblasti zobrazovacích metod a ke zlepšení terapeutických postupů (systémová trombolýza, mechanická trombektomie). Nicméně stále otevřenou kapitolou a výzkumně atraktivní oblastí zůstává oblast stabilních a relevantních biomarkerů izolovaných z krevního séra či jiných tělních tekutin (plná krev, plazma, mozkomíšní mok, moč). Biomarker poškození mozkové tkáně či marker, který by mohl být využit v klinické praxi k stanovení prognózy nebo rizika recidivy u pacientů po CMP, stále chybí. S rozvojem znalostí o miRNA se zdá, že jsou tyto malé nekódující molekuly součástí řady pochodů zapojených do patofyziologie akutního a subakutního mozkového infarktu, ať se jedná o apoptózu, hypoxické poškození neuronů, angiogenezi, zánětlivou reakci či aterosklerózu mozkových tepen [18]. Tím, že jsou miRNA zapojeny do výše uvedených pochodů, lze předpokládat, že jejich extracelulární hladiny budou změněny již v akutní fázi a určení specifických profilů miRNA by mohlo vést ke zlepšení diagnostiky, k vytipování pacientů ohrožených brzkou rekurencí, či v rámci pátrání po etiologii mozkového infarktu (např. až u 20 % pacientů se nepodaří určit jednoznačnou příčinu a jedná se o tzv. Embolic Stroke of Undetermined Source; ESUS [19]).
V současné době byla již provedena řada animálních i humánních studií, které se věnovaly jak patofyziologické, tak diagnostické roli miRNA, a byť se vzájemně lišily v designu experimentu, použitých metodách nebo v selekci pacientů, přinesla každá z nich unikátní informace a nové pohledy na molekulární pozadí mozkového infarktu.
První studie byly převážně studiemi animálními, kdy byla zvířatům uměle navozena akutní ischemie. U těchto zvířat následovalo tzv. miRNA profilováni, tj. bylo stanoveno více než 700 známých miRNA (tzv. miRNA profil) z vzorku mozkové tkáně nebo vzorku extracelulární tekutiny (většinou krve). Na základě srovnání těchto profilů s profily zvířat z placebo skupiny (bez navození akutní ischemie) byly vytipovány tzv. kandidátní miRNA (řádově jednotky až desítky molekul), které byly specificky či nespecificky dysregulovány (tj. jejich hladiny byly zvýšené či snížené) a vykazovaly orgánovou (mozkovou) specificitu [20–25]. Takto vytipované molekuly (kandidátní) byly následně validovány a studovány v různých kohortách pacientů s příznaky akutního mozkového infarktu. Těmto molekulám jsou věnovány následující odstavce.
Kandidátní miRNA u mozkového infarktu
Rodina let-7
Rodina let-7 (let-7a až let-7i) představuje jednu z nejvíce zastoupených miRNA rodin v mozku, kde vykonává stěžejní role v neurogenezi a diferenciaci neuronů [26]. V patofyziologii mozkového infarktu se předpokládá, že by tyto molekuly mohly být zapojeny do procesu neurogeneze [5], angiogeneze, zánětu a aterosklerózy [27,28]. V provedených profilovacích studiích [21,22,24] bylo opakovaně prokázáno snížení hladin a navíc specifická blokáda let-7f s použitím antagomir na myších modelech měla neuroprotektivní účinek [29]. Toto přirozeně vedlo k hypotéze, že terapeutické snížení rodiny let-7 aktivuje neuroprotektivní mechanizmy zprostředkované alespoň z části signální dráhou IGF-1 (inzulinu podobný růstový faktor).
miR-21
U miR-21 bylo opakovaně prokázáno, že se uplatňuje při procesech spojených s ischemií a hypoxií a že má silný antiapoptotický efekt [30]. Zvýšení hladin této miRNA bylo pozorováno specificky u pacientů s lakunárními infarkty [31]. V animální studii publikované Bullerem et al byla prokázána zvýšená exprese miR-21 v zóně hraničící s ischemických ložiskem (obdoba penumbry – tkáň v riziku ischemického postižení) ve srovnání s expresí v kontralaterálních neuronech [32]. Arteficiální zavedení miR-21 do kyslíkem a glukózou deprivovaných buněk (obdoba penumbry) vedlo k delšímu přežití neuronů inhibicí apoptózy [32,33]. Limitací pro možné terapeutické užití je však skutečnost, že tato molekula není orgánově specifická – tzn. je zapojena nejen do mozkové, ale i do myokardiální ischemie, kde byl rovněž prokázán její antiapoptotický vliv na kardiomyocyty [34]. Její případné využití v terapii by mohlo mít mnohé vedlejší a nežádoucí účinky.
Rodina miR-29
Rodina miR-29 je zastoupena čtyřmi miRNA (miR-29a, miR-29b-1, miR-29b-2 a miR-29c), které cílí proapoptotické i antiapoptotické členy rodiny Bcl-2. S ohledem na ambivalentní zapojení do obou procesů je nutné jejich funkce chápat v souvislosti s konkrétním modelem ischemie. V různých animálních modelech bylo pozorováno snížení [35–37] i zvýšení [38,39] hladin členů této miRNA rodiny. Laboratorně bylo zkoumáno zapojení těchto molekul do patofyziologických procesů v ischemickém jádře i penumbře. Khanna et al a Pandi et al v jádru ischemie („core“) popsali snížení miR-29b a miR-29c, což bylo spojeno s progresí ischemického poškození mozku. V experimentu pak dokázali, že podání α-tokotrienolu (vitamin E) ovlivňuje hladiny těchto dvou miRNA a má protektivní účinky – podání α-tokotrienolu vedlo ke snížení objemu infarktu a podpoře přežívání neuronů v zóně hypoxie. Naopak Dhiraj et al [38] se zaměřili na hodnocení rodiny miR-29 v penumbře. V in vivo i in vitro modelech penumbry byla nalezena změna exprese miR-29b-2 [38].
miR-124
miR-124 je označována jako mozkově specifická miRNA [40] (téměř výhradně exprimována v centrální nervové soustavě [25], kde se podílí na regulaci neuronální diferenciace a neurogeneze v dospělosti [41]). Byly provedeny různé studie zaměřené na stanovení hladin miR-124 po ischemickému inzultu. Jednotlivé studie využívaly různé protokoly indukce ischemie a vzájemně se mezi sebou významně lišily v použité metodice (např. velikostí vzorku, v intervalu sběru vzorků od indukce ischemie, technikami izolace nebo výběrem interní kontroly), což mohou být faktory, které by mohly vysvětlit protichůdnost publikovaných výsledků.
Dosud celkem pět studií prokázalo zvýšení hladin miR-124 po indukci mozkové ischemie [22,40,42,43]. Jeyaseelan et al identifikovali visinin like 1 protein (VSNL1) jako cíl miR-124. Jedná se o neuronální vápníkový senzor, který je v animálních modelech hojně exprimován v CNS [22] a který je v současnosti navíc studován také jako potenciální biomarker demencí [44]. Intralezionální aplikace miR-124 v experimentu vedla ke snížení objemu a velikosti infarktového ložiska a menšímu funkčnímu poškození [42]. K podobnému závěru došla i skupina Sun et al, která v experimentu sledovala zvýšení hladiny miR-124 v penumbře. Opakovaně prokázala, že zvýšení/ snížení hladin miR-124 vede ke zvýšení/ redukci objemu infarktové léze, a to in vivo i in vitro. K opačným výsledkům došla skupina Zhu et al a Liu et al. V jejich modelech ischemie bylo naopak pozorováno snížení hladin miR-124 [45,46]. Nesourodé výsledky studií staví tuto miRNA do pozice nevhodného biomarkeru akutní mozkové ischemie, avšak jsou potřeba ještě další, zejména rozsáhlejší studie, aby bylo možno tyto závěry jednoznačně potvrdit či vyvrátit.
Rodina miR-181
Rodina miR-181 je tvořena čtyřmi členy (miR-181a, -181b, -181c a -181d). Tyto miRNA jsou hojně exprimovány v savčím mozku [47]. Jejich cílem jsou mRNA pro proteiny zahrnuté do procesu apoptózy (např. rodina antiapoptotických proteinů Bcl-2 [48]) nebo do ochrany buněk (např. ochranné proteiny endoplazmatického retikula či heat-shock proteiny [49,50]). Arteficiální inhibice miR-181 (blokáda její funkce) v kultivovaných astrocytech tlumila procesy buněčné smrti [49]. Členové miR-181 rodiny rovněž nepřímo ovlivňují glutamátový transportér (GLT-1), čímž jsou miR-181 mj. zapojeny do ochrany vůči glutamátem indukované excitotoxicitě a tím nepřímo do neuroprotekce [51].
miR-210
miR-210, nazývaná též „mistrovská hypoxa-miR”, představuje hypoxií indukovanou a antiapoptotickou miRNA [52]. Zvýšení její exprese v lidských endoteliálních buňkách stimuluje tvorbu kapilárám podobných struktur a zvyšuje buněčnou migraci a diferenciaci [53]. Arteficiální navýšení miR-210 v animálních modelech mozkového infarktu vedlo ke zvýšenému počtu nových cév [54] i progenitorů neuronů v subventrikulární zóně [55], což dále vyústilo ve zvýšení angio- a neurogeneze. Slibný potenciál miR-210 v rámci akutní ischemie je studován v probíhajících humánních i animálních studiích.
miR-223
miR-223 je poslední podrobněji zkoumaná miRNA u mozkové ischemie. Společně s miR-130a a miR-320 cílí na geny akvaporinů, zejmená akvaporinu 4, který je typicky exprimován v mozku [56]. miR-223 vzbuzuje větší výzkumný zájem nejen kvůli prokázaným účinkům na mozkové akvaporiny [22], ale také proto, že je secernována krevními destičkami [57] a transportována v lipoproteinových částicích (HDL i LDL) [58]. V současnosti se předpokládá, že plní klíčovou roli v metabolizmu cholesterolu [59]. Podobně jako miR-181 má i miR-223 neuroprotektivní efekt přes inhibici glutamátové excitotoxicity [60]. Ve studii provedené Duanem et al bylo navíc pozorováno, že hladiny miR-223 jsou nižší u pacientů s diabetes mellitus, což přispívá k aktivaci krevních destiček a zvyšuje riziko vzniku trombu [61].
miRNA jako biomarkery u akutního mozkového infarktu v humánních studiích
Na základě rozsáhlé literární rešerše jsme shledali výše diskutované miRNA jako potenciální biomarkery v rámci ischemické CMP. Ve dvou nezávislých animálních studiích bylo popsáno zvýšení miR-124, které trvalo min. 48 hod po vyvolání CMP, avšak nebyla pozorována žádná korelace s výsledným stavem experimentálních zvířat či s velikostí infarktu [25,40]. Zajímavým zjištěním bylo, že hladiny miR-124 po akutním mozkovém infarktu byly v lidských studiích zvýšené [62] i snížené [63]. Ve studii Leung et al bylo zvýšení hladiny miR-124 nápadné pouze v časné fázi (během 6 hod od vzniku) a při dalším vzorkování byly hladiny již signifikantně nižší [62]. Ve studii Liu et al bylo naopak prokázáno snížení miR-124 a negativní korelace s výsledným objemem infarktu, hladinou C reaktivního proteinu (CRP) a hladinou matrix metaloproteinázy 9 (MMP-9), což pravděpodobně reflektovalo poškození mozkové tkáně, endotelu a aktivovaný zánět [63].
Let-7 (spolu s miR-30a a miR-126) byla studována u 247 pacientů, a to v různých časových intervalech po proběhlém mozkovém infarktu (v akutní fázi/ během 24 hod, v subakutní fázi během jednoho týdne a v chronické fázi do 48 týdnů). Hladiny let-7 byly signifikantně sníženy a k normalizaci hladin došlo až po 24 týdnech od proběhlého iktu. Zajímavé bylo zjištění, že hladiny let-7 jsou dominantně sníženy u pacientů s prokázanou aterosklerózou velkých tepen (large artery aterosclerosis) [64].
Zapojení miR-21 v patofyziologii akutního mozkového infarktu bylo studováno u 233 pacientů: 1. pacienti s ischemickou CMP, 2. pacienti s prokázanou aterosklerózou karotid dle ultrazvukového vyšetření bez proběhlé CMP a 3. u 157 kontrol. Cílem bylo sledování vývoje hladin miR-21 a dalších potenciálních mikroRNA (miR-221) v krevním séru [65] a srovnání s uvedenými kontrolami. miR-21 a miR-221 vykazovaly opačné trendy – v porovnání s kontrolami byla hladina miR-21 signifikantně zvýšena a hladina miR-221 signifikantně snížena.
U miR-210 bylo prokázáno snížení jejich hladin v leukocytech periferní krve u pacientů po akutním mozkovém infarktu, přičemž v průběhu následujících dvou týdnů docházelo k dalšímu poklesu. Klinicky zajímavá byla prokázaná korelace mezi hladinami miR-210 a NIHSS (škála hodnotící tíži deficitu/ National Institutes of Health Stroke Scale, 0 až 42 – vyšší hodnota znamená těžší neurologický deficit) a modifikované Rankinovy škály (mRS hodnotící tíži deficitu a soběstačnost po proběhlém mozkovém infarktu). Lepší prognóza byla prokázána u pacientů s vyššími hladinami miR--210 v porovnání s pacienty s nižší hladinou. Zeng et al studovali hladiny miR-210 v mononukleárních buňkách periferní krve společně s hladinami dalších potenciálních biomarkerů vč. některých cytokinů (např. IFNγ – interferon gama, IL-1 – interleukin 1, IL-6 – interleukin 6, TNFα – tumor necrosis factor alfa) a hemostatických markerů (fibrin a jeho degradační produkty, D-dimery apod.). Kombinace miR-210, FDP a IL-6 měla vůbec nejvyšší senzitivitu i specificitu v predikci výsledného stavu po CMP (definovaný jako mRS po třech měsících) v porovnání s použitím jednotlivých markerů [66].
U miR-223 bylo pozorováno zvýšení v krevním oběhu po proběhlém akutním mozkovém infarktu [67]. U této miRNA byla prokázána negativní korelace s NIHSS (v animální části studie také s velikostí infarktu). Zapojení a význam miR-223 je zkoumán v probíhajících studiích.
Z výsledků dosud proběhlých studií vyplývá, že do patofyziologie akutního mozkového infarktu jsou zapojeny i další miRNA (miR-17 [19], miR-103 [68], miR-107 [69], miR-126 [19] miR-134 [70,71], miR-200c [72], miR-376-5p [73], miR-424 [22,74,75]). Informace o jejich funkci a zapojení do rozvoje mozkové ischemie jsou však značně omezené a jejich funkce a potenciální využití jako nových biomarkerů je nutné ověřit v dalších navazujících studiích.
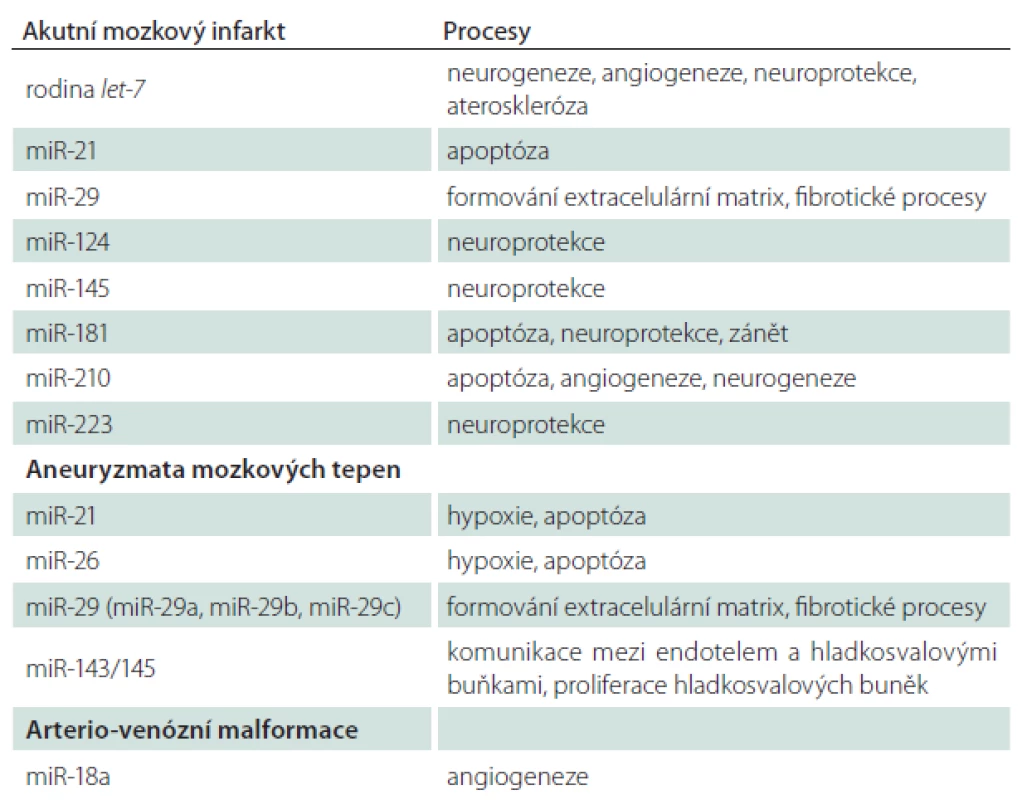
Zapojení mikroRNA do patofyziologických procesů u akutního mozkového infarktu shrnuje schéma 1. Tab. 1 shrnuje kandidátní molekuly u vybraných cerebrovaskulárních onemocnění a procesy, do kterých jsou jednotlivé molekuly zapojeny.

miRNA u intrakraniálních aneuryzmat
Intrakraniální aneuryzmata představují léze stěny mozkových arterií. Vyskytují se u 0,5–3 % populace a odpovídají za 80–85 % netraumatických subarachnoidálních krvácení. Stanovení optimální terapie u asymptomatických aneuryzmat je i nadále předmětem debat. Odvíjí se od anamnestických dat konkrétního pacienta, velikosti, počtu a lokalizace aneuryzmat a jejich vývoji (růstu v čase) na zobrazení mozkových tepen. V rozhodování by mohlo mít významnou roli stanovení specifických biomarkerů předpovídajících klinický vývoj aneuryzmatu vč. rizika ruptury asymptomatických aneuryzmat [76– 79].
miRNA profilovací studie u intrakraniálních aneuryzmat
Animální profilovací studie ze vzorků arteriální stěny identifikovala 14 miRNA, jejichž hladiny byly oproti kontrolnímu vzorku cévní stěny zvýšeny, a šest miRNA, jejichž hladiny byly sníženy [80]. V rámci humánních studií bylo profilování provedeno z operačních vzorků i z krve pacientů s diagnostikovaným intrakraniálním aneuryzmatem. Analýza vzorků arteriální stěny 14 pacientů po ruptuře aneuryzmatu a 14 zdravých kontrol odhalila změněnou hladinu u 18 miRNA [81]. O rok později provedli Liu et al skríning a popsali změněnou hladinu více než 150 miRNA. U čtyř z nich (let-7a, miR-1, miR-30c a miR-101) byla prokázána účast na programované buněčné smrti, organizaci a stabilizaci extracelulární matrix, signální dráze TGF-β a proliferaci hladkosvalových buněk [82]. Profilovací studie cirkulujících miRNA u 24 pacientů prokázala změněné hladiny 86 různých miRNA. V rámci snahy identifikovat možný prognostický biomarker ruptury byly zkoumány vzorky od pacientů po ruptuře aneuryzmatu a bez ruptury aneuryzmatu a ukázalo se, že zvýšení hladin miR-16 a miR-25 lze společně s nedostatečně kompenzovanou hypertenzí považovat za významné nezávislé rizikové faktory ruptury [83,84].
Kandidátní miRNA u intrakraniálních aneuryzmat
U intrakraniálních aneuryzmat bylo potvrzeno zvýšení hladiny hypoxické a apoptotické miR-21. Přitom její vyšší hladiny byly spojeny s vyšší pravděpodobností růstu aneuryzmatu [84,85]. Další detekovaná miRNA, miR-29, hraje významnou roli ve formování extracelulární matrix. Nicméně je nutné uvést, že výsledky dosud proběhlých studií jsou protichůdné – u aneuryzmat abdominální aorty jsou hladiny přímo úměrné růstu aneuryzmatu [86–88]; u intrakraniálních aneuryzmat bylo prokázáno zvýšení i snížení hladin miR-29b oproti kontrolním vzorkům [80–82,84]. Další miRNA, které byly u intrakraniálních aneuryzmat studovány, byly miR-143/-145. Jedná se o klastr miRNA významně zapojený do komunikace mezi endotelem a hladkosvalovými buňkami a opakovaně bylo prokázáno, že snížené hladiny miR-143/-145 jsou spojeny s rizikem růstu aneuryzmatu [81,89].
miRNA u mozkových arterio-venózních malformací
Arterio-venózní malformace (AVM) jsou komplexy abnormálních arterií a vén, které spolu přímo komunikují, a to bez normálně vytvořeného kapilárního řečiště. Liší se v morfologii, velikosti, lokalizaci, v riziku ruptury a následného mozkového krvácení. Klinicky mohou být asymptomatické nebo se mohou projevit ložiskovým neurologickým deficitem (dle jejich lokalizace), bolestmi hlavy anebo symptomatickými epileptickými záchvaty při akutním zakrvácení. Výzkum o úloze miRNA u AVM je zatím omezen na klastr miR-17-92, z něhož nejvýznamnější je miR-18a. Tato miRNA je zapojena do regulace angiogeneze, kde společně s miR--17, miR-19a a miR-20a (všechny jsou součástí klastru miR-17-92) plní antiangiogenní funkce. Pravděpodobně ovlivňují vývoj kapilárního řečiště a proliferaci endotelu [90–92]. Úloha miR-18a byla studována u vzorků z AVM od šesti pacientů, z nichž byly kultivovány buněčné linie. Následná aplikace miR-18a do takto získaných buněk vedla ke stabilizaci jejich funkce [92]. Terapeutický potenciál miR-18a je zkoumán v probíhajících studiích.
Shrnutí
miRNA plní řadu rolí ve všech procesech probíhajících v lidském těle za fyziologických i patologických podmínek. Studium jejich hladin v hypoxické mozkové tkáni v animálním modelu, v buněčných kulturách podrobených hypoxii či lidských tělesných tekutinách po akutním mozkovém infarktu přineslo unikátní informace o patofyziologických procesech probíhajících na subcelulární úrovni. Výsledky probíhajícího výzkumu miRNA v oblasti cerebrovaskulárních onemocnění by v budoucnosti mohly přispět k vývoji nových diagnostických a terapeutických metod personifikované medicíny. Nutno však zdůraznit, že před vstupem do rutinní klinické praxe je nezbytné vyřešit řadu nezodpovězených otázek a současných limitací, a to jak technických (např. nadále není určena vhodná vnitřní kontrola pro stanovení miRNA z plazmy či moči; jsou užívány rozdílné kity pro izolace miRNA; není dořešena otázka stability vzorků v preanalytické fázi), tak bezpečnostních (např. při využití miRNA jako potenciálních terapeutik nelze na základě současných znalostí s jistotou predikovat, jaké mohou být vedlejší účinky, za jak dlouho se efekt podaných miRNA projeví a zda bude možné při rozvoji nežádoucích účinků tyto účinky farmakologicky zvrátit). Zodpovězení těchto a dalších otázek je předmětem intenzivního výzkumu.
Grantová podpora: 1. FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123), 2. „Kardiovaskulární systém od buňky k lůžku pacienta“ číslo MUNI/A/1326/2014 podpořený z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2015.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jan Novák
Fyziologický ústav LF MU
Kamenice 5
625 00 Brno
e-mail: 324158@mail.muni.cz
Přijato k recenzi: 1. 10. 2015
Přijato do tisku: 14. 12. 2015
Sources
1. Esteller M. Non-coding RNAs in human disease. Nat Rev Genet 2011;12(12):861– 74. doi: 10.1038/nrg3074.
2. Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 2004;116(2):281– 97.
3. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993;75(5):843– 54.
4. Reinhart BJ, Slack FJ, Basson M, et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature 2000;403(6772):901– 6.
5. Pasquinelli AE, Reinhart BJ, Slack F, et al. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature 2000;408(6808):86– 9.
6. Calin GA, Dumitru CD, Shimizu M, et al. Frequent deletions and down-regulation of micro- RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci U S A 2002;99(24):15524– 9.
7. Weber JA, Baxter DH, Zhang S, et al. The microRNA spectrum in 12 body fluids. Clin Chem 2010;56(11):1733– 41. doi: 10.1373/clinchem.2010.147405.
8. Kondkar AA, Abu-Amero KK. Utility of circulating microRNAs as clinical biomarkers for cardiovascular diseases. BioMed Res Int 2015;2015:821823. doi: 10.1155/2015/ 821823.
9. Zhang W, Qian P, Zhang X, et al. Autocrine/ Paracrine Human Growth Hormone-stimulated MicroRNA 96-182-183 Cluster Promotes Epithelial-Mesenchymal Transition and Invasion in Breast Cancer. J Biol Chem 2015;290(22):13812– 29. doi: 10.1074/jbc.M115.653261.
10. Madonna R, Cadeddu C, Deidda M, et al. Cardioprotection by gene therapy: a review paper on behalf of the Working Group on Drug Cardiotoxicity and Cardioprotection of the Italian Society of Cardiology. Int J Cardiol 2015;191:203– 10. doi: 10.1016/j.ijcard.2015.04.232.
11. Chen X, Zhang L, Su T, et al. Kinetics of plasma microRNA-499 expression in acute myocardial infarction. J Thorac Dis 2015;7(5):890– 6. doi: 10.3978/j.issn.2072-1439.2014.11.32.
12. Arrese M, Eguchi A, Feldstein AE. Circulating microRNAs: emerging biomarkers of liver disease. Semin Liver Dis 2015;35(1):43– 54. doi: 10.1055/s-0034-1397348.
13. van Rooij E, Olson EN. MicroRNA therapeutics for cardiovascular disease: opportunities and obstacles. Nat Rev Drug Discov 2012;11(11):860– 72. doi: 10.1038/nrd3864.
14. Rayner KJ, Esau CC, Hussain FN, et al. Inhibition of miR-33a/ b in non-human primates raises plasma HDL and lowers VLDL triglycerides. Nature 2011;478(7369):404– 7. doi: 10.1038/nature10486.
15. Rayner KJ, Sheedy FJ, Esau CC, et al. Antagonism of miR-33 in mice promotes reverse cholesterol transport and regression of atherosclerosis. J Clin Invest 2011;121(7):2921– 31. doi: 10.1172/JCI57275.
16. Wahlquist C, Jeong D, Rojas-Muñoz A, et al. Inhibition of miR-25 improves cardiac contractility in the failing heart. Nature 2014;508(7497):531– 5. doi: 10.1038/nature13073.
17. Janssen HL, Reesink HW, Lawitz EJ, et al. Treatment of HCV infection by targeting microRNA. N Engl J Med 2013;368(18):1685– 94. doi: 10.1056/NEJMoa1209026.
18. Soreq H, Wolf Y. NeurimmiRs: microRNAs in the neuroimmune interface. Trends Mol Med 2011;17(10):548– 55. doi: 10.1016/j.molmed.2011.06.009.
19. Kim JM, Jung KH, Chu K, et al. Atherosclerosis-related circulating microRNAs as a predictor of strokerecurrence. Transl Stroke Res 2015;6(3):191– 7. doi: 10.1007/s12975-015-0390-1.
20. Dharap A, Bowen K, Place R, et al. Transient focal ischemia induces extensive temporal changes in rat cerebral microRNAome. J Cereb Blood Flow Metab 2009;29(4):675– 87. doi: 10.1038/jcbfm.2008.157.
21. Gubern C, Camós S, Ballesteros I, et al. miRNA expression is modulated over time after focal ischaemia: up-regulation of miR-347 promotes neuronal apoptosis. FEBS J 2013;280(23):6233– 46. doi: 10.1111/febs.12546.
22. Jeyaseelan K, Lim KY, Armugam A. MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion. Stroke J Cereb Circ 2008;39(3):959– 66.
23. Liu FJ, Lim KY, Kaur P, et al. microRNAs involved in regulating spontaneous recovery in embolic stroke model. PloS One 2013;8(6):e66393.
24. Selvamani A, Williams MH, Miranda RC, et al. Circulating miRNA profiles provide a biomarker for severity of stroke outcomes associated with age and sex in a rat model. Clin Sci Lond Engl 2014;127(2):77– 89. doi: 10.1042/CS20130565.
25. Weng H, Shen C, Hirokawa G, et al. Plasma miR--124 as a biomarker for cerebral infarction. Biomed Res 2011;32(2):135– 41.
26. Rehfeld F, Rohde AM, Nguyen DT, et al. Lin28 and let-7: ancient milestones on the road from pluripotency to neurogenesis. Cell Tissue Res 2015;359(1):145– 60. doi: 10.1007/s00441-014-1872-2.
27. Hulsmans M, Holvoet P. MicroRNA-containing microvesicles regulating inflammation in association with atherosclerotic disease. Cardiovasc Res 2013;100(1):7– 18. doi: 10.1093/cvr/cvt161.
28. Valadi H, Ekström K, Bossios A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 2007;9(6):654– 9.
29. Selvamani A, Sathyan P, Miranda RC, et al. An antagomir to microRNA Let7f promotes neuroprotection in an ischemic stroke model. PloS One 2012;7(2):e32662. doi: 10.1371/journal.pone.0032662.
30. Bienertova-Vasku J, Novak J, Vasku A. MicroRNAs in pulmonary arterial hypertension: pathogenesis, diagnosis and treatment. J Am Soc Hypertens 2015;9(3):221– 34. doi: 10.1016/j.jash.2014.12.011.
31. Tan KS, Armugam A, Se pramaniam S, et al. Expression profile of MicroRNAs in young stroke patients. PloS One 2009;4(11):e7689. doi: 10.1371/ journal.pone.0007689.
32. Buller B, Liu X, Wang X, et al. MicroRNA-21 protects neurons from ischemic death. FEBS J 2010;277(20):4299– 307. doi: 10.1111/j.1742-4658.2010.07818.x.
33. Zhou J, Zhang J. Identification of miRNA-21 and miRNA-24 in plasma as potential early stage markers of acute cerebral infarction. Mol Med Rep 2014;10(2):971– 6. doi: 10.3892/mmr.2014.2245.
34. Dong S, Cheng Y, Yang J, et al. MicroRNA expression signature and the role of microRNA-21 in the early phase of acute myocardial infarction. J Biol Chem 2009;284(43):29514– 25. doi: 10.1074/jbc.M109.027896.
35. Huang LG, Li JP, Pang XM, et al. MicroRNA-29c Correlates with Neuroprotection Induced by FNS by Targeting Both Birc2 and Bak1 in Rat Brain after Stroke. CNS Neurosci Ther 2015;21(6):496– 503. doi: 10.1111/cns.12383.
36. Khanna S, Rink C, Ghoorkhanian R, et al. Loss of miR-29b following acute ischemic stroke contributes to neural cell death and infarct size. J Cereb Blood Flow Metab 2013;33(8):1197– 206. doi: 10.1038/jcbfm.2013.68.
37. Pandi G, Nakka VP, Dharap A, et al. MicroRNA miR-29c down-regulation leading to de-repression of its target DNA methyltransferase 3a promotes ischemic brain damage. PloS One 2013;8(3):e58039. doi: 10.1371/journal.pone.0058039.
38. Dhiraj DK, Chrysanthou E, Mallucci GR, et al. miRNAs-19b, -29b-2* and -339-5p show an early and sustained up-regulation in ischemic models of stroke. PloS One 2013;8(12):e83717. doi: 10.1371/journal.pone.0083717.
39. Shi G, Liu Y, Liu T, et al. Upregulated miR-29b promotes neuronal cell death by inhibiting Bcl2L2 after ischemic brain injury. Exp Brain Res 2012;216(2):225– 30. doi: 10.1007/s00221-011-2925-3.
40. Laterza OF, Lim L, Garrett-Engele PW, et al. Plasma MicroRNAs as sensitive and specific biomarkers of tissue injury. Clin Chem 2009;55(11):1977– 83. doi: 10.1373/clinchem.2009.131797.
41. Meza-Sosa KF, Pedraza-Alva G, Pérez-Martínez L. MicroRNAs: key triggers of neuronal cell fate. Front Cell Neurosci 2014;8:175. doi: 10.3389/fncel.2014.00175.
42. Doeppner TR, Doehring M, Bretschneider E, et al. MicroRNA-124 protects against focal cerebral ischemia via mechanisms involving Usp14-dependent REST degradation. Acta Neuropathol 2013;126(2):251– 65. doi: 10.1007/s00401-013-1142-5.
43. Sun Y, Gui H, Li Q, et al. MicroRNA-124 protects neurons against apoptosis in cerebral ischemic stroke. CNS Neurosci Ther 2013;19(10):813– 9. doi: 10.1111/cns.12142.
44. Fang M, Wang J, Zhang X, et al. The miR-124 regulates the expression of BACE1/ β-secretase correlated with cell death in Alzheimer’s disease. Toxicol Lett 2012;209(1):94– 105. doi: 10.1016/j.toxlet.2011.11.032.
45. Liu XS, Chopp M, Zhang RL, et al. MicroRNA profiling in subventricular zone after stroke: MiR-124a regulates proliferation of neural progenitor cells through Notch signaling pathway. PloS One 2011;6(8):e23461. doi: 10.1371/journal.pone.0023461.
46. Zhu F, Liu JL, Li JP, et al. MicroRNA-124 (miR-124) regulates Ku70 expression and is correlated with neuronal death induced by ischemia/ reperfusion. J Mol Neurosci 2014;52(1):148– 55. doi: 10.1007/s12031-013-0155-9.
47. Miska EA, Alvarez-Saavedra E, Townsend M, et al.Microarray analysis of microRNA expression in the developing mammalian brain. Genome Biol 2004;5(9):R68.
48. Ouyang YB, Giffard RG. MicroRNAs affect BCL-2 family proteins in the setting of cerebral ischemia. Neurochem Int 2014;77:2– 8. doi: 10.1016/j.neuint.2013.12.006.
49. Ouyang YB, Lu Y, Yue S, et al. miR-181 regulates GRP78 and influences outcome from cerebral ischemia in vitro and in vivo. Neurobiol Dis 2012;45(1):555– 63. doi: 10.1016/j.nbd.2011.09.012.
50. Ouyang YB, Giffard RG. MicroRNAs regulate the chaperone network in cerebral ischemia. Transl Stroke Res 2013;4(6):693– 703. doi: 10.1007/s12975-013-0280-3.
51. Ouyang YB, Xu L, Liu S, et al. Role of astrocytes in delayed neuronal death: GLT-1 and its novel regulation by MicroRNAs. Adv Neurobiol 2014;11:171– 88. doi: 10.1007/978-3-319-08894-5_9.
52. Chan YC, Banerjee J, Choi SY, et al. miR-210: the master hypoxamir. Microcirc 2012;19(3):215– 23. doi: 10.1111/j.1549-8719.2011.00154.x.
53. Fasanaro P, D’Alessandra Y, Di Stefano V, et al. MicroRNA-210 modulates endothelial cell response to hypoxia and inhibits the receptor tyrosine kinase ligand Ephrin-A3. J Biol Chem 2008;283(23):15878– 83. doi: 10.1074/jbc.M800731200.
54. Lou L, Guo F, Liu F, et al. miR-210 activates notch signaling pathway in angiogenesis induced by cerebral ischemia. Mol Cell Biochem 2012;370(1– 2):45– 51. doi: 10.1007/s11010-012-1396-6.
55. Zeng L, He X, Wang Y, et al. MicroRNA-210 overexpression induces angiogenesis and neurogenesis in the normal adult mouse brain. Gene Ther 2014;21(1):37– 43. doi: 10.1038/gt.2013.55.
56. Sepramaniam S, Ying LK, Armugam A, et al. MicroRNA-130a represses transcriptional activity of aquaporin 4 M1 promoter. J Biol Chem 2012;287(15):12006– 15. doi: 10.1074/jbc.M111.280701.
57. Pan Y, Liang H, Liu H, et al. Platelet-secreted microRNA-223 promotes endothelial cell apoptosis induced by advanced glycation end products via targeting the insulin-like growth factor 1 receptor. J Immunol Baltim Md 2014;192(1):437– 46. doi: 10.4049/jimmunol.1301790.
58. Tabet F, Vickers KC, Cuesta Torres LF, et al. HDL--transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nat Commun 2014;5:3292. doi: 10.1038/ncomms4292.
59. Vickers KC, Landstreet SR, Levin MG, et al. MicroRNA-223 coordinates cholesterol homeostasis. Proc Natl Acad Sci U S A 2014;111(40):14518– 23. doi: 10.1073/pnas.1215767111.
60. Harraz MM, Eacker SM, Wang X, et al. MicroRNA-223 is neuroprotective by targeting glutamate receptors. Proc Natl Acad Sci U S A 2012;109(46):18962– 7. doi: 10.1073/ pnas.1121288109.
61. Duan X, Zhan Q, Song B, et al. Detection of platelet microRNA expression in patients with diabetes mellitus with or without ischemic stroke. J Diabetes Complications 2014;28(5):705– 10. doi: 10.1016/j.jdiacomp.2014.04.012.
62. Leung LY, Chan CP, Leung YK, et al. Comparison of miR-124-3p and miR-16 for early diagnosis of hemorrhagic and ischemic stroke. Clin Chim Acta 2014;433:139– 44. doi: 10.1016/j.cca.2014.03.007.
63. Liu Y, Zhang J, Han R, et al. Downregulation of serum brain specific microRNA is associated with inflammation and infarct volume in acute ischemic stroke. J Clin Neurosci 2015;22(2):291– 5. doi: 10.1016/j.jocn.2014.05.042.
64. Long G, Wang F, Li H, et al. Circulating miR-30a, miR--126 and let-7b as biomarker for ischemic stroke in humans. BMC Neurol 2013;13:178. doi: 10.1186/1471-2377-13-178.
65. Tsai PC, Liao YC, Wang Y-S, et al. Serum microRNA-21 and microRNA-221 as potential biomarkers for cerebrovascular disease. J Vasc Res 2013;50(4):346– 54. doi: 10.1159/000351767.
66. Zeng L, Liu J, Wang Y, et al. MicroRNA-210 as a novel blood biomarker in acute cerebral ischemia. Front Biosci 2011;3:1265– 72.
67. Wang Y, Zhang Y, Huang J, et al. Increase of circulating miR-223 and insulin-like growth factor-1 is associated with the pathogenesis of acute ischemic stroke in patients. BMC Neurol 2014;14:77. doi: 10.1186/1471-2377-14-77.
68. Vinciguerra A, Formisano L, Cerullo P, et al. MicroRNA--103-1 selectively downregulates brain NCX1 and its inhibition by anti-miRNA ameliorates stroke damage and neurological deficits. Mol Ther 2014;22(10):1829– 38. doi: 10.1038/mt.2014.113.
69. Yang ZB, Zhang Z, Li TB, et al. Up-regulation of brain-enriched miR-107 promotes excitatory neurotoxicity through down-regulation of glutamate transporter-1 expression following ischaemic stroke. Clin Sci Lond Engl 2014;127(12):679– 89. doi: 10.1042/CS20140084.
70. Chi W, Meng F, Li Y, et al. Downregulation of miRNA--134 protects neural cells against ischemic injury in N2A cells and mouse brain with ischemic stroke by targeting HSPA12B. Neuroscience 2014;277:111– 22. doi: 10.1016/j.neuroscience.2014.06.062.
71. Chi W, Meng F, Li Y, et al. Impact of microRNA-134 on neural cell survival against ischemic injury in primary cultured neuronal cells and mouse brain with ischemic stroke by targeting HSPA12B. Brain Res 2014;1592:22– 33. doi: 10.1016/j.brainres.2014.09.072.
72. Stary CM, Xu L, Sun X, et al. MicroRNA-200c contributes to injury from transient focal cerebral ischemia by targeting Reelin. Stroke 2015;46(2):551– 6. doi: 10.1161/STROKEAHA.114.007041.
73. Li LJ, Huang Q, Zhang N, et al. miR-376b-5p regulates angiogenesis in cerebral ischemia. Mol Med Rep 2014;10(1):527– 35. doi: 10.3892/mmr.2014.2172.
74. Liu P, Zhao H, Wang R, et al. MicroRNA-424 protects against focal cerebral ischemia and reperfusion injury in mice by suppressing oxidative stress. Stroke 2015;46(2):513– 9. doi: 10.1161/STROKEAHA.114.007482.
75. Zhao H, Wang J, Gao L, et al. MiRNA-424 protects against permanent focal cerebral ischemia injury in mice involving suppressing microglia activation. Stroke 2013;44(6):1706– 13. doi: 10.1161/STROKEAHA.111.000504.
76. Brown RD, Wiebers DO, Forbes GS. Unruptured intracranial aneurysms and arteriovenous malformations: frequency of intracranial hemorrhage and relationship of lesions. J Neurosur 1990;73(6):859– 63.
77. Brown RD, Broderick JP. Unruptured intracranial aneurysms: epidemiology, natural history, management options, and familial screening. Lancet Neurol 2014;13(4):393– 404. doi: 10.1016/S1474-4422(14)70015-8.
78. Shiue I, Arima H, Hankey GJ, et al. Modifiable lifestyle behaviours account for most cases of subarachnoid haemorrhage: a population-based case-control study in Australasia. J Neurol Sci 2012;313(1– 2):92– 4. doi: 10.1016/j.jns.2011.09.017.
79. Vernooij MW, Ikram MA, Tanghe HL, et al. Incidental findings on brain MRI in the general population. N Engl J Med 2007;357(18):1821– 8.
80. Lee HJ, Yi JS, Lee HJ, et al. Dysregulated expression profiles of microRNAs of experimentally induced cerebral aneurysms in rats. J Korean Neurosurg Soc 2013;53(2):72– 6. doi: 10.3340/jkns.2013.53.2.72.
81. Jiang Y, Zhang M, He H, et al. MicroRNA/ mRNA profiling and regulatory network of intracranial aneurysm. BMC Med Genomics 2013;6:36. doi: 10.1186/1755-8794-6-36.
82. Liu D, Han L, Wu X, et al. Genome-wide microRNA changes in human intracranial aneurysms. BMC Neurol 2014;14(1):188. doi: 10.1186/s12883-014-0188-x.
83. Jin H, Li C, Ge H, et al. Circulating microRNA: a novel potential biomarker for early diagnosis of intracranial aneurysm rupture a case control study. J Transl Med 2013;11:296. doi: 10.1186/1479-5876-11-296.
84. Li P, Zhang Q, Wu X, et al. Circulating microRNAs serve as novel biological markers for intracranial aneurysms. J Am Heart Assoc 2014;3(5):e000972. doi: 10.1161/JAHA.114.000972.
85. Maegdefessel L, Azuma J, Toh R, et al. MicroRNA-21 blocks abdominal aortic aneurysm development and nicotine-augmented expansion. Sci Transl Med 2012;4(122):22. doi: 10.1126/scitranslmed.3003441.
86. Boon RA, Seeger T, Heydt S, et al. MicroRNA-29 in aortic dilation: implications for aneurysm formation. Circ Res 2011;109(10):1115– 9. doi: 10.1161/CIRCRESAHA.111.255737.
87. Maegdefessel L, Azuma J, Tsao PS. MicroRNA-29b regulation of abdominal aortic aneurysm development. Trends Cardiovasc Med 2014;24(1):1– 6. doi: 10.1016/j.tcm.2013.05.002.
88. Merk DR, Chin JT, Dake BA, et al. MiR-29b participates in early aneurysm development in Marfan syndrome. Circ Res 2012;110(2):312– 24. doi: 10.1161/CIRCRESAHA.111.253740.
89. Elia L, Quintavalle M, Zhang J, et al. The knockout of miR-143 and -145 alters smooth muscle cell maintenance and vascular homeostasis in mice: correlates with human disease. Cell Death Differ 2009;16(12):1590– 8. doi: 10.1038/cdd.2009.153.
90. Doebele C, Bonauer A, Fischer A, et al. Members of the microRNA-17-92 cluster exhibit a cell-intrinsic antiangiogenic function in endothelial cells. Blood 2010;115(23):4944– 50. doi: 10.1182/blood-2010-01-264812.
91. Ferreira R, Santos T, Amar A, et al. Argonaute-2 promotes miR-18a entry in human brain endothelial cells. J Am Heart Assoc 2014;3(3):e000968. doi: 10.1161/JAHA.114.000968.
92. Ferreira R, Santos T, Amar A, et al. MicroRNA-18a improves human cerebral arteriovenous malformation endothelial cell function. Stroke 2014;45(1):293– 7. doi: 10.1161/STROKEAHA.113.003578.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2016 Issue 3
Most read in this issue
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Validační studie české verze Bostonského testu pojmenování
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
