Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
Surgical Treatment of Supratentorial Cortico‑ subcortical Cavernous Malformation
Aim:
The aim of the study is to present surgical outcome of treatment of supratentorial cavernous malformation of the brain at the Department of Neurosurgery, Charles University and the Central Military Hospital in Prague.
Material and methods:
We retrospectively enrolled patients diagnosed between 2000 and 2012 with supratentorial, cortico‑ subcortically located cavernoma. We analysed epidemiological and radiological data, clinical presentation and surgical results including complications.
Results:
Initial symptoms included epileptic seizure (49%), headache (22%) and focal neurological deficit (19%); 15% of cavernomas were found incidentally. Radiological signs of recent haemorrhage on MR scans were found in 27% patients. We performed surgery in 145 patients with 158 cavernous malformations. Twenty five lesions were treated conservatively. Surgical complications occurred in 8% of patients. One patient died and one had permanent neurological deficit attributable to surgery. Postoperative seizure rate was significantly higher in a group with wound infection or postoperative hematoma (p < 0.05).
Conclusion:
Microsurgical resection of lobar cavernoma is relatively safe procedure with minimal morbidity and mortality. Postoperative hematoma or wound infection might have an epileptogenic potential.
Key words:
cavernous malformation – microsurgery – epilepsy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
:
M. Májovský; D. Netuka; O. Bradáč; V. Beneš
:
Neurochirurgická klinika 1. LF UK a ÚVN – VFN Praha
:
Cesk Slov Neurol N 2014; 77/110(5): 631-637
:
Short Communication
Podpořeno IGA MZ NT 13627.
Cíl:
Cílem studie je představit dlouhodobé výsledky chirurgické léčby supratentoriálních kavernózních malformací mozku na Neurochirurgické klinice 1. LF UK a ÚVN‑ VFN.
Soubor a metodika:
Retrospektivně jsme do studie zařadili pacienty se supratentoriálním, kortiko‑ subkortikálně uloženým kavernomem léčené v letech 2000– 2012. Hodnotili jsme epidemiologická data pacientů, radiologický nález, klinický obraz onemocnění a operační výsledky včetně komplikací.
Výsledky:
Iniciálním příznakem byl epileptický záchvat (u 49 % kavernomů), cefalea (22 %), fokální neurologický deficit (19 %) a 15 % bylo náhodně nalezených. Známky recentního krvácení na MR byly přítomny u 27 % pacientů. Operovali jsme celkem 145 pacientů s 158 kavernomy. Dvacet pět lézí bylo léčeno konzervativně. K chirurgické komplikaci došlo v 8 %. U dvou pacientů (1,4 %) se trvale zhoršil stav v přímé souvislosti s operací. Pooperační výskyt epileptického záchvatu byl signifikantně vyšší ve skupině s rannou infekcí či pooperačním hematomem (p < 0,05).
Závěr:
Mikrochirurgická resekce hemisferálního kavernomu je relativně bezpečná operace s minimální morbiditou a mortalitou. Pooperační hematom nebo ranná infekce může mít epileptogenní potenciál.
Klíčová slova:
kavernózní malformace – mikrochirurgie – epilepsie
Úvod
Kavernomy (též kavernózní angiomy) jsou cévní malformace tvořené klubkem dilatovaných patologických cév, v jejichž stěně chybí hladká svalovina. Svým tvarem bývají často přirovnávány k plodu moruše nebo k popcornu (obr. 1). Na rozdíl od arteriovenózních malformací jsou nízkoprůtokové (netvoří AV zkrat) a nejsou zobrazitelné angiograficky. Náplní je buď krev, nebo trombus v různé fázi organizace. Termín „kavernózní malformace“ použil poprvé patolog českého původu Karel Rokytanský v roce 1855 pro tuto lézi v játrech [1]. První případ mozkového kavernomu popsal Hubert von Lushka o rok dříve [2] a první sérii pěti operovaných pacientů publikoval Walter Dandy v roce 1928 [3]. V české literatuře poprvé představuje problematiku kavernomů Zvěřina ve své kapitole v knize Mozkové ischemie a hemoragie [4]. Kozler et al publikují první sérii 14 operovaných pacientů v roce 1999 [5].
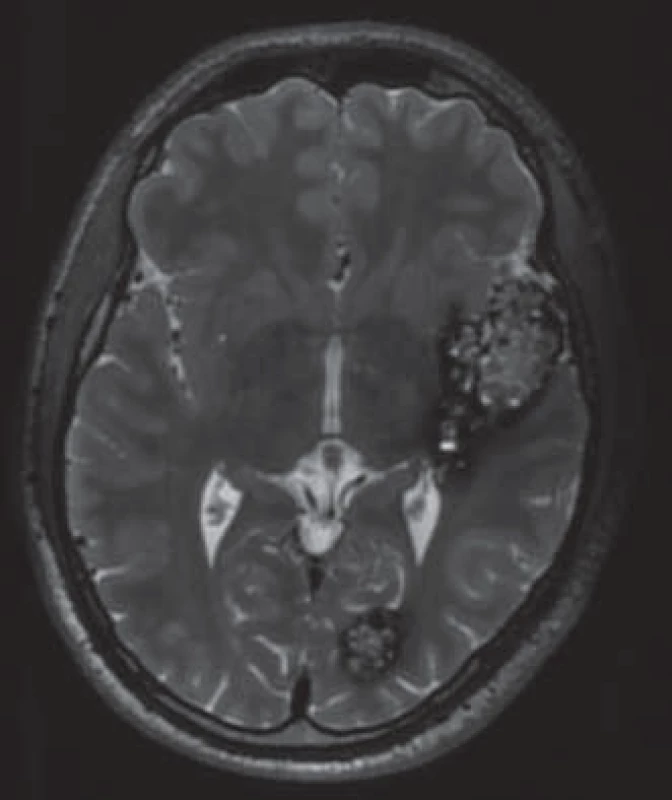
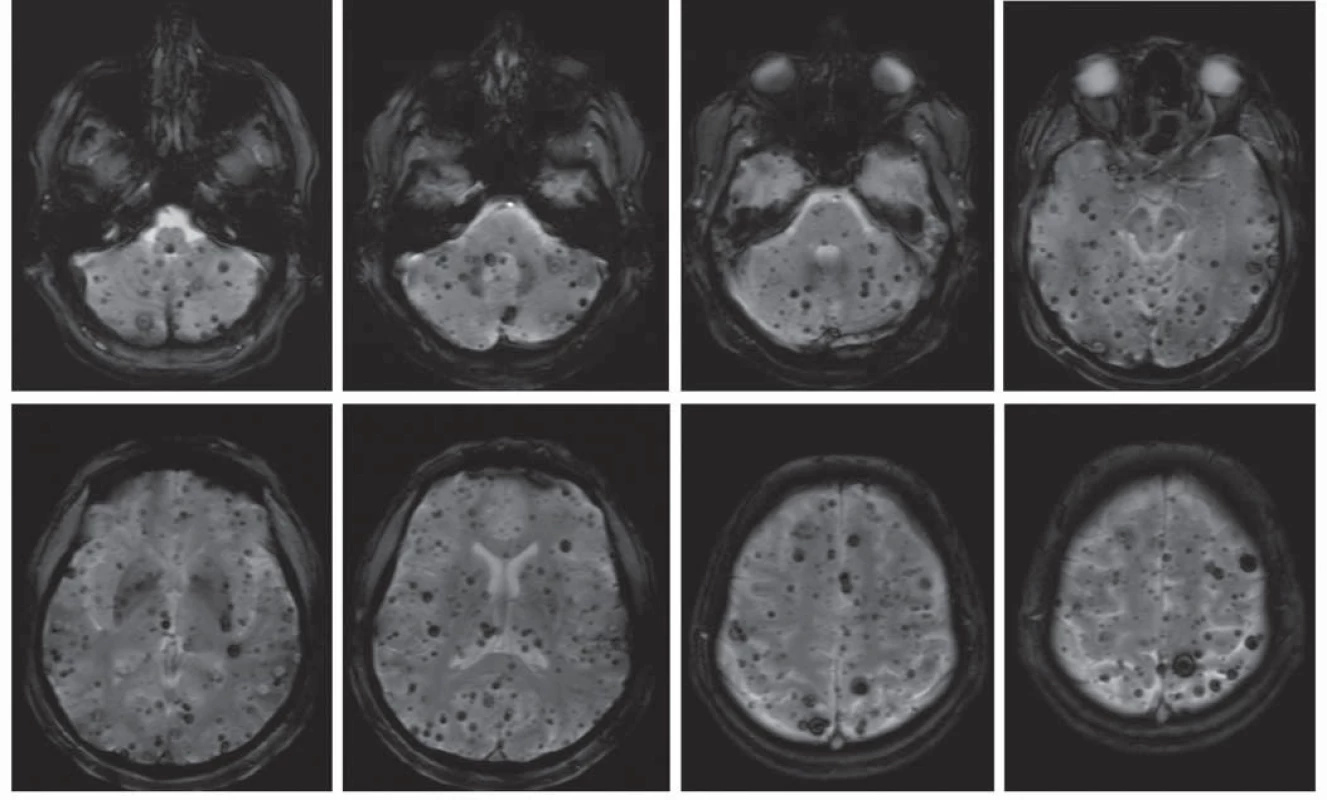
Prevalence v populaci je přibližně 0,6 % [6], což řadí kavernomy mezi nejčastější cévní malformace mozku. Vyskytují se buď jako sporadické léze (80 %), nebo jako hereditární onemocnění s autozomálně dominantním typem dědičnosti (20 %) [7]. Labauge et al ukázali na neúplnou penetranci hereditární formy, proto je její podíl pravděpodobně ještě vyšší [8]. Pacienti s dědičnou formou onemocnění mají častěji mnohočetné kavernomy (obr. 2). Asi v jedné třetině případů se kavernomy vyskytují spolu s další cévní malformací – venózním angiomem (Developmental Venous Anomaly, DVA). Samy o sobě jsou venózní angiomy benigní léze [9], ovšem jak bude uvedeno dále, mohou zvyšovat riziko krvácení z kavernomu [10].
Přirozený průběh onemocnění je ve většině případů příznivý a malformace zůstává asymptomatická. Pokud se klinicky projeví, příznakem supratentoriálních lézí je epileptický záchvat, fokální deficit nebo cefalea, případně jejich kombinace. Infratentoriální kavernomy se většinou projevují různým stupněm mozečkových či kmenových příznaků, mohou ale také způsobit devastující kmenové krvácení a smrt pacienta [11].
Všechny uvedené příznaky vznikají na podkladě většího či menšího extralezionálního krvácení. Hlavní rizikový faktor pro krvácení je již proběhlá hemoragie. Prospektivní observační studie uvádějí riziko krvácení 0,2– 0,6 % za rok pro incidentální kavernomy a 4,5– 7,4 % za rok pro léze, které se projevily symptomatickou hemoragií [12– 14]. Zdá se tedy, že existují jednak kavernomy, jež mají tendenci k benignímu chování, a jednak kavernomy, které jsou rizikovější a pravděpodobně budou krvácet. Bohužel nemáme v tuto chvíli přesvědčivý diagnostický nástroj, jak tyto dvě skupiny předem identifikovat. Některé studie naznačují, že pokud se kavernom vyskytuje spolu s venózním angiomem, riziko hemoragie je vyšší [10]. Další charakteristiky kavernózních malformací, jako jsou velikost, lokalizace či jejich multiplicita, nemají na míru krvácení vliv [13]. Lokalizace v elokventních částech mozku pochopitelně zvyšuje klinickou závažnost eventuálního krvácení, ale četnost krvácení je stejná jako v jiných oblastech.
Léčebná modalita, která přichází v úvahu na prvním místě, je mikrochirurgická resekce. Další možnost je observace a ve vzácných případech i radiochirurgie. Většina autorů se shoduje na tom, že hemisferálně uložený symptomatický kavernom je indikován k operaci. Resekce musí být radikální, protože ponechání rezidua ještě zvyšuje riziko krvácení v porovnání s přirozeným průběhem onemocnění [15].
Naše výsledky u kmenových kavernomů jsme referovali v Acta Neurochirurgica [16], dále jsme ve stejném období operovali 15 míšních kavernomů. Zde si dovolujeme předložit naši sérii supratentoriálních kavernomů.
Soubor a metodika
Do souboru jsme zařadili pacienty s kavernomem mozku léčené na Neurochirurgické klinice 1. LF UK a ÚVN v letech 2000 až 2012. Retrospektivně jsme zjišťovali epidemiologická data pacientů, klinický obraz onemocnění a operační výsledky. Zařazeni byli všichni pacienti, u kterých klinický i MR nález odpovídal kavernomu, u operovaných byla diagnóza potvrzena histologicky. Hodnotili jsme iniciální příznaky (porucha vědomí, cefalea, epileptický záchvat, fokální deficit). Sledovali jsme, zda kavernom krvácel, přičemž krvácení jsme definovali jako známky extralezionální hemoragie na MR, která se projevila klinicky.
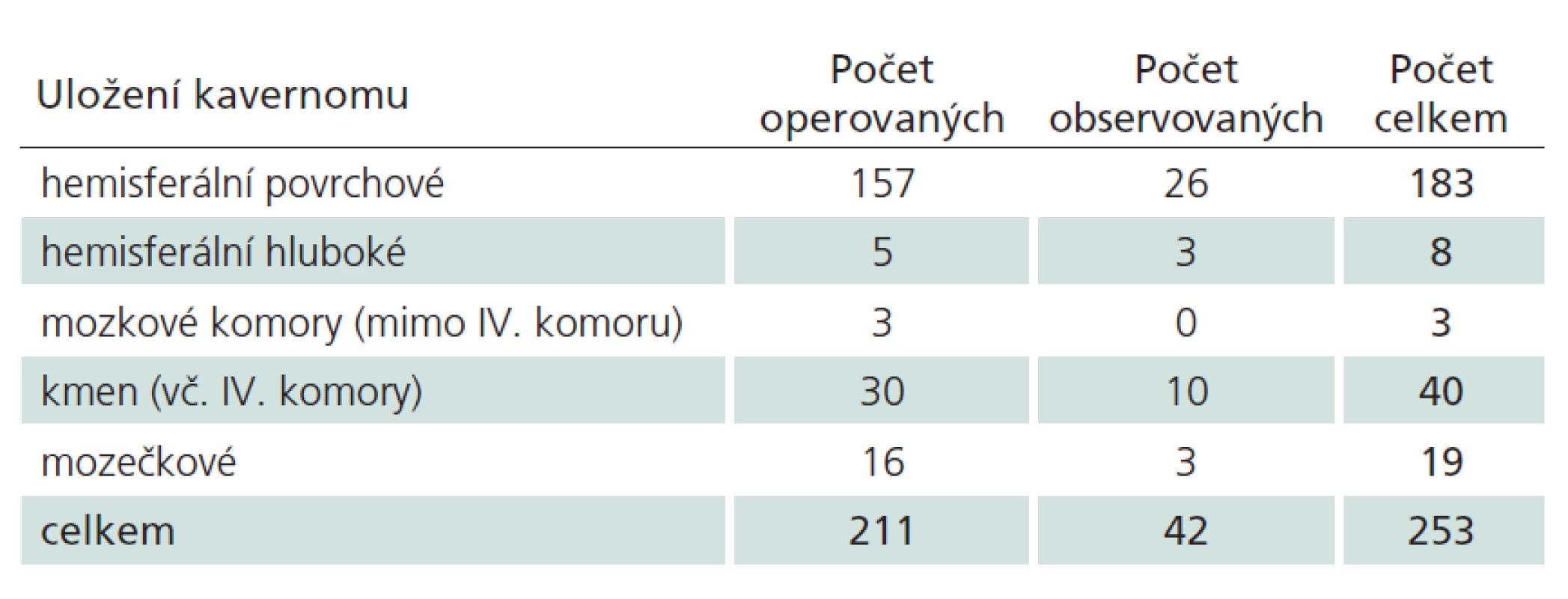
Celkem jsme vyšetřili 211 pacientů (104 žen a 107 mužů), u nichž jsme diagnostikovali 253 kavernomů. Anatomická distribuce byla následující: 194 supratentoriálně, 59 infratentoriálně, z toho 40 bylo v mozkovém kmeni a 19 v mozečku (tab. 1). Dvacet šest pacientů bylo nositeli více než jednoho kavernomu, u devíti z nich byla molekulárně genetickými metodami potvrzena heterozygotní mutace v jednom z genů CCM.
K operaci jsme indikovali celkem 187 pacientů s 211 kavernomy. Indikovány byly jednoznačně kavernomy, které krvácely. U asymptomatických lézí byla zvážena jejich lokalizace, chirurgická dostupnost, komorbidity pacienta a přihlédnuto bylo i k přání pacienta.
V dalším textu se budeme věnovat pouze supratentoriálně kortiko‑ subkortikálně uloženým lézím. Hluboko uložené kavernomy (mozkové komory, bazální ganglia, capsula interna) představují zcela odlišnou problematiku ve smyslu symptomatologie, indikace k operaci i operačního přístupu [16,17]. Supratentoriálních kortiko‑ subkortikálních lézí jsme zaznamenali celkem 183. Distribuovány byly, s přihlédnutím k velikosti jednotlivých laloků, proporcionálně – 72 kavernomů frontálně, 47 temporálně, 43 parietálně a 21 okcipitálně.
Klinickým příznakem byl nejčastěji epileptický záchvat (u 49 % kavernomů), cefalea (22 %), fokální deficit (19 %) a 15 % bylo náhodně nalezených. Známky recentního krvácení na MR byly zjištěny u 27 % pacientů. Průměrný věk pacientů v době diagnózy byl 37 let, nejmladšímu bylo devět let a nejstaršímu 68 let.
Výsledky
Operovali jsme 145 pacientů se 158 kavernomy. Dvacet pět kavernomů bylo řešeno konzervativně. Díky rutinnímu použití neuronavigace bylo možné provést kraniotomii pouze v rozsahu nezbytném pro bezpečnou resekci léze. Pětkrát se stalo, že kavernom nebyl napoprvé nalezen, proto jsme provedli novou magnetickou rezonanci a poté kavernom resekovali. V období před rokem 2008 jsme museli v takovém případě pacienta v celkové anestezii převézt z operačního sálu na pracoviště MR, provést zobrazovací vyšetření a pak transportovat zpět na sál. Po otevření nového sálu s možností intraoperační MR se celý proces výrazně zjednodušil a zkrátil. Při plánování operačního výkonu lézí v blízkosti elokventních oblastí jsme doplnili funkční MR a traktografii, peroperačně potom monitorovali elektrofyziologickou kortikální i subkortikální stimulací. Tzv. awake kraniotomie má své místo při plánování chirurgického přístupu ke kavernomu v blízkosti řečových center, v našem souboru jsme ji použili u jednoho pacienta.
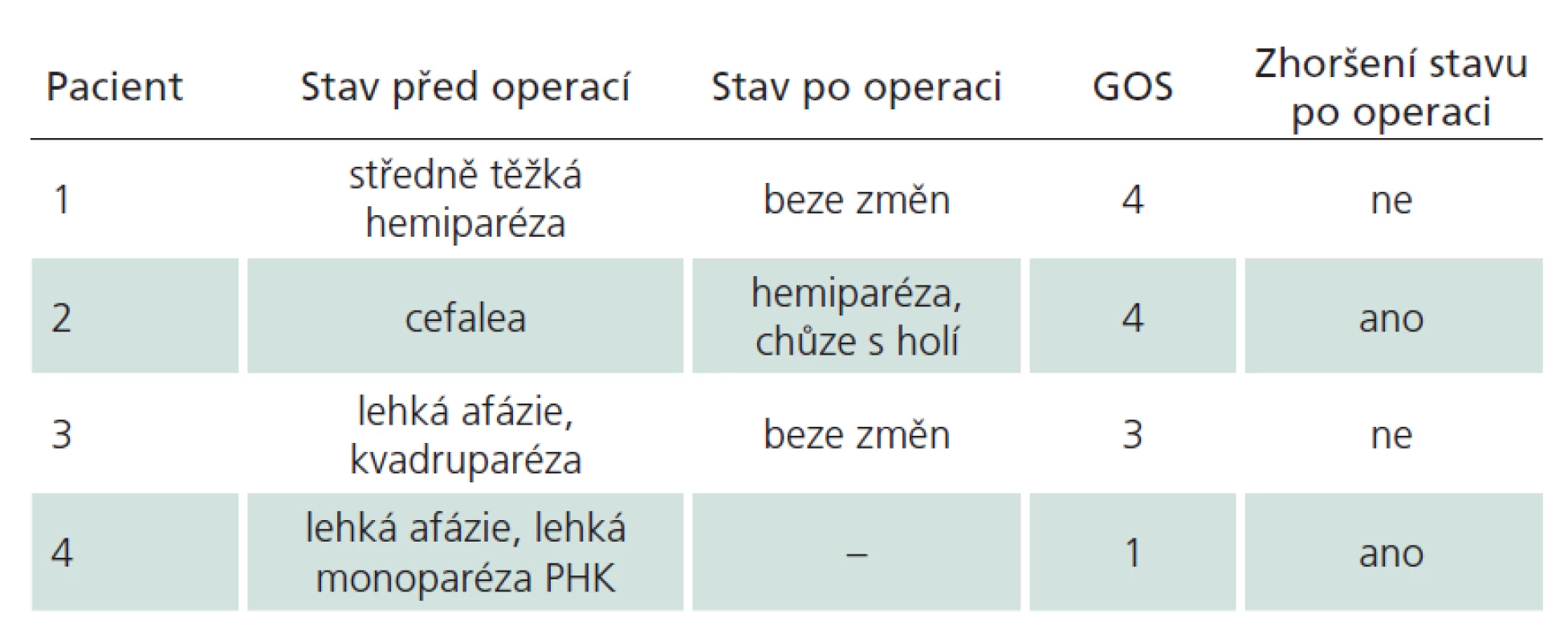
MR‑ radikální resekce bylo dosaženo ve 156 případech. Ze zbylých dvou pacientů (1,4 %), u kterých pooperační magnetická rezonance prokázala reziduum, byl pouze jeden symptomatický, a vyžádal si tak druhý výkon. Druhý pacient byl zcela bez příznaků, riziko reoperace v již operovaném terénu by převážilo benefit, a proto jsme od intervence ustoupili. V obou případech byla původně zamýšlena radikální resekce, a tudíž reziduum považujeme za chirurgickou chybu. Všichni pacienti byli dlouhodobě ambulantně sledováni, průměrný follow‑up byl 29 měsíců. Klinický stav jsme hodnotili dle Glasgow Outcome Scale (GOS) [18]. GOS bylo jen u čtyř pacientů (2,7 %) nižší než 5 (GOS 4 dva pacienti, GOS 3 jeden pacient, GOS 1 jeden pacient). Dva z nich byli už předoperačně v horším klinickém stavu následkem krvácení z kavernomu, u dvou (1,4 %) došlo ke zhoršení po výkonu (viz dále a tab. 2).
Jak jsme již uvedli, zaznamenali jsme jedno úmrtí u 64leté pacientky po atypickém intracerebrálním krvácení z kavernomu uloženého parietálně vlevo. Po proběhlém krvácení měla lehkou percepční afázii a lehkou parézu pravé horní končetiny. Po kompenzaci interních komorbidit jsme 18 dní po krvácení indikovali resekci léze. Pooperační průběh byl komplikován výrazným lokálním otokem mozku a rezultujícím zhoršením klinického stavem ve smyslu těžké pravostranné hemiparézy a výrazné zmatenosti. Posléze se rozvinula infekční komplikace v místě kraniotomie a pod obrazem těžké sepse pacientka 37. den po operaci zemřela.
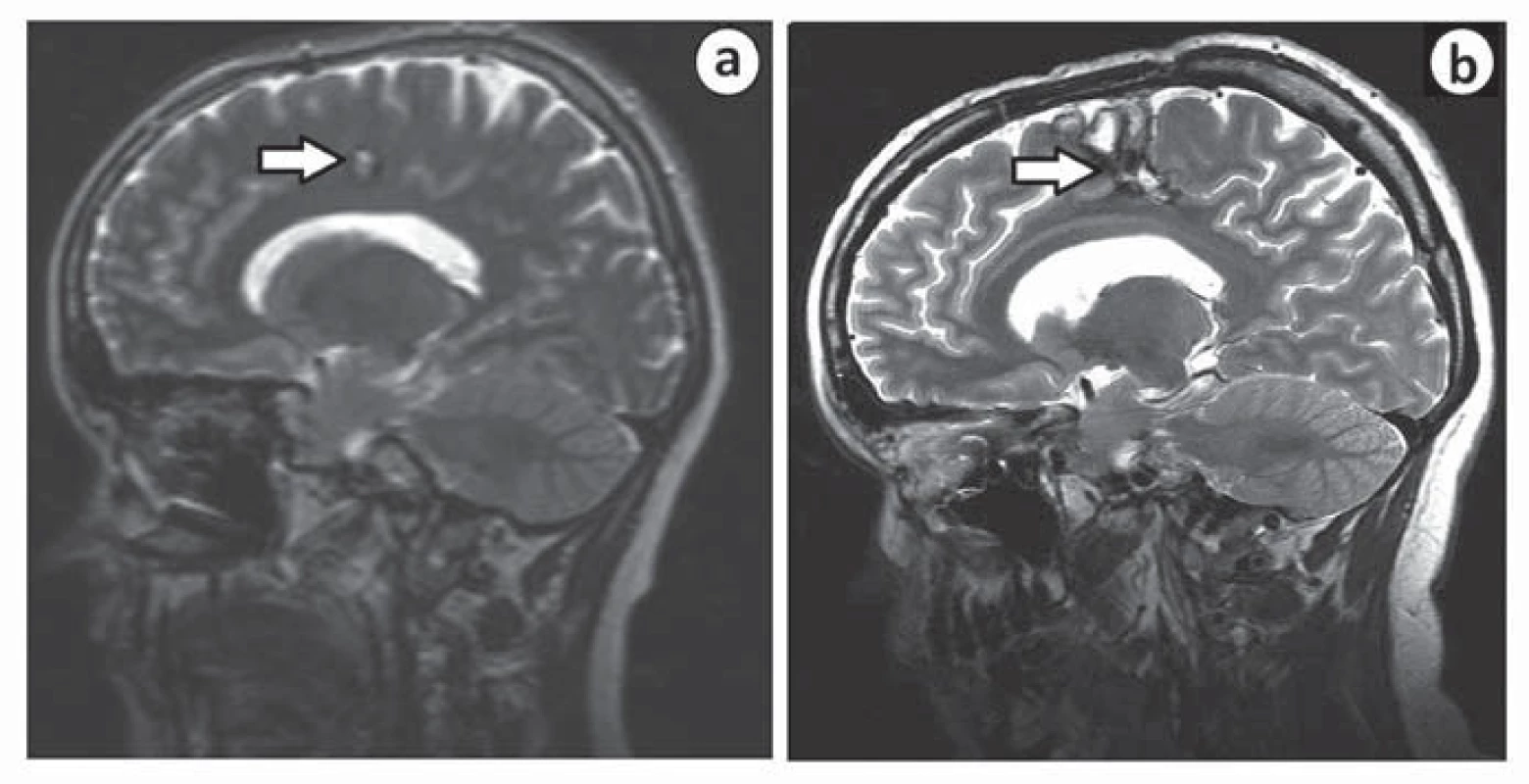
Druhá pacientka, u níž došlo ke zhoršení stavu po výkonu, byla operována v roce 2007 pro kavernom v gyrus cinguli vpravo, v sousedství gyrus praecentralis. Iniciální příznak byla pouze chronická bolest hlavy. Po operaci došlo k rozvoji těžké levostranné hemiparézy s plegií na levé dolní končetině. Intenzivní fyzioterapie upravila deficit na středně těžkou hemiparézu, pacientka je nyní schopna chůze s holí. Za příčinu komplikace považujeme špatně zvolenou trajektorii chirurgického přístupu k lézi (obr. 3).
K chirurgické komplikaci (krvácivé či infekční) došlo v 12 případech (7,6 %). Pooperační hematom se vyskytl u pěti pacientů (3,2 %), z toho tři si vyžádaly operační revizi. Konzervativně jsme řešili dva drobné asymptomatické pooperační hematomy, které se spontánně resorbovaly.
V jednom případě se vyskytla krvácivá komplikace v důsledku neúmyslného uzavření venózního angiomu. Po resekci kavernomu temporálně vlevo u mladého muže došlo k rozvoji expresivní fatické léze. CT vyšetření ukázalo intracerebrální krvácení v oblasti kraniotomie, které jsme hodnotili jako hemoragickou infarzaci. Při operační revizi se tento předpoklad potvrdil – venózní angiom byl trombotizovaný. Afázie se postupně upravila ad integrum a pacient byl po celou dobu sledování bez obtíží.
U druhého pacienta, kde byla nutná revize pro hematom, se peroperačně jedna z odvodných žil musela obětovat, aby se získal přístup k lézi. Jednalo se o kavernom o průměru 2,5 cm uložený temporoparietálně vlevo. Pooperačně se rozvinula hemiparéza a expresivní afázie. Po chirurgické revizi se stav zlepšil a pacient je dlouhodobě bez následků. Za příčinu komplikace považujeme opět venózní infarkt způsobený přerušením drénující žíly (obr. 4).



Infekční komplikace nastala celkem u sedmi pacientů (4,4 %). Z tohoto počtu šlo šestkrát o osteomyelitidu s následnou revizí a jednou o povrchovou rannou infekci, která se spontánně zhojila. Klinicky se chirurgická komplikace projevila epileptickým záchvatem, topickým neurologickým nálezem nebo lokálními známkami infekce.
U 10 pacientů neměla chirurgická komplikace žádné dlouhodobé následky, v jednom případě došlo k úmrtí u pacientky na těžkou sepsi v souvislosti s osteomyelitidou a v jednom případě k trvalému pooperačnímu deficitu (středně těžká hemiparéza) – oba viz výše.
Hodnotili jsme též časný pooperační výskyt epileptických záchvatů (do 30 dnů po výkonu). Alespoň jeden záchvat se vyskytl u 25 pacientů. Dvacet z nich prodělalo epileptický záchvat už i před operací.
Statistické vyhodnocení bylo provedeno pomocí Fisherova exaktního testu (Fisher two‑sided exact test). Sledovali jsme souvislost mezi pooperační komplikací a výskytem epileptických záchvatů (viz dále).
Diskuze
I přes rutinní použití bezrámové navigace jsme v pěti případech nedokázali kavernom při výkonu ihned nalézt. Zatímco při plánování kraniotomie je nepřesnost navigace v řádu milimetrů, po odklopení kostní ploténky a vypuštění likvoru může dojít k posunu mozkové tkáně až o centimetr. U relativně malých lézí, jako jsou kavernomy, to znesnadňuje jejich lokalizaci.
V éře před intraoperační magnetickou rezonancí jsme provedli dočasnou suturu rány a v celkové anestezii pacienta převezli na radiodiagnostické pracoviště k akvizici MR. Od roku 2008 jsme ve třech případech s výhodou využili intraoperační MR (iMR). Jedná se o další využití iMR, které představuje výhody jak pro pacienta, tak pro chirurga. Z pohledu pacienta se významně zkracuje čas v celkové anestezii a snižuje se riziko potenciální infekční komplikace, protože neopouští operační trakt. Operatér této možnosti využije, pokud má pocit, že disekce mozkové tkáně při hledání kavernomu je příliš rozsáhlá, zejména v elokventních oblastech mozku.
Další možností, jak využít iMR při resekcích kavernomů v blízkosti pyramidové dráhy, je peroperační traktografie. Spolu s elektrofyziologickým monitoringem pomáhá identifikovat polohu kortikospinální dráhy a zvyšuje bezpečnost výkonu [19].
Mortalita (GOS 1) a těžká morbidita (GOS 2– 3) v našem souboru dosahuje 1,4 %. Práce s více než 50 operovanými pacienty se supratentoriálním kavernomem uvádějí výskyt dlouhodobé těžké morbidity v rozmezí 0– 4,8 % [20– 26].
Mikrochirurgická resekce lobárního kavernomu nebývá technicky náročná. Používá se transsulkální přístup, který umožňuje použít nejkratší operační koridor k lézi [27,28]. Rozhodující je pečlivá předoperační rozvaha s cílem zvolit správnou trajektorii přístupu. Jako ilustrativní příklad uvádíme mladou pacientku s kavernomem uloženým precentrálně vlevo (obr. 5a, b). Před výkonem jsme provedli traktografii DTT (Diffusion Tensor Tractography), jež lokalizovala kortikospinální trakt laterálně od kavernomu (obr. 5c, d).Abychom se pyramidové dráze vyhnuli, zvolili jsme přístup kontralaterální – transfalcinní a kavernom za použití elektrofyziologického monitorování úspěšně resekovali (obr. 5e, f). Pacientka měla jen přechodně lehkou parézu pravé dolní končetiny, která se spontánně upravila. Transfalcinní přístup poprvé popsal Goel v roce 1995 [29]. Je výhodný pro léze uložené blízko střední čáry v situacích, kdy je ipsilaterální přístup příliš riskantní [30]. Využití DTT v plánování přístupu k paraventrikulárnímu kavernomu popisují i Niizuma et al [31].



Při analýze našich výsledků jsme zjistili asociaci mezi chirurgickou komplikací a pooperačním výskytem epileptických záchvatů. U 54 % pacientů s pooperačním hematomem či místní infekcí došlo do 30 dnů od výkonu k epileptickému záchvatu. Ve skupině bez chirurgické komplikace byl výskyt výrazně nižší – 13,6 %. Rozdíl obou sledovaných skupin je statisticky signifikantní (p = 0,0017). Předpokládaný patofyziologický mechanizmus může být dvojí – působení volných radikálů a iontová dysbalance na membráně neuronů [32]. I při nevelkém krvácení do resekční dutiny jsou v důsledku rozkladu erytrocytů neurony vystaveny působení hemoglobinu. Uvolněné železo reaguje s peroxidem vodíku za vzniku volných radikálů (Reactive Oxygen Species, ROS), které mají epileptogenní účinek. Dále ROS inhibují tvorbu kyseliny gamaaminomáselné (GABA), což dále zvyšuje excitabilitu neuronů [32]. V případě infekční komplikace dochází také ke vzniku volných radikálů. Při floridním purulentním zánětu se uvolňuje velkého množství ROS z aktivovaných fagocytů (neutrofilů a makrofágů), které potom působí výše zmíněným způsobem. Druhým popsaným epileptogenním mechanizmem je porucha distribuce iontů v oblasti cytoplazmatické membrány neuronů. K tomu dochází lokální ischemizací nervové tkáně, jež může být způsobena pouhou manipulací při resekci kavernomu nebo např. použitím retraktorů. Ischemie sníží dostupnost energetického substrátu ATP pro Na+/ K+ pumpu, která udržuje napěťový a chemický gradient na membráně, a tím hyperpolarizaci nervové buňky. Selhání této funkce logicky usnadňuje depolarizaci neuronu a to vyústí opět v hyperexcitabilitu neuronu [32].
Dostupná literatura na toto téma je velmi chudá. Dosud nebyla publikována klinická práce, která by se zabývala časnou pooperační epilepsií v souvislosti s rannou komplikací v místě kraniotomie po neurochirurgickém výkonu. Pouze Lieu et al se ve své práci o epilepsii po operacích intrakraniálních meningeomů zmiňují o tom, že ve skupině pacientů se záchvatem do jednoho týdne po operaci mělo v 33 % z nich hematom v resekční dutině [33]. Naší hypotézu, tedy že jak pooperační hematom, tak infekční komplikace zvyšují riziko symptomatické epilepsie, je třeba ověřit v prospektivně vedené studii. Zároveň se nabízí otázka, zda epileptickému paroxyzmu u pacientů se známou komplikací lze předejít profylakticky podávanou antiepileptickou léčbou.
Dva z pěti případů hemoragických komplikací připisujeme nechtěnému uzavření venózního angiomu. Přestože jde o anomální cévy, mají svou fyziologickou drenážní funkci [34]. Jejich přerušení nebo trombotizace vede k venóznímu infarktu příslušné mozkové tkáně a může vyústit v hemoragickou infarzaci se závažnými klinickými důsledky. Většina autorů DVA při operaci šetří a vůbec je neatakuje [35– 37]. Na druhé straně existují práce, které popisují chirurgickou léčbu těchto lézí. Yamada et al definovali podskupinu DVA, již pojmenovali „perikapilární arteriovenózní malformace“ a které s úspěchem resekovali [38]. Wurm et al obhajují koagulaci venózních angiomů ve snaze zabránit recidivě kavernomu [39]. Publikovali sérii 15 pacientů operovaných pro kavernom s přidruženým DVA. Ve skupině, kde byl angiom ponechán intaktní (devět pacientů), došlo ke třem recidivám kavernomu. Ve skupině, u níž byl angiom koagulován (šest pacientů), ani k jedné. Sami se venózním angiomům pečlivě vyhýbáme a úzkostlivě je chráníme. Jedno ze dvou úmrtí v naší sérii kmenových kavernomů bylo způsobeno vynucenou obětí DVA probíhajícího přes kavernom [16].
K infekční komplikaci v místě operační rány došlo v naší sérii v 4,4 % případů. Používáme rutinně antibiotickou profylaxi podáním 2 g cefazolinu 30– 60 min před incizí [40]. Literatura uvádí poměrně široké rozmezí výskytu ranných infekcí po elektivní kraniotomii: 0,8– 7,8 % [41– 44]. Haines považuje prevalenci pod 5 % za přijatelnou [45]. Kivelev et al publikovali chirurgickou sérii 48 temporálně uložených kavernomů s výskytem ranné infekce 4 % [20].
Závěr
Mikrochirurgická resekce hemisferálního kavernomu je v rukách zkušeného neurochirurga relativně bezpečná operace s minimální morbiditou a mortalitou. MR‑ radikální resekce lze dosáhnout v naprosté většině případů, a předejít tak eventuálnímu krvácení. V situaci, kdy není při operaci kavernom ihned nalezen, je elegantním pomocníkem iMR. Pooperační hematom nebo ranná infekce může mít epileptogenní potenciál. Na základě našich zkušeností doporučujeme zvážit profylaktické podávání antiepileptické terapie u pacientů s jakoukoliv chirurgickou komplikací, aby se předešlo pooperačním epileptickým záchvatům.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Májovský
Neurochirurgická klinika
1. LF UK a ÚVN – VFN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: martin.majovsky@uvn.cz
Přijato k recenzi: 17. 2. 2014
Přijato do tisku: 14. 4. 2014
Sources
1. Rokytansky C, Swaine WE. Manual of pathological anatomy. Philadelphia: Blanchard & Lea 1855: 191– 194.
2. Luschka H. Cavernose Blutgeschwulst des Gehirns. Virchows Arch 1854; 6: 458– 470.
3. Dandy WE. Venous abnormalities and angiomas of the brain. Arch Surg 1928; 17: 715– 793.
4. Zvěřina E. Chirurgie cévních onemocnění mozku. In: Kalvach et al (eds). Mozkové ischemie a hemoragie. Praha: Grada Publishing 1997: 321– 351.
5. Kozler P, Beneš V. Supratentoriální kavernomy. Cesk Slov Neurol N 1999; 62/ 95: 271– 276.
6. Moriarity JL, Clatterbuck RE, Rigamonti D. The natural history of cavernous malformations. Neurosurg Clin N Am 1999; 10(3): 411– 417.
7. Rigamonti D, Hadley MN, Drayer BP, Johnson MC, Hoenig‑ Rigamonti K, Knight JT et al. Cerebral cavernous malformations. Incidence and familial occurrence. N Engl J Med 1988; 319(6): 343– 347.
8. Labauge P, Laberge S, Brunereau L, Levy C, Tournier‑ Lasserve E. Hereditary cerebral cavernous angiomas: clinical and genetic features in 57 French families. Lancet 1998; 352(9144): 1892– 1897.
9. Töpper R, Jürgens E, Reul J, Thron A. Clinical significance of intracranial developmental venous anomalies. J Neurol Neurosurg Psychiatry 1999; 67(2): 234– 238.
10. Abdulrauf SI, Kaynar MY, Awad IA. A comparison of the clinical profile of cavernous malformations with and without associated venous malformations. Neurosurgery 1999; 44(1): 41– 46.
11. Dey M, Turner MS, Wollmann R, Awad IA. Fatal „hypertensive“ intracerebral hemorrhage associated with a cerebral cavernous angioma: case report. Acta Neurochir 2011; 153(2): 421– 423. doi: 10.1007/ s00701‑ 010‑ 0801‑ 8.
12. Al‑ Holou WN, O‘Lynnger TM, Pandey AS, Gemmete JJ, Thompson BG, Muraszko KM et al. Natural history and imaging prevalence of cavernous malformations in children and young adults. J Neurosurg Pediatr 2012; 9(2): 198– 205. doi: 10.3171/ 2011.11.PEDS11390.
13. Kondziolka D, Lunsford LD, Kestle JR. The natural history of cerebral cavernous malformations. J Neurosurg 1995; 83(5): 820– 824.
14. Kondziolka D, Monaco EA 3rd, Lunsford LD. Cavernous malformations and hemorrhage risk. Prog Neurol Surg 2013; 27: 141– 146. doi: 10.1159/ 000341774.
15. Kivelev J, Niemelä M, Kivisaari R, Dashti R, Laakso A,Hernesniemi J. Long‑term outcome of patients with multiple cerebral cavernous malformations. Neurosurgery 2009; 65(3): 450– 455. doi: 10.1227/ 01.NEU.0000346269.59554.DB.
16. Bradac O, Majovsky M, de Lacy P, Benes V. Surgery of brainstem cavernous malformations. Acta Neurochir 2013; 155(11): 2079– 2083. doi: 10.1007/ s00701‑ 013‑ 1842‑ 6.
17. Wostrack M, Shiban E, Harmening K, Obermueller T, Ringel F, Ryang YM et al. Surgical treatment of symptomatic cerebral cavernous malformations in eloquent brain regions. Acta Neurochir 2012; 154(8): 1419– 1430. doi: 10.1007/ s00701‑ 012‑ 1411‑ 4.
18. Jennett B, Bond M. Assessment of outcome after severe brain damage. Lancet 1975; 1(7905): 480– 484.
19. Ostrý S, Belšan T, Otáhal J, Beneš V, Netuka D. Is intraoperative diffusion tensor imaging at 3.0T comparable to subcortical corticospinal tract mapping? Neurosurgery 2013; 73(5): 797– 807. doi: 10.1227/ NEU.0000000000000087.
20. Kivelev J, Niemelä M, Blomstedt G, Roivainen R, Lehecka M, Hernesniemi J. Microsurgical treatment of temporal lobe cavernomas. Acta Neurochir 2011; 153(2): 261– 270. doi: 10.1007/ s00701‑ 010‑ 0812‑ 5.
21. Stavrou I, Baumgartner C, Frischer JM, Trattnig S,Knosp E. Long‑term seizure control after resection of supratentorial cavernomas: a retrospective single‑center study in 53 patients. Neurosurgery 2008; 63(5): 888– 896. doi: 10.1227/ 01.NEU.0000327881.72964.6E.
22. Baumann CR, Acciarri N, Bertalanffy H, Devinsky O, Elger CE, Lo Russo G et al. Seizure outcome after resection of supratentorial cavernous malformations: a study of 168 patients. Epilepsia 2007; 48(3): 559– 563.
23. Amin‑Hanjani S, Ogilvy CS, Ojemann RG, Crowell RM. Risks of surgical management for cavernous malformations of the nervous system. Neurosurgery 1998; 42(6): 1220– 1227.
24. Ferroli P, Casazza M, Marras C, Mendola C, Franzini A, Broggi G. Cerebral cavernomas and seizures: a retrospective study on 163 patients who underwent pure lesionectomy. Neurol Sci 2006; 26(6): 390– 394.
25. D‘Angelo VA, De Bonis C, Amoroso R, Cali A, D‘Agruma L, Guarnieri V et al. Supratentorial cerebral cavernous malformations: clinical, surgical and genetic involvement. Neurosurg Focus 2006; 21(1): e9.
26. Gross BA, Smith ER, Goumnerova L, Proctor MR, Madsen JR, Scott RM. Resection of supratentorial lobar cavernous malformations in children: clinical article. J Neurosurg Pediatr 2013; 12(4): 367– 373. doi: 10.3171/ 2013.7.PEDS13126.
27. Zhou H, Miller D, Schulte DM, Benes L, Rosenow F,Bertalanffy H et al. Transsulcal approach supported by navigation‑ guided Neurophysiological monitoring for resection of paracentral cavernomas. Clin Neurol Neurosurg 2009; 111(1): 69– 78.
28. Jabre A, Patel A. Transsulcal microsurgical approach for subcortical small brain lesions: technical note. Surg Neurol 2006; 65(3): 312– 313.
29. Goel A. Transfalcine approach to a contralateral hemispheric tumour. Acta Neurochir 1995; 135(3– 4): 210– 212.
30. Chi JH, Lawton MT. Posterior interhemispheric approach: surgical technique, application to vascular lesions, and benefits of gravity retraction. Neurosurgery 2006; 59 (Suppl 1): ONS41– ONS49.
31. Niizuma K, Fujimura M, Kumabe T, Higano S, Tominaga T. Surgical treatment of paraventricular cavernous angioma: fibre tracking for visualizing the corticospinal tract and determining surgical approach. J Clin Neurosci 2006; 13(10): 1028– 1032.
32. Manaka S, Ishijima B, Mayanagi Y. Postoperative seizures: epidemiology, pathology and prophylaxis. Neurol Med Chir 2003; 43(12): 589– 600.
33. Lieu AS, Howng SL. Intracranial meningiomas and epilepsy: incidence, prognosis and influencing factors. Epilepsy Res 2000; 38(1): 45– 52.
34. Raychaudhuri R, Batjer HH, Awad IA. Intracranial cavernous angioma: a practical review of clinical and biological aspects. Surg Neurol 2005; 63(4): 319– 328.
35. Rigamonti D, Spetzler RF, Medina M, Rigamonti K,Geckle DS, Pappas C. Cerebral venous malformations. J Neurosurg 1990; 73(4): 560– 564.
36. Sasaki O, Tanaka R, Koike T, Koide A, Koizumi T, Ogawa H. Excision of cavernous angioma with preservation of coexisting venous angioma. Case report. J Neurosurg 1991; 75(3): 461– 464.
37. Buhl R, Hempelmann RG, Stark AM, Mehdorn HM.Therapeutical considerations in patients with intracranial venous angiomas. Eur J Neurol 2002; 9(2): 165– 169.
38. Yamada S, Liwnicz BH, Thompson JR, Colohan AR, Iacono RP, Tran JT. Pericapillary arteriovenous malformations angiographically manifested as cerebral venous malformations. Neurol Res 2001; 23(5): 513– 521.
39. Wurm G, Schnizer M, Fellner FA. Cerebral cavernous malformations associated with venous anomalies: surgical considerations. Neurosurgery 2005; 57 (Suppl 1): 42– 58.
40. Bratzler DW, Dellinger EP, Olsen KM, Perl TM, Auwaerter PG, Bolon MK et al, American Society of Health‑ System Pharmacists; Infectious Disease Society of America; Surgical Infection Society; Society for Healthcare Epidemiology of America. Clinical practice guidelines for antimicrobial prophylaxis in surgery. Am J Health Syst Pharm 2013, 70(3): 195– 283.
41. Buang SS, Haspani MS. Risk factors for neurosurgical site infections after a neurosurgical procedure: a prospective observational study at Hospital Kuala Lumpur. Med J Malaysia 2012; 67(4): 393– 398.
42. Korinek AM, Baugnon T, Golmard JL, van Effenterre R, Coriat P, Puybasset L. Risk factors for adult nosocomial meningitis after craniotomy: role of antibiotic prophylaxis. Neurosurgery 2006; 59(1): 126– 133.
43. McClelland S 3rd, Hall WA. Postoperative central nervous system infection: incidence and associated factors in 2111 neurosurgical procedures. Clin Infect Dis 2007; 45(1): 55– 59.
44. Zhan R, Zhu Y, Shen Y, Shen J, Tong Y, Yu H et al. Post‑operative central nervous system infections after cranial surgery in China: incidence, causative agents and risk factors in 1470 patients. Eur J Clin Microbiol Infect Dis 2014; 33(5): 861– 866. doi: 10.1007/ s10096‑ 013‑ 2026‑ 2.
45. Haines SJ. Efficacy of antibiotics prophylaxis in clean neurosurgical operations. Neurosurgery 1989; 24(3): 401– 405.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2014 Issue 5
Most read in this issue
- Czech Training Version of the Montreal Cognitive Assessment (MoCA‑ CZ1) for Early Identification of Alzheimer Disease
- Leukodystrophies – Clical and Radiological Findings
- Barriers of Nervous System under Physiological and Pathological Conditions
- Surgical Treatment of Supratentorial Cortico‑ subcortical Cavernous Malformation

