Bariéry nervového systému za fyziologických a patologických stavů
Barriers of Nervous System under Physiological and Pathological Conditions
Central and peripheral nervous systems are separated from the bloodstream by barrier structures that prevent free migration of water-soluble molecules through the tight junctions of the choroid plexus endothelial and epithelial cells. These barriers also play a role in the influx of essential molecules and elimination of xenobiotics. In recent years, differences and common features of the various barrier systems are being explored. Their disorders play a key role in a number of nervous system diseases. The present paper describes the structure and function of barrier systems under physiological and pathological conditions.
Key words:
blood brain barrier – blood nerve barrier – endotelial cells – astrocytes – pericytes
The author declare he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
:
J. Piťha
:
Neurologická klinika 1. LF UK a VFN v Praze
; Neurologické oddělení, Krajská zdravotní, a. s. – Nemocnice Teplice, o. z.
:
Cesk Slov Neurol N 2014; 77/110(5): 553-559
:
Review Article
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amcsnn2014553
Centrální a periferní nervový systém jsou odděleny od krevního řečiště bariérami, které brání volnému přechodu ve vodě rozpustných molekul prostřednictvím těsných spojů, jež propojují endoteliální buňky a epiteliální buňky plexus chorioideus. Tyto bariéry též hrají roli v influxu esenciálních molekul a odstraňování xenobiotik. V posledních letech jsou objasňovány rozdíly a společné rysy jednotlivých bariérových systémů. Jejich poruchy hrají klíčovou roli v celé řadě chorob nervového systému. Článek objasňuje strukturu a funkci bariérových systémů za fyziologických a patologických okolností.
Klíčová slova:
hematoencefalická bariéra – hematoneurální bariéra – endoteliální buňky – astrocyty – pericyty
Úvod
Centrální i periferní nervový systém (CNS, PNS) je extrémně vulnerabilní vůči noxám zevního i vnitřního prostředí. Nepřekvapuje, že se vyvinuly specializované struktury izolující neurony od krevního řečiště a likvoru. Bariéry CNS a PNS chrání nervovou tkáň před toxickými a patogenními látkami, regulují iontovou rovnováhu, facilitují nutriční transport a blokují potenciálně škodlivé molekuly. Buněčné bariéry reprezentují hranici mezi kapilárním cévním řečištěm a extracelulární matrix neuronů a gliových buněk. Lze diferencovat hematoencefalickou bariéru (HEB), hematolikvorovou bariéru (HLB), hematomíšní bariéru (HMB) a hematoneurální bariéru (HNB) [1].
Je zřejmé, že poškození těchto bariér hraje klíčovou roli v rozvoji celé řady onemocnění CNS a PNS. Jde zejména o cévní onemocnění mozku, traumata, zánětlivé a autoimunitní onemocnění, epilepsie, neurodegenerativní choroby a polyneuropatie. V poslední době byly popsány nové poznatky týkající se funkce bariérových systémů na buněčné a molekulární úrovni.
Struktura a funkce hematoencefalické bariéry
V roce 1885 publikoval Paul Ehrlich zjištění, že různé, ve vodě rozpustné barvy aplikované do krevního oběhu, nabarvily všechny orgány kromě mozku a míchy. Předpokládal, že CNS má nižší afinitu k těmto barvivům. O tři roky později Biedl a Kraus demonstrovali, že žlučové kyseliny, které v experimentu při přímé aplikaci do mozku vyvolávají epileptické záchvaty a kóma, nebyly toxické, pokud byly aplikovány do krve. V roce 1967 Reese a Karnovsky pomocí elektronové mikroskopie prokázali při pokusech s křenovou peroxidázou, že existují mezibuněčné těsné spoje (Tight Junction, TJ), které jsou lokalizovány na úrovni cévního endotelu [2].
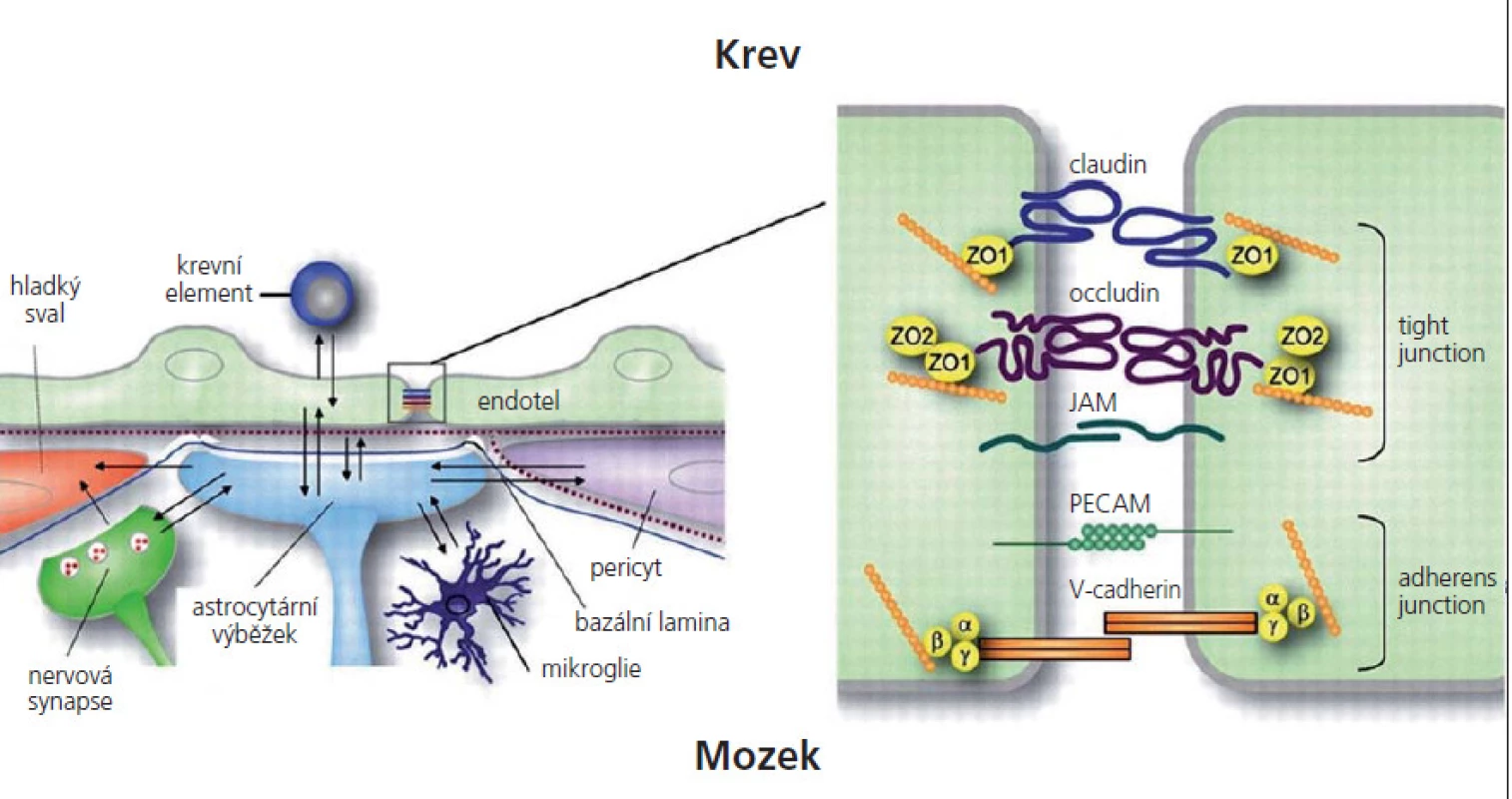
HEB je tvořena komplexním systémem skládajícím se z vysoce specializovaných mozkových mikrovaskulárních endoteliálních buněk (MEB) a bazální membrány obsahující velké množství pericytů. Na bazální membránu, jež je tvořena kolagenem, lamininem, heparinem a sulfát proteoglykanem, nasedají vlákna hladkého svalstva [3]. Kromě vrstvy endoteliálních buněk se na HEB podílí zakončení astrocytů. Astrocyty zprostředkují kontakt mezi MEB a nervovými synapsemi. Celý tento komplex tvoří neurovaskulární jednotku (obr. 1) [4]. Perivaskulární makrofágy jsou odpovědné za imunitní dohled [5].
V některých oblastech mozku, tzv. cirkumventrikulárních orgánech, se HEB nevyskytuje. Jsou charakteristické svou malou velikostí, vysokou propustností, perforací kapilár a výskytem specializovaných ependymálních buněk, tzv. tanycitů, z nichž některé jsou vybaveny chemoreceptory předávajícími podněty z krve do CNS. Patří sem area postrema, eminentia mediana se sousedící neurohypofýzou, subkomisurální a subfornikální orgán a lamina terminalis (resp. její organum vasculosum) [6].
MEB se liší od jiných endoteliálních buněk malým množstvím fenestrací, tvorbou TJ, omezením pasivní difuze mezi buňkami, minimální endocytózou, existencí specifických transportních systémů a zvýšenou aktivitou enzymů, které metabolizují xenobiotika (cizorodé látky, např. léky, toxiny apod.) [7– 9].
Důležitá složka mozkových kapilár a postkapilárních venul jsou pericyty. Poměr pericytů k endoteliálním buňkám je v mozku a sítnici 1 : 1, zatímco v plicích 1 : 10, což naznačuje jejich důležitou roli v bariérových systémech. Regulují angiogenezi, formaci HEB v průběhu embryogeneze, cévní stabilitu, regulaci kapilárního průtoku krve a eliminaci toxických buněčných produktů. Jejich nedostatek zvyšuje propustnost HEB pro řadu stopových látek [10,11].
Astrocyty patří mezi nejdůležitější gliové buňky CNS, které kromě jiného ovlivňují mozkovou mikrocirkulaci v závislosti na neuronální aktivitě a zpětně regulují aktivitu neuronální sítě [12,13]. Astrocyty ovlivňují junkční a transportní vlastnosti HEB, ale není jasné, zda jsou tyto pochody pod neuronální kontrolou [14]. Indukční vlivy astrocytů se podílejí na diferenciaci a funkci endotelu HEB [15].
Akvaporin‑4 (AQP4) je v mozku a míše jednou z nejrozšířenějších molekul. Vyskytuje se zejména v membránách astrocytů v HEB a HLB. AQP4 je zapojen v řadě patofyziologických procesů, jeho fyziologická role není zcela jasná. Nedávné poznatky svědčí o jeho vlivu na regulaci objemu extracelulárních prostor, cirkulaci likvoru a resorpci mezibuněčných tekutin. Podílí se na zánětu, buněčné migraci a dalších buněčných funkcích.
Řada imunitních buněk je v interakci s HEB. Nejdůležitější je vliv perivaskulárních makrofágů, jejichž úloha je kromě imunitního dohledu i fagocytóza buněčných fragmentů [17]. V perivaskulárních regionech se vyskytují žírné buňky, jejichž role nebyla plně objasněna [18]. V parenchymu CNS je hojně zastoupena mikroglie pocházející z monocytární buněčné linie. Ta vstupuje do CNS během embryogeneze a podílí se na neuronálním zrání a přirozené imunitní odpovědi. Může se chovat jako antigen prezentující buňka v rámci přirozené i adaptivní imunitní odpovědi [19].
Interendoteliální TJ v CNS tvoří složitý komplex transmebránových a cytoplazmatických proteinů ukotvených k cytoskeletu aktinem (obr. 1). Bylo referováno o celé řadě proteinů, které se zde nacházejí. Jedná se o okludin, klaudin‑3, klaudin‑5, klaudin-12, zona occludens (ZO)- 1, ZO‑2 a junkční adhezivní molekuly (JAM)- A [20– 25]. Klaudin‑5 je nezbytný pro udržování bariérových vlastností HEB za fyziologických podmínek, úroveň jeho exprese se zhoršuje při některých patologických stavech. Klaudin‑3 je zvýšeně exprimován při zrání HEB [26].
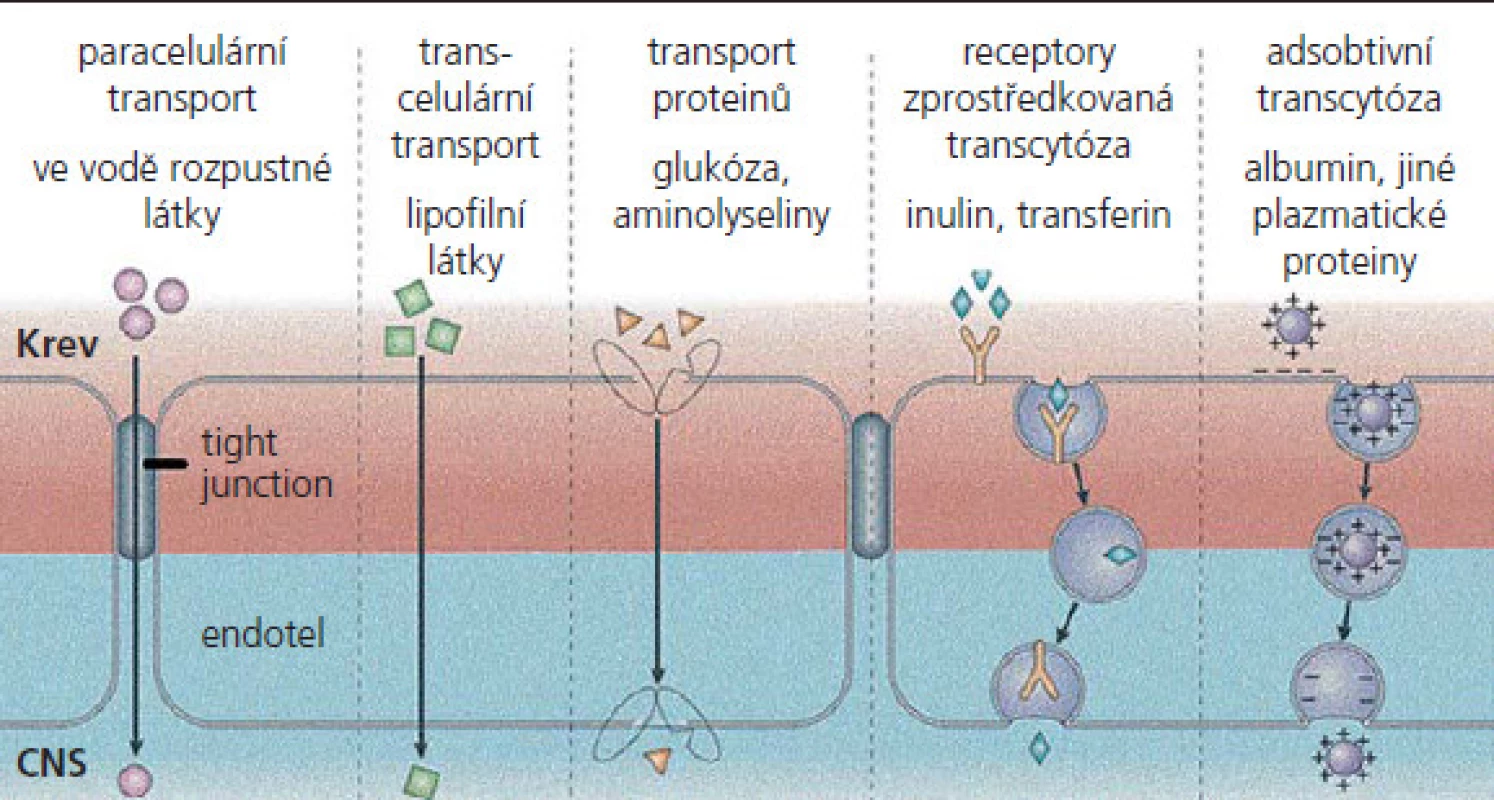
MEB exprimují různé influxní a exfluxní transportní systémy, které ovlivňují nejen poskytování živin, ale s výjimkou léků i prostupnost excesivních neurotoxických látek, např. neurotransmiterů a jejich metabolitů (obr. 2). Mezi nejvýznamnější exfluxní transportéry patří P‑glykoprotein (P‑gp), „multidrug resistance associated protein“ (MRP) a adenozin trifosfát (ATP), přičemž se u všech předpokládá, že zabraňují vstupu xenobiotik do CNS [27– 29]. MEB také podporují influx různých nutričních faktorů, které využívají specifické transportní systémy, jako jsou glukózový transpotér 1 (glu1), transportér monokarboxylové kyseliny 1 (MCT1) a přenašeč kreatininu [30– 32]. Přestup látek z krve do mozku se uskutečňuje na podkladě jejich rozpustnosti v tucích nebo pomocí přenašečových systémů. Snadno prostupuje voda a látky dobře rozpustné v lipidech, např. etanol, nikotin, plyny (O2, CO2, N2O). Nezbytné hydrofilní látky jsou do mozku transportovány pomocí specifických transportních systémů (glukóza, neutrální aminokyseliny). Vezikulární transport je velmi omezený. Neporušená hematoencefalická bariéra prakticky znemožňuje prostup makromolekul do mozkové tkáně. Průniku těchto látek do mozku zabraňuje také enzymatická bariéra, na níž se podílejí enzymové systémy, lokalizované ve stěnách mozkových cév, např. monoaminooxydázy (enzymy degradující monoaminy) a aminopeptidázy (enzymy rozkládající enkefaliny).
Hematoencefalická bariéra za patologických stavů
Poškození HEB je patrné u různých neurologických afekcí, ať již traumatických, ischemických, zánětlivých či degenerativních. Porucha bariérových systémů může být prospěšná (umožňuje vstup imunokompetentních buněk do CNS a jejich podíl na reparativním zánětu), nebo poškozující. Protrahovaná porucha HEB vede k vazogennímu edému se zvýšeným influxem vody a proteinů do CNS, což může způsobit zvýšení nitrolebního tlaku s fatálními důsledky. Na buněčné úrovni dochází k narušení myelinových obalů, zvýšené astrocytární reaktivitě a to má za následek neuronální dysfunkci či ireverzibilní axonální ztrátu [33].
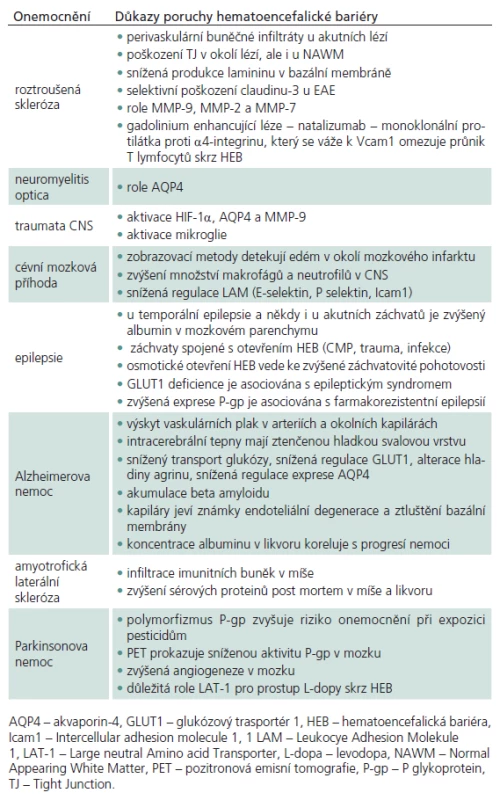
Dysfunkce HEB během patologických stavů je podmíněna narušením TJ, zvýšením transcytózy, změnou transportních systémů a zvýšenou leukocytární infiltrací. Na poruše HEB se účastní řada molekul – vazoaktivní bílkoviny (Vascular Endothelial cell Growth Factor, VEGF, Reactive Oxygen Species, ROS) zánětlivé cytokiny (interleukin 1- IL‑1, IL‑6, tumor nekrotizující faktor alfa, TNF‑alfa), matrix metaloproteinázy a jejich inhibitory (MMP‑9, MMP‑2, MMP‑7) a leukocytární adhezní molekuly (P‑selektin, E‑selektin, Intercellular adhesion molecule 1 – Icam1, Vascular cell adhesion molecule 1 – Vcam1) [34]. Nedávné studie ukazují důležitou roli chemokinů a jejich receptorů (CXCL12, CCL19, CCL20 a CCL21) v udržování homeostatických funkcí. Zatímco endoteliální exprese těchto chemokinů reguluje průnik leukocytů do CNS, kde vykonávají imunitní kontrolu, nová data svědčí o tom, že CXCL12 je též zapojen do neurogeneze a přežívání neuronů [35]. Přehled onemocnění, u kterých se v patogenezi uplatňuje porucha HEB, je uveden v tab. 1.
Roztroušení skleróza
Roztroušená skleróza (RS) je autoimunitní onemocnění s prvky neurodegenerace. Relaps remitující forma RS je charakterizována poruchou HEB s masivní perivaskulární infiltrací makrofágy a neutrofily [36]. V imunopatogenezi RS hrají důležitou roli MMP.
U relaps remitující formy se MMP podílejí na porušení HEB, perivaskulární infiltraci lymfocyty a zesílení chemotaktického gradientu. MMP se účastní i na ložiskovém poškození myelinu vedoucím ke vzniku typických demyelinizačních lézí a na přerušení axonů. Významné je i jejich působení neurotoxické [37,38].
Porucha HEB je dobře patrná na magnetické rezonanci mozku (MR), kdy u longitudinálních studií, ale i v klinické praxi po aplikaci gadolinia dochází u čerstvých aktivních lézí k akumulaci kontrastní látky, zatímco u lézí starších tomu tak není [39– 41]. Mnohé důkazy svědčí pro to, že i počáteční fáze progresivní RS jsou zprostředkovány autoimunitním zánětem imunokompetentními buňkami usídlenými za HEB [42]. Zajímavé jsou studie, které prokazují redukci proteinů asociovaných s TJ v místech normálně vypadající bílé hmoty (Normal Appearing White Matter, NAWM, To podporuje předpoklad, že dysfunkce HEB se vykytuje i v místech, kde se nevyskytují aktivní léze [43,44].
Praktický důsledek ovlivnění role HEB u RS je zavedení monoklonální protilátky natalizumabu do léčebné praxe. V současné době je to nejefektivnější léčba u vysoce aktivní RS. Natalizumab je antagonista a4- integrinu. Jeho hlavní nežádoucí účinek je možnost reaktivace JCV (John Cunningham viru) u predisponovaných jedinců. Tento vir je odpovědný za rozvoj progresivní multifokální leukoencefalopatie (PML). Blokádou HEB je totiž výrazně omezena možnost rozpoznání JCV T lymfocyty, jež prostupují HEB a dohlížejí na potenciální možnost výskytu infekce [45].
Vysoké dávky metylprednizolonu redukují hladiny MMP‑9 v likvoru blokádou aktivátoru proteinu‑1 pro MMP‑9 gen. Tím dochází k uzavření HEB, což se využívá k léčbě akutního relapsu [46].
Neuromyelitis optica
Porucha HEB je daleko výraznější u neuromyelitis optica (NMO) a může napomáhat v diferenciální diagnostice oproti RS [47]. V imunopatogenezi NMO hrají důležitou roli protilátky proti AQP4, které jsou snadno detekovatelné v séru. Sérum pacientů s NMO má selektivní patologický vliv na buněčné membrány astrocytů exprimující AQP4, zejména v oblasti Ranvierových zářezů s možnou inicializací demyelinizace [48].
Traumatické postižení CNS
Pro poruchy HEB při mozkových traumatech je typický rozvoj mozkového edému, zánět a smrt neuronů. Aktivuje se hypoxii indukující faktor‑1a (HIF‑1a), AQ‑4 a MMP‑9, které se podílejí na rozvoji mozkového edému a zvýšené permeabilitě HEB. Na poruše HEB se v experimentu podílí i oxidativní stres a aktivace mikroglie [49].
Mozkové ischemie
Cerebrální ischemie vede k dvoufázovému poškození HEB [50]. Její počáteční otevření je reverzibilní, zprostředkované MMP‑2. V podmínkách akutní hypoxie dochází k akumulaci HIF‑1a, který má neuroprotektivní efekt. Stimuluje endoteliální růstový faktor a transformující růstový faktor‑b, jež jsou důležité v angiogenezi a neurogenezi [51].
K dalšímu otevření HEB dochází 24– 48 hod po reperfuzi v závislosti na délce ischemie. Zánětlivé cytokiny indukují tvorbu MMP‑3 a MMP‑9 a také cyklooxygenázy 2 (COX‑2), přičemž nastává větší destrukce HEB. Důsledkem toho je vstup neutrofilů a monocytů, které jsou zdrojem MMP a toxických krevních produktů. Oxidativní stres poškozuje endoteliální buňky HEB a přispívá k vazogennímu edému [52]. MMP‑7 ovlivňuje stabilitu aterorosklerotických plátů prostřednictvím makrofágů [53].
Epilepsie
Patologické změny HEB s extravazáty albuminu v mozkovém parenchymu byly pozorovány u akutních epileptických záchvatů [54]. Ačkoliv není zcela jasné, zda dysfunkce HEB je příčina nebo následek této poruchy, je zřejmé, že dochází k iontové dysbalanci a změnám energetického metabolizmu. Nedostatek glukózového transportéru 1 (GLUT1) vede k rozvoji epileptického syndromu, který může být pozitivně ovlivněn ketogenní dietou [55].
Epileptický syndrom je často provázen zánětlivými změnami CNS. Dochází ke zvýšené expresi zánětlivých mediátorů, např. interleukinu‑1b (IL‑1b), tumor nekrotizujícího faktoru alfa (TNFa), cyklooxygenázy 2 (COX‑2) a chemokinu CXCL 10 (CXCL10), které mohou v postparoxyzmálním období poškozovat mozkovou tkáň a zvyšovat záchvatovou pohotovost [56]. HEB je kritické místo v léčbě epilepsie. Zvýšená exprese P‑gp je asociována s farmakorezistentní epilepsií [57].
Alzheimerova nemoc
Zvýšená propustnost HEB u Alzheimerovy nemoci (AD) úzce koreluje s progresí nemoci [58]. Intracerebrální arterie a kapiláry mají ztenčenou vrstvu hladkých svalů, obsahují amyloidní plaky, dochází k degeneraci endotelu se ztluštěním bazální membrány [59]. Otevření HEB na základě hypoxických inzultů vede k akumulaci plazmatického beta amyloidu v mozkovém parenchymu nebo vaskulárním endotelu. Důležitou roli v buněčném transportu beta amyloidu hraje nízkodenzitní lipoproteinu příbuzný protein 1 (LRP1) [60].
Amyotrofická laterální skleróza
U amyotrofické laterální sklerózy (ALS) byly nalezeny zvýšené hladiny albuminu, IgG a lymfocytární infiltráty indikující poškození HEB. U experimentálních myších modelů ALS při využití SOD1 (superoxid dismutáza 1) mutací docházelo k redukci endoteliálního GLUT1, klaudinu-5, ZO1 a okludinu. Patologické změny astrocytárních zakončení byly pozorovány již v časných fázích onemocnění. Tyto nálezy by mohly mít zásadní význam pro vývoj účinných terapeutických postupů [61].
Některé studie prokázaly, že degeneraci motoneuronu v předních rozích míšních předchází poškození neurovaskulární jednotky, což by mohlo mít též terapeutický význam [62].
Parkinsonova nemoc
Polymorfizmus MDR1 genu (Multidrug Resistence 1gen) kódujícího P‑gp je asociován s narůstajícím rizikem rozvoje Parkinsonovy nemoci (PD) u jedinců exponovaných pesticidům pronikajícím do CNS narušenou HEB [63]. Recentní studie prokázala, že MMP‑3 se podílí na ztrátě dopaminergních neuronů nigrostriatální dráhy u 1- metyl‑4- fenyl‑1,2,3,6- tetrahydropyridin (MPTP) myšího modelu PD u poškozené HEB infitrované periferijními imunitními buňkami [64].
Hematolikvorová bariéra
Bohatě vaskularizovaný chorioideální plexus (CHP) je poměrně netěsný. Existuje zde velmi rychlý krevní průtok (10krát vyšší než v mozku) a vysoký obrat tekutin (cca 400 000 µL/ den) s obsahem stopových prvků, peptidů a hormonů [65]. Místo fenestrovaného endotelu funkci HEB přebírá vrstva epiteliálních buněk vytvářejících TJ. Jeho apikální ventrikulární membrána tvoří HLB [66]. Klaudin‑1, - 2, a - 3 je lokalizován v oblasti epiteliálních spojů a selektivně exprimován v CHP. Zde jsou též exprimovány jiné, s TJ asociované proteiny, např. okludin, ZO‑1 a ZO‑2 [67]. Klaudin‑11 se vyskytuje výhradně v CHP a je součástí paralelních TJ [68].
CHP není jen jednoduchá difuzní bariéra, ale zásobuje CNS nutričními látkami, např. vitaminy a glukózou. Podílí se ale i na eliminaci xenobiotik a metabolických produktů. Transcelulární epiteliální aktivní transport a sekrece jsou energeticky náročné procesy, na kterých se podílí mitochondrie, endoplazmatické retikulum a Golgiho aparát [65]. Vyšetření likvoru představuje unikátní možnost získání informací o fyziologických i patologických procesech CNS. Intratékální aplikace medikamentů představuje jednu z možností, jak „obejít“ HEB u léčiv, které by touto bariérou obtížně pronikaly. HLB se podílí na homeostáze CNS společně s HEB [69].
Hematomíšní bariéra
Hematomíšní bariéra (HMB) je funkční ekvivalent HEB ve smyslu existence specializovaného mikroprostředí pro buněčné složky míchy. Nedávno získané poznatky svědčí o tom, že mezi HEB a HMB existují funkční rozdíly. HMB je prostupná pro cytokiny mnohem více než HEB [70]. V in vitro studii Ge a Pachter ukázali, že v kulturách MEB izolovaných z myší míchy je nižší exprese ZO‑1 a okludinu v porovnání s kulturami mozkových MEB [71].
Poruchy HMB jsou zřejmé u celé řady onemocnění, např. u neuromyelitis optica, ALS, radiačního poškození míchy, míšní ischemie a traumat. Ve všech případech, stejně jako u poruch HEB, jsou terapeuticky účinné vysoké dávky metylprednizolonu.
Hematoneurální bariéra
Poruchy hematoneurální bariéry (HNB) jsou iniciálně přítomny u mnoha autoimunitních onemocnění PNS. Jde např. o Guillainův‑Barrého syndrom, chronickou zánětlivou demyelinizační polyradikuloneuritidu (CIDP) a paraproteinemické polyneuropatie [72].
HNB zahrnuje endoneurální mikrocirkulaci a vnitřní vrstvu perineuria. Strukturálním podkladem HNB jsou TJ mezi sousedními MEB periferních nervů (PnMEB) a mezi perineurálními buňkami [73]. Látky pocházející z krevního řečiště se mohou dostat do endoneurálního extracelulárního prostoru buď přes endoneurální vaskulární endotel, nebo perineurium. Řada studií ukazuje, že perineurální permeabilita je mnohem nižší než prostupnost endoneurárálních vlásečnic [73,74]. PnMEB tvoří v perineuriu většinu vlásečnic, a proto je lze považovat za skutečné rozhraní mezi krví a periferními nervy. Ačkoliv vlastnosti HNB jsou podobné jako u HEB, dosud jsou omezené poznatky o molekulárních mechanizmech podílejících se na stavbě HNB. Na izolovaných tkáňových kulturách krysích PnMEB je patrné, že dochází k expresi TJ molekul, jako okludin, klaudin‑5, klaudin‑12, ZO‑1, ZO‑2 a junkčních adhezních molekul (JAM) 1 na úrovni mRNA. Na mezibuněčných spojích byl též detekován klaudin‑5. Krysí PnMEB též exprimovaly influxní transportéry (GLUT‑1) a některé efluxní transportéry [75]. Endoteliální buňky formující HNB exprimují podobné TJ a transportní proteiny, jako je tomu u HEB k ochraně nervových vláken před toxickými a patogenními vlivy v krvi. Dodávají esenciální látky pomocí influxních trasportérů.
Na rozdíl od HEB součástí HNB nejsou astrocyty. Jejich roli vykonávají nejspíše pericyty periferních nervů, což jsou jediné buňky podílející se kromě PnMEB na stavbě endoneurálních vlásečnic. Solubilní faktory, secernované z pericitární buněčné linie, derivované z lidského sedacího nervu, snižují clearance inulinu přes PnMEB. Buněčné linie pericytů lidských periferních nervů exprimují řadu neurotrofických faktorů, jako nervový růstový faktor (NGF), mozkem derivovaný neurotrofní faktor (BDNF) a glií derivovaný neurotrofní faktor (GDNF) [76]. Tyto látky mohou bránit axonálnímu poškození a podílet se na axonální regeneraci PNS. Lze soudit, že mají dosud nedoceněný terapeutický potenciál [77].
Snížená regulace klaudinu‑1 a dislokace ZO‑1, patrná u CIDP, může indikovat poruchu HNB [78]. V imunopatogenezi CIDP a neuropatií asociovaných s vaskulitidou hrají rovněž důležitou roli MMP. MMP‑9 zprostředkuje zánětlivou buněčnou infiltraci T lymfocyty a makrofágy [79].
Závěr
Ačkoliv existují mezi bariérovými systémy odlišnosti, mají mnohé společného. Všechny se podílejí na udržování homeostázy nervového systému. Specifické transportní systémy participují na příjmu esenciálních látek, jiné realizují eliminaci metabolitů a toxických zplodin. Společným rysem je výskyt TJ a jiných molekul, např. ZO. Významný podíl na funkci bariér mají endoteliální, eventuálně epiteliální buňky, pericyty a zejména výběžky astrocytů.
Pokračující výzkum v oblasti modifikace bariérových systémů přináší nové terapeutické možnosti, jak je zřejmé na příkladu RS. V budoucnu lze očekávat vývoj dalších léků, zejména v oblasti neurodegenerativních chorob, cévních, traumatických, nádorových onemocnění a autoimunitních polyneuropatií.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jiří Piťha
Neurologické oddělení
Krajská zdravotní, a.s. – Nemocnice Teplice, o.z.
Duchcovská 53
415 29 Teplice
e-mail: pithaj@seznam.cz
Přijato k recenzi: 10. 4. 2014
Přijato do tisku: 3. 7. 2014
Sources
1. Abbot NJ. Evidence for bulk fow of brain intestitial fluid: significance for physiology and pathology. Neurochem Int 2004; 45(4): 545– 552.
2. Wong AD, Ye M, Levy AF, Rothstein JD, Bergles DE,Searson PC. The blood‑brain barrier: an engineering perspective. Front Neuroeng 2013; 6: 7. doi: 10.3389/ fneng.2013.00007.
3. Tilling T, Engelbertz C, Decker S, Korte D, Hüwel S, Galla HJ. Expression and adhesive properties of basement membrane proteins in cerebral capillary endothelial cell cultures. Cell Tissue Res 2002; 310(1): 19– 29.
4. Muoio V, Persson PB, Sendeski MM. The neurovascular unit – concept review. Acta Physiol (Oxf) 2014; 210(4): 790– 798. doi: 10.1111/ apha.12250.
5. Williams K, Alvarez X, Lackner AA. Central nervous system perivascular cells are immunoregulatory cells that connect the CNS with the peripheral immune system. Glia 2001; 36(2): 156– 164.
6. Ganong WF. Circumventricular organs: definition and role in the regulation of endocrine and autonomic function. Clin Exp Pharmacol Physiol 2000; 27(5– 6): 422– 427.
7. Engelhardt B. T cell migration into the central nervous system during health and disease: different molecular keys allow access to different central nervous system compartments. Clin Exp Neuroimmunol 2010; 1: 79– 93.
8. Takeshita Y, Ransohoff RM. Inflammatory cell trafficking across the blood‑brain barrier: chemokine regulation and in vitro models. Immunol Rev 2012; 248(1): 228– 239. doi: 10.1111/ j.1600‑065X.2012.01127.x.
9. Joó F. Endothelial cells of the brain and other systems: some similarities and differences. Prog Neurobiol 1996; 48(3): 255– 273.
10. Winkler EA, Bell RD, Zlokovic BV. Central nervous system pericytes in health and disease. Nat Neurosci 2011; 14(11): 1398– 1405. doi: 10.1038/ nn.2946.
11. Armulik A, Genové G, Mäe M, Nisancioglu MH,Wallgard E, Niaudet C et al. Pericytes regulate the blood‑brain barrier. Nature 2010; 468(7323): 557– 561. doi: 10.1038/ nature09522.
12. Zhang Y, Barres BA. Astrocyte heterogeneity: an underappreciated topic in neurobiology. Curr Opin Neurobiol 2010; 20(5): 588– 594. doi: 10.1016/ j.conb.2010.06.005.
13. Attwell D, Buchan AM, Charpak S, Lauritzen M, Macvicar BA, Newman EA. Glial and neuronal control of brain blood flow. Nature 2010; 468(7321): 232– 243. doi: 10.1038/ nature09613.
14. Petzold GC, Murthy VN. Role of astrocytes in neurovascular coupling. Neuron 2011; 71(5): 782– 797. doi: 10.1016/ j.neuron.2011.08.009.
15. Abbott NJ, Rönnbäck L, Hansson E. Astrocyte‑endothelial interactions at the blood‑brain barrier. Nat Rev Neurosci 2006; 7(1): 41– 53.
16. Badaut J, Fukuda AM, Jullienne A, Petry KG. Aquaporin and brain diseases. Biochim Biophys Acta 2014; 1840(5): 1554– 1565. doi: 10.1016/ j.bbagen.2013.10.032.
17. Polfliet MM, Zwijnenburg PJ, van Furth AM, van der Poll T, Döpp EA, Renardel de Lavalette C et al. Meningeal and perivascular macrophages of the central nervous system play a protective role during bacterial meningitis. J Immunol 2001; 167(8): 4644– 4650.
18. Wilhelm M, Silver R, Silverman AJ. Central nervous system neurons acquire mast cell products via transgranulation. Eur J Neurosci 2005; 22(9): 2238– 2248.
19. Streit WJ, Conde JR, Fendrick SE, Flanary BE, Mariani CL. Role of microglia in the central nervous system’s immune response. Neurol Res 2005; 27(7): 685– 691.
20. Furuse M, Hirase T, Itoh M, Nagafuchi A, Yonemura S, Tsukita S et al. Occludin: novel integral membrane protein localizing at tight junctions. J Cell Biol 1993; 123(6): 1777– 1788.
21. Wolburg H, Wolburg‑Buchholz K, Kraus J, Rascher‑Eggstein G, Liebner S, Hamm S et al. Localization of claudin‑3 in tight junctions of the blood‑brain barrier is selectively lost during experimental autoimmune encephalomyelitis and human glioblastoma multiforme. Acta Neuropathol 2003; 105(6): 586– 592.
22. Schrade A, Sade H, Couraud PO, Romero IA, Weksler BB, Niewoehner J. Expression and localization of claudins‑3 and – 12 in transformed human brain endothelium. Fluids Barriers CNS 2012; 9: 6. doi: 10.1186/ 2045‑8118‑9‑6.
23. Nitta T, Hata M, Gotoh S, Seo Y, Sasaki H, Hashimoto N et al. Size‑selective loosening of the blood‑brain barrierin claudin‑5– deficient mice. J Cell Biol 2003; 161(3): 653– 660.
24. Ohtsuki S, Sato S, Yamaguchi H, Kamoi M, Asashima T, Terasaki T. Exogenous expression of claudin‑5 induces barrier properties in cultured rat brain capillary endothelial cells. J Cell Physiol 2007; 210(1): 81– 86.
25. Yeung D, Manias JL, Stewart DJ, Nag S. Decreased junctional adhesion molecule‑A expression during blood‑brain barrier breakdown. Acta Neuropathol 2008; 115(6): 635– 642. doi: 10.1007/ s00401‑008‑0364‑4.
26. Liebner S, Corada M, Bangsow T, Babbage J, Taddei A, Czupalla CJ et al. Wnt/ beta‑catenin signaling controls development of the blood‑brain barrier. J Cell Biol 2008; 183(3): 409– 417. doi: 10.1083/ jcb.200806024.
27. Schinkel AH, Wagenaar E, Mol CA, van Deemter L.P‑glycoprotein in the blood‑brain barrier of mice influences the brain penetration and pharmacological activity of many drugs. J Clin Invest 1996; 97(11): 2517– 2524.
28. Nies AT, Jedlitschky G, König J, Herold‑Mende C, Steiner HH, Schmitt HP et al. Expression and immunolocalization of the multidrug resistance proteins, MRP1- MRP6(ABCC1- ABCC6), in human brain. Neuroscience 2004; 129(2): 349– 360.
29. Cisternino S, Mercier C, Bourasset F, Roux F, Scherrmann JM. Expression, up‑regulation, and transport activity of the multidrug‑resistance protein Abcg2 at the mouse blood‑brain barrier. Cancer Res 2004; 64(9): 3296– 3301.
30. Cornford EM, Hyman S, Swartz BE. The human brain GLUT1 glucose transporter: ultrastructural localization to the blood‑brain barrier endothelia. J Cereb Blood Flow Metab 1994; 14(1): 106– 112.
31. Kanai Y, Segawa H, Miyamoto K, Uchino H, Takeda E, Endou H. Expression cloning and characterization of a transporter for large neutral amino acids activated by the heavy chain of 4F2 antigen (CD98). J Biol Chem 1998; 273(37): 23629– 23632.
32. Kido Y, Tamai I, Okamoto M, Suzuki F, Tsuji A. Functional clarification of MCT1- mediated transport of monocarboxylic acids at the blood‑brain barrier using in vitro cultured cells and in vivo BUI studies. Pharm Res 2000; 17: 55– 62.
33. Daneman R. The blood‑brain barrier in health and dissease. Ann Neurol 2012; 72(5): 648– 672. doi: 10.1002/ ana.23648.
34. Larsen JM, Martin DR, Byrne ME. Recent advances in delivery through the blood‑brain barrier. Curr Top Med Chem 2014; 14(9): 1148– 1160.
35. Williams JL, Holman DW, Klein RS. Chemokines in the balance: maintenance of homeostasis and protection at CNS barriers. Front Cell Neurosci 2014; 8: 154. doi: 10.3389/ fncel.2014.00154.
36. Lassmann H. Multiple sclerosis pathology: evolution of pathogenetic concepts. Brain Pathol 2005; 15(3): 217– 222.
37. Hladíková M, Štourač P. Matrixové metaloproteinázy v patogenezi roztroušené sklerózy. Cesk Slov Neurol N 2008; 71/ 104(5): 530– 536.
38. Mirshafiey A, Asghari B, Ghalamfarsa G, Jadidi‑Niaragh F, Azizi G. The significance of matrix metalloproteinases in the immunopathogenesis and treatment of multiple sclerosis. Qaboos Univ Med J 2014; 14(1): 13– 25.
39. Bielekova B, Kadom N, Fisher E, Jeffries N, Ohayon J,Richert N et al. MRI as a marker for disease heterogeneity in multiple sclerosis. Neurology 2005; 65(7): 1071– 1076.
40. Cotton F, Weiner HL, Jolesz FA, Guttmann CR. MRI contrast uptake in new lesions in relapsing‑remitting MS followed at weekly intervals. Neurology 2003; 60(4): 640– 646.
41. Zivadinov R, Cox JL. Neuroimaging in multiple sclerosis. Int Rev Neurobiol 2007; 79: 449– 474.
42. Bradl M, Lassmann H. Progressive multiple sclerosis. Semin Immunopathol 2009; 31(4): 455– 465. doi: 10.1007/ s00281‑009‑0182‑3.
43. Plumb J, McQuaid S, Mirakhur M, Kirk J. Abnormal endothelial tight junctions in active lesions and normal‑appearing white matter in multiple sclerosis. Brain Pathol 2002; 12(2): 154– 169.
44. Cramer SP, Simonsen H, Frederiksen JL, Rostrup E, Larsson HB. Abnormal blood‑brain barrier permeability in normal appearing white matter in multiple sclerosis investigated by MRI. Neuroimage Clin 2013; 4: 182– 189. doi: 10.1016/ j.nicl.2013.12.001.
45. Nicholas JA, Racke MK, Imitola J, Boster AL. First‑line natalizumab in multiple sclerosis: rationale, patient selection, benefits and risks. Ther Adv Chronic Dis 2014; 5(2): 62– 68. doi: 10.1177/ 20406 22313514790.
46. Rosenberg GA, Dencoff JE, Correa YN, Reiners M, Ford CC. Effect of steroids on CSF matrix metalloproteinases in multiple sclerosis: relation to blood‑brain barrier injury. Neurology 1996; 46(6): 1626– 1632.
47. Tomizawa Y, Yokoyama K, Saiki S, Takahashi T, Matsuoka J, Hattori N. Blood‑brain barrier disruption is more severe in neuromyelitis optica than in multiple sclerosis and correlates with clinical disability. J Int Med Res 2012; 40(4): 1483– 1491.
48. Hinson SR, Pittock SJ, Lucchinetti CF, Roemer SF,Fryer JP, Kryzer TJ et al. Pathogenic potential of IgG binding to water channel extracellular domain in neuromyelitis optica. Neurology 2007; 69(24): 2221– 2231.
49. Higashida T, Kreipke CW, Rafols JA, Peng C, Schafer S, Schafer P et al. The role of hypoxia‑inducible factor‑1a, aquaporin‑4 and matrix metalloproteinase‑9 in blood brain barrier disruption and brain edema after traumatic brain injury. J Neurosurg 2011; 114(1): 92– 101. doi: 10.3171/ 2010.6.JNS10207.
50. Kuroiwa T, Ting P, Martinez H, Klatzo I. The biphasic opening of the blood‑brain barrier to proteins following temporary middle cerebral artery occlusion. Acta Neuropathol 1985; 68(2): 122– 129.
51. Helton R, Cui J, Scheel JR, Ellison JA, Ames C, Gibson C et al. Brain‑specific knock out of hypoxia‑inducible factor‑1alpha reduces rather than increases hypoxic‑ischemic damage. J Neurosci 2005; 25(16): 4099– 4107.
52. Sandoval KE, Witt KA. Blood‑brain barrier tight junction permeability and ischemic stroke. Neurobiol Dis 2008; 32(2): 200– 219. doi: 10.1016/ j.nbd.2008.08.005.
53. Abbas A, Aukrust P, Russell D, Krohg‑Sørensen K,Almås T, Bundgaard D et al. Matrix metalloproteinase 7 is associated with symptomatic lesions and adverse events in patients with carotid atherosclerosis. PLoS One 2014; 9(1): 272– 279. doi: 10.1371/ journal.pone.0084935.
54. van Vliet EA, da Costa Araujo S, Redeker S, van Schaik R, Aronica E, Gorter JA. Blood‑brain barrier eakage may ead to progression of temporal lobe epilepsy. Brain 2007; 130(2): 521– 534.
55. Ramm‑Pettersen A, Nakken KO, Haavardsholm KC,Selmer KK. Occurrence of GLUT1 deficiency syndrome in patients treated with ketogenic diet. Epilepsy Behav 2014; 32: 76– 78. doi: 10.1016/ j.yebeh.2014.01.003.
56. Rojas A, Jiang J, Ganesh T, Yang MS, Lelutiu N, Gueorguieva P et al. Cyclooxygenase‑2 in epilepsy. Epilepsia 2014; 55(1): 17– 25. doi: 10.1111/ epi.12461.
57. Abbott NJ, Khan EU, Rollinson CM, Reichel A, Janigro D, Dombrowski SM et al. Drug resistance in epilepsy: the role of the blood‑brain barrier. Novartis Found Symp 2002; 243: 38– 47.
58. Ryu JK, McLarnon JG. A leaky blood‑brain barrier, fibrinogen infiltration and microglialreactivity in inflamed Alzheimer’s disease brain. J Cell Mol Med 2009; 13: 2911– 2925. doi: 10.1111/ j.1582‑4934.2008.00434.x.
59. Zlokovic BV. Neurovascular mechanisms of Alzheimer’s neurodegeneration. Trends Neurosci 2005; 28(4): 202– 208.
60. Zlokovic BV, Deane R, Sagare AP, Bell RD, Winkler EA. Low‑density lipoprotein receptor‑related protein‑1: a serial clearance homeostatic mechanism controlling Alzheimer‘s amyloid beta‑peptide elimination from the brain. J Neurochem 2010; 115(5): 1077– 1089. doi: 10.1111/ j.1471‑4159.2010.07002.x.
61. Garbuzova‑Davis S, Sanberg PR. Blood‑CNS Barrier Impairment in ALS patients versus an animal model. Front Cell Neurosci 2014; 8: 21. doi: 10.3389/ fncel.2014.00021.
62. Miyazaki K, Ohta Y, Nagai M, Morimoto N, Kurata T,Takehisa Y et al. Disruption of neurovascular unit prior to motor neuron degeneration in amyotrophic lateral sclerosis. J Neurosci Res 2011; 89(5): 718– 728. doi: 10.1002/ jnr.22594.
63. Drozdzik M, Bialecka M, Mysliwiec K, Honczarenko K, Stankiewicz J, Sych Z. Polymorphism in the P‑glycoprotein drug transporter MDR1 gene: a possible link between environmental and genetic factors in Parkinson’s disease. Pharmacogenetics 2003; 13(5): 259– 263.
64. Chung YC, Kim YS, Bok E, Yune TY, Maeng S, Jin BK.MMP‑3 contributes to nigrostriatal dopaminergic neuronal loss, BBB damage, and neuroinflammation in an MPTP mouse model of Parkinson‘s disease. Mediators Inflamm 2013; 4: 351– 355.
65. Johanson CE, Stopa EG, McMillan PN. The blood cerebrospinal fluid barrier: structure and functional significance. Methods Mol Biol 2011; 686: 101– 131. doi: 10.1007/ 978‑1‑60761‑938‑3_4.
66. Dziegielewska KM, Hinds LA, Møllgard K, Reynolds ML, Saunders NR. Blood‑brain, blood‑cerebrospinal fluid and cerebrospinal fluid‑brain barriers in a marsupial (Macropus eugenii) during development. J Physiol 1988; 403: 367– 388.
67. Kratzer I, Vasiljevic A, Rey C, Fevre‑Montange M, Saunders N, Strazielle N et al. Complexity and developmental changes in the expression pattern of claudins at the blood‑CSF barrier. Histochem Cell Biol 2012; 138(6): 861– 879. doi: 10.1007/ s00418‑012‑1001‑9.
68. Wolburg H, Wolburg‑Buchholz K, Liebner S, Engelhardt B. Claudin‑1, claudin‑2 and claudin‑11 are present in tight junctions of choroid plexus epithelium of the mouse. Neurosci Lett 2001; 307(2): 77– 80.
69. Lehtinen MK, Bjornsson CS, Dymecki SM, Gilbertson RJ, Holtzman DM, Monuki ES. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. J Neurosci 2013; 33(45): 17553– 17559. doi: 10.1523/ JNEUROSCI.3258‑13.2013.
70. Pan W, Banks WA, Kastin AJ. Permeability of the blood‑brain and blood‑spinal cord barriers to interferons. J Neuroimmunol 1997; 76(1– 2): 105– 111.
71. Ge S, Pachter JS. Isolation and culture of microvascular endothelial cells from murine spinal cord. J Neuroimmunol 2006; 177(1– 2): 209– 214.
72. Kanda T. Biology of the blood‑nerve barrier and its alteration in immune mediated neuropathies. J Neurol Neurosurg Psychiatry 2013; 84(2): 208– 212. doi: 10.1136/ jnnp‑2012‑302312.
73. Latker CH, Wadhwani KC, Balbo A, Rapoport SI. Blood‑nerve barrier in the frog during Wallerian degeneration: Are axons necessary for maintenance of barrier functions? J Comp Neurol 1991; 308(4): 650– 664.
74. Weerasuriya A, Curran GL, Poduslo JF. Blood‑nerve transfer of albumin and its implications for the endoneurial microenvironment. Brain Res 1989; 494(1): 114– 121.
75. Sano Y, Shimizu F, Nakayama H, Abe M, Maeda T,Ohtsuki S et al. Endothelial cells constituting blood‑nerve barrier have highly specialized characteristics as barierr‑forming cells. Cell Struct Funct 2007; 32(2): 139– 147.
76. Shimizu F, Sano Y, Abe MA, Maeda T, Ohtsuki S,Terasaki T et al. Peripheral nerve pericytes modify the blood‑nerve barrier function and tight junctional molecules through the secretion of various soluble factors. J Cell Physiol 2011; 226(1): 255– 266. doi: 10.1002/ jcp.22337.
77. Sano Y, Kanda Y. Blood‑neural barrier: overview and lates progress. Clin Exper Neuroimunol 2013; 4(2): 220– 227.
78. Kanda T, Numata Y, Mizusawa H. Chronic inflammatory demyelinating polyneuropathy: decreased claudin‑5 and relocated ZO‑1. J Neurol Neurosurg Psychiatry 2004; 75(5): 765–769.
79. Renaud S, Erne B, Fuhr P, Said G, Lacroix C, Steck AJet al. Matrix metalloproteinases‑9 and –2 in secondary vasculitic neuropathies. Acta Neuropathol 2003; 105(1): 37–42.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2014 Issue 5
Most read in this issue
- Czech Training Version of the Montreal Cognitive Assessment (MoCA‑ CZ1) for Early Identification of Alzheimer Disease
- Leukodystrophies – Clical and Radiological Findings
- Barriers of Nervous System under Physiological and Pathological Conditions
- Surgical Treatment of Supratentorial Cortico‑ subcortical Cavernous Malformation
