Synkopy, hluchota a slepota u karcinomu prsu – kazuistika
Syncope, Blindness and Deafness in Breast Cancer – a Case Report
Breast cancer is frequently associated with brain metastases and is the most common solid tumor to exhibit leptomeningeal carcinomatosis. The authors describe a case of a 61-years--old woman with generalized breast cancer who suffered from postural syncopes and suddenly developed deafness and blindness. Magnetic resonance imaging and cerebrospinal fluid analysis confirmed leptomeningeal infiltration. This type of clinical presentation of leptomeningeal carcinomatosis is considered to be very rare.
Key words:
breast neoplasms – meningeal carcinomatosis – postural syncope – blindness –deafness
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
K. Bechyně; I. Schenk
Authors‘ workplace:
Neurologické oddělení, Nemocnice Písek a. s.
Published in:
Cesk Slov Neurol N 2013; 76/109(5): 630-633
Category:
Case Report
Overview
Karcinom prsu je jeden z nejčastějších typů nádoru, jenž postihuje mozek metastázami, a mezi solidními tumory se řadí na první místo ve frekvenci výskytu leptomeningeální karcinomatózy. Autoři popisují kazuistiku 61leté ženy s generalizovaným lobulárním karcinomem prsu, u níž se objevily posturální synkopy a rychle postupující hluchota a slepota. U pacientky byla pomocí vyšetření magnetickou rezonancí a likvorologickým rozborem zjištěna leptomeningeální karcinomatóza. Tento klinický soubor ve vztahu k leptomeningeální karcinomatóze je velice raritní.
Klíčová slova:
karcinom prsu – meningeální karcinomatóza – posturální synkopa – slepota –hluchota
Úvod
Karcinom prsu je jeden z nejčastějších typů nádoru, jenž postihuje mozek metastázami. Incidence symptomatických mozkových metastáz se pohybuje od 10 do 16 %. Obvykle to jsou mnohočetná či solitární ložiska. Nejméně častým typem metastatického postižení je leptomeningeální karcinomatóza. Přesto se karcinom prsu řadí na první místo mezi solidními tumory ve frekvenci leptomeningeálního rozsevu [1].
Klinický nález při leptomeningeální karcinomatóze (LMC) může být pleomorfní a multifokální [2– 4]. Přinášíme kazuistiku pacientky s karcinomem prsu, u níž se rozvinula leptomeningeální karcinomatóza pod obrazem neobvyklé kombinace krátkodobých poruch vědomí a rychlé simultánní ztráty sluchu i zraku.
Kazuistika
U 61leté ženy, do té doby s nevýznamnou osobní anamnézou, byl v roce 2002 zjištěn karcinom prsu. Během pěti měsíců podstoupila několik cyklů chemoterapie s následnou pravostrannou mastektomií. Histologie upřesnila nález jako invazivní lobulární karcinom. Léčba pokračovala radioterapií jizvy po ablaci a oblastí regionálních uzlin. Dále se navázalo hormonální léčbou ukončenou v roce 2008.
V roce 2010 byly na PET/ CT zjištěny metastázy do 8.– 9. žebra vpravo s doprovodným fluidotoraxem. Onkolog indikoval hormonální terapii, přičemž se ale nepodařilo zabránit rychlému zvětšování tumorózní expanze na pravé straně hrudníku a dalšímu metastatickému rozsevu do nitrohrudních uzlin a obratlových těl C5, L5. Byla provedena lokální radioterapie na oblasti infiltrátu hrudní stěny a dále změna hormonální léčby na cytostatickou, která probíhala od listopadu 2010 do března 2011. Při kontrolním PET/ CT nebyla zjištěna ložiska viabilní neoplazie. Vzhledem k dyspepsii, celkové únavě a leukopenii byla chemoterapie přerušena.
2. 4. 2011 byla pacientka přivezena na chirurgickou ambulanci pro několikadenní nauzeu, zvracení a opakované krátkodobé poruchy vědomí charakteru posturálních synkop. Chirurg provedl akutní sonografii břicha a RTG snímek hrudníku bez významnějšího nálezu. Stav uzavřel jako gastritis a pacientku odeslal na interní oddělení.
Tam byla přijata s hlavní diagnózou recidivujících synkopálních stavů. Opakovaně ztrácela vědomí ve stoji i vsedě, opět ho rychle nabývala v horizontální poloze. Stěžovala si na celkovou únavu, slabost, posléze i pocity závratí a mírné bolesti hlavy. Nebyla prokázána posturální hypotenze (TK vleže 170/ 100, vsedě 160/ 100, vstoje 165/ 105 torr). Telemetrické monitorování EKG přenášelo trvale sinusový rytmus o frekvenci 60– 86/ min. V základním laboratorním skríningu nebyly zásadnější patologické hodnoty.
Jelikož internista nedokázal vysvětlit opakované synkopy, byla pacientka dne 5. 4. 2011 přeložena na neurologické oddělení. V čase překladu byla plně lucidní, afebrilní, bez objektivních meningeálních příznaků či poruchy hlavových nervů, na končetinách byla areflexie, nebyly přítomny paretické příznaky ani poruchy taxe či pyramidální iritační jevy, nebyla porucha čití. Pacientka byla ležící a vyšetřování se muselo provádět pouze vleže, protože při vertikalizaci se prudce zhoršovaly všechny její subjektivní obtíže, ke kterým se ještě přidalo zvracení a oboustranný tinnitus.
Během dalších osmi dnů stav rychle progredoval. Postupně se zhoršoval zrak a sluch. Závěrem se skokově objevila úplná hluchota a slepota při mydriatických areaktivních zornicích. Při vertikalizaci s latencí jen několika sekund ztrácela vědomí, po položení zpět na lůžko se objevil horizontální nystagmus, který postupně mizel, jak pacientka opět nabývala vědomí.
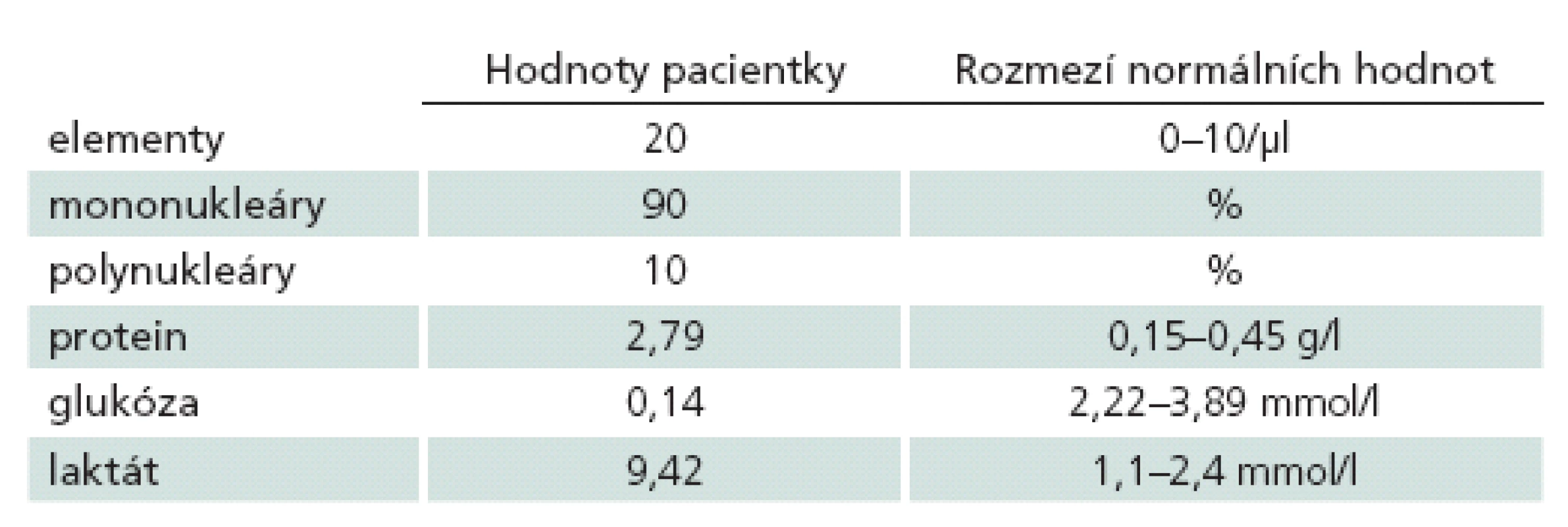
Provedená MR mozku a krční míchy s kontrastní látkou přinesla obraz jemného enhancementu měkkých plen v zadní jámě lební a krční míchy. Kontrastní sycení vykazovaly i oba VIII. hlavové nervy (obr. 1). V likvoru byly nalezeny maligně vyhlížející synciciální buněčné struktury (obr. 2), projevy výrazného katabolizmu likvorového kompartmentu s hypoglykorhachií a syndromem proteino‑ cytologické asociace (tab. 1).
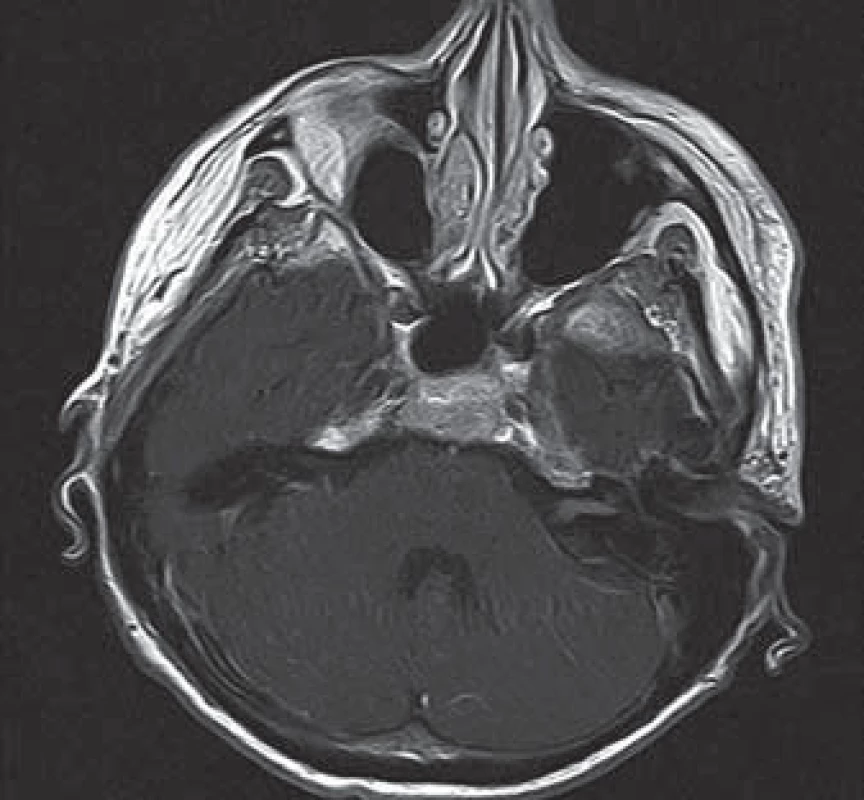
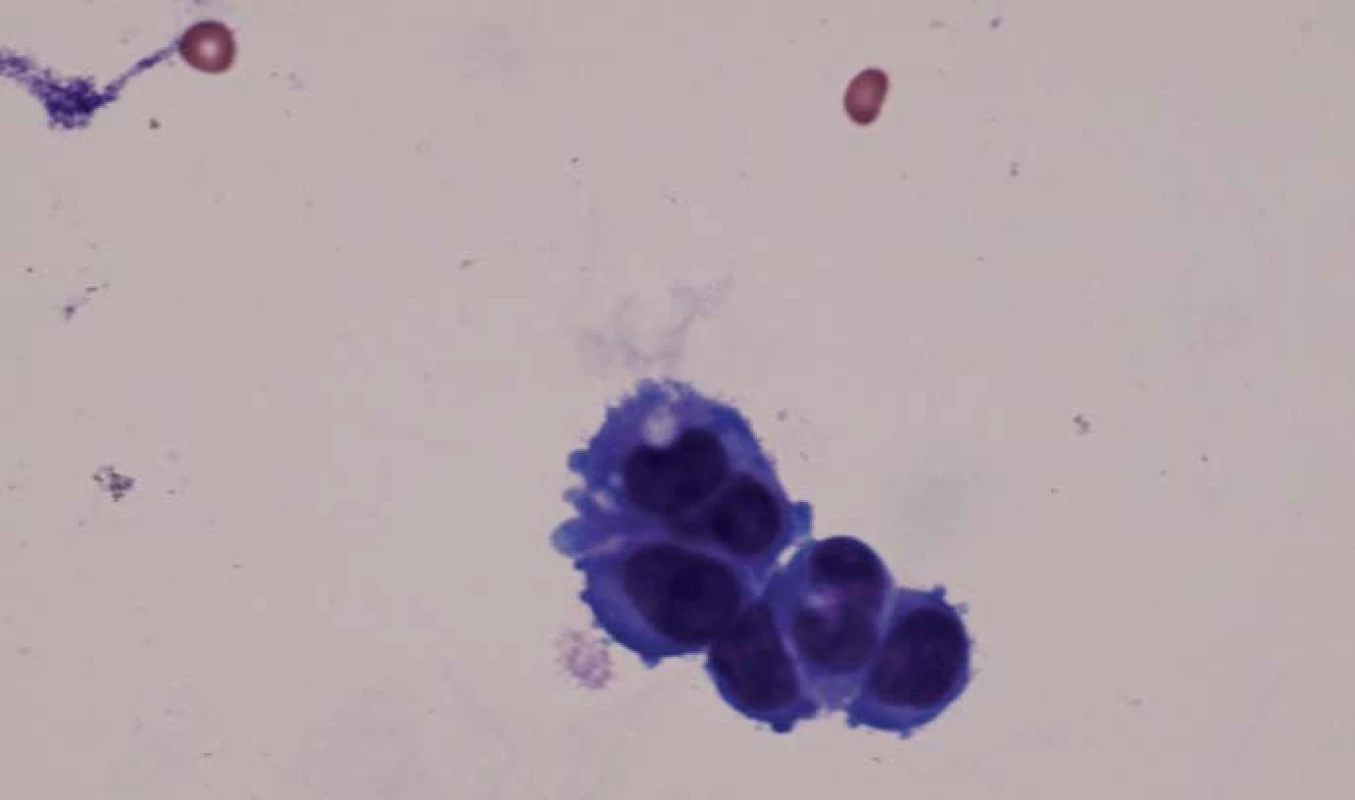
V dalším průběhu nemoci se objevila trvalá kvantitativní porucha vědomí, kvadruparéza a okohybná porucha. Šestnáctý den od přijetí do nemocnice pacientka umírá.
Případ jsme uzavřeli jako leptomeningeální karcinomatózu při generalizovaném lobulárním karcinomu prsu.
Diagnóza leptomeningeální karcinomatózy byla potvrzena sekčním nálezem, v němž patolog popsal difuzní nádorovou infiltraci měkkých plen mozku a míchy adenokarcinomem. Nádorové infiltráty se v některých místech propagovaly do mozkového parenchymu, resp. bílé hmoty míšní. Stejný nález byl při odstupech nervů jak hlavových, tak i spinálních (krční míchy). Zjištěna byla i perivaskulární propagace (obr. 3). Imunohistochemické vyšetření identifikovalo původ maligních elementů v lobulárním karcinomu prsu.
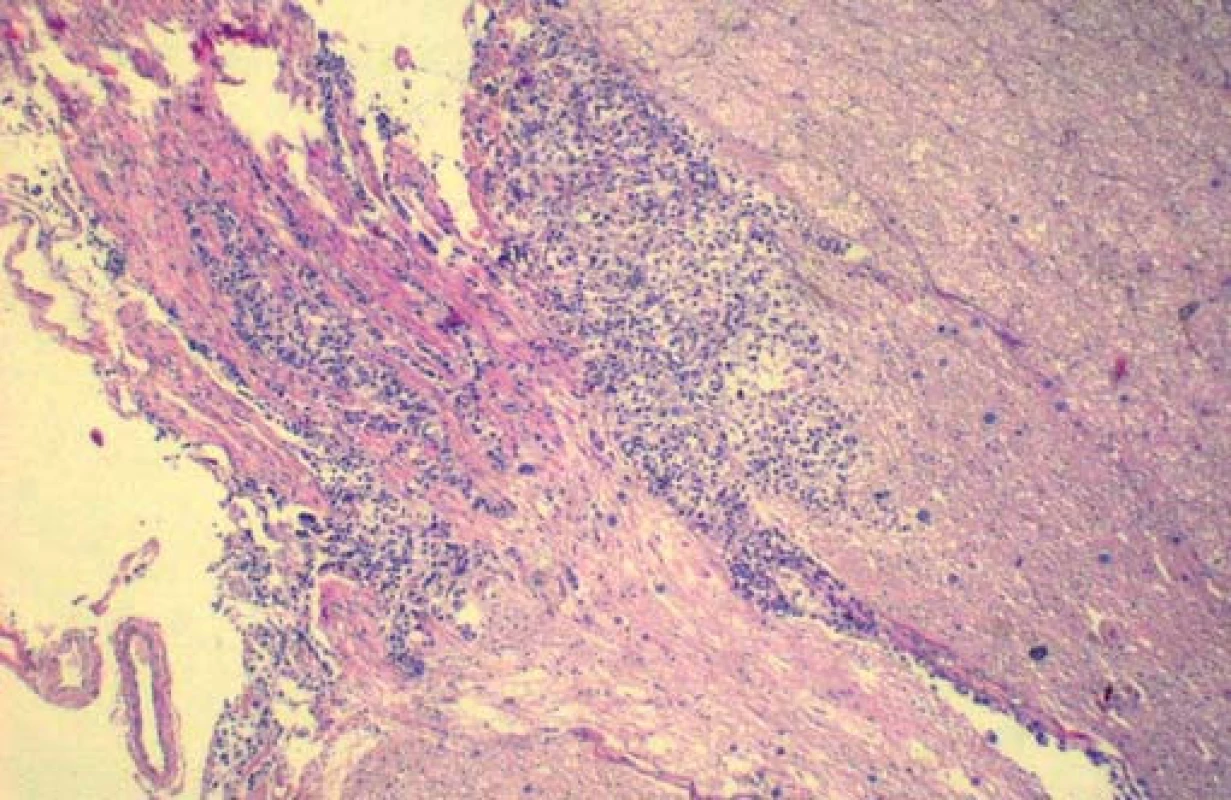
Diskuze
Metastatické postižení leptomening bylo poprvé popsáno švýcarským patologem K. J. Eberthem v roce 1870 a termín „(lepto‑ )meningeální karcinomatóza“ pak zavedl v roce 1902 Siefert [2].
Frekvence výskytu LMC je u karcinomu prsu mezi 2 a 5 % [2]. Silnější asociaci s LMC má jeho lobulární histologický subtyp, což je zřejmě způsobeno rozdílnou expresí určitých proteinů (E‑ cadherin, tenascin a další). Lobulární typ způsobuje spíše LMC bez současné přítomnosti metastáz para‑meningeálních struktur (kostní či mozkové metastázy). LMC jako jediný příznak malignity je málo obvyklý a 70– 90 % pacientů s karcinomem prsu má aktivní systémové onemocnění v čase diagnózy [3].
Metastatické šíření na leptomeningy se děje hematogenní nebo lymfogenní cestou, prorůstáním podél nervových či cévních struktur a z blízkých kostních, resp. mozkových ložisek. Další diseminace podél pia mater je nezávislé na směru toku likvoru [3,4].
V mikroskopickém obraze maligní buňky spolu s lokální fibrózou lemují leptomeningy, mozkové cévy a nervy. V těchto oblastech se také vyskytují demyelinizační ložiska. Maligní infiltrace perivaskulárních a Virchow‑ Robinových prostorů je spojována s ischemickými změnami [3]. Maligní buňky mohou invadovat do subpiálního parenchymu, hlavových (spinálních) nervů, agregovat se v masy v subarachnoideálním prostoru nebo vytvářet obstrukci likvorových cest [2,4]. Aktivita nádorových buněk také alteruje celkový metabolizmus v CNS [4].
Vznikající symptomy vyplývají z poruch mozkových hemisfér (15 % pacientů), hlavových nervů (35 %) a míchy, resp. míšních kořenů (60 %) [2].
Oční příznaky se u LMC vyskytují často a v řadě podob [5]. Porucha vizu jako část klinického syndromu LMC byla poprvé popsána v roce 1955 v práci Fischer‑ Williamse a následně v roce 1961 také Katzem [6]. Obvykle počíná unilaterálně, avšak oboustranné postižení se rozvíjí během několika dnů. Další progrese probíhá v řádech týdnů, nicméně úplné oslepnutí může vzniknout i do 48 hod. Je několik teorií vysvětlujících poruchu zraku u LMC. Především se jedná o pozorování infiltrace subarachonoideálního prostoru maligními buňkami okolo optického nervu. Ovšem porucha zraku se objevuje i u pacientů bez tohoto fenoménu. Chronický otok papily při zvýšeném nitrolebním tlaku může také hrát kauzální či podpůrnou roli. Je ale nutné podotknout, že nález na optickém fundu je obvykle normální. Patologické změny v oblasti okcipitálních laloků, pokud jsou přítomny, nedosahují míry vysvětlující vznik slepoty. Jsou popsány jednotlivé případy přímé neoplazmatické infiltrace optického nervu či choroidey [7,8]. Předpokládá se i podíl cévní složky [8]. Kombinace bolestí hlavy, poruchy vizu a pupilárních reflexů při normálním nálezu na optickém disku je považována za diagnostický kvartet leptomeningeální infiltrace obalů optického nervu [5].
Senzorineurální porucha sluchu je naopak poměrně zřídka se vyskytující manifestace LMC [9]. Poprvé ji popsal Saenger v roce 1900 [10]. Porucha sluchu obvykle počíná unilaterálně s doprovodným tinnitem a následnou rychlou progresí do bilaterálního postižení, případně v doprovodu parézy VII. hlavového nervu či dalších konkomitantních příznaků [9]. Patofyziologický podklad bývá stavěn na infiltraci VIII. hlavového nervu, jeho malignitou indukovanou ischemizaci či přímou infiltrací sluchového labyrintu. Korelující nález při kontrastním MR vyšetření hlavy je enhancement VIII. hlavového nervu nebo meatus acusticus internus [11]. Progresivní porucha VIII. hlavového nervu s bolestí hlavy či periferní parézou VII. hlavového nervu u pacienta s anamnézou maligního onemocnění je pak další diagnostický soubor patřící k LMC [9,10].
Vzhledem k nálezu na kontrastním MR vyšetření mozku jsme předpokládali, že porucha sluchu u naší pacientky byla způsobena přímou infiltrací VIII. hlavového nervu, což histologické vyšetření potvrdilo. Průběh II. hlavového nervu ani jednotlivé vrstvy očního bulbu bohužel nebyly podrobněji vyšetřeny, čili určení patogeneze slepoty chybí.
Souběh ztráty sluchu a zraku při LMC a solidním tumoru je velmi raritní. V literatuře jsme našli pouze dvě podobné kazuistiky. První popisuje případ 65letého muže se základní diagnózou kolorektálního karcinomu, druhá pak 64leté ženy s nemalobuněčným karcinomem plic [8,12].
Naše pacientka navíc trpěla krátkodobými poruchami vědomí v návaznosti na posturální změny, zprvu nepravidelně, ale s postupnou progresí onemocnění trvale s intolerancí vzpřímené polohy. Stav jsme hodnotili jako posturální neurálně mediované synkopy.
Synkopa je dalším možným projevem LMC [4,13]. V jejím patofyziologickém mechanizmu hraje důležitou roli arteriální baroreceptorový reflex (baroreflex). Nádorem způsobená porucha aferentních drah baroreflexu se projevuje tzv. reflexní synkopou, porucha eferentních drah pak ortostatickou (neurogenní) hypotenzí, která také rezultuje v synkopální stavy [13].
Metastázy karcinomu prsu mohou přímo zasáhnout sinus caroticus, jak popsali Holmes et al [14]. Literatura rovněž uvádí různé formy neuropatie IX. a X. hlavového nervu indukované nádorem, které se projevují synkopami [15]. Sozzi et al popsali případ leptomeningeální karcinomatózy se sekundární vago‑ glossofaryngeální neuralgií v doprovodu synkop [16]. Bruera et al zjistili, že pacienti s pokročilým stadiem prsního karcinomu trpí často ortostatickou hypotenzí v důsledku poruchy kardiovaskulárních autonomních funkcí [17]. Ortostatická hypotenze jako důsledek sekundární autonomní dysfunkce je zapříčiněna i paraneoplastickým procesem [13].
Přesné určení patofyziologického podkladu synkopálních stavů je v našem případě velmi obtížné. Zjistili jsme sekčním nálezem infiltrativní proces IX.– X. hlavového nervu, ale pacientka nevykazovala kromě synkop další symptomy patřící k poruše těchto nervů. Histologické vyšetření sinus caroticus jsme neprovedli. Porucha baroreflexu mohla vzniknout i na centrální úrovni mozkového kmene, neboť v této oblasti byla histologicky zjištěna infiltrace parenchymu maligními buňkami. Paraneoplastický proces také nemůžeme zcela vyloučit, byť onkoneurální protilátky (anti‑Hu, Yo, Ri, PNMA2, amfifyzin, NMDAR) byly negativní.
Identifikace maligních buněk v likvoru je „sine qua non“ diagnózy LMC, ovšem u 5 % pacientů je cytologické vyšetření negativní. Základní likvorologické metody pak mohou diagnózu podporovat: zvýšený počet elementů (64 % pacientů), zvýšená hodnota proteinu (59– 76 %), nízká hodnota glukózy (31– 75 %) [4].
Z grafických metod je nejpřínosnější kontrastní MR vyšetření, které dosahuje 90% senzitivity při LMC na podkladě solidního tumoru [3]. Kompatibilní s diagnózou je kontrastní enhancement leptomening, subependymální zóny, hlavových a spinálních nervů nebo hydrocefalus [3,4].
Léčba LMC je v zásadě paliativní a symptomatická, neboť i agresivní terapeutický přístup může pouze prodloužit dobu přežití z jednoho na tři měsíce. Smrt nastává často z neurologické příčiny [4].
Závěr
Leptomeningeální karcinomatóza je svou povahou velice různorodá jednotka. Může postihovat současně více úrovní nervové soustavy, a tak tvořit velice neobvyklý klinický obraz. Naše kazuistika, kde se LMC zpočátku prezentovala posturálními synkopami, ke kterým se přidala úplná ztráta sluchu a zraku, je toho příkladem a dle nám dostupných informací jediným takovým případem ve spojení s karcinomem prsu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Karel Bechyně
Neurologické oddělení
Nemocnice Písek a.s.
K. Čapka 589
397 01 Písek
e-mail: karel.bechyne@centrum.cz
Přijato k recenzi: 23. 2. 2013
Přijato do tisku: 21. 5. 2013
Sources
1. Weil RJ, Palmieri DC, Bronder JL, Stark AM, Steeg PS. Breast cancer metastasis to the central nervous system. Am J Pathol 2005; 167(4): 913– 920.
2. Martins SJ, Azevedo CR, Chinen LT, Cruz MR, Peterlevitz MA, Gimenes DL. Meningeal carcinomatosis in solid tumors. Arq Neuropsiquiatr 2011; 69(6): 973– 980.
3. Jayson GC, Howell A. Carcinomatous meningitis in solid tumors. Ann Oncol 1996; 7(8): 773– 786.
4. Groves MD. Leptomeningeal disease. Neurosurg Clin N Am 2011; 22(1): 67– 78.
5. McFadzean R, Brosnahan D, Doyle D, Going J, Hadley D, Lee W. A diagnostic quartet in leptomeningeal infiltration of the optic nerve sheath. J Neuroophthalmol 1994; 14(3): 175– 182.
6. Teare JP, Whitehead M, Rake MO, Coker RJ. Rapid onset of blindness due to meningeal carcinomatosis from an oesophageal adenocarcinoma. Postgrad Med J 1991; 67(792): 909– 911.
7. Altrocchi PH, Eckman PB. Meningeal carcinomatosis and blindness. J Neurol Neurosurg Psychiatry 1973; 36(2): 206– 210.
8. Kirthi V, Penn H, Hamdulay S, Ranger A, Higgens C. Losing all sense: a case of meningeal carcinomatosis. BMJ Case Rep 2011; 2011: bcr1020103446.
9. Testoni S, Pirodda A, Pastore Trossello M, Minguzzi E,D‘Alessandro R. Meningeal carcinomatosis causing isolated bilateral symmetric progressive hearing loss. Neurol Sci 2005; 25(6): 345– 347.
10. Baba S, Matsuda H, Gotoh M, Shimada K, Yokoyama Y, Sakanushi A. A case of meningeal carcinomatosis presenting with the primary symptoms of facial palsy and sensorineural deafness. J Nippon Med Sch 2006; 73(4): 240– 243.
11. Goyault G, Kremer S, Martin E, Riehm S, Dietemann JL, Veillon F. Leptomeningeal carcinomatosis and sensorineural hearing loss: correlation of labyrinthine enhancement patterns with symptoms. J Neuroradiol 2009; 36(2): 98– 101.
12. Bruce BB, Tehrani M, Newman NJ, Biousse V. Deafness and blindness as a presentation of colorectal meningeal carcinomatosis. Clin Adv Hematol Oncol 2010; 8(8): 564– 566.
13. Benarroch EE. The arterial baroreflex: functional organization and involvement in neurologic disease. Neurology 2008; 71(21): 1733– 1738.
14. Holmes FA, Glass JP, Ewer MS, Terjanian T, Tetu B.Syncope and hypotension due to carcinoma of the breast metastatic to the carotid sinus. Am J Med 1987; 82(6): 1238– 1242.
15. Lin HW, Rho MB, Amin‑Hanjani S, Barker FG, Deschler DG. Glossopharyngeal and limited vagal neurectomy for cancer‑related carotid sinus syncope. Skull Base 2009; 19(5): 369– 373.
16. Sozzi G, Marotta P, Piatti L. Vagoglossopharyngeal neuralgia with syncope in the course of carcinomatous meningitis. Ital J Neurol Sci 1987; 8(3): 271– 275.
17. Stone CA, Kenny RA, Nolan B, Lawlor PG. Autonomic dysfunction in patients with advanced cancer; prevalence, clinical correlates and challenges in assessment. BMC Palliat Care 2012; 11: 3.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 5
Most read in this issue
- Wilsonova nemoc
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině



