Současné možnosti využití magnetické rezonance v diagnostice normotenzního hydrocefalu
Current Possibilities of the Use of Magnetic Resonance in the Diagnosis of Normal Pressure Hydrocephalus
Normal pressure hydrocephalus, especially idiopathic, is a disease of older age. Diagnosis of this disease is still a topic of scientific research and discussions. Magnetic resonance imaging of the brain seems to be a perspective diagnostic tool. In our review, we present modalities of magnetic resonance imaging of the brain that can be useful in the diagnostic algorithm of normal pressure hydrocephalus. We present both, conventional magnetic resonance imaging that shows the morphology of brain parenchyma, as well as modalities that provide valuable information about the functional parameters of the brain tissue. Although research in this area is promising, the optimal modality of magnetic resonance imaging of the brain has not been identified yet. Therefore, magnetic resonance imaging continues to be used as a complementary method and cannot fully replace the liquorodynamic tests.
Key words:
normal pressure hydrocephalus – gait disturbances – dementia – incontinentia – magnetic resonance imaging of the brain
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
T. Radovnický 1; M. Nováková 2; M. Derner 2; P. Vachata 1; M. Sameš 1
Authors‘ workplace:
Neurochirurgická klinika Univerzity J. E. Purkyně a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
1; Radiologické oddělení, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
2
Published in:
Cesk Slov Neurol N 2013; 76/109(5): 584-591
Category:
Review Article
Podpořeno grantem IGA MZ ČR NT14448-3/2013.
Overview
Normotenzní hydrocefalus, především idiopatický, je choroba osob vyššího věku, jejíž diagnostika je stále předmětem odborného výzkumu a diskuzí. Jako perspektivní se jeví v této oblasti vyšetření magnetickou rezonancí mozku. V přehledu uvádíme metody magnetické rezonance využitelné v diagnostice normotenzního hydrocefalu. Zabýváme se jak vyšetřením standardní magnetickou rezonancí, která zobrazuje mozkový parenchym morfologicky, tak i modalitami, které poskytují cenné informace o funkčním stavu mozkové tkáně. Ačkoliv je výzkum v této oblasti slibný, stále se nedaří identifikovat optimální modalitu vyšetření a magnetická rezonance prozatím zůstává metodou komplementární a nemůže v současnosti nahradit prováděné likvorodynamické testování.
Klíčová slova:
normotenzní hydrocefalus – poruchy chůze – demence – inkontinence – magnetická rezonance mozku
Použité zkratky
ADC kvocient zjevné difuze (Apparent Diffusion Coefficient)
BD Binswangerova nemoc (Binswanger’s Disease)
Cho cholin
Cr kreatin (creatin)
CSF mozkomíšní mok (CerebroSpinal Fluid)
CT výpočetní tomografie (Computed Tomography)
DTI zobrazení difuzních tenzorů (Diffusion Tensor Imaging)
DTPA diethylentriaminpentaacetát
DWI difuzně vážený obraz (Diffusion Weighted Imaging)
FA frakční anizotropie (Fractional Anisotropy)
MD průměrná difuzivita (Mean Diffusivity)
MR magnetická rezonance (Magnetic Resonance)
NAA N-acetylaspartát
NPH normotenzní hydrocefalus (Normal Pressure Hydrocephalus)
PC-MRI metoda fázového kontrastu magnetické rezonance (Phase Contrast Magnetic Resonance Imaging)
PWI perfuzně vážený obraz (Perfusion Weighted Imaging)
rCBV relativní objem krve v mozku (relative Cerebral Blood Volume)
ROI oblast zájmu (Region Of Interest)
Tna celkový N-acetylaspartát (Total N-acetylaspartate)
Úvod
Normotenzní hydrocefalus (NPH), především idiopatický, je choroba vyššího věku, která významným způsobem zhoršuje kvalitu života a zvyšuje závislost pacientů na rodině či na ústavní péči. NPH proto představuje závažný zdravotnický, ale i socioekonomický problém. Tato choroba byla popsána poprvé Hakimem a Adamsem již v roce 1965 jako typ komunikujícího hydrocefalu s normálním tlakem mozkomíšního moku [1]. Ačkoliv je tedy známa již několik desítek let, její etiologie a patogeneze není dosud objasněna. Pokud se NPH diagnostikuje správně a pacientovi se dostane adekvátní léčby (zkratový výkon), dochází ke zlepšení kvality života [2]. Diagnostika NPH by se měla opírat o typickou klinickou Hakimovu‑ Adamsovu triádu, tzn. poruchy chůze, kognitivní deficit a sfinkterové poruchy. Další součástí mozaiky diagnostiky NPH je likvorodynamické vyšetřování, nejčastěji lumbální infuzní test či dočasné zavedení zevní lumbální drenáže. Používanou metodou na některých pracovištích je i přímé měření intrakraniálního tlaku zavedeným čidlem [3]. Stěžejní pro diagnostiku NPH jsou i zobrazovací metody. Výpočetní tomografie (CT) a magnetická rezonance mozku (MR)ukáže základní nález při onemocnění NPH, a to dilataci komorového systému. CT je základním vyšetřením pro zobrazení mozkové tkáně a likvorových prostor či perfuze daných oblastí parenchymu. Při vyšetřování CT ale pacienta vystavujeme radiační zátěži a při srovnání s MR má nižší kontrastní rozlišení. MR vyšetření je oproti tomu nezátěžové a v poslední době se objevují nová programová vybavení pro MR, která v diagnostice NPH poskytují informace nejen o morfologii mozkové tkáně, ale i o funkčních a metabolických vlastnostech mozkového parenchymu. V dalším textu metody používané v diagnostice NPH shrnujeme. Jedná se o vyšetření standardní MR, difuzně a perfuzně vážené MR, zobrazení difuzních tenzorů, volumetrii, metodu fázového kontrastu a MR cisternografii. Vynecháváme přitom technické detaily a metodologii jednotlivých vyšetření, neboť toto sdělení je určeno zejména neurologické a neurochirurgické odborné veřejnosti. Jednotlivé metody jsou řazeny chronologicky dle vzniku.
Standardní magnetická rezonance
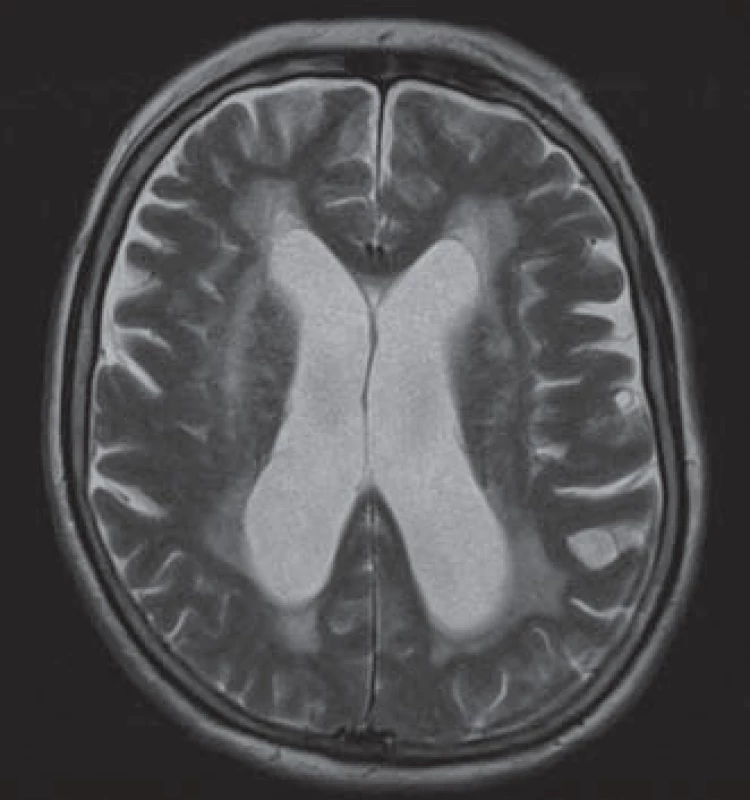
Standardní MR mozku je základní vyšetření v diagnostice NPH. U všech pacientů by měla být přítomna dilatace komorového sytému, která je ve většině studií definována jako Evansův index > 0,3. Tento index je poměrem mezi maximální šíří frontálních rohů postranních komor a maximálním vnitřním průměrem lebky [4]. Hattori et al udávají, že pacienti s NPH měli oproti pacientům s jiným typem demencí signifikantně vyšší Evansův index (0,37 ± 0,04) [5]. Vyšší Evansův index je velmi senzitivní, ale málo specifický pro NPH a výše hodnoty Evansova indexu nekoreluje s tíží klinických příznaků a nepředpovídá odpověď pacienta na zkratový výkon. U klinických responderů se také Evansův index často nevrací zpět k fyziologické hodnotě [6]. Evansův index se může velmi lišit v závislosti na výši axiálního řezu či úhlu zobrazení. Proto by dle Tomy et al mělo být využíváno volumetrické měření objemu komor. Nejvíce podle této práce s volumetrickým měřením koreloval Evansův index měřený 16 mm nad rovinou danou spojnicí commisura anterior a posterior [7]. Ambarki et al v práci, která srovnává volumetrické měření objemu komor a hodnotu Evansova indexu, taktéž došli k závěru, že tyto hodnoty spolu nekorelují, a doporučují používat spíše volumetrii [8]. Další měřenou hodnotou je úhel corpus callosum. Ishii et al srovnávali úhel corpus callosum u pacientů s NPH, Alzheimerovou chorobou a u zdravých dobrovolníků. Dle jejich měření byl úhel corpus callosum u NPH pacientů signifikantně menší než u ostatních dvou skupin [9]. V T2 váženém obraze jsou u pacientů s NPH viditelné periventrikulární hyperintenzity dané transependymálním prosakem mozkomíšního moku, tedy zvýšením obsahu vody v extracelulárním prostoru (obr. 1). Svůj podíl může mít i glióza a edém periventrikuláního parenchymu [10]. V některých studiích je udávána přítomnost periventrikulární hyperintenzity na T2 váženém obraze jako pozitivní prediktivní faktor. Toto je pak vysvětleno tím, že u těchto pacientů ještě nedošlo k ustálení hydrocefalu a změny v periventrikulární tkáni jsou ještě reverzibilní, proto po provedení zkratu dochází u těchto pacientů k výraznějšímu zlepšení klinického stavu ve srovnání s pacienty bez periventrikulárních hyperintenzit [11–14]. Navzdory tomu však senzitivita i specificita periventrikulárních hyperintenzit zůstává nízká [15]. Algin et al zjišťovali přítomnost periventrikulárních hyperintenzit v T2 váženém obraze u pacientů s NPH, s jinou etiologií demence a u zdravých dobrovolníků. Udávají, že přítomnost tohoto znaku byla častější u nemocných než u dobrovolníků. Avšak signifikantní rozdíl mezi NPH skupinou a skupinou s jinou příčinou demence nebyl nalezen. Taktéž nezjistili rozdíl mezi shunt respondéry a non‑respondéry [16].
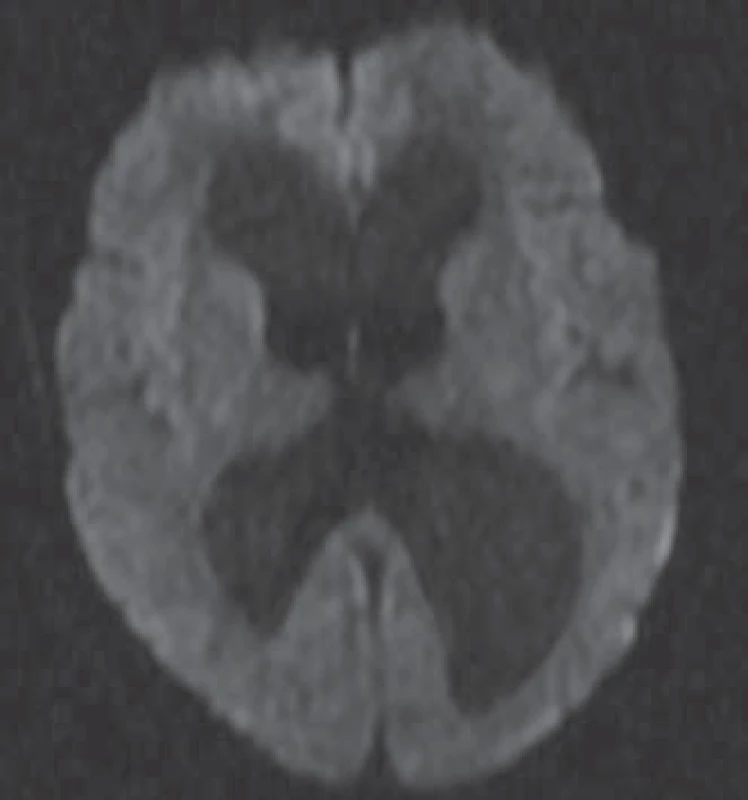
Difuzně vážená magnetická rezonance
Difuzně vážená MR mozku (MR DWI) je modalita vyšetření MR, která je založena na difuzivitě (obr. 2). Sledovaná hodnota je ADC (kvocient zjevné difuze), jež vyjadřuje difuzivitu vody v mozkové tkáni bez ohledu na směrovou závislost difuze [17]. Teoretickým základem pro vyšetřování ADC je předpoklad, že při NPH dochází k přestupu vody transependymálně, čímž se mění vlastnosti periventrikulární mozkové tkáně. Při zaměření ROI (oblast zájmu) periventrikulárně do míst transependymálního prosaku by tedy měla být hodnota ADC u pacientů s NPH vyšší než u zdravých jedinců vzhledem k vyšší koncentraci vody. Pokud je hodnota ADC vyšší než 7,56 × 10– 4 mm²/ s, transependymální prosak likvoru je potvrzen [18–20]. Ng et al popisují u všech pacientů s NPH v jejich souboru periventrikulárně (při frontálních a okcipitálních rozích postranních komor) zvýšený ADC, který po provedení zkratu klesá, což koreluje se zlepšením klinického stavu pacientů. Věří, že za symptomy NPH je spíše odpovědná akumulace vody v mozkovém parenchymu než ventrikulomegalie. Dále popisují, že pokud se opět hodnota ADC po provedení zkratu zvýší, jedná se o citlivý ukazatel malfunkce shuntu [17].
Tullberg et al se zaměřili na hodnoty ADC u pacientů s Binswangerovou nemocí (BD), NPH a u kontrolní skupiny v periventrikulární bílé hmotě a v hluboké bílé hmotě frontálního a okcipitálního laloku. Dle jejich výsledků měli pacienti s BD v daných oblastech mozku vyšší hodnoty ADC než pacienti s NPH. Shunt respondéři měli přitom srovnatelné hodnoty ADC s kontrolní skupinou zdravých dobrovolníků. Vyšší hodnota ADC u pacientů s BD tedy může být spojena se ztrátou axonální integrity a ireverzibilními změnami. Nezvýšené hodnoty ADC tak u NPH pacientů mohou znamenat reverzibilní lézi. Metoda měření ADC by tedy mohla významně přispět k odlišení shunt respondérů a non‑respondérů. Tullberg et al také prokázali, že vyšší hodnota ADC ve frontální periventrikulární hmotě byla spojena se závažnějšími poruchami v kognitivní sféře jak u pacientů s BD, tak i u pacientů s NPH [21].
MR DWI je podobně jako MR DTI (zobrazení difuzních tenzorů) založena na sledování difuzních parametrů. Jedná se o perspektivní metodu v odlišení respondérů a non‑respondérů. Zvýšená hodnota ADC značí však již ireverzibilní lézi, proto je pro záchyt respondérů nedostatečně senzitivní a vhodná je kombinace s jinou modalitou MR (např. DTI).
MR spektroskopie
Tato modalita vyšetření MR umožňuje sledovat koncentraci určitých metabolitů v mozkové tkáni či intraventrikulárně (obr. 3). Jelikož lze předpokládat, že metabolizmus mozkové tkáně je NPH ovlivněn, je tato metoda potenciálně perspektivní. Předmětem současného výzkumu je, jaké metabolity vykazují specifické změny a ve kterých oblastech mozkové tkáně se tak děje. Jednotlivé studie přitom vykazují velmi rozdílné výsledky. Lundin et al vyšetřovali pomocí absolutní kvantifikace koncentraci metabolitů v thalamu a ve frontální hluboké bílé hmotě. Zjistili, že koncentrace N‑ acetylaspartátu (NAA) byla v thalamu pacientů s NPH o 11 % nižší než u zdravých dobrovolníků. Koncentrace celkového N‑ acetylaspartátu (tNA) byla v téže oblasti o 6 % nižší. Výsledky této studie tedy ukazují na přítomnost neuronální dysfunkce v thalamu nemocných. V hluboké frontální bílé hmotě rozdíly v koncentraci NAA ani tNA oproti zdravým dobrovolníkům nezjistili [22]. Lenfeldt et al popisují snížení poměru NAA/ Cr (kreatinin) v hluboké frontální bílé hmotě NPH pacientů v porovnání s kontrolní skupinou. Dále zjistili, že u pacientů, kteří nereagují zlepšením neurologického stavu po implantaci zevní lumbální drenáže, je poměr NAA/ Cr signifikantně nižší než u pacientů, kteří zlepšení neurologického stavu vykazují. To znamená, že u těchto jedinců nedosáhl stupeň neuronálního poškození ireverzibility a implantace zkratu má ještě klinický význam [23]. del Mar Matarin et al ve svém měření poměru metabolitů v mediální části frontálních laloků zjistili, že u pacientů s NPH po zkratovém výkonu poměr NAA/ Cr v této oblasti stoupá. Pooperační hodnota poměru těchto metabolitů pak korelovala se stavem kognitivních funkcí pacientů (měřeno pomocí Mini Mental State Exam) [24]. Shiino et al se zaměřili na poměr NAA/ Cr a NAA/ Cho (cholin) v periventrikulárním mozkovém parenchymu pacientů se sekundárním NPH a srovnali výsledky s klinickým vývojem. Zjistili, že zvýšený poměr NAA/ Cho má 89,5% prediktivní hodnotu na zlepšení klinického stavu pacienta po zkratovém výkonu [25]. Algin et al měřili poměry koncentrací metabolitů v blízkosti frontálních rohů postranních komor u pacientů s NPH, s jiným typem demence a u kontrolní skupiny. Dle jejich měření byl poměr NAA/ Cr a NAA/ Cho u NPH pacientů nižší než u zdravých jedinců. Stejně tak snížen byl však i u pacientů s jinou etiologií demence. V koncentracích látek mezi shunt respondéry a non‑respondéry taktéž nebyl nalezen signifikantní rozdíl. Ke stejnému závěru došli při zkoumání poměru Cho/ Cr, který je vyšší u pacientů s NPH nebo jinou demencí oproti zdravým jedincům. Korelace mezi klinickou reakcí NPH pacienta na shunt a poměrem Cho/ Cr taktéž nebyla zjištěna [16]. MR spektroskopie by tedy podle Algina et al neměla být využívána jako hlavní diagnostická metoda, ale jen jako doplňková. Braun et al udávají, že MR spektroskopie nedokázala určit specifické změny metabolitů u pacientů s hydrocefalem, a nelze ji tedy použít v jeho diagnostice [26]. Zjistili tak na velmi heterogenním souboru 24 pacientů ve věkovém rozmezí 1 den–83 let. Příčina hydrocefalu byla taktéž rozdílná (hydrocefalus nezralých novorozenců i NPH). Závěry studie tedy nelze brát jako validní.
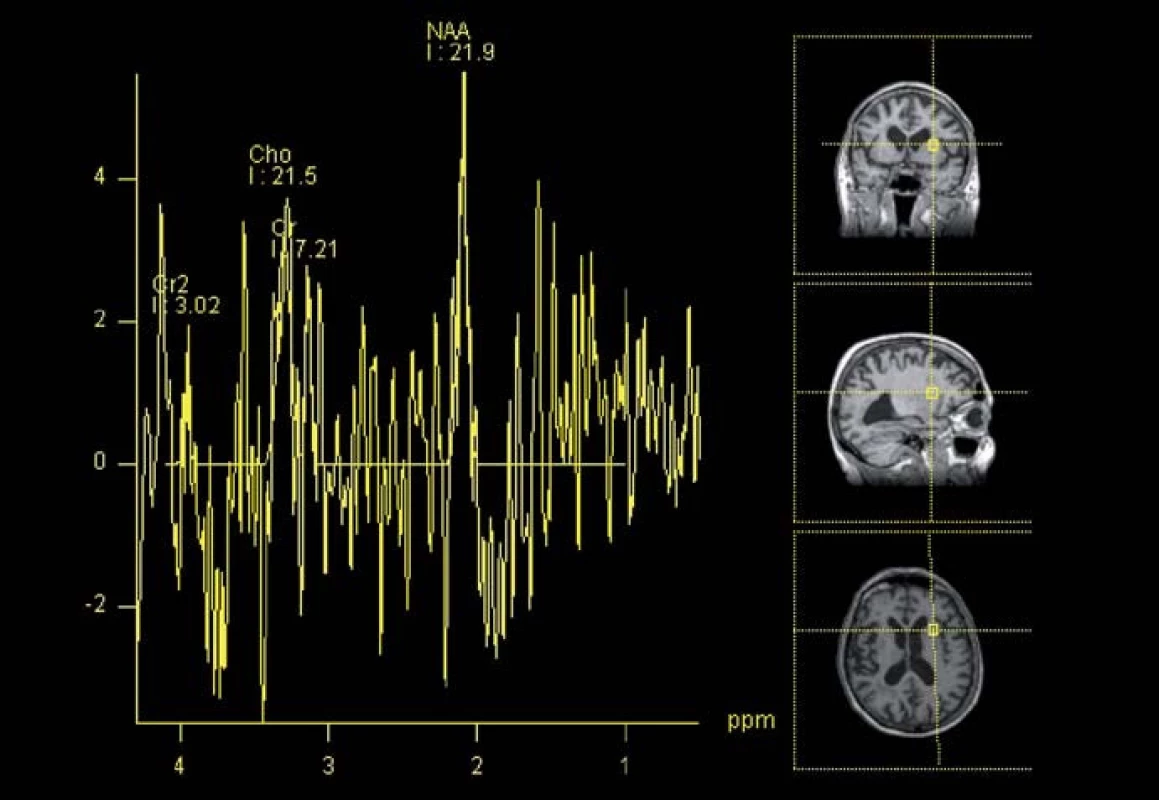
Ačkoliv prozatímní výsledky jsou slibné, myšlenka využití MR spektroskopie je relativně nová a další výzkum na dostatečně početných souborech pacientů je nutný. Potenciál spektroskopie je však vysoký a ze své podstaty je perspektivní i pro detekci shunt respondérů (tab. 1).
Perfuzně vážená magnetická rezonance
MR PWI (perfuzně vážený obraz) je metoda umožňující kvantifikaci perfuzních parametrů mozkové tkáně. Výzkum v této oblasti byl prováděn již díky perfuznímu CT. MR oproti CT nové zásadní poznatky nepřinesla a publikovaných prací je poskrovnu. Signifikantní výsledky přinesla práce Corkilla et al, kteří měřili relativní objem krve (rCBV) v periventrikulární mozkové tkáni u NPH shunt respondérů, non‑respondérů a u zdravých dobrovolníků. Zjistili, že u NPH skupiny byl rCBV významně redukován oproti dobrovolníkům. Nebyl však rozdíl mezi respondéry a non‑respondéry. Nezaznamenali ani změny po implantaci shuntu. Stejný závěr byl i při měření rCBV v periventikulárních hyperintenzitách na T2 váženém obraze. Pokud však do své analýzy zahrnuli ADC, pak dokázali spolehlivě predikovat klinickou odpověď pacienta na implantaci shuntu. Shunt respondéři měli v této oblasti totiž redukovaný rCBV, ale nevýrazně zvýšený ADC. Non‑ respondéři měli redukovaný rCBV a zvýšený ADC, což tedy pravděpodobně ukazuje na závažnější a ireverzibilní destrukci mozkové tkáně [27]. Z uvedeného vyplývá, že měření perfuzních parametrů samo o sobě nemá dostatečnou prediktivní hodnotu. V kombinaci s jinými modalitami však prediktivní hodnota stoupá.
Zobrazení difuzních tenzorů
Standardní MR zobrazí dilataci komorového systému, poukáže na potenciálně komprimované oblasti mozkové tkáně, ale nedokáže určit závažnost tlakového či napěťového poškození nervových vláken v dané oblasti mozku. Tyto informace lze získat díky zobrazení difuzních tenzorů (DTI). Tato relativně nová MR metoda používá difuzní gradienty k určení difuzního tenzoru a získání hodnot průměrné difuzivity (MD) a frakční anizotropie (FA) (obr. 4). Tyto hodnoty poskytují mikrostrukturální informace o bílé hmotě. Zvýšený tlak likvoru při hydrocefalu, NPH při B-vlnách nevyjímaje, způsobuje kompresi bílé hmoty mozkové, zejména periventrikulárně. Tento tlak mění její vlastnosti. Jedná se zejména o změnu FA, jež vyjadřuje směrovou závislost procesu difuze [28,29]. FA je vypočtena jako část difuzního tenzoru odpovídajícího anizotropii. Hodnota FA = 0 odpovídá izotropnímu médiu (v mozku je tímto médiem mozkomíšní mok). Symetrická anizotropie, kdy probíhá difuze jen jediným směrem, je vyjádřena hodnotou FA = 1. Tedy čím je hodnota FA vyšší, tím vyšší je anizotropie a směrové uspořádání zobrazované tkáně. Komprimovaný nervový svazek vykazuje v rovině paralelní k průběhu vláken zvýšenou difuzivitu, v rovině kolmé sníženou. To vede celkově ke zvýšení frakční anizotropie v komprimovaném svazku [30,31]. Tyto změny FA mohou být sledovány například i v bílé hmotě komprimované tumorem [32]. Dle předpokladu v komprimované bílé hmotě mozkové díky dilatovaným komorám u pacientů s hydrocefalem hodnota FA stoupá a po dekompresi, tedy po derivaci mozkomíšního moku, opět klesá. Konkrétně které oblasti mozku změny FA spolehlivě při onemocnění NPH vykazují, není ještě zcela objasněno a dostupné práce často vykazují zcela rozdílné výsledky.
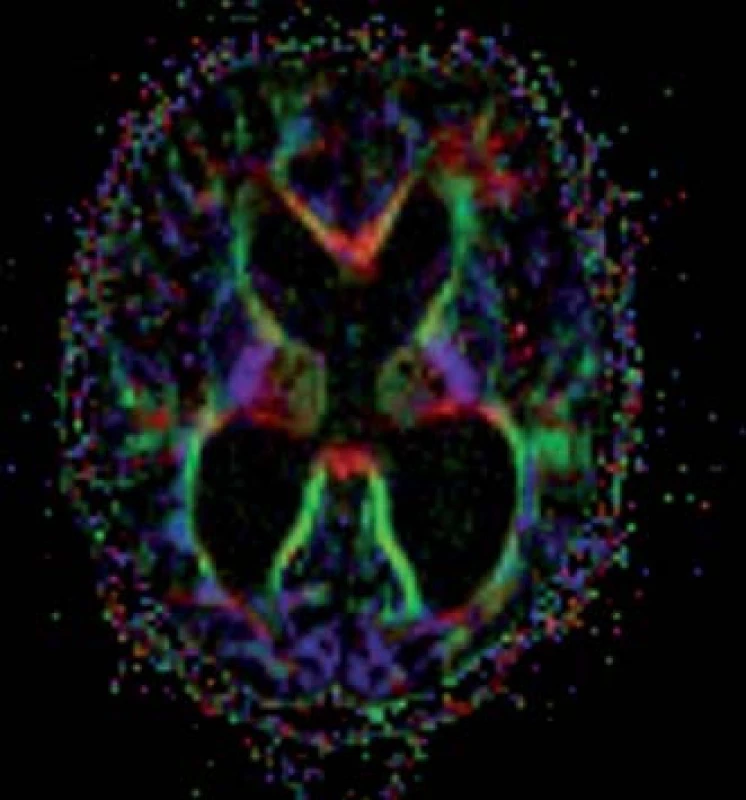
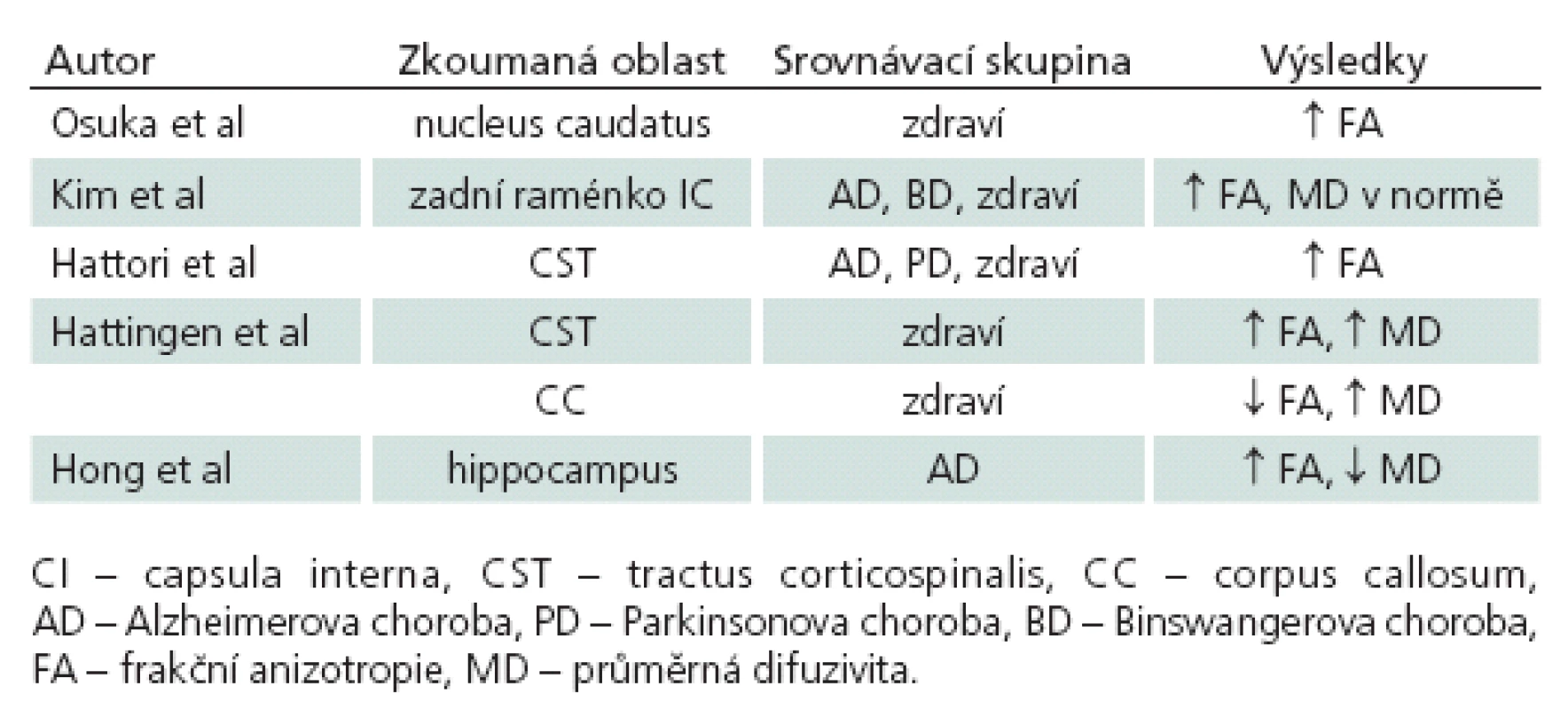
Dle Osuky et al, kteří porovnali změny FA u zdravých jedinců a u pacientů s NPH před zkratovým výkonem a po něm, je signifikantní zvýšení FA v nucleus caudatus. Po zkratovém výkonu FA v této oblasti rychle klesá, což koreluje i s klinickým zlepšením pacientů. Prozatím nebyl nalezen korelát mezi stupněm zvýšení hodnoty FA a tíží klinických příznaků. Prediktivní hodnota zvýšené FA na klinické zlepšení pacienta je tedy nejasná [33].
V jiné práci Kim et al tvrdí, že v jejich studii ve všech měřených oblastech (přední a zadní raménko capsula interna, genu a splenium corporis callosi, fasciculus longitudinalis superior et inferior) naměřili u NPH pacientů změny jak ve FA, tak i v MD. Signifikantní byla však změna jen v oblasti zadního raménka capsula interna. Zde byla FA u pacientů s NPH oproti pacientům s Alzheimerovou demencí, subkortikální vaskulární demencí a zdravých dobrovolníků signifikantně vyšší. MD žádné významné změny nevykazovala. Určili, že tyto změny mají 87,5% senzitivitu a 95% specificitu pro diagnózu NPH. Domnívají se, že hodnota FA nejprve díky kompresi vláken stoupá, ty ale postupně při přetrvávajícím tlaku podléhají degeneraci, čímž se FA opět snižuje, ale MD se naopak zvyšuje. Jelikož je zadní raménko capsula interna od frontálních rohů postranních komor, při kterých se předpokládají nejvýraznější kompresivní změny, relativně vzdálené, je hodnota FA zvýšená s nezměněnou MD i u pokročilejších stadií nemoci. Kim et al také prokázali, že u shunt respondérů hodnota FA v zadním raménku capsula interna klesá, hodnota MD se nemění. Udávají, že tato metoda dokáže spolehlivě identifikovat shunt respondéry. DTI parametry u shunt non‑respondérů se však nezabývají [34].
Hattori et al porovnávali FA kortikospinálního traktu u pacientů s NPH, Alzheimerovou chorobou, Parkinsonovou chorobou s demencí a u zdravých dobrovolníků. Zjistili, že hodnoty FA v kortikospinálním traktu jsou ve srovnání s ostatními skupinami signifikantně vyšší. Udávají, že tyto hodnoty mají senzitivitu, resp. specificitu 94 % a 80 %. Snímky traktografie kortikospinální dráhy byly podrobeny také vizuální analýze. Vzhled této dráhy rozdělili do dvou skupin. Typ Apředstavuje dráha s nízkou anizotropií a s hrubým průběhem vláken, typ B je pak dráha s vysokou anizotropií a přímým („hladkým“) uspořádáním vytrasovaných vláken. Typ B je tedy obrazem komprimovaného svazku. Vzhled dráhy byl hodnocen slepě a nezávisle na sobě neurologem a neuroradiologem. Shoda mezi nimi byla v 88,1 %. Typ B byl přítomen u NPH pacientů v 94,4 %, u pacientů s Alzheimerovou nemocí v 27,2 %, u pacientů s Parkinsonovou nemocí v 9,1 % a u zdravých dobrovolníků v 5,3 %. Zastoupení vláken typu B je tedy u NPH pacientů signifikantně vyšší než u ostatních skupin. Změnami po zavedení shuntu se Hattori et al nezabývali [5].
Hattingen et al měřili FA a MD v kortikospinální dráze a v corpus callosum pacientů s NPH a u zdravých dobrovolníků. Zjistili, že hodnota MD byla vyšší jak v kortikospinální dráze, tak i v corpus callosum. Hodnota FA byla vyšší v kortikospinální dráze, ale v corpus callosum byla nižší. Vysvětlují to odlišnými prostorovými vztahy vláken těchto periventrikulárních drah ke komorovému systému. Kortikospinální dráha probíhá laterálně od komorového systému. To znamená, že jeho dilatace způsobí její kompresi a jakousi konsolidaci vláken v jednom směru, což hodnotu FA zvyšuje. Oproti tomu corpus callosum leží nad komorovým systémem, proto tlak, který je na něj vyvíjen, způsobuje spíše rozestup vláken, jejich natahování a axonální degeneraci. Z toho důvodu zde dochází ke snižování hodnoty FA [35].
Hong et al vycházeli z poznatků, že hippocampus pacientů s Alzheimerovou chorobou vykazuje vyšší hodnoty FA a nižší hodnoty MD než hippocampus zdravých osob. Tyto změny jsou tedy odrazem axonální desintegrace bílé hmoty nemocných [36]. Obě skupiny proto porovnali s parametry naměřenými v hippocampu pacientů s NPH. Zjistili, že u pacientů s Alzheimerovou nemocí je FA signifikantně nižší a MD vyšší než u pacientů s NPH. Stejný rozdíl byl mezi pacienty s NPH a zdravými dobrovolníky. Změny v hippocampu nemocných s NPH pak vysvětlují tlakovým působením dilatovaných temporálních rohů postranních komor. Objem hippocampu se přitom, dle volumetrických studií, mezi těmito skupinami neliší. Dle této studie je tedy DTI slibný nástroj k diferenciální diagnostice NPH a Alzheimerovy nemoci a je spolehlivější než volumetrická analýza [37].
Na základě výsledků uvedených prací se u pacientů s NPH dají identifikovat změny difuzních parametrů v určitých oblastech měření. Autoři se však rozcházejí v lokalizaci významných odchylek od zdravých jedinců, či pacientů s jiným typem onemocnění (shrnuto v tab. 2). MR DTI metoda se podle některých autorů jeví jako perspektivní v odlišení respondérů a non‑respondérů zejména ve srovnání FA a MD, což je ve vyšetřování pacientů s NPH kruciální.

MR volumetrie
MR volumetrie umožňuje měření objemu zkoumaných struktur. Zajišťuje přesnější měření objemu komor a poskytuje validnější informace nežli Evansův index, jehož hodnota se značně liší v závislosti na výšce měření, sklonu apod [7]. S rozvojem této metody tedy pomalu ustupuje do pozadí tradiční využití Evansova indexu (viz také kapitola Standardní MR), ale pro časovou náročnost vyhodnocování volumetrie je však tato metoda pro rutinní měření objemu komorového systému nevhodná a Evansův index tak stále nebyl nahrazen. Ambarki et al považují za normu pro objem komorového systému 77 ml. Vyšší hodnoty jsou dle tohoto týmu citlivý ukazatel hydrocefalu. Senzitivita pro určení hydrocefalu je sice vysoká, nicméně specificita pro diagnózu NPH je velmi nízká a jako taková je pro diagnostiku NPH nedostačující [8].
Moore et al srovnali hodnotu Evansova indexu, šířku mozkového kortexu (měřeno od piální hranice k junkci šedé a bílé hmoty), objemu komorového systému a celkového intrakraniálního objemu u pacientů s NPH, Alzheimerovou a Parkinsonovou chorobou a u zdravých dobrovolníků. Zjistili, že poměr objemu komorového systému k šířce kortexu byl u NPH pacientů signifikantně vyšší než u ostatních skupin. Jiné poměry či hodnoty samotné dostatečnou senzitivitu a specificitu neměly. Evansův index a objem komorového systému byl sice vyšší u všech pacientů s NPH, ale stejně tak byly tyto hodnoty zvýšeny nad normu u 50 % pacientů s Alzheimerovou chorobou. Samotná šířka kortexu byla sice u NPH pacientů menší než u pacientů s Parkinsonovou chorobou, ale od ostatních skupin tyto pacienty neodlišuje. Proto tyto parametry v diferenciální diagnóze selhávají [38].
Kitagaki et al ve své práci porovnali objem komorového systému, bazálních cisteren, prostoru v Sylviově rýze a objem subarachnoideálních prostor nad úrovní Sylviovy rýhy. Zaměřili se na pacienty s NPH, Alzheimerovou nemocí a vaskulární demencí. Charakteristickým znakem u NPH pacientů byl větší objem komorového systému a menší objem suprasylvijského subarachnoideálního prostoru. Hodnocení prováděli jak vizuálně, tak i volumetricky. Obě metody vykázaly překvapivou shodu. Objem prostoru v Sylviově rýze byl u NPH pacientů větší než u pacientů s Alzheimerovou nemocí. Objem bazálních cisteren byl u všech tří skupin pacientů srovnatelný. U několika pacientů s NPH si také všimli izolovaně dilatovaného sulku na konvexitě nebo na mediálním povrchu hemisféry. Tento nález nebyl u pacientů z jiných skupin přítomen [39]. Savolainen et al se zaměřili na volumetrickou analýzu hippocampu nemocných s NPH, Alzheimerovou nemocí a zdravými dobrovolníky. Zjistili, že NPH skupina měla menší objem hippocampu vlevo než skupina zdravých dobrovolníků. Ve srovnání se skupinou s Alzheimerovou nemocí měli ale objem hippocampu bilaterálně větší. Soudí dokonce, že respondéři měli větší objem hippocampu oproti non‑respondérům. Výsledky ale nebyly statisticky signifikantní [40].
Ač výše uvedené práce poukazují na některé změny v objemu měřených struktur u pacientů s NPH, širšímu využití metody brání nízká specificita a senzitivita vyšetření. Výsledky v identifikaci respondérů a non‑respondérů nejsou dle dostupných prací statisticky signifikantní. Proto se MR volumetrie zatím jako perspektivní metoda nejeví.
Metoda fázového kontrastu MR
Využití této metody vyšetření MR bylo publikováno poprvé v roce 1991 Bradleym, který poukázal na korelaci mezi CSF flowvoid fenoménem (hypointenzní artefakt v T2 vážených snímcích způsobený pohybem mozkomíšního moku) v aquaeductus mesencephali a odpovědí pacientů na zkratový výkon [41]. Dle Monroovy‑ Kellyho doktríny je intrakraniální kompartment neexpandibilní. Tento kompartment se skládá z mozkového parenchymu, mozkomíšního moku a krve obsažené v intrakraniálních cévách. Rozdíl v poměru objemu arteriální a venózní krve během systoly a diastoly vede k pulzatilním, drobným změnám objemu kompartmentu. Tyto změny objemu působí na mozkomíšní mok a zapříčiňují jeho kompenzatorní pohyb (v systole směrem z mozkových komor do konvexitárního subarachnoideálního prostoru a do páteřního kanálu, v diastole naopak). V intrakraniálním prostoru zdravých jedinců dochází k expanzi mozkové tkáně jak směrem „dovnitř“, tedy komprimuje do mozkových komor, tak i „ven“, směrem do subarachnoideálních prostorů. U pacientů s NPH je mozkový parenchym vlivem intraventrikulárního tlaku likvoru již komprimován „směrem ven“, proto expandující pohyb mozkové tkáně během systoly je možný pouze „směrem dovnitř“ do intraventrikulárních prostor. Pohyb likvoru je následkem toho výraznější. Nejvíce jsou patrné změny v aquaeductus mesencephali, kde je tok ve srovnání se zdravými jedinci hyperdynamický jak v systole, tak i diastole [42–44]. Na základě této teorie byla vyvinuta modalita vyšetření MR mozku, která tok likvoru v aquaeductus mesencephali detekuje a umožňuje jej kvantitativně hodnotit. Jedná se o PC‑ MR (metoda fázového kontrastu) (obr. 5, 6). Nejčastěji sledované parametry jsou rychlost toku likvoru (cm/ s), průtok likvoru (ml/ min) a měření tepového objemu mozkomíšního moku (µl), přičemž nejvyšší signifikance byla zjištěna u měření průtoku. Za normu průtoku likvoru v systole je dle Ngua et al považována hodnota 13,3 ml/ min, v diastole pak 10,6 ml/ min [17]. Vyšší rozdíly toku v systole a diastole znamenají hyperdynamický tok likvoru v aquaeductus mesencephali, což může být využito v diagnostice NPH. Za normu tepového objemu likvoru je považováno 42 µl. Pacienti s vyšším tepovým objemem podle Parrkoly ze zkratového výkonu profitovali [45]. Pozornost byla věnována umístění ROI, ale rozdílnost sledovaných parametrů v jednotlivých etážích aquaeductus mesencephali u téhož jedince prokázána nebyla. V dosavadních studiích byl ROI nejčastěji umisťován do aquaeductus mesencephali v úrovni colliculus inferior v rovině kolmé na průběh Sylviova mokovodu. Ng et al prokázali, že původně hyperdynamický tok se u respondérů na zkratový výkon normalizoval, u non‑respondérů nikoliv. Zároveň však poukazuje na to, že prediktivní hodnota metody na klinické zlepšení pacienta po zkratovém výkonu je stále nízká [17]. Toto vyšetření taktéž spolehlivě odhalí eventuální stenózu aquae ductus Sylvii, která může mít podobné příznaky jako NPH, ale léčba se liší [46].
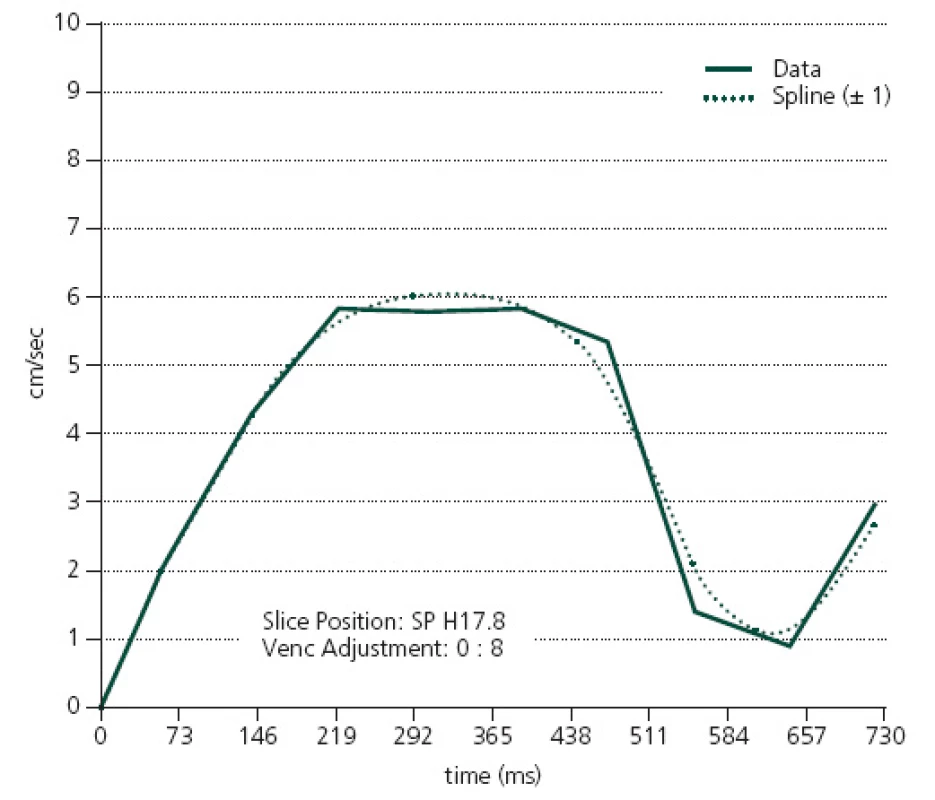
Ačkoliv publikované výsledky jsou slibné, tato metoda stále naráží na její nízkou prediktivní hodnotu. Dalším problémem je relativně náročná metodika vyšetření.
MR cisternografie
Tato relativně nová metoda je založena na detekci kontrastní látky intrakraniálně po jejím intratékálním podání. V minulosti byly v diagnostice NPH používány i izotopová cisternografie či CT cisternografie. Větší oblibu však nezískaly pro svoji invazivitu, radiační zátěž vyšetřovaných, nízkou rozlišovací schopnost a malou přesnost v predikci klinické odpovědi pacienta po implantaci shuntu [47]. Algin et al publikovali zatím ojedinělou práci zabývající se využitím MR cisternografie v diagnostice NPH. U pacientů s NPH a u zdravých dobrovolníků po intratékální aplikaci 1 ml gadolinia‑ DTPA (diethyl enetriaminepent acetate) sledovali pomocí MR mozku přítomnost kontrastní látky v postranních komorách s odstupem 12, 24 a 48 hod. Jako pozitivní výsledek byla brána perzistence kontrastní látky po dobu 24 hod. Při svých měřeních zjistili, že všichni pacienti s NPH měli kontrastní látku v postranních komorách přítomnu po 12 a 24 hod. U 78 % pacientů byla látka prokazatelná i po 48 hod. V postranních komorách zdravých dobrovolníků byla kontrastní látka po 24 hod přítomna jen ve 20 % případů a po 48 hod u žádného z nich již detekovatelná nebyla [48]. Ačkoliv autoři práce prezentují spolehlivé odlišení NPH pacientů a zdravých jedinců, odlišením respondérů a non‑respondérů se nezabývají. Zásadní nevýhodou metody je její invazivita. Proto lze předpokládat, že k jejímu širšímu využití nedojde.
Závěr
Magnetická rezonance je progresivní metoda vyšetřování pacientů s NPH. Její hlavní výhodou je neinvazivní a radiačně nezátěžová povaha vyšetření, což minimalizuje riziko periprocedurálních komplikací. MR mozku lze navíc provádět ambulantně. Konkrétně jaká modalita MR je pro diagnostiku NPH nejvhodnější, to zůstává dosud nezodpovězeno. I když MR dovoluje lépe pochopit patofyziologické mechanizmy u NPH, naším cílem by neměla být pouze identifikace specifických změn na MR mozku u pacientů s NPH, ale především neinvazivní odlišení respondérů a non‑respondérů, jakož i diferenciální diagnostika ostatních chorob s podobnou symptomatologií. V tomto ohledu se jeví jako nadějné zejména MR DTI, MR DWI a spektroskopie. Všechny doposud publikované studie mají ale jednu společnou limitaci – malý soubor vyšetřených pacientů a často rozdílná diagnostická kritéria pro NPH. Multicentrická studie v této oblasti bohužel zatím chybí. MR mozku je v diagnostice NPH bezesporu perspektivní metoda a zaslouží si jistě další soustředěný výzkum, avšak v současné době není schopna v selekci pacientů s NPH ke zkratové operaci likvorodynamické testy nahradit.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Radovnický
Neurochirurgická klinika
Univerzity J. E. Purkyně a Krajská zdravotní a. s.
Masarykova nemocnice v Ústí nad Labem, o. z.
Sociální péče 3316/12A
401 13 Ústí nad Labem
e-mail: tomas.radovnicky@kzcr.eu
Přijato k recenzi: 7. 2. 2013
Přijato do tisku: 18. 2. 2013
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 5
Most read in this issue
- Wilsonova nemoc
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
