Endovaskulární léčba ischemické cévní mozkové příhody
Endovascular Treatment of an Ischemic Cerebrovascular Event
Stroke is one of the most frequent causes of mortality, morbidity and disability worldwide, especially in developed countries. Acute occlusion of cerebral artery, detectable during the first hours after an onset of symptoms in more than 70% of patients, is the most common cause of acute ischemic stroke. Early recanalization of cerebral artery is associated with a higher chance for independency after three months and lower mortality. In addition to pharmacological methods (systemic, local and combined thrombolysis), endovascular mechanical methods to accelerate recanalization of occluded cerebral arteries are being tested. The paper describes various endovascular instruments and results of studies conducted so far. Results from initial studies showed mechanical devices to be safe and effective with increasing proportion of successful recanalizations and relatively low risk of both periprocedural complications and symptomatic intracranial bleeding. At present, mechanical recanalization methods are indicated especially in patients with acute occlusion of intracranial artery and intravenous thrombolysis failure or contraindication.
Key words:
acute stroke – treatment – endovascular procedures – retrievers – stents
:
D. Školoudík 1,2; M. Kuliha 1,2; T. Jonszta 3; R. Herzig 1
:
Komplexní cerebrovaskulární centrum, Neurologická klinika LF UP a FN Olomouc
1; Komplexní cerebrovaskulární centrum, Neurologická klinika FN Ostrava
2; Komplexní cerebrovaskulární centrum, Radiologická klinika FN Ostrava
3
:
Cesk Slov Neurol N 2012; 75/108(6): 669-683
:
Minimonography
Cévní mozkové příhody (CMP) patří celosvětově k nejčastějším příčinám mortality, morbidity a invalidizace, a to především v rozvinutých zemích. Nejčastější příčinou ischemické CMP je akutní uzávěr mozkové tepny, který lze prokázat u více než 70 % pacientů v prvních hodinách od začátku příznaků. Časná rekanalizace mozkové tepny je spojena s vyšší šancí na dosažení soběstačnosti po třech měsících a snížení mortality. Kromě farmakologických metod (systémového, lokálního a kombinovaného podání trombolytika) jsou v poslední době testovány k urychlení rekanalizace mozkové tepny také endovaskulární mechanické metody. V práci jsou popsána jednotlivá endovaskulární instrumentária a výsledky dosud provedených studií. Výsledky prvních studií prokázaly bezpečnost a účinnost jednotlivých mechanických instrumentárií s neustále se zvyšujícím procentem úspěšných rekanalizací a relativně nízkým rizikem jak periprocedurálním, tak symptomatického intrakraniálního krvácení. V současnosti je indikována mechanická rekanalizace u pacientů s akutním uzávěrem mozkové tepny především při selhání nebo kontraindikaci intravenózní trombolýzy.
Klíčová slova:
akutní cévní mozková příhoda – léčba – endovaskulární výkony – extrakční zařízení – stentya
Úvod
Cévní mozkové příhody (CMP) patří celosvětově k nejčastějším příčinám mortality, morbidity a invalidizace populace, a to především v rozvinutých zemích [1,2]. Ischemická CMP (iCMP) tvoří v Evropě a Severní Americe 80–85 % všech CMP. Incidence a prevalence CMP se v jednotlivých evropských zemích liší a podle odhadů Světové zdravotnické organizace (WHO) patří Česká republika spolu s Litvou, Řeckem a Portugalskem k evropským zemím s nejvyšší incidencí a prevalencí CMP, která je třikrát vyšší než např. ve Švýcarsku či Francii [3].
Závažnost iCMP dokládá fakt, že minimálně 30 % pacientů zůstává i po třech měsících nesoběstačných [2] a 90denní mortalita se pohybuje mezi 10 a 17 %. U pacientů s maligním infarktem dokonce převyšuje 75 % [4].
Nejčastější příčina iCMP je akutní uzávěr intrakraniální tepny nebo krční tepny zásobující mozek. Okludovanou tepnu lze prokázat u více než 70 % pacientů s akutní iCMP v prvních 6 hod od vzniku příznaků [5]. Lokalizace uzávěru mozkové tepny spolu s mírou zapojení kolaterálního řečiště, kterým odpovídá i tíže neurologického deficitu, a též čas do dosažení rekanalizace tepny (doba tepenného uzávěru) patří k nejdůležitějším známým prognostickým faktorům u pacientů s iCMP. Časná rekanalizace v prvních 6 hod (v některých případech až 24, event. 72 hod) od vzniku příznaků je spojena s vyšší šancí na dosažení soběstačnosti po třech měsících a snížení mortality, přičemž s prodloužením doby do rekanalizace tepny tato šance klesá [6].
Studie NINDS, publikovaná v roce 1995, prokázala jako první účinnost léčby systémovou trombolýzou (IVT) rekombinantním aktivátorem tkáňového plazminogenu aplikovaným v dávce 0,9 mg/kg v hodinové infuzi v časovém okně do 3 hod od začátku příznaků [7]. V roce 2008 studie ECASS 3 prokázala účinnost této léčby i v prodlouženém časovém okně do 4,5 hod [8]. Přes tyto úspěchy však počet soběstačných pacientů po léčbě systémovou trombolýzou nepřesahuje 55 % [9], přičemž k selhání léčby dochází především u pacientů s uzávěrem velké mozkové tepny (T okluze vnitřní karotidy, a. basilaris) [10].
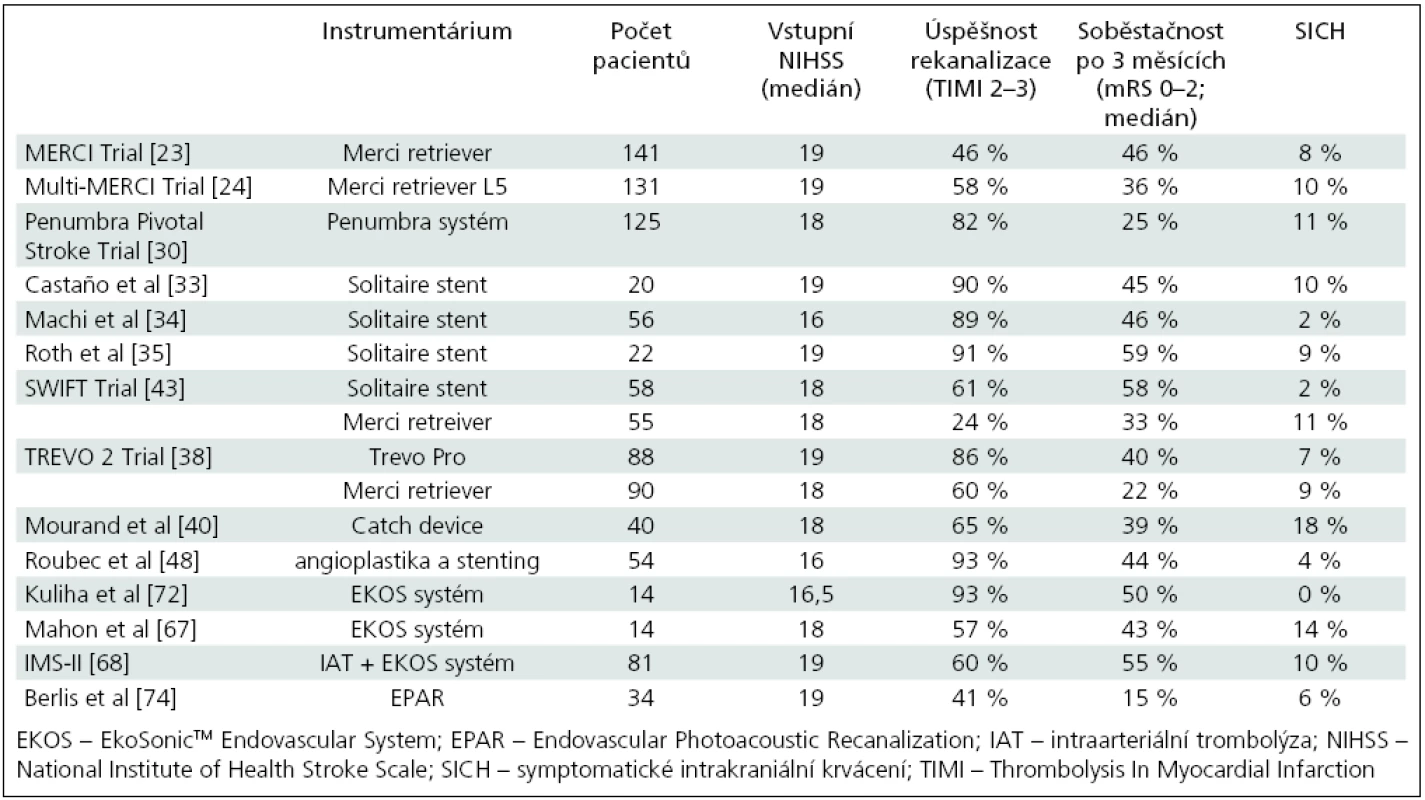
Z těchto důvodů se v posledním desetiletí testují nové metody urychlení rekanalizace mozkové tepny [11]. Kromě změny dávkovacího systému IVT, intraarteriální trombolýzy (IAT) a kombinace IVT-IAT [12–14] se dostávají do klinické praxe mechanické (endovaskulární, neurointervenční) metody, např. Merci Retrieval System®, Penumbra System®, stent Solitaire®, Trevo Pro®, Catch Device®, Phenox Clot Retriever®, BONNET Intracranial Flow Restoration Device®, pRESET Thrombectomy Retriever®, přímá perkutánní transluminální angioplastika se zavedením stentu (PTAS), EkoSonicTM Endovascular System, In-Time™ Retrieval Device, Amplatz Goose-Neck MicroSnare®, Attracter-18™, Neuronet™ Guidant Device, LaTIS laser Device®, Possis Angiojet System® a další, podobně jako v léčbě akutních koronárních syndromů (tab. 1) [15–20].
![Endovaskulární systémy používané k mechanické rekanalizaci mozkových tepen [20].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/142e48b8e7b706889a48ec801c498759.png)
Výsledky metaanalýzy 53 klinických studií zahrnujících 2 066 pacientů ukazují, že k časné rekanalizaci dochází pouze u 24,1 % pacientů spontánně bez aplikace specifické léčby, 46,2 % pacientů léčených IVT, 63,2 % pacientů léčených IAT, 67,5 % pacientů léčených kombinací IVT-IAT, avšak až 83,6 % pacientů léčených mechanickými metodami [6]. Přes vysoký počet rekanalizací prezentovaných v jednotlivých, většinou malých a nerandomizovaných studiích s jednotlivými instrumentárii, je hlavní limitací této léčby její špatná dostupnost. V následujícím textu jsou shrnuta jednotlivá instrumentária používaná k endovaskulárním mechanické rekanalizaci a výsledky studií, které byly dosud provedeny (tab. 2)
Instrumentária k endovaskulární trombektomii
Merci Retriever® (Concentric Medical, Mountain View, CA, USA)
Merci Retrieval System® je endovaskulární katétr vyvinutý ke stažení trombembolu z mozkové tepny u pacientů s akutní iCMP. Jednalo se o první testované instrumentárium určené k trombektomii, které bylo testováno a posléze i běžně používáno u pacientů s iCMP.
Merci retriever je složen ze tří částí: mikrokatétru Merci, balónkového vodicího katétru Merci a samotného retrievru Merci. Je konstruován z nitinolového (nikl--titan) šroubovicového paměťového vlákna (obr. 1) a designován k vytažení trombembolu z velkých mozkových tepen. Merci Retriever je zaváděn do místa uzávěru tepny mikrokatétrem, v němž je narovnán, a po vysunutí z mikrokatétru se vrátí zpět do šroubovicového tvaru (tvaru vývrtky). Další částí instrumentária je balónkový vodicí katétr, který je dostupný ve dvou velikostech – 8F a 9F. Na jeho konci je silikonový balónek umožňující po nafouknutí dočasné zastavení krevního toku pro prevenci distální embolizace.
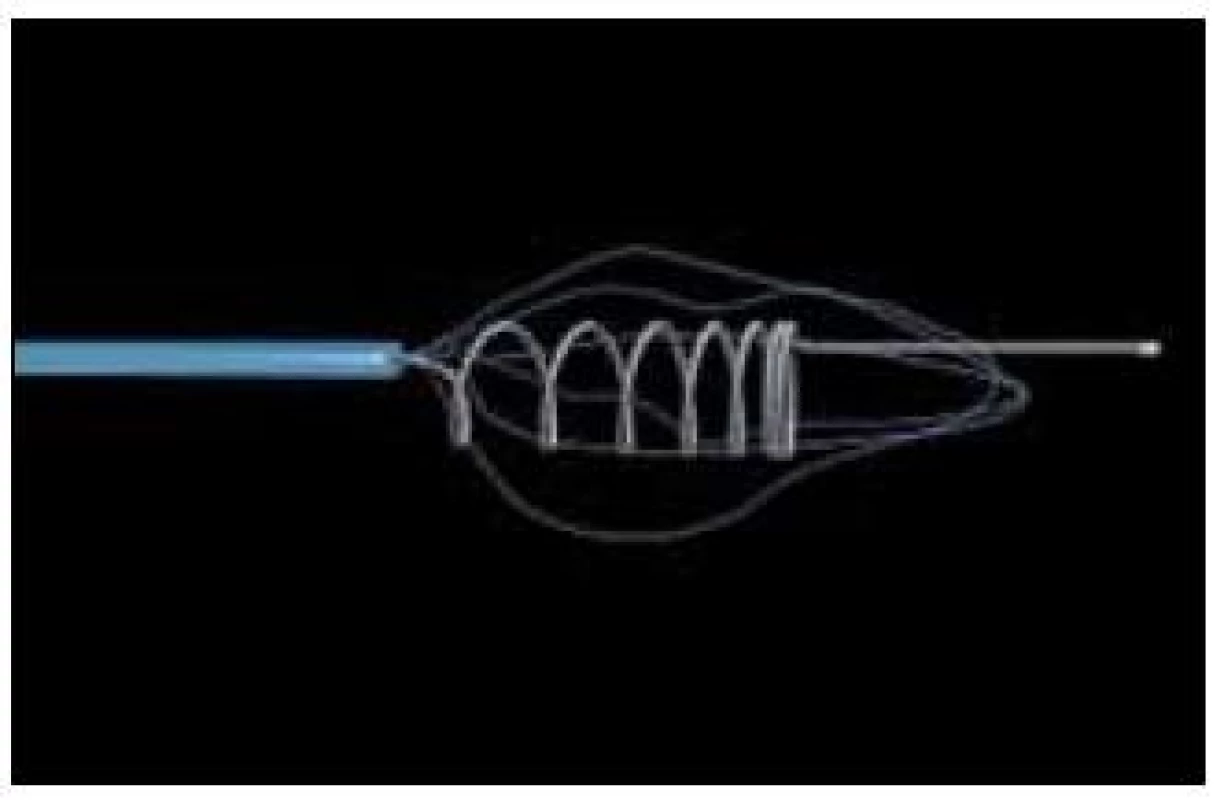
Retrievry Merci jsou v současnosti dostupné v minimálně 10 různých velikostech pro možnost použití v tepnách různé šíře. Zatím nejnovější generací je V série. Kromě léčby pacientů s iCMP je Merci retriever indikován také k vytahování cizích těles z mozkových, periferních nebo koronárních tepen, většinou špatně umístěných nebo dislokovaných během intervenčních radiologických procedur. Jeho nevýhodou je relativně složitá manipulace a riziko natažení spirály v ohybu mezi C7 úsekem a. carotis interna (ACI) a M1 úsekem a. cerebri media (ACM).
Merci Retriever byl poprvé schválen Food and Drug Administration (FDA) v roce 2004. Od té doby byl použit u více než 14 000 pacientů v Evropě, USA, Kanadě, Austrálii, Singapuru, Japonsku a také v České republice.
Publikované studie
Merci Retriever byl testován ve třech prospektivních, nerandomizovaných, multicentrických studiích. Do pilotní fáze studie MERCI (Mechanical Embolus Removal in Cerebral Ischemia I) trial bylo zařazeno 28 pacientů a úspěšné rekanalizace bylo dosaženo v 64 % případů. Následná druhá fáze studie MERCI byla zaměřena na bezpečnost a účinnost retrieveru Merci v rekanalizaci mozkové tepny do 8 hod od začátku příznaků u pacientů kontraindikovaných k IVT (celkem bylo zařazeno 141 pacientů). Jako kontrolní skupina byla vybrána placebová větev ze studie PRolyse in Acute Cerebral Thromboembolism (PROACT II) study. Jelikož jen u 18 % pacientů v placebové větvi studie studie PROACT II bylo dosaženo časné rekanalizace, bylo jako cíl studie MERCI stanoveno dosažení rekanalizace u minimálně 30 % pacientů. Avšak do studie MERCI byli zařazeni nejen pacienti s uzávěrem M1 nebo M2 úseku ACM, ale také pacienti s uzávěrem sifonu ACI či uzávěrem vertebrální či bazilární tepny [21].
Rekanalizace bylo nakonec dosaženo v 46 % případů (intention to treat analysis), což bylo signifikantně více než v kontrolní skupině (p < 0,0001), a to i při vyloučení pacientů, kteří by byli kontraindikovani pro studii PROACT II [22]. Klinicky závažné periprocedurální komplikace se vyskytly u 7,1 % pacientů, symptomatické intrakraniální krvácení (SICH) u 7,8 % pacientů, přičemž se procento SICH nelišilo mezi pacienty, kteří byli zároveň léčeni IVT, a pacienty, kteří IVT pro kontraindikace nedostali. Soběstačnosti definované jako hodnota modifikované Rankinovy škály (modified Rankin scale, mRS, 0–2 body po 3 měsících) dosáhlo 46 % pacientů, což bylo signifikantně více než v kontrolní skupině, kde soběstačnosti dosáhlo jen 10 % pacientů (relativní riziko 4,4; p < 0,0001). Také mortalita byla u pacientů léčených retrieverem Merci nižší než v kontrolní skupině (32 vs 54 %, relativní riziko 0,59; p < 0,01) [23].
Tyto pozitivní výsledky byly následně potvrzeny v mezinárodní, multicentrické prospektivní studii Multi MERCI na 164 pacientech léčených do 8 hod od začátku příznaků, u kterých byla IVT kontraindikována nebo selhala (nedošlo k rekanalizaci mozkové tepny). Mechanická rekanalizace pomocí samotného retrievru Merci vedla k úspěchu u 57,3 % pacientů, pokud byla použita i IAT, došlo k rekanalizaci u 69,5 % pacientů. Klinicky závažné periprocedurální komplikace se vyskytly u 5,5 % pacientů, SICH u 9 % pa-cientů [24]. Ve studii nebyla prokázána signifikantní závislost mezi dobou do dosažení rekanalizace a výsledným klinickým stavem pacienta, ale po adjustaci na věk, vstupní hodnotu skóre National Institute of Health Stroke Scale (NIHSS) a hladinu glukózy byl prokázán silný trend k dosažení horšího klinického výsledku u pacientů rekanalizovaných později [25]. Výsledný stav rekanalizace tepny byl nejsilnější prediktor výsledného klinického stavu pacienta, přičemž stažení trombu bylo negativně ovlivněno především hodnotou krevního tlaku [26].
Post-hoc analýza ukázala, že pacienti s uzávěrem segmentu M1 a M2 ACM se nelišili ve výsledném klinickém stavu, riziku SICH a periprocedurálních komplikacích ani mortalitě [27]. Následná analýza ukázala, že mechanická rekanalizace pomocí retrieveru Merci byla úspěšná i u pacientů s okluzí sifonu ACI (39 % úspěšných rekanalizací) a uzávěrem ve vertebrobazilárním řečišti (78 % pacientů). Pacienti po úspěšné rekanalizaci tepny měli lepší výsledný klinický stav než pacienti s neúspěšnou rekanalizací i než členové kontrolní skupiny [28,29].
Penumbra System® (Penumbra Inc., Alameda, CA, USA)
Penumbra System® je další instrumentárium schválené FDA, které bylo vytvořeno k revaskularizaci (otevření) uzavřené mozkové tepny. Tento systém je založen na kontinuální aspiraci trombembolu z mozkové tepny. Skládá se z reperfuzního mikrokatétru, který je napojen na aspirační pumpu vytvářející sací tlak okolo –20 inHG (50 mmHg). Kromě sání se zde uplatňuje také unikátní vodič (tzv. separátor), který odlučuje části trombu či embolu a ty jsou nasávány. Separátor též brání ucpání katétru. Systém nepotřebuje k dosažení rekanalizace tepny aplikaci trombolytika, stejně jako předchozí instrumentárium, ale na rozdíl od katétru Merci je zde minimalizovana potřeba slepého průniku uzavřenou tepnou, protože je umístěn jen k proximálnímu konci trombembolu. Díky flexibilitě a různým velikostem reperfuzních mikrokatétrů (0,26–0,54“ [palce]) je možno takto rekanalizovat i uzávěry v distálnějších větvích ACM nebo a. cerebri anterior (ACA), avšak při použití 0,54“ mikrokatétru byla úspěšnost rekanalizace vyšší.
Publikované studie
V pilotní studii fáze 1 bylo dosaženo 100% rekanalizace (TIMI 2 nebo 3) u všech 20 pacientů (na celkem 21 tepnách). V následné studii fáze 2, do které bylo zařazeno 125 pacientů s uzávěrem mozkové tepny, bylo dosaženo kompletní nebo parciální rekanalizace u 81,6 % pacientů, přičemž riziko periprocedurálních komplikací bylo velmi nízké (3,4 %). SICH bylo detekováno u 11,2 % pacientů a celková mortalita dosáhla 32,8 %. Ačkoli ke zlepšení v neurologickém stavu pacienta o minimálně 4 body v NIHSS škále při propuštění došlo u 57,8 % pacientů, soběstačnosti po třech měsících (mRS 0–2) dosáhlo jen 25 % pacientů. Obdobně jako ve studiích s retrievrem Merci i zde byl výsledný klinický stav pacientů s úspěšnou rekanalizací mozkové tepny signifikantně lepší než u pacientů po neúspěšném výkonu [30,31].
Následná retrospektivní studie zahrnující 139 pacientů léčených zařízením Penumbra System® v sedmi evropských a amerických centrech tyto výsledky potvrdila. Úspěšná rekanalizace byla dosažena u 84 % pacientů s podobným rizikem periprocedurálních komplikací a SICH, ale soběstačnosti dosáhlo již 40 % pacientů [32].
Solitaire™ Stent (Ev3, Irvine, CA, USA)
Solitaire™ AB (FR) Neurovascular Remodeling Device je odpoutatelný, samoexpandibilní, plně retrahovatelný stent původně vyvinutý pro překlenutí krčku aneuryzmatu, který se před několika lety začal testovat také pro rekanalizaci mozkových tepen u akutní iCMP (obr. 2a, b). V současné době se jedná o nejčastější instrumentárium používané k rekanalizaci mozkové tepny, a to především v Evropě.

SolitaireTM AB (FR) Stent je zaváděn přes standardní 0,021“ nebo 0,027“ mikrokatétr podobně jako intrakraniální embolizační spirála (coil). Jednoduše jej lze zavést i do vinutých tepen a obvykle je potřeba několika pokusů o stažení trombembolu z tepny, než je dosaženo rekanalizace. Verze AB (remodelační) a FR (dedikované revaskularizační instrumentárium) jsou velmi podobné a jsou dostupné v několika velikostech – verze AB o průměru 3–6 mm a délce 27,3–51,6 mm, verze FR o průměru 4 a 6 mm a délce 26, 31 a 42 mm. Vzhledem k rozdílné ceně je v České republice v současnosti zaregistrována pouze verze AB.
Unikátnost stentu SolitaireTM je v jeho dvojí funkci – umožňuje dočasný intrakraniální bypass k okamžitému obnovení toku přes místo uzávěru tepny a následně jej lze využít k vytažení trombembolu z tepny. V případě, že není možno trombembolus stáhnout, lze stent SolitaireTM ponechat v místě uzávěru podobně jako jiné stenty při cerebrální PTAS.
Publikované studie
Dosud byly publikovány studie pouze z Evropy, protože v USA zatím není toto instrumentárium schváleno FDA. Castaño et al [33] zveřejnili první zkušenosti s léčbou 20 pacientů s iCMP a uzávěrem mozkové tepny v přední cirkulaci pomocí stentu Solitaire AB, vyvinutého pro překlenutí krčku aneuryzmatu. Rekanalizace (TICI 2b/3) bylo dosažena v 90 % případů, přičemž nedošlo k žádné periprocedurální komplikaci a SICH bylo detekováno u 10 % pacientů. 45 % pacientů bylo soběstačných po třech měsících (mRS ≤ 2).
Úspěšné off-label použití verze AB vedlo rychle k rutinnímu používání stentu SolitaireTM AB (FR) při rekanalizaci mozkové tepny. Machi et al [34] dosáhli s tímto typem stentu úspěšné rekanalizace u 50 z 56 pacientů (89 %) a soběstačnosti po třech měsících (mRS ≤ 2) u 46 % pacientů. Periprocedurální komplikace se vyskytly v 9 % případů, SICH bylo u jednoho pacienta, k asymptomatickému subarachnoidálnímu krvácení došlo ve dvou případech. Průměrný počet pokusů o vytažení trombembolu byl dva (1–5 v jednotlivých případech).
Podobných výsledků dosáhli také Roth et al [35] a Seifert et al [36] s úspěšnou rekanalizací u 91, resp. 100 % pacientů a 10% rizikem SICH. V obou studiích dosáhlo soběstačnosti po třech měsících (mRS 0–2) 50 % pacientů. Také ve studii REscue, COmbined, and Stand--alone Thrombectomy (RECOST) bylo dosaženo vysoké úspěšnosti, plná rekanalizace (TICI 3) byla dosažena u 84 % pacientů a soběstačnost po třech měsících u 54 % pacientů. SICH se vyskytlo pouze v 2 % případů [37].
Trevo Pro® (Concentric Medical, Mountain View, CA, USA)
Trevo System® je 4 × 20mm instrumentárium podobné stentu. Je velmi měkké, takže umožňuje jednoduché zavedení přes vinuté tepny a jeho zavřený distální konec je uzpůsoben k prevenci perforace tepny (obr. 3a, b). Může být použit k rekanalizaci tepen o průměru 1,5 až 3,5 mm. Trevo System® je zaváděn do uzavřené tepny mikrokatétrem o vnitřním průměru 0,021“. Samotné zavedení a extrakce trombembolu jsou prováděny podobně jako u stentu SolitaireTM. Bezpečnost a účinnost tohoto systému jsou v současnosti testovány ve studii TREVO 2 Clinical Trial [38].

Soubor prvních 13 pacientů léčených pomocí Trevo System® publikovali Mendonça et al (osm pacientů s uzávěrem ACM a pět s uzávěrem ACI). Úspěšné rekanalizace bylo dosaženo v 77 % případů, nebyla zaznamenána žádná periprocedurální komplikace, 30 % pacientů bylo soběstačných po třech měsících, 30 % pacientů zemřelo [39].
Catch Device® (Balt Extrusion, Montmorency, Francie)
Catch Device® je malý drátěný košík o průměru 4 mm. Je vyroben z nitinolu a je určen k vytažení trombu z tepny do průměru 5 mm. K zavádění instrumentária je nutno používat mikrokatétr Vasco +21 s vnitřním průměrem 0,0236“. Mikrokatétr musí být naložen minimálně 2 cm za trombus, pak se otevře košíček a celý systém i s trombem je stažen přes 6F vodicí (guiding) katétr.
Mourand et al publikovali výsledky retrospektivní studie se 40 pacienty s akutní iCMP. Rekanalizace (TIMI 2–3) bylo dosažena v 65 % případů. SICH se vyskytlo u 18 % pacientů, periprocedurální komplikace u 15 %. Soběstačnosti po třech měsících (mRS ≤ 2) dosáhlo 39 % pacientů. Soběstačnost (56,5 vs 7,7 % pacientů) i mortalita (30,0 vs 61,5 % pacientů) byly signifikantně lepší u pacientů s úspěšnou rekanalizací [40].
Phenox Clot Retriever® (Phenox GmbH, Bochum, Německo)
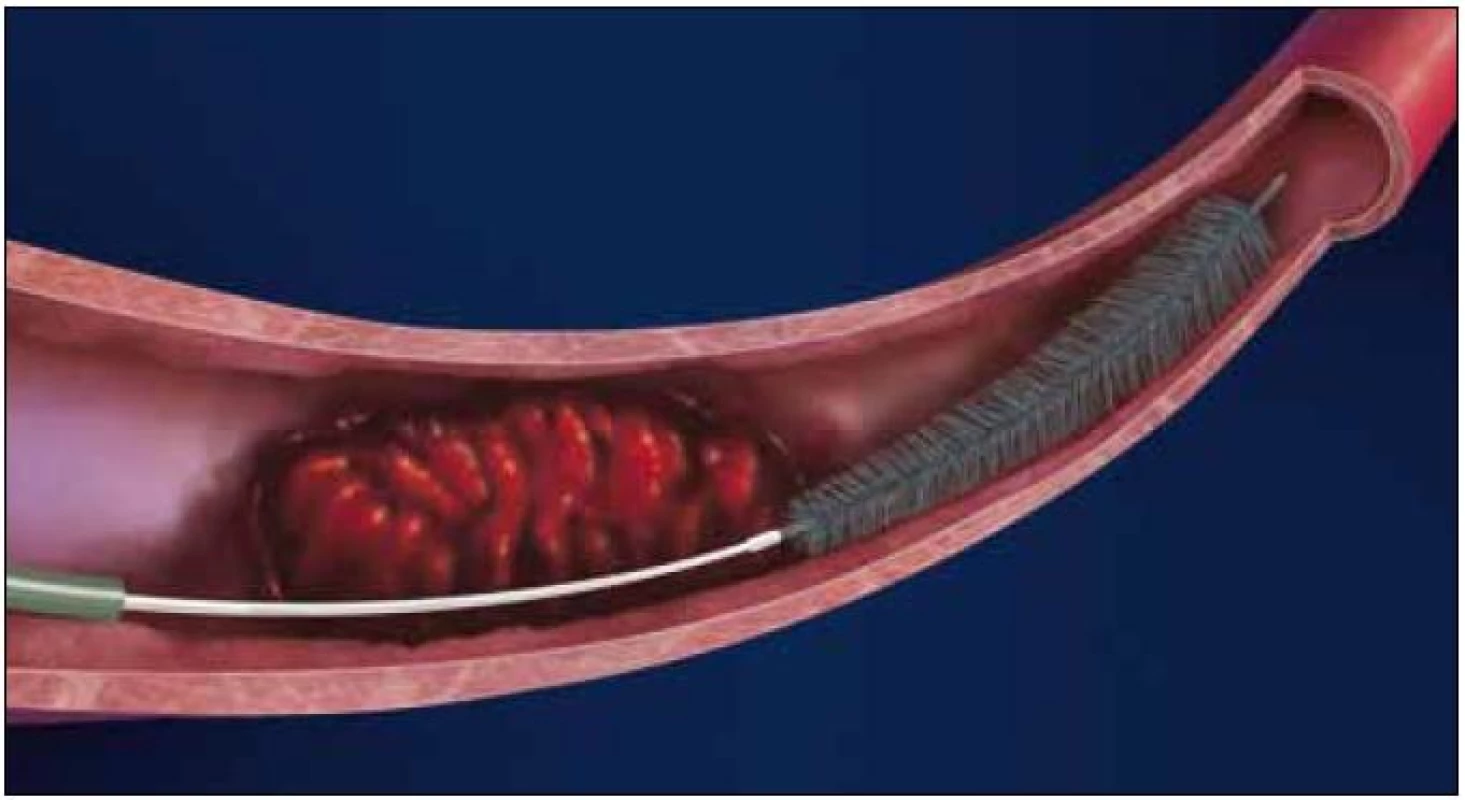
Phenox Clot Retriever – pCR® je kartáčku podobné instrumentárium určené pro vytažení trombu z tepny (obr. 4). Nylonová vláknitá struktura se rozšiřuje od proximálního k distálnímu konci. Retriever je dlouhý 22 mm a dostupný ve třech šířkách pro rekanalizaci tepen v rozmezí 1 až 3 mm. Retriever pCR je zaváděn do tepny přes mikrokatétr za trombembolus, který je následně zachycen do vláken a vtažen do vodicího katétru pod stálou aspirací a následně vytažen z tepny.
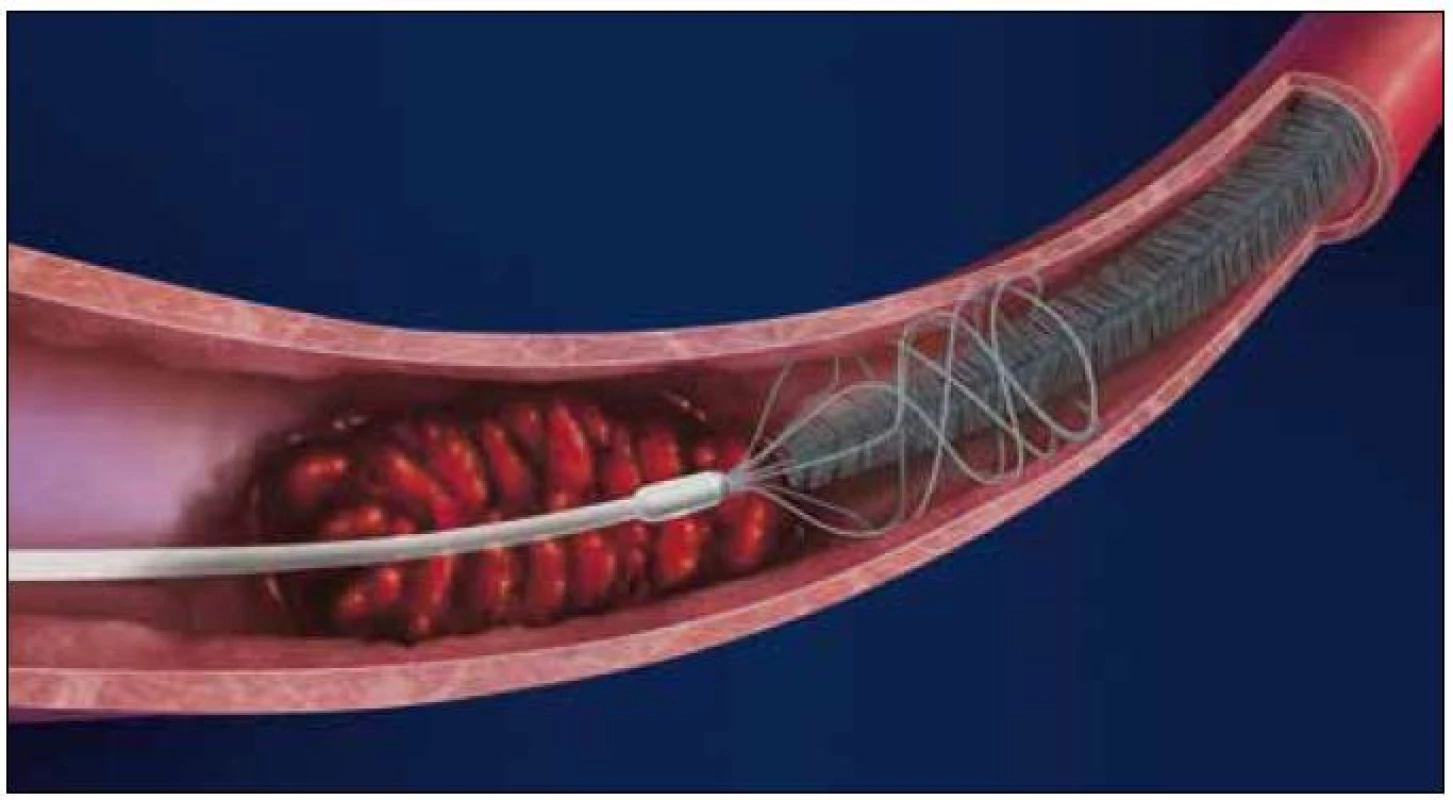
Podobnou strukturu jako retriever pCR má CRC Phenox Clot Retriever CAGE®. Je tvořen opět polyamidovými vlákny, má strukturu kartáčku, ale navíc obsahuje nitinolové vinutí na proximálním konci kartáčku. Ten dává extrakčnímu zařízení větší radiální rozsaha je tudíž vhodnější pro starší, organizované tromby (obr. 5). Systém je dostupný ve dvou šířkách pro rekanalizaci tepen v rozmezí 2 až 3 mm. Použití je u tohoto systému shodné jako u systému pCR. Oba systémy jsou určeny pro jednorázové použití, musí tedy být vyměněny, pokud extrakce trombu selže.
BONNET Intracranial Flow Restoration Device® (Phenox GmbH, Bochum, Německo)
The BONNET Intracranial Flow Restoration Device® se skládá ze samoexpandibilního nitinolového pletení z polyamidových filament o rozměrech 5 × 35 mm, které je pevně spojeno s vodičem (obr. 6). BONNET® je vysoce flexibilní, čímž umožňuje zavedení i do velmi vinutých tepen. Systém je zaváděn do tepny přes mikrokatétr a rozvine se distálně za trombem, event. po zavedení mikrokatétru do nitra trombu. K rekanalizaci tepny dochází stažením trombu zachyceného do systému BONNET® spolu s mikrokatétrem přes vodicí katétr. Tento systém lze použít opakovaně.
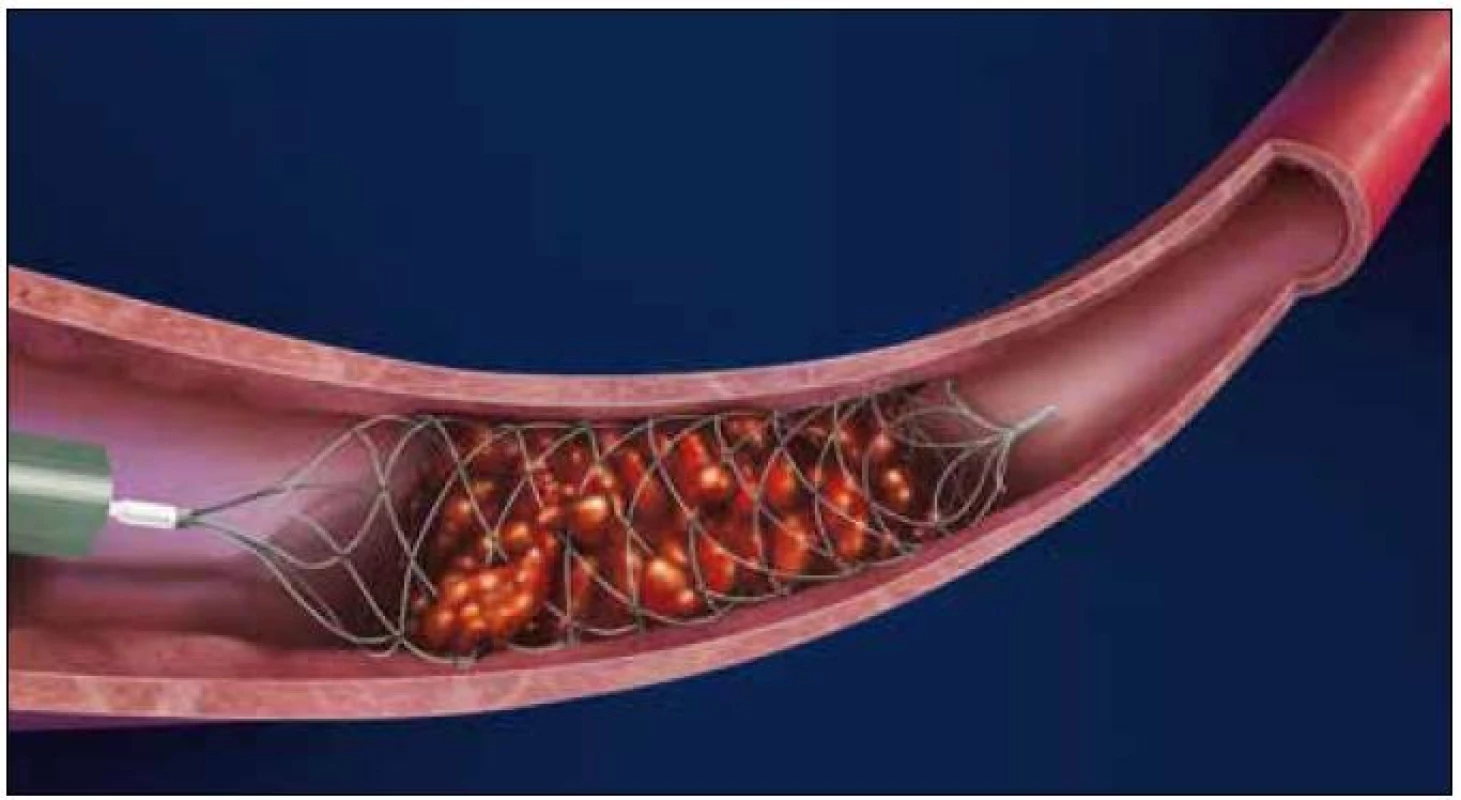
Novou variantou je BONNET Short Intracranial Flow Restoration Device®. Kromě odlišné velikosti 5 × 23 mm má systém nový tvar a vyšší relativní radiální sílu.
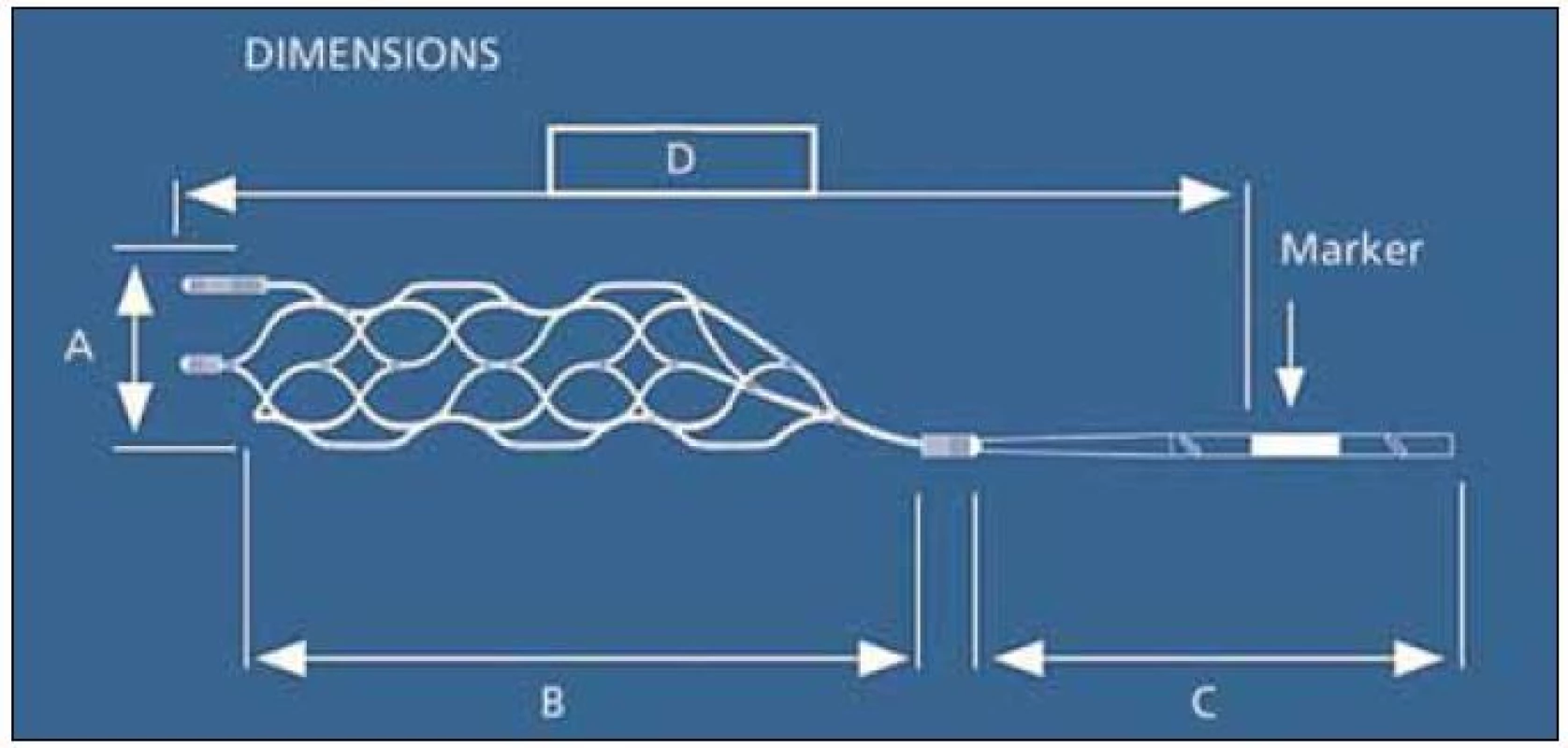
PRESET Thrombectomy Retriever® (Phenox GmbH, Bochum, Německo)
PRESET Thrombectomy Retriever® je další laserově vyřezávaný, samoexpandibilním nitinolovým systém velikosti 4 × 30 mm. Je určen pro extrakci trombu z tepen o šířce 2 až 4 mm (obr. 7). Je opět zaváděn do místa uzávěru tepny přes mikrokatétr o průměru 0,021“ a technika extrakce trombembolu je shodná jako u sytému BONNET®.
Probíhající studie s instrumentárii pro trombektomii
Výsledky studií s moderními instrumentárii pro trombektomii prokázaly vysokou úspěšnost rekanalizace mozkové tepny. Baker et al [41] vybrali všechny studie s pacienty s iCMP včetně kazuistik, které popisovaly efektivitu jednotlivých instrumentárií k trombektomii. Vybrali celkem 87 publikací: 18 prospektivních, 7 retrospektivních studií a 62 kazuistik. Úspěšnost rekanalizace tepen se pohybovala v širokém rozmezí od 43 do 78 % u MERCI Retriever po 83 až 100 % u Penumbra System. SICH bylo hodnoceno v 16 studiích a jeho četnost nepřesáhla 11 %, disekce nebo perforace tepen se pohybovaly mezi 0 a 7 %. Prediktory špatného výsledného stavu pacientů byly vyšší věk, CMP v anamnéze a vyšší hodnota vstupního skóre NIHSS. Úspěšnost rekanalizace tepny byla naopak prediktorem dobrého výsledného klinického stavu [41]. Nicméně hlavní limitací těchto studií byla chybějící evidence fragmentace, distální embolizace či relokace trombu [42].
V současnosti probíhají v Evropě a USA tři studie, které testují retrahovatelné stenty v léčbě akutní iCMP. Studie SolitaireTM FR with the Intention for Thrombectomy (SWIFT) již ukončila nábor pacientů a jejím cílem je srovnat výsledky léčby pomocí Solitaire FR s retrieverem Merci u 200 pacientů s akutní okluzí mozkové tepny [43]. Cílem druhé studie nazvané Trial and Cost Effectiveness Evaluation of IA Thrombectomy in acute IS (THRACE) je srovnat IVT s trombektomií pomocí retrieveru Merci, systému Penumbra, Catch device a stentu SolitaireTM FB u 480 pacientů. Studie Thrombectomy Revascularization of Large Vessel Occlusions (TREVO 2) je další nedávno zahájená studie, jejímž cílem je srovnat systém TREVO s retrieverem Merci v léčbě pacientů s iCMP. Předpokládaný cílový počet pacientů zařazených do studie je 178 [44].
Probíhající studie Mechanical Retrieval and Recanalization of Stroke Clots Using Embolectomy (MR-RESCUE) má za cíl zhodnotit efektivitu standardní IVT u pacientů s proximální okluzí hlavních tepen Willisova okruhu v přední cirkulaci a srovnat ji s mechanickou trombektomií (pomocí retrieveru MERCI nebo systému Penumbra) v časovém okně 8 hod od vzniku příznaků [45].
Ve studii DWI/PWI and CT perfusion assessment in the triage of wake-up and late presenting strokes undergoing neurointervention (DAWN) jsou pacienti s okluzí velké mozkové tepny s dobou trvání více než 8 hod selektováni pomocí magnetické rezonance nebo perfuzní výpočetní tomografie k neurointervenci mezi 8. a 24. hod [46].
Použití stentů
Cerebrální perkutánní transluminální angioplastika a stenting (cPTAS)
Dalším instrumentáriem, které se začalo používat k dosažení rekanalizace okludované mozkové tepny, byly intrakraniální samoexpandibilní stenty (mikrostenty). Přímá cPTAS se začala používat jako záchranná („rescue“) procedura k obnovení toku krve v uzavřené tepně nebo při časné reokluzi po úspěšné IVT. Původně byla určena pro pacienty s trombózou tepny na podkladě aterosklerotické stenózy, podobně jako u akutních koronárních syndromů. Později se tato technika rozšířila i na embolické uzávěry tepen.
Používané samoexpandibilní stenty byly schváleny původně na remodelaci tepen při léčbě aneuryzmat – EnterpriseTM stent (Cordis Neurovascular, Miami Lakes, FL, USA), NeuroformTM system (Stryker, Natick, MA, USA), Leo stent (Balt Extrusion, Montmorency, Francie) – a k léčbě aterosklerotických stenóz mozkových tepen – WingspanTM system (Stryker, Natick, MA, USA). Stenty NeuroformTM a WingspanTM jsou stenty s otevřenými buňkami (open-cell design), stenty EnterpriseTM a Leo jsou stenty s uzavřenými buňkami (closed-cell design) (obr. 8) [47]. Closed--cell design umožňuje mimo jiné opětovné vytažení stentu po jeho částečném (nesprávném) zavedení (70 % u stentu EnterpriseTM a 90 % u stentu Leo).
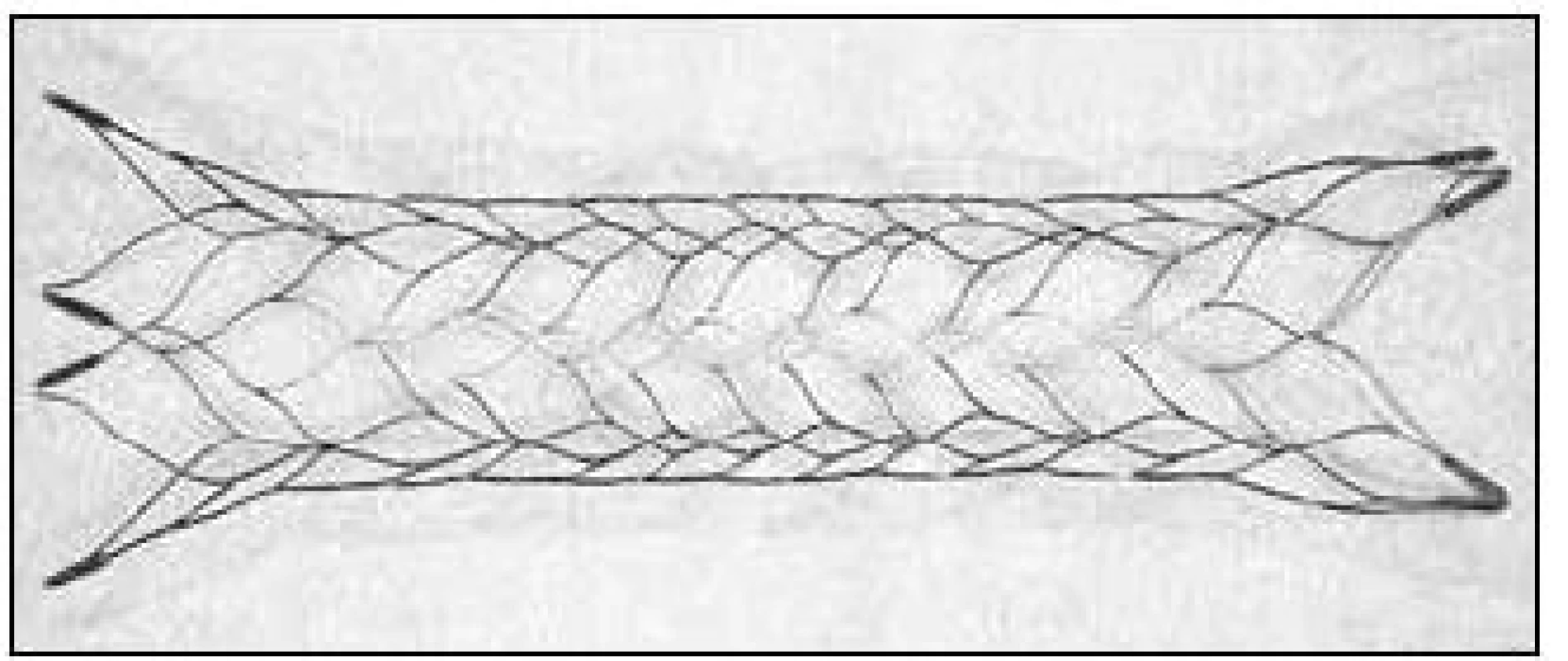
V současnosti je metoda cPTAS používána off-label v léčbě pacientů s iCMP. Jejím největším omezením je nutnost nasazení duální antiagregace k prevenci retrombózy stentu. V kombinaci s aplikací trombolytika u takto léčených pacientů by duální antiagregace mohla znamenat vyšší riziko SICH, to však nebylo v následných studiích potvrzeno [48]. Další potenciální limitací je riziko vzniku restenózy v oblasti stentu, riziko uzávěru perforátorů stentem a také riziko embolizace části trombu do periferie. Tento fenomén je popisován jako „snow-plowing“ a může vést ke vzniku infarktových ložisek i přes rekanalizaci tepny. S tímto rizikem jsou však spojeny všechny endovaskulárním techniky.
Publikované studie
Fitzsimmons et al popsali kazuistiky pacientů s akutní iCMP léčených pomocí cPTAS [49]. Použili stent Neuroform k rekanalizaci levé ACM po neúspěšné rekanalizaci pomocí lokálně aplikovaného inhibitoru glykoproteinu (GP) IIb/IIIa. Následně bylo publikováno několik dalších kazuistik, především od Levyho et al [50], kteří byli jedněmi z prvních propagátorů této léčby. Ve studii z roku 2007 publikovali výsledky léčby 19 pacientů (16 pomocí stentu Neuroform a 3 pomocí stentu Wingspan) se 100% úspěšností zavedení stentu. Rekanalizace (TIMI 2–3) bylo dosažena v 79 % případů, 22 % pacientů bylo soběstačných (mRS ≤ 3) po třech měsících. SICH bylo zaznamenáno v 11 % případů.
Většina dalších dosud publikovaných studií byly pouze monocentrické, otevřené studie, zahrnující maximálně 20 pacientů [51–60]. Rekanalizace se v těchto studiích pohybovaly mezi 60 a 100 % a soběstačnosti po třech měsících (mRS 0–2) bylo dosaženo u 36–74 % pacientů [52,53,55–60].
Jediná dosud publikovaná multicentrická, prospektivní, kontrolovaná studie, v níž byli pacienti s akutní iCMP léčeni pomocí cPTAS, pochází z českých pracovišť [48]. Cílem studie bylo srovnat bezpečnost a účinnost cPTAS se standardní léčbou u pacientů kontraindikovaných k IVT nebo u pacientů, u nichž IVT selhala. Celkem bylo do studie zařazeno 131 pacientů s okluzí ACM, z nichž 75 bylo léčeno pomocí IVT. Úspěšná IVT s rekanalizací tepny do 60 minut byla zjištěna jen u 26 pacientů (35 %). Pacienti, u nichž IVT selhala nebo byla kontraindikována, byli dle místa bydliště léčeni cPTAS do 8 hod od začátku příznaků nebo jen standardní léčbou. Rekanalizace mozkové tepny bylo dosaženo u 92,6 % pacientů po cPTAS. Soběstačnosti (mRS 0–2) po třech měsících dosáhlo 57,7 % pacientů po úspěšné IVT s rekanalizací tepny. U pacientů, u nichž IVT selhala, dosáhlo signifikantně více pacientů soběstačnosti při léčbě cPTAS než při standardní léčbě (43,5 vs 15,4 %; p = 0,03). Také u pacientů kontraindikovaných k IVT dosáhlo signifikantně více pacientů soběstačnosti při léčbě cPTAS než při standardní léčbě (45,2 vs 8,0 %; p = 0,0004). Dle multivariační logistické regresní analýzy byla negativním prediktorem dobrého výsledného klinického stavu pouze vstupní hodnota NIHSS (OR 0,854; 95% CI: 0,751–0,971; p = 0,004) a úspěšná rekanalizace ACM byla jeho pozitivním prediktorem (OR 5,550; 95% CI: 1,477–20,851; p = 0,006). SICH bylo detekováno jen u jednoho pacienta (4,3 %) léčeného IVT a následně cPTAS a jednoho pacienta (3,2 %) léčeného pouze cPTAS. Nebyla zaznamenána žádná periprocedurální komplikace.
Endovaskulární sonolýza
EkoSonicTM Endovascular System (EKOS Corporation, Bothell, WA, USA)
Ačkoli zatím není plně vysvětlen komplexní efekt ultrazvuku na akceleraci lýzy trombu, předpokládá se, že ultrazvukové vlnění akceleruje enzymatickou fibrinolýzu primárně netermálním mechanizmem – zvýšením transportu fibrinolytik do nitra trombu díky mechanickému rozrušení struktury trombu [61], přímou aktivací endogenních fibrinolytických enzymů mechanickým rozrušením vazeb komplexních molekul těchto enzymů s jejich inhibitory či iritací endotelu se zvýšením produkce fibrinolytických enzymů [62,63], tranzitorní periferní (kapilární) vazodilatací způsobenou pravděpodobně zvýšenou produkcí a vyplavováním oxidu dusnatého z endotelií [64,65]. Radiační síla a akustické kavitace jsou dalším možné a diskutované mechanické efekty ultrazvuku [66].
V současnosti jsou dvě možnosti aplikace sonolýzy – transkraniálním přístupem přes intaktní kost a endovaskulárním přístupem.
EkoSonicTM Endovascular System umožňuje cílené lokální podání rekombinantního tkáňového aktivátoru plazminogenu a zároveň aplikaci vysokofrekvenčního, nízkoenergetického ultrazvukového vlnění do místa uzávěru tepny pro rychlejší penetraci fibrinolytika do nitra trombu (obr. 9a, b). Systém se skládá z infuzního katétru EKOS MicroLys US pro neurovaskulární intervence EkoSonicSVTM nebo periferní tepny EkoSonicTM. Na konci katétru je vestavěn cylindrický piezoelektrický převodník, který přeměňuje vysokofrekvenční energii na ultrazvukové vlnění. Výkon u převodníku EkoSonicSVTM je 0,45 W při frekvencích 1,4–1,9 MHz. Druhou částí systému je centrální jednotka, která generuje specifickou energii a monitoruje výstupní výkon a teplotu hrotu katétru.

Publikované studie
V pilotní studii fáze 1 s 14 pacienty s akutní iCMP došlo po sonolýze s použitím systému EkoSonicSVTM k rekanalizaci tepny do 60 min u 60 % pacientů [67]. Následně bylo instrumentárium testováno ve studii Interventional Management of Stroke (IMS) II [68]. Kompletní rekanalizace tepny byla dosažena do 60 min u 41 % pacientů, do 120 min dokonce u 68,9 % pacientů. SICH bylo detekováno v 9,9 % případů, u žádného z pacientů nebyla zaznamenána periprocedurální komplikace.
Janjua et al [69] popsali distální embolizaci u pacienta léčeného endovaskulární sonolýzou při manipulaci s katétrem v oblasti trombu. Další studie s tímto instrumentáriem však tuto komplikaci nepopisují [70,71].
Kuliha et al [72] prezentovali výsledky studie pacientů s akutní iCMP a okluzí ACM (sedm pacientů) nebo a. basilaris (sedm pacientů), kteří byli léčeni endovaskulární sonolýzou systémem EKOS v kombinaci s IAT do 8 hod od začátku příznaků. U osmi pacientů byl aplikován stent do reziduální stenózy. Rekanalizace mozkové tepny byla úspěšná u 13 (92,9 %) pacientů, z toho u 10 pacientů byla rekanalizace kompletní. Sedm (50 %) pacientů bylo soběstačných (mRS 0–2) po třech měsících. U žádného pacienta nedošlo k SICH nebo periprocedurální komplikaci. Časné zlepšení neurologického deficitu o minimálně 4 body během 24 hod (100 vs 4,6 % pacientů; p = 0,0001) a dosažení soběstačnosti po třech měsících (71,4 vs 13,6 % pacientů; p = 0,003) byly signifikantně častější u pacientů s okluzí ACM léčených endovaskulární sonolýzou než u kontrol. Tříměsíční mortalita byla signifikantně nižší u pacientů s okluzí a. basilaris léčených endovaskulárním sonolýzou než u kontrol (0 vs 66,7 % pacientů; p = 0,013).
Další studie testující endovaskulární sonolýzu byla studie IMS-III, jejímž cílem bylo srovnat standardní IVT s kombinovanou IVT-IAT trombolýzou. V případě přetrvávající okluze tepny po IVT byla podána IAT a eventuálně byla aplikována endovaskulární sonolýza pomocí systému EKOS® nebo byla provedena mechanická trombektomie [73]. Studie však byla po interní analýze v dubnu 2012 předčasně ukončena pro malou pravděpodobnost dosažení signifikantního rozdílu mezi jednotlivými metodami léčby.
Další experimentální systémy
EPAR® – Endovascular Photoacoustic Recanalization (Endovasix Inc., Belmont, CA, USA)
Systém EPAR® je určen k mechanické fragmentaci trombembolu. Je založen na laserové technologii. Skládá se z 3F hydrofilně potaženého mikrokatétru s pěti okénky na distálním konci. V každém z nich je jedno optické vlákno. Světelná energie přiváděná rychlostí 1 000 pulzů na sekundu je převedena na akustickou energii na fibrooptickém konci katétru. Ta vytváří mikrokavitační bubliny. Tyto kavitační kapsy expandují a následně kolabují a vytvářejí tlak na trombus, který je postupně emulzifikován a rozbit na částice o průměru menším než kapiláry (in vitro 1 až 10 µm). Systém je určen k rychlé emulzifikaci trombu. Hlavním cílem je aktivovat mechanickou trombolýzu a tím redukovat potřebu trombolytika.
Publikované studie
Berlis et al publikovali studii s 34 pacienty s iCMP a uzávěrem mozkové tepny (medián skóre NIHSS 19 bodů) [74]. Rekanalizaci dosáhli u 41,1 % pacientů. Průměrný čas procedury byl 9,65 min. Periprocedurální komplikace se vyskytla u jednoho a SICH u dvou pacientů (5,9 %). Mortalita byla 38,2 %.
Systém však v současnosti není na trhu dostupný.
ReviveTM SE Blood Clot Retrieval® (Codman and Shurtleff, Inc., Johnson and Johnson Company, Raynham, MA, USA)
ReviveTM SE® je samoexpandibilní nitinolový košíček, který může být využit jako dočasný bypass v místě tepenného uzávěru a následně pak k extrakci trombu. Je zaváděn mikrokatétrem přímo do místa trombu a poté může být opakovaně rozvinut.
Výsledky pilotní studie s 10 pacienty s akutní iCMP publikovali Rohde at al. Úspěšnou rekanalizaci tepny (TICI 2b nebo 3) dosáhli u všech 10 pacientů, a to bez periprocedurálních komplikací. Po měsíci dosáhlo klinického zlepšení o minimálně 10 bodů ve škále NIHSS nebo hodnoty NIHSS 0–1 bod šest pacientů, tři pacienti zemřeli. SICH bylo diagnostikováno u dvou pacientů [75].
V současnosti je toto zařízení testováno ve studii RIVER I (Reperfuse Ischemic Vessels with Endovascular Recanalization).
Penumbra Separator™ 3D® (Penumbra, Alameda, CA, USA)
Penumbra Separator™ 3D® je nové instrumentárium k extrakci trombu, zavedené na trh v lednu 2012. Svým designem se podobá 3D košíčku a podobně jako další stent-extrakční zařízení je zaváděn mikrokatétrem do místa uzávěru tepny a extrakce trombu je navíc posílena ještě aktivní aspirací přes vodicí katétr.
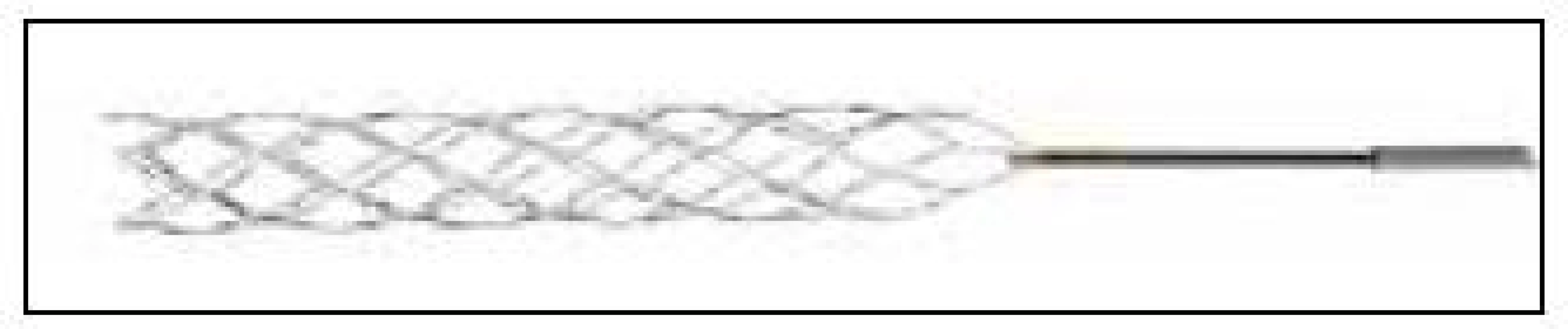
Mindframe Capture LP® (Mindframe Inc., Irvine, CA, USA)
MindFrame capture LP® je další instrumentárium podobné stentu určené k dočasnému bypassu uzavřené tepny a efektivní trombektomii (obr. 10). Jeho výhodou je kompatibilita s 10/14 mikrokatétry s vnitřním průměrem 0,0165“.
Acandis APERIO® System (Acandis Gmbh and Co. KG, Pforzheim, Německo)
Acandis APERIO® System je samoexpandibiliní instrumentárium podobné stentu určené k extrakci trombu přes mikrokatétr o průměru 0,027“.
Possis Angiojet System® (Possis Medical, Minneapolis, MN, USA)
Possis Angiojet System® je 5F systém založený na reolytickém efektu na trombus, který je dosažen rychlým vysokotlakým solným proudem, jenž vytváří distálně sání na principu Venturiho efektu a vede k fragmentaci a aspiraci trombu. Již byla publikována první kazuistika pacienta s okluzí ACI, která byla rekanalizována pomocí tohoto systému [76].
Latis Laser Device® (Spectanetics, Colorado Springs, CO, USA)
Latis Laser Device® je mikrokatétr s laserem na konci. Pilotní studie však byla zastavena po náboru 12 pacientů vzhledem k problémům se zavedením katétru do místa uzávěru tepny. Systém v současnosti není na trhu.
Amplatz Goose-Neck Microsnare® (Ev3 Medical, Plymouth, MN, USA)
Systém Amplatz Goose-Neck Microsnare® se skládá z mikrokatétru, oka (lasa) a rotátoru. Mikrolaso je tvořeno nitinolovým lankem a pozlacenou wolframovou smyčkou. Tento systém byl testován k extrakci trombů pevné konzistence. U měkkých trombů se využívá opakovaného průchodu lasa trombem k jeho disrupci. Chopko et al [16] publikovali první případ takto léčeného pacienta již v roce 2000, což je pravděpodobně první publikace o mechanické trombektomii z intrakraniálního řečiště.
Attracter-18™ (Boston Scientific/Target Therapeutics, Fremont, CA, USA)
Attracter-18™ je obdobný systém jako předchozí Amplatz Goose-Neck Microsnare® (tzv. goose-neck snare), primárně vyvinutý pro stažení dislokovaných embolizačních spirál během coilingu aneuryzmat. Dá se použít i k extrakci trombembolu. V současnosti již není na trhu.
Neuronet™ Guidant Device® (Guidant Corp, Temecula, CA, USA)
Neuronet™ je samoexpandibilní košíček, který se zavádí distálně za trombus mikrokatétrem. Poté je stažen zpět do trombu a spolu s ním stažen do katétru. V současnosti již není na trhu.
In-Time™ Retrieval Device® (Boston Scientific, Boston, MA, USA)
Princip tohoto extrakčního zařízení je podobný jako u Neuronet Guidant Device®. V současnosti již není na trhu.
Hodnocení rekanalizace mozkové tepny
Jelikož signifikantní rozdíl v klinickém hodnocení výsledného zdravotního stavu u pacientů s iCMP léčených různými metodami vyžaduje relativně velký počet léčených pacientů, jako primární cíl je vybírána míra rekanalizace mozkové tepny. Z proběhlých studií totiž vyplývá, že časná rekanalizace tepny je silný prediktor dosažení dobrého výsledného zdravotního stavu pacienta s iCMP.
K určení míry rekanalizace mozkové tepny jsou používány nejčastěji transkraniální dopplerovské vyšetření nebo transkraniální duplexní sonografie či, u pacientů léčených endovaskulární metodou, raději digitální subtrakční angiografie. V tab. 3–7 jsou uvedeny nejčastěji používané klasifikace. Největším omezením těchto klasifikací je však nejen to, že v jednotlivých studiích jsou používány různé klasifikační systémy, a proto jsou výsledky obtížně srovnatelné, ale především jejich nízká reprodukovatelnost a slabá shoda při hodnocení nezávislými hodnotiteli [77]. Při hodnocení rekanalizace libovolné mozkové tepny pomocí klasifikace TIMI byl korelační koeficient kappa 0,4 (95% CI: 0,2–0,6) [78], při hodnocení rekanalizace pouze ACM pomocí klasifikace TICI byl korelační koeficient kappa jen 0,277 s plnou shodou jen v 44 % případů [48].
![Klasifikace okluze a rekanalizace tepen TIMI (Thrombolysis In Myocardial Infarction) [77].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/6567ed6a5cc51d8aa4e66cfabc054d1d.png)
![Klasifikace okluze a rekanalizace tepen TICI (Thrombolysis In Cerebal Infarction) [81].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/8a5ed27e3d842fb0878a97a18816d836.png)
![Modifikovaná klasifikace okluze a rekanalizace tepen TICI (Thrombolysis In Cerebral Infarction) [82].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/ae0e3ffa224aa9d7d9a421a434b55c09.png)
![Klasifikace okluze a rekanalizace tepen TIBI (Thrombolysis In Brain Infarction) [80].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/9638c0e5daa99903dbe7f1099ab4c37c.png)
![Klasifikace okluze a rekanalizace tepen COGIF (Consensus On Grading Intracranial Flow obstruction) [80].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/872242ba1353837b2eab1d26be413fa0.png)
Nicméně ani korelace hodnocení klinického stavu mezi dvěma hodnotiteli nevykazují lepší shodu. Korelační koeficient kappa pro hodnocení mRS dvěma hodnotiteli byl jen 0,25 s úplnou shodou jen u 43 % pacientů [79].
Péče o pacienta indikovaného k rekanalizačnímu intervenčnímu výkonu v akutní fázi CMP
U pacienta indikovaného k převozu na angiografické vyšetření s plánem provedení rekanalizačního intervenčního výkonu je nutno bez zbytečného časového prodlení zajistit: dva kvalitní periferní vstupy, základní odběry včetně hemokoagulačních parametrů, anesteziologa k dohledu a vedení analgosedace/anestezie, podat premedikaci – bisulepin (Dithiaden®, Zentiva, Praha, Česká republika), event. při neklidu zahájit sedaci – midazolam (Dormicum®, Roche, Praha, Česká republika).
Péče o pacienta v průběhu intervenčního výkonu
U pacienta jsou po celou dobu výkonu monitorovány elektrokardiogram, krevní tlak a saturace krve z periferie. Po celou dobu výkonu by měl být přítomen anesteziolog, který vede analgosedaci/anestezii pacienta tak, aby nedocházelo k nežádoucím pohybům pacienta v průběhu výkonu.
Není vhodná paušální celková anestezie s nutností intubace pacienta a umělé plicní ventilace, kdy je nutno použít myorelaxancia a vysoké dávky sedativ s rozvojem sekundární farmakologické hypotenze a prolongované sedace s nutností delší umělé plicní ventilace.
Preferujeme analgosedaci opakovanými malými dávkami midazolamu, fentanylu a propofolu, event. jejich kombinací, což většinou zajistí dostatečnou analgezii, možnost rychle měnit hloubku sedace při zachování kardiovaskulární stability a dostatečnou spontánní ventilaci. Je-li nutná hlubší sedace, preferujeme ji jen krátkodobě (po dobu intervence) s podporou ventilace přes laryngeální masku. Pokud toto není možné a je nutná celková anestezie, zůstává pacient sedován, intubován a na umělé plicní ventilaci s cílem co nejrychlejšího odtlumení a weaningu (přechodu na spontánní ventilaci) po stabilizaci stavu.
Po celou dobu analgosedace/anestezie je nutno sledovat krevní tlak a vyvarovat se arteriální hypotenze (systolický tlak krve by neměl do doby rekanalizace tepny klesnout pod 135 mmHg). Pokud k ní dojde, jsou doporučeny volumexpandéry (krystaloidy, koloidy) případně nasazení vazopresorů (noradrenalin, dobutamin).
Jednotný protokol antikoagulační léčby při mechanické rekanalizaci mozkové tepny zatím neexistuje. Obvykle se podává 2 000–5 000 IU (international unit) heparinu intraarteriálně jako prevence vzniku trombu na endovaskulárním instrumentariu. Např. ve studiích IMS I a II bylo po podání bolu 2000 IU bolus pokračováno v kontinuální infuzi 450 IU/h [68].
V průběhu výkonu lze použít zastavení toku v přístupové tepně, přičemž instrumentárium, které zachytí embolus, je následně stahováno proti proudu. K tomuto účelu je dle všobecného konsenzu doporučeno použít pracovní katétr s dvěma luaminy a balónkem na konci. Aspirace 20ml či 50ml stříkačkou při stahování tento efekt dále zvyšuje. Jako variantu lze použít i 6F pracovní katétr, zvláště u tepen malého kalibru anebo u tepen, na kterých jsou kličky v jejich extrakraniálním průběhu.
Jedním z rizik mechanické extrakce embolu (především při použití Merci retrievru a Penumbra systému) je riziko perforace tepny. Při této komplikaci je doporučena embolizace perforované tepny.
Péče o pacienta po intervenčním výkonu
Péče o pacienta po intervenčním výkonu je závislá na stavu pacienta. Pacient může být zcela při vědomí a již bez neurologického deficitu. V tomto případě je pacient krátce observován na iktové jednotce a je zahájeno došetření v rámci sekundární prevence CMP.
Pokud přetrvává různá tíže neurologického deficitu, porucha vědomí či poruchy ventilace, je nutná komplexní ošetřovatelská péče na jednotce intenzivní péče, léčba komplikací a zahájení včasné rehabilitace.
U všech pacientů je nutno po odeznění heparinizace (použité v průběhu výkonu) odstranit kanylu z arterie použité k provedení intervence (nejčastěji a. femoralis). Po odstranění kanyly následuje komprese tepny (např. systémem FemoStop™), posléze zátěží s pískem s přechodem na běžný režim po 8 až 24 hod. Vpich v třísle je také možno uzavřít uzavíracím zařízením (např. FemoSeal™, Angio-Seal™, Perclose® ProGlide Vascular Close Device), zvláště pokud bylo aplikováno trombolytikum. Místo kanylace je nutno sledovat a při vzniku hematomu či podkožní rezistence realizovat sonografické vyšetření k vyloučení vzniku pseudoaneuryzmatu. Pokud dojde ke vzniku pseudoaneuryzmatu punktované tepny, je nutno nadále ponechat kompresi této tepny a sledovat sonograficky dutinu pseudoaneuryzmatu až do uzavření. Sporadicky je nutná chirurgická intervence.
Vzácná, avšak závažnou komplikace v místě kanylace tepny je krvácení z místa vpichu (a. femoralis) do oblasti stehna, event. malé pánve – příznaky jsou arteriální hypotenze, anemizace, vznik a progrese hematomu v oblasti místa vpichu. Zde je nutno neprodleně zajistit chirurgickou revizi se suturou tepny a současným hrazením krevních ztrát [80].
Závěr
Časná rekanalizace mozkové tepny je u pacientů s akutní iCMP spojena se signifikantně vyšší pravděpodobností dosažení soběstačnosti po třech měsících a snížením mortality. Kromě farmakologických metod (IVT, IAT a jejich kombinace) se začínají do klinické praxe rychle prosazovat také endovaskulární mechanické metody. Výsledky prvních studií ukazují bezpečnost a účinnost různých mechanických instrumentárií s neustále se zvyšujícím procentem úspěšných rekanalizací a relativně nízkým rizikem rozvoje periprocedurálních komplikací a SICH.
doc. MUDr. David Školoudík, Ph.D., FESO
Komplexní cerebrovaskulární centrum
Neurologická klinika FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: skoloudik@email.cz
Přijato k recenzi: 6. 9. 2012
Přijato do tisku: 10. 10. 2012
Recenzenti
prof. MUDr. Antonín Krajina, CSc.
doc. MUDr. František Charvát, Ph.D.
MUDr. Ondřej Škoda
Doc. MUDr. David Školoudík, Ph.D., FESO
Docent David Školoudík se narodil 2. března 1972 v Havířově. V letech 1990–1996 studoval Lékařskou fakultu Univerzity Palackého v Olomouci, obor všeobecné lékařství. Od roku 1996 pracoval jako sekundární lékař na neurologickém oddělení Vítkovické nemocnice. V roce 1999 absolvoval atestaci I. stupně z oboru neurologie. Od roku 2001 pracoval jako sekundární lékař, později staniční lékař iktové jednotky a zástupce přednosty pro vědu a vzdělávání ve Fakultní nemocnici Ostrava. V roce 2002 složil atestaci II. stupně z oboru neurologie. Od roku 2005 vyučuje na Lékařské fakultě UP v Olomouci. V roce 2007 obhájil dizertační práci, o dva roky později habilitoval v oboru neurologie na LF UP v Olomouci. Od roku 1998 vede kurzy IPVZ „Transkraniální duplexní sonografie“. Je autorem nebo spoluautorem 118 odborných článků, z toho 58 prací v impaktovaných časopisech. Autorsky se podílel na dvou monografiích, devíti kapitolách v monografiích a čtyřech pedagogických publikacích. Počet citací v současnosti převyšuje 200, z toho 113 citací je v SCI, Hirschův index je 6. Za své vědecké práce byl oceněn Výroční cenou Nadace Český literární fond (Literární cena Josefa Hlávky) za nejlepší odbornou publikaci v České republice za rok 2003 (monografie Neurosonologie), Haškovcovou cenou Nadačního fondu Paula Janssena, Hennerovou cenou za nejlepší odbornou práci v oboru neurologie pro autory do 35 let za rok 1999 a 2004 a cenou České neurologické společnosti za vynikající krátké sdělení či kazuistiku za rok 2010. Podílel se na řešení 10 grantů (šest v CEP), z toho v pěti případech jako hlavní řešitel. Od roku 2008 je členem redakční rady časopisu Neurológia a člen Advisory Board časopisu Ultrasound in Medicine and Biology. Podílel se na organizaci 12 kongresů a je školitelem pěti postgraduálních studentů, z nichž dva již úspěšně obhájili dizertační práci.
Sources
1. Feigin VL, Lawes CM, Bennett DA, Anderson CS. Stroke epidemiology: a review of population-based studies of incidence prevalence and case-fatality in the late 20th century. Lancet Neurol 2003; 2(1): 43–53.
2. Rosamond W, Flegal K, Furie K, Go A, Greenlund K, Haase N et al. Heart disease and stroke statistics – 2008 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2008; 117(4): e25–e146.
3. Truelsen T, Piechowski-Jóźwiak B, Bonita R, Mathers C, Bogousslavsky J, Boysen G. Stroke incidence and prevalence in Europe: a review of available data. Eur J Neurol 2006; 13(6): 581–598.
4. van der Worp HB, van Gijn J. Clinical practice. Acute ischemic stroke. N Engl J Med 2007; 357(6): 572–579.
5. Fieschi C, Argentino C, Lenzi GL, Sacchetti ML, Toni D, Bozzao L. Clinical and instrumental evaluation of patients with ischemic stroke within the first six hours. J Neurol Sci 1989; 91(3): 311–321.
6. Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke 2007; 38(3): 967–973.
7. Tissue Plasminogen Activator for Acute Ischemic Stroke. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. N Engl J Med 1995; 333(24): 1581–1588.
8. Hacke W, Kaste M, Bluhmki E, Brozman M, Dávalos A, Guidetti D et al. ECASS 3 Investigators. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359(13): 1317–1329.
9. Külkens S, Hacke W. Thrombolysis with alteplase for acute ischemic stroke: review of SITS-MOST and other Phase IV studies. Expert Rev Neurother 2007; 7(7): 783–788.
10. Lee KY, Han SW, Kim SH, Nam HS, Ahn SW, Kim DJ et al. Early recanalization after intravenous administration of recombinant tissue plasminogen activator as assessed by pre- and post-thrombolytic angiography in acute ischemic stroke patients. Stroke 2007; 38(1): 192–193.
11. Jonszta T, Kuliha M, Roubec M, Herzig R, Šaňák D, Procházka V et al. Endovascular Treatment of Acute Ischemic Stroke. In: Sanders KI, Jackson AM (eds). New Developments in Angiography Research. New York: Nova Science Publishers. In press 2012.
12. Blakeley JO, Llinas RH. Thrombolytic therapy for acute ischemic stroke. J Neurol Sci 2007; 261(1–2): 55–62.
13. Brott T, Bogousslavsky J. Treatment of acute ischemic stroke. N Engl J Med 2000; 343(10): 710–722.
14. Ahmad A, Sharma VK. More on: optimal dose for stroke thrombolysis in Asians. J Thromb Haemost 2012; 10(9): 1970–1971.
15. Smith WS, Sung G, Starkman S, Saver JL, Kidwell CS, Gobin YP et al. MERCI Trial Investigators. Safety and efficacy of mechanical embolectomy in acute ischemic stroke: results of the MERCI trial. Stroke 2005; 36(7): 1432–1440.
16. Chopko BW, Kerber C, Wong W, Georgy B. Transcatheter snare removal of acute middle cerebral artery thromboembolism: technical case report. Neurosurgery 2000; 46(6): 1529–1531.
17. Kerber CW, Barr JD, Berger RM, Chopko BW. Snare retrieval of intracranial thrombus in patients with acute stroke. J Vasc Interv Radiol 2002; 13(12): 1269–1274.
18. Fourie P, Duncan IC. Microsnare-assisted mechanical removal of intraprocedural distal middle cerebral arterial thromboembolism. Am J Neuroradiol 2003; 24(4): 630–632.
19. Schumacher HC, Meyers PM, Yavagal DR, Harel NY, Elkind MS, Mohr JP et al. Endovascular mechanical thrombectomy of an occluded superior division branch of the left MCA for acute cardioembolic stroke. Cardiovasc Intervent Radiol 2003; 26(3): 305–308.
20. Baker WL, Colby JA, Tongbram V, Talati RA, Silverman IE, White CM et al. Neurothrombectomy Devices for Treatment of Acute Ischemic Stroke. Rockville (MD): Agency for Healthcare Research and Quality 2011.
21. Smith WS, Sung G, Starkman S, Saver JL, Kidwell CS, Gobin YP et al. MERCI Trial Investigators. Safety and efficacy of mechanical embolectomy in acute ischemic stroke: results of the MERCI trial. Stroke 2005; 36(7): 1432–1438.
22. Josephson SA, Saver JL, Smith WS. Merci and Multi Merci Investigators. Comparison of mechanical embolectomy and intra-arterial thrombolysis in acute ischemic stroke within the MCA: MERCI and Multi MERCI compared to PROACT II. Neurocrit Care 2009; 10(1): 43–49.
23. Smith WS. Safety of mechanical thrombectomy and intravenous tissue plasminogen activator in acute ischemic stroke. Results of the multi Mechanical Embolus Removal in Cerebral Ischemia (MERCI) trial part I. AJNR Am J Neuroradiol 2006; 27(6): 1177–1182.
24. Smith WS, Sung G, Saver J, Budzik R, Duckwiler G, Liebeskind DS et al. Multi MERCI Investigators. Mechanical thrombectomy for acute ischemic stroke: final results of the Multi MERCI Trial. Stroke 2008; 39(4): 1205–1212.
25. Nogueira RG, Smith WS, Sung G, Duckwiler G, Walker G, Roberts R et al. MERCI and Multi MERCI Writing Committee. Effect of time to reperfusion on clinical outcome of anterior circulation strokes treated with thrombectomy: pooled analysis of the MERCI and Multi MERCI trials. Stroke 2011; 42(11): 3144–3149.
26. Nogueira RG, Liebeskind DS, Sung G, Duckwiler G, Smith WS. Multi MERCI Writing Committee. Predictors of good clinical outcomes, mortality, and successful revascularization in patients with acute ischemic stroke undergoing thrombectomy: pooled analysis of the Mechanical Embolus Removal in Cerebral Ischemia (MERCI) and Multi MERCI Trials. Stroke 2009; 40(12): 3777–3783.
27. Shi ZS, Loh Y, Walker G, Duckwiler GR. MERCI and Multi MERCI Investigators. Clinical outcomes in middle cerebral artery trunk occlusions versus secondary division occlusions after mechanical thrombectomy: pooled analysis of the Mechanical Embolus Removal in Cerebral Ischemia (MERCI) and Multi MERCI trials. Stroke 2010; 41(5): 953–960.
28. Flint AC, Duckwiler GR, Budzik RF, Liebeskind DS, Smith WS. MERCI and Multi MERCI Writing Committee. Mechanical thrombectomy of intracranial internal carotid occlusion: pooled results of the MERCI and Multi MERCI Part I trials. Stroke 2007; 38(4): 1274–1280.
29. Lutsep HL, Rymer MM, Nesbit GM. Vertebrobasilar revascularization rates and outcomes in the MERCI and multi-MERCI trials. J Stroke Cerebrovasc Dis 2008; 17(2): 55–57.
30. Penumbra Pivotal Stroke Trial Investigators. The penumbra pivotal stroke trial: safety and effectiveness of a new generation of mechanical devices for clot removal in intracranial large vessel occlusive disease. Stroke 2009; 40(8): 2761–2768.
31. Saver JL, Liebeskind DS, Nogueira RG, Jahan R. Need to clarify Thrombolysis In Myocardial Ischemia (TIMI) scale scoring method in the Penumbra Pivotal Stroke Trial. Stroke 2010; 41(2): e115–e116.
32. Grunwald IQ, Wakhloo AK, Walter S, Molyneux AJ, Byrne JV, Nagel S et al. Endovascular stroke treatment today. AJNR Am J Neuroradiol 2011; 32(2): 238–243.
33. Castaño C, Dorado L, Guerrero C, Millán M, Gomis M, Perez de la Ossa N et al. Mechanical thrombectomy with the Solitaire AB device in large artery occlusions of the anterior circulation: a pilot study. Stroke 2010; 41(8): 1836–1840.
34. Machi P, Costalat V, Lobotesis K, Maldonado IL, Vendrell JF, Riquelme C et al. Solitaire FR thrombectomy system: immediate results in 56 consecutive acute ischemic stroke patients. J Neurointerv Surg 2012; 4(1): 62–66.
35. Roth C, Papanagiotou P, Behnke S, Walter S, Haass A, Becker C et al. Stent-assisted mechanical recanalization for treatment of acute intracerebral artery occlusions. Stroke 2010; 41(11): 2559–2567.
36. Seifert M, Ahlbrecht A, Dohmen C, Spuentrup E, Moeller-Hartmann W. Combined interventional stroke therapy using intracranial stent and local intra-arterial thrombolysis (LIT). Neuroradiology 2010; 53(4): 273–282.
37. Costalat V, Machi P, Lobotesis K, Maldonado I, Vendrell JF, Riquelme C et al. Rescue, combined, and stand-alone thrombectomy in the management of large vessel occlusion stroke using the solitaire device: a prospective 50-patient single-center study: timing, safety, and efficacy. Stroke 2011; 42(7): 1929–1935.
38. Nogueira RG, Lutsep HL, Gupta R, Jovin TG, Albers GW, Walker GA et al. TREVO 2 Trialist. Trevo versus Merci retrievers for thrombectomy revascularisation of large vessel occlusions in acute ischaemic stroke (TREVO 2): a randomised trial. Lancet 2012; 380(9849): 1231–1240.
39. Mendonça N, Flores A, Pagola J, Rubiera M, Rodríguez-Luna D, De Miquel MA et al. Trevo System: Single-Center Experience with a Novel Mechanical Thrombectomy Device. J Neuroimaging. In press 2011.
40. Mourand I, Brunel H, Costalat V, Riquelme C, Lobotesis K, Milhaud D et al. Mechanical thrombectomy in acute ischemic stroke: catch device. AJNR Am J Neuroradiol 2011; 32(8): 1381–1385.
41. Baker WL, Colby JA, Tongbram V, Talati R, Silverman IE, White CM et al. Neurothrombectomy devices for the treatment of acute ischemic stroke: state of the evidence. Ann Intern Med 2011; 154(4): 243–252.
42. Meyers PM, Schumacher HC, Connolly ES jr, Heyer EJ, Gray WA, Higashida RT. Current status of endovascular stroke treatment. Circulation 2011; 123(22): 2591–2601.
43. Saver JL, Jahan R, Levy EI, Jovin TG, Baxter B, Nogueira RG et al. Solitaire flow restoration device versus the Merci Retriever in patients with acute ischaemic stroke (SWIFT): a randomised, parallel--group, non-inferiority trial. Lancet 2012; 380(9849): 1241–1249.
44. Thrombectomy Revascularization of Large Vessel Occlusion in Acute Ischemic Stroke (TREVO). Available from: http://clinicaltrials.gov/ct2/show/NCT01088672.
45. Mechanical Retrieval and Recanalization of Stroke Clots Using Embolectomy (MR-RESCUE). Available from: http://clinicaltrials.gov/ct2/show/NCT00389467.
46. DWI/PWI and CTP assessment in the triage of wake-up and late presenting strokes undergoing neurointervention (DAWN). Available from: http://www.strokecenter.org/trials/clinicalstudies/dwipwi-and-ctp-assessment-in-the-triage-of-wake-up-and-late-presenting-strokes-undergoing-neurointervention.
47. Samaniego EA, Dabusand G, Linfante I. Stenting in the treatment of acute ischemic stroke: literature review. Front Neurol 2011; 2: 76.
48. Roubec M, Kuliha M, Prochazka V, Krajca J, Czerny D, Jonszts T et al. A controlled trial of revascularization in acute stroke. Radiology. In press 2012.
49. Fitzsimmons BF, Becske T, Nelson PK. Rapid stent-supported revascularization in acute ischemic stroke. AJNR Am J Neuroradiol 2006; 27(5): 1132–1134.
50. Levy EI, Mehta R, Gupta R, Hanel RA, Chamczuk AJ, Fiorella D et al. Self-expanding stents for recanalization of acute cerebrovascular occlusions. AJNR Am J Neuroradiol 2007; 28(5): 816–822.
51. Zaidat OO, Wolfe T, Hussain SI, Lynch JR, Gupta R, Delap J et al. Interventional acute ischemic stroke therapy with intracranial self-expanding stent. Stroke 2008; 39(8): 2392–2395.
52. Brekenfeld C, Schroth G, Mattle HP, Do DD, Remonda L, Mordasini P et al. Stent placement in acute cerebral artery occlusion: use of a self-expandable intracranial stent for acute stroke treatment. Stroke 2009; 40(3): 847–852.
53. Mocco J, Hanel RA, Sharma J, Hauck EF, Snyder KV, Natarajan SK et al. Use of a vascular reconstruction device to salvage acute ischemic occlusions refractory to traditional endovascular recanalization methods. J Neurosurg 2010; 112(3): 557–562.
54. Suh SH, Kim BM, Roh HG, Lee KY, Park SI, Kim DI et al. Self-expanding stent for recanalization of acute embolic or dissecting intracranial artery occlusion. AJNR Am J Neuroradiol 2010; 31(3): 459–463.
55. Linfante I, Samaniego EA, Geisbüsch P, Dabus G. Self-expandable stents in the treatment of acute ischemic stroke refractory to current thrombectomy devices. Stroke 2011; 42(9): 2636–2638.
56. Nakano S, Iseda T, Yoneyama T, Kawano H, Wakisaka S. Direct percutaneous transluminal angioplasty for acute middle cerebral artery trunk occlusion: an alternative option to intra-arterial thrombolysis. Stroke 2002; 33(12): 2872–2876.
57. Qureshi AI, Siddiqui AM, Suri MF, Kim SH, Ali Z, Yahia AM et al. Aggressive mechanical clot disruption and low-dose intra-arterial third-generation thrombolytic agent for ischemic stroke: a prospective study. Neurosurgery 2002; 51(5): 1319–1329.
58. Jovin TG, Gupta R, Uchino K, Jungreis CA, Wechsler LR, Hammer MD et al. Emergent stenting of extracranial internal carotid artery occlusion in acute stroke has a high revascularization rate. Stroke 2005; 36(11): 2426–2430.
59. Levy EI, Siddiqui AH, Crumlish A, Snyder KV, Hauck EF, Fiorella DJ et al. First Food and Drug Administration-approved prospective trial of primary intracranial stenting for acute stroke: SARIS (stent-assisted recanalization in acute ischemic stroke). Stroke 2009; 40(11): 3552–3556.
60. Levy EI, Rahman M, Khalessi AA, Beyer PT, Natarajan SK, Hartney ML et al. Midterm clinical and angiographic follow-up for the first Food and Drug Administration-approved prospective, Single-Arm Trial of Primary Stenting for Stroke: SARIS (Stent-Assisted Recanalization for Acute Ischemic Stroke). Neurosurgery 2011; 69(4): 915–920.
61. Francis CW, Blinc A, Lee S, Cox C. Ultrasound accelerates transport of recombinant tissue plasminogen activator into clots. Ultrasound Med Biol 1995; 21(3): 419–424.
62. Skoloudik D, Fadrna T, Roubec M, Bar M, Zapletal O, Blatny J et al. Changes in hemocoagulation in acute stroke patients after one-hour sono-thrombolysis using a diagnostic probe. Ultrasound Med Biol 2010; 36(7): 1052–1059.
63. Skoloudik D, Fadrna T, Bar M, Zapletalova O, Zapletal O, Blatny J et al. Changes in haemocoagulation in healthy volunteers after a 1-hour thrombotripsy using a diagnostic 2–4 MHz transcranial probe. J Thromb Thrombolysis 2008; 26(2): 119–124.
64. Suchkova VN, Baggs RB, Francis CW. Effect of 40-kHz ultrasound on acute thrombotic ischemia in a rabbit femoral artery thrombosis model: enhancement of thrombolysis and improvement in capillary muscle perfusion. Circulation 2000; 101(19): 2296–2301.
65. Bardon P, Skoloudik D, Langova K, Herzig R, Kanovský P. Changes in blood flow velocity in the radial artery during 1-hour ultrasound monitoring with a 2-MHz transcranial probe – a pilot study. J Clin Ultrasound 2010; 38(9): 493–496.
66. Harvey EN. Biological aspects of ultrasonic waves a general survey. Biol Bull 1930; 59(3): 306–325.
67. Mahon BR, Nesbit GM, Barnwell SL, Clark W, Marotta TR, Weill A et al. North American clinical experience with the EKOS MicroLysUS infusion catheter for the treatment of embolic stroke. AJNR Am J Neuroradiol 2003; 24(3): 534–538.
68. IMS II Trial Investigators. The Interventional Management of Stroke (IMS) II Study. Stroke 2007; 38(7): 2127–2135.
69. Janjua N, Alkawi A, Suri MF, Qureshi AI. Impact of arterial reocclusion and distal fragmentation during thrombolysis among patients with acute ischemic stroke. AJNR Am J Neuroradiol 2008; 29(2): 253–258.
70. Nogueira RG, Yoo AJ, Buonanno FS, Hirsch JA. Endovascular approaches to acute stroke, part 2: a comprehensive review of studies and trials. AJNR Am J Neuroradiol 2009; 30(5): 859–875.
71. Tomsick T, Broderick J, Carrozella J, Khatri P, Hill M, Palesch Y et al. Interventional Management of Stroke II Investigators. Revascularization results in the Interventional Management of Stroke II trial. Am J Neuroradiol 2008; 29(3): 582–587.
72. Kuliha M, Roubec M, Jonszta T, Krajca J, Czerny D, Krajina A et al. Safety and efficacy of endovascular sonolysis using the EkoSonicTM endovascular system in acute stroke patients. Am J Neuroradiol. In press 2012.
73. Khatri P, Hill MD, Palesch YY, Spilker J, Jauch EC, Carrozzella JA et al. Interventional Management of Stroke III Investigators. Methodology of the Interventional Management of Stroke III Trial. Int J Stroke 2008; 3(2): 130–137.
74. Berlis A, Lutsep H, Barnwell S, Norbash A, Wechsler L, Jungreis CA et al. Mechanical thrombolysis in acute ischemic stroke with endovascular photoacoustic recanalization. Stroke 2004; 35(5): 1112–1116.
75. Rohde S, Haehnel S, Herweh C, Pham M, Stampfl S, Ringleb PA et al. Mechanical thrombectomy in acute embolic stroke: preliminary results with the revive device. Stroke 2011; 42(10): 2954–2956.
76. Gonzalez RG, Hirsch JA, Lev MH et al. Acute Ischemic Stroke: Imaging and Intervention. 2nd ed. Berlin: Springer-Verlag 2011.
77. Tomsick T. TIMI, TIBI, TICI: I came, I saw, I got confused. AJNR Am J Neuroradiol 2007; 28(2): 382–384.
78. Bar M, Mikulik R, Jonszta T, Krajina A, Roubec M, Skoloudik D et al. Diagnosis of recanalization of the intracranial artery has poor inter-rater reliability. AJNR Am J Neuroradiol 2012; 33(5): 972–974.
79. Wilson JT, Hareendran A, Hendry A, Potter J, Bone I, Muir KW. Reliability of the modified Rankin Scale across multiple raters: benefits of a structured interview. Stroke 2005; 36(4): 777–781.
80. Tomek A, Šaňák D, Šrámek M et al. Neurointenzivní péče. Praktická příručka. Praha: Mladá fronta 2012.
81. Higashida RT, Furlan AJ, Roberts H, Tomsick T, Connors B, Barr J et al. Technology Assessment Committee of the American Society of Interventional and Therapeutic Neuroradiology; Technology Assessment Committee of the Society of Interventional Radiology. Trial design and reporting standards for intra-arterial cerebral thrombolysis for acute ischemic stroke. Stroke 2003; 34(8): e109–e137.
82. Noser EA, Shaltoni HM, Hall CE, Alexandrov AV, Garami Y, Cacayorin ED et al. Aggressive mechanical clot disruption: a safe adjunct to thrombolytic therapy in acute stroke? Stroke 2005; 36(2): 292–296.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 6
Most read in this issue
- A Global Epidemic of Multiple Sclerosis?
- Cortical Pathology in Multiple Sclerosis – Morphology, Immunopathology and Clinical Context
- Structure of Care in Neurorehabilitation
- Endovascular Treatment of an Ischemic Cerebrovascular Event

