Opakovaná intradetruzorová aplikace botulinumtoxinu A u dětí s hyperaktivitou detruzoru
Repeated Intradetrusor Application of Botulinum Toxin A in Children with Detrusor Overactivity
Objective:
Analysis of therapy by repeated intradetrusor application of botulinum toxin A in children’s urinary bladder detrusor overactivity. Material and methods: The study included a total of 17 patients between the ages of 6 and 14 years (mean 9.5, median 9). Eight of them were treated for neurogenic detrusor overactivity (Group I: 4 girls and 4 boys), and nine for non-neurogenic detrusor overactivity (Group II: 3 girls and 6 boys). Botulinum toxin A at a dose of 10 to 12 IU/ kg, in proportion to body weight, was applied endoscopically. Nine patients were treated twice, the others two or three times 6 months after previous injection in every case. Both urodynamic data and bladder diary data were assessed 1, 3, and 6 months after each application. Results: 11 patients (65%) showed improved urine continence while 2 (11%) of patients exhibited full extinction of incontinence. Extinction and/or reduction of non-inhibited detrusor contractions always culminated in the third month after application. No one child demonstrated a change of miction regime or need for catheterisation. Maximum increase of cystometric capacity took effect after 3 months: in Group I by 55% (107 ±76 ml; p = 0.0068), in Group II by 40% (72 ±41 ml; p = 0.0010). The degree of greatest decrease of maximum detrusor pressure was: Group I by 49% (29 ±11.2 cm H2O; p = 0.0126) three months after application; Group II by 64% (45 ±16.5 cm H2O; p = 0.0069), one month after second application. No adverse effects emerged during treatment. Conclusion: Intradetrusor application of botulinum toxin A appears to be a safe and efficient treatment for detrusor overactivity in children, regardless of its origin. Repeated application does not potentiate the effect of this treatment.
Key words:
neurogenic bladder – botulinum toxin A – detrusor overactivity – incontinence
Authors:
P. Zerhau 1; M. Husár 1; E. Brichtová 2; Z. Mackerle 2; O. Šmakal 3; J. Vrána 3
Authors‘ workplace:
Odd. dětské urologie, Klinika dětské chirurgie, ortopedie a traumatologie LF MU a FN Brno
1; Odd. dětské neurochirurgie, Klinika dětské chirurgie, ortopedie a traumatologie LF MU a FN Brno
2; Urologická klinika LF UP a FN Olomouc
3
Published in:
Cesk Slov Neurol N 2011; 74/107(4): 471-474
Category:
Short Communication
Overview
Cíl:
Analýza výsledků léčby hyperaktivity detruzoru močového měchýře opakovanou intradetruzorovou aplikací botulinumtoxinu A u dětí. Soubor a metodika: Do studie bylo zařazeno celkem 17 pacientů ve věku 6–14 roků (průměr 9,5; medián 9). Osm z nich s neurogenním postižením (skupina I: 4 dívky, 4 chlapci), devět s non-neurogenní poruchou detruzoru (skupina II: 3 dívky, 6 chlapců). Botulinumtoxin A byl aplikován endoskopicky v dávce 10–12 IU/ kg váhy dítěte. U devíti pacientů byla aplikace provedena 2krát, u dvou pacientů 3krát, vždy po šesti měsících od injektáže předchozí. Urodynamická měření i údaje z mikčních deníků byly hodnoceny po 1, 3 a 6 měsících od každé aplikace. Výsledky: Ke zlepšení kontinence moči došlo u 11 pacientů (65 %), ke kompletnímu vymizení inkontinence u dvou (11 %). Vymizení a/nebo snížení netlumených kontrakcí detruzoru mělo maximum vždy po 3. měsíci od aplikace. Ke změně režimu močení/cévkování nedošlo u žádného dítěte. K největšímu nárůstu maximální cystometrické kapacity došlo po třech měsících, ve skupině I o 55 % (107 ± 76 ml; p = 0,0068), ve skupině II o 40 % (72 ± 41 ml, p = 0,0010). Největší pokles maximálního detruzorového tlaku nastal ve skupině I po 3 měsících, o 49 % (29 ± 11,2 cm H2O; p = 0,0126), ve skupině II o 64 % (45 ± 16,5 cm H2O; p = 0,0069) po jednom měsíci od 2. aplikace. Nežádoucí účinky léčby se u žádného pacienta nevyskytly. Závěr: Intradetruzorová aplikace botulinumtoxinu A je bezpečná a efektivní léčba hyperaktivity detruzoru u dětí, bez ohledu na její genezi. Opakovaná aplikace nemá potencující efekt.
Klíčová slova:
neurogenní měchýř – botulinumtoxin A – hyperaktivní detruzor – inkontinence
Úvod
Hyperaktivita detruzoru močového měchýře představuje závažný medicínský a sociální problém. Její následky – inkontinence moči, infekce močového traktu a poškození horních močových cest – nejsou vždy uspokojivě zvládnutelné. Farmakologická léčba není mnohdy účinná nebo dobře tolerovaná, chirurgické zákroky nejsou prosty komplikací. Výzkum se proto v posledních letech zaměřuje kauzálněji, na ovlivnění nervového zásobení detruzoru.
Neurotoxická látka botulinumtoxin A (BoNT/A) blokuje cholinergní přenos na neuromuskulárním přechodu a redukuje zejména excesivní, abnormální kontrakce svaloviny. BoNT/A je využíván k ovlivnění dystonií příčně pruhovaného svalstva [1], v urologii jeho účinky popsali poprvé Dykstra et al [2]. Lze jej využít i ke snížení tonu hladké svaloviny, zejména k léčbě hyperaktivity detruzoru, neurogenní i non-neurogenní geneze. Přímá intradetruzorová aplikace BoNT/A výrazně snižuje počet netlumených kontrakcí a intravezikální tlak, zvyšuje kapacitu močového měchýře a zlepšuje močovou kontinenci. Byl prokázán efekt i na aferentní inervaci detruzoru a navrženo využití metody u pacientů s refrakterním hyperaktivním měchýřem. Významné vedlejší účinky dosud nebyly popsány. Studie s aplikací botulinumtoxinu u dospělých probíhají již delší dobu [3,4]. Zkušenosti s aplikací u dětí jsou podstatně méně rozsáhlé, v naší literatuře jinými autory zatím nepublikované. Cílem práce je analýza výsledků léčby detruzorové hyperaktivity opakovanou aplikací BoNT/A ve vlastním souboru pacientů a výzkum jeho možných kumulativních účinků.
Materiál a metodika
V hodnoceném souboru byl v letech 2008–2010 u 17 dětí ve věku 6–14 roků (průměr 9,5; medián 9,0) endoskopicky do detruzoru aplikován BoNT/A, preparát Botox®. V osmi případech (skupina I, 4 dívky a 4 chlapci) se jednalo o neurogenní původ hyperaktivity (meningomyelokéla 6×, míšní tumor 1×, ischemie míchy 1×), u devíti dětí (skupina II, 3 dívky, 6 chlapců) o příčinu non-neurogenní. U všech dětí byla předchozí konzervativní léčba anticholinergiky (propiverin, oxybutinin, tolterodin) neúčinná nebo nebyla v terapeutické dávce tolerována. BoNT/A byl aplikován v dávce 10–12 IU/ kg váhy dítěte, maximálně však 300 IU, do 25–30 míst detruzoru ve třech sagitálních řadách po 8–10 vpiších, mimo trigonum. U devíti pacientů byla aplikace provedena 2×, u dvou pacientů 3×. Na základě výsledků výzkumu a krátkých zkušeností před vlastní studií byl termín reaplikace BoNT/A stanoven na dobu po 6. měsíci od předchozí injektáže, kdy již docházelo k poklesu účinku toxinu. Před zahájením léčby byli ve skupině I kontinentní tři pacienti, ve skupině II jeden pacient, spontánní mikce byli schopni tři, resp. šest pacientů. V průběhu studie byl sledován vliv na kontinenci, urodynamické parametry a délka trvání účinku BoNT/A. Urodynamická měření a klinické konzultace byly prováděny vždy po 1, 3 a 6 měsících od každé aplikace BoNT/A. K hodnocení byla použita popisná statistika a Wilcoxonův párový test.
Výsledky
Ke zlepšení kontinence došlo ve skupině I u čtyř pacientů (50 %), ke kompletnímu vymizení inkontinence u jednoho dítěte (12,5 %). Ve skupině II nastalo zlepšení u sedmi (78 %), vymizení inkontinence u jednoho (11 %), zbývající pacient zůstává trvale kontinentní. U pacientů, kterým nebyl aplikován BoNT/A opakovaně, přetrvávaly tyto změny po dobu 8–9 měsíců, od 6. měsíce měly ale sestupnou tendenci. Ke změně režimu močení/cévkování nedošlo u žádného dítěte. Ve skupině I se cévkovalo před injektáží i po ní pět dětí, ve skupině II tři děti, ostatní močí spontánně s postmikčním reziduem do 15 % maximální cystometrické kapacity (Vmax).
K nárůstu průměrné maximální cystometrické kapacity (Vmax ) došlo u všech pacientů, s rozdíly podle počtu injektáží. Od 1. aplikace BoNT/A nejvíce po třech měsících jak ve skupině I (+55 %; p = 0,0067), tak ve skupině II (+40 %; p = 0,0010) (tab. 1, 3). Po reinjektážích, tj. aplikaci BoNT/A opakovaně po šesti měsících, došlo k vzestupu Vmax ve skupině I opět nejvíce po třech měsících od reinjektáže (+14 %), ve skupině II po 1 i 3 měsících (+37 %; p = 0,0382; +39 %; p = 0,022). Sumační efekt opakovaných aplikací BoNT/A pozorován nebyl (tab. 2, 4, graf 1, 2).
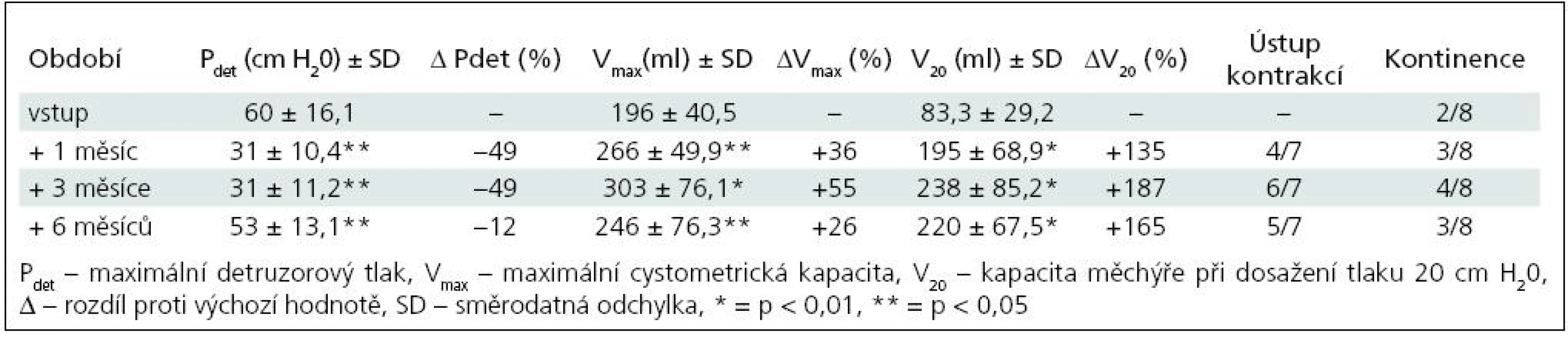
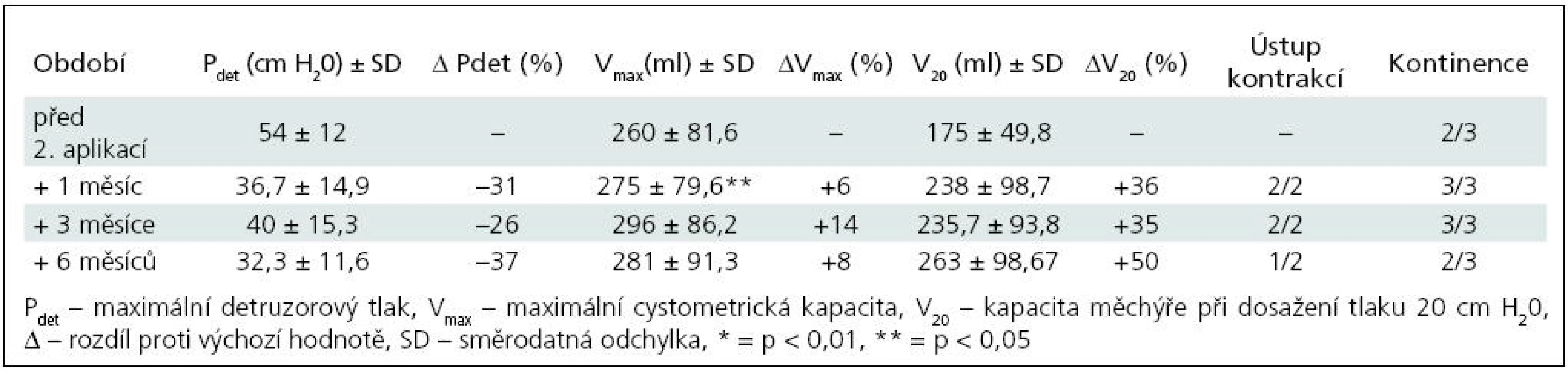
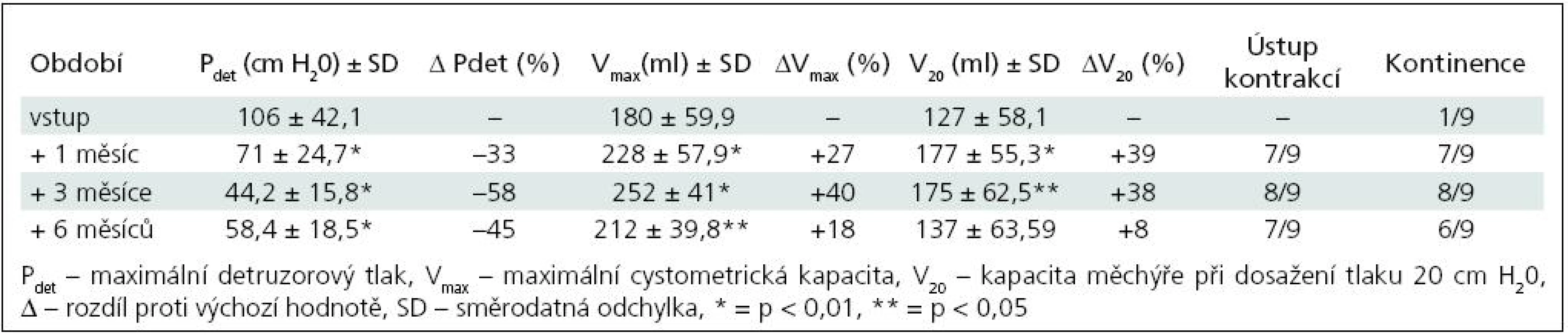
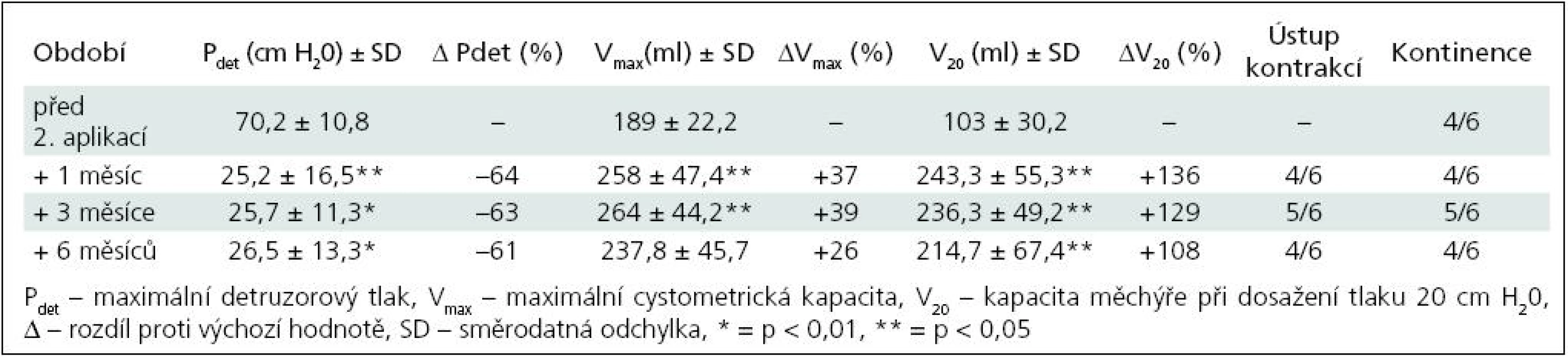


Ke snížení průměrného maximálního detruzorového tlaku (Pdet) došlo také u všech dětí. Ve skupině I nejvýrazněji 1. a 3. měsíc po 1. aplikaci (–49 %; p = 0,0126) a 6 měsíců po 2. aplikaci (–37 %).
Ve skupině II nejvíce tři měsíce od 1. aplikace (–58 %; p = 0,0015), po druhé aplikaci byly hodnoty stacionární od 1. do 6. měsíce, s nevýznamným minimem v 1. měsíci (–64 %; p = 0,0138). Dva pacienti, sledovaní doposud tři měsíce od 3. aplikace (tj. 15 měsíců od aplikace první), měli maximální pokles Pdet tři měsíce po 3. aplikaci, o 58 %. Vzhledem k jejich malému počtu nejsou uváděni v samostatných tabulkách.
Vzestup průměrného cystometrického objemu při dosažení tlaku 20 cm H20 (V20) se výrazně zvýšil u obou skupin. U skupiny I s maximem po třech měsících od 1. aplikace (+187 %; p = 0,0015), po 2. aplikaci došlo ke zvýšení s maximem v 6. měsíci (+50 %; p = 0,297). Ve skupině II byla dosahovaná zlepšení časově posunuta, s maximálním navýšením jeden měsíc od 2. aplikace (+136 %; p = 0,0125).
Zřetelné bylo vymizení nebo výrazné snížení netlumených kontrakcí, u většiny pacientů zřetelné nejvíce vždy kolem 3. měsíce po aplikaci BoNT/A.
Výskyt nežádoucích účinků systémových (malátnost, únava) ani lokálních (přetrvávající hematurie, bakteriurie u spontánně močících, pánevní bolesti) nebyl v našem souboru pozorován.
Diskuze
Jeden z nejúčinnějších biologických toxinů – botulinumtoxin A (BoNT/A) – působí inhibici acetylcholinu na presynaptických cholinergních zakončeních, s výsledným poklesem svalové kontraktility v místě aplikace. Chemická denervace je reverzibilní proces, trvající v laboratorních podmínkách 3–6 měsíců. Těchto vlastností je v urologii využíváno od konce 80. let minulého století, kdy byla poprvé popsána aplikace BoNT/A do svaloviny zevního svěrače [2].
První klinické pokusy s užitím BoNT/A k potlačení parasympatické aktivity detruzoru popsali Schurchová et al [3] u pacientů s poraněním míchy, Schulte-Baukloh et al [5] jej poprvé použili u dětí s hyperaktivitou detruzoru. V české literatuře popsali své zkušenosti s BoNT/A u dospělých jako první Krhut et al [4,6], první zkušenosti se souborem dětí má zatím naše pracoviště.
Načasování opakované aplikace BoNT/A po šesti měsících od aplikace předchozí má své opodstatnění ve zjištěné době účinku. Maximálních zlepšení jsme téměř vždy dosáhli mezi 1. a 3. měsícem od aplikace, po 6. měsíci se efekt již zmenšoval. Zajímavé je srovnání těchto údajů v literatuře. Zatímco Riccabona et al [7] popisují trvání dostatečného účinku 10,5 měsíce u dětí s meningomyelokélou a uvádějí nutnost reaplikace po jednom roce, Altaweel et al [8] jsou přesvědčeni o nutnosti reinjektáže po šesti měsících, stejně jako Chenet et al [9]. Naše dosavadní zkušenosti se tedy blíží spíše této kratší době účinku BoNT/A, s maximem tři měsíce od aplikace, a to jak u dětí s neurogenním postižením, tak u non-neurogenní indikace.
Zlepšení kontinence nastávalo u většiny pacientů již po 1. měsíci a přetrvávalo šest měsíců od každé aplikace bez podstatných změn. Podobně příznivý efekt měl BoNT/A na ústup kontrakcí, bez ohledu na genezi hyperaktivity detruzoru.
Vzestup Vmax měl u obou námi měřených skupin identický průběh. Maxima bylo dosaženo vždy 3. měsíc po výkonu, bez ohledu na původ hyperaktivity a počet aplikací. U neurogenního močového měchýře byl nárůst kapacity o 55 %, ve skupině non-neurogenní 40 % po první aplikaci, s následným poklesem po šesti měsících a opětným nárůstem po reaplikaci. Opětný pokles 6 měsíců po reaplikaci byl poté méně markantní (graf 1). Obdobný sinusový průběh hodnot po replikacích uvádějí Do Ngoc Thanh et al [10], jeho soubor je ovšem o něco menší (sedm dětí) a týká se pouze dětí s transverzální lézí míšní. Riccabona et al [7] v souboru 15 dětí s meningomyelokélou uvádějí vzestup kapacity o více než 200 %, trvající do 9. měsíce, po 2. aplikaci však již s podstatným poklesem po 3. měsíci. Námi zjištěné účinky měly tedy vyrovnanější charakter i po opakované aplikaci.
Pokles Pdet vykazoval v celém souboru opět sinusový průběh (graf 2), přestože mezi oběma skupinami byly rozdíly v absolutních hodnotách, zejména na počátku studie (60, resp. 106 cm H2O v první, resp. druhé skupině). Po třech měsících po 1. aplikaci a celou dobu sledování po aplikaci druhé byly již hodnoty vyrovnanější (tab. 1–4). Srovnatelná vyšetření u obou skupin pacientů po opakované aplikaci BoNT/A jsme v literatuře nenalezli.
Hoebecke et al [11] jako jedni z mála popisují vedlejší účinky léčby (vezikoureterální reflux, uroinfekt, postmikční reziduum), v našem souboru nebyly pozorovány. Obdobně nedošlo k obávané změně režimu vyprazdňování – pacientům již dříve se cévkujícím se sice zvýšilo postmikční reziduum, u spontánně močících však nemusela být zahájena katetrizace.
Závěr
Intradetruzorová aplikace BoNT/A je bezpečná a efektivní léčba hyperaktivity detruzoru u dětí, bez ohledu na její původ. Vede k výraznému zvýšení kontinence, poklesu netlumených kontrakcí a zlepšení urodynamických ukazatelů funkce dolních močových cest. Opakovaná aplikace nemá stoupající efekt, podle dosavadních zkušeností má její načasování smysl v době ústupu účinku aplikace první, tj. po 6. měsíci od první injektáže. Standardizace léčby stejně jako dlouhodobé morfologicko-funkční sledování vyžaduje pokračování studií na větších počtech pacientů.
Práce je podporována grantem IGA MZ ČR – NS 9845-3.
prim.
MUDr. Pavel Zerhau, CSc.
Odd.
dětské urologie, Klinika dětské chirurgie, ortopedie
a traumatologie LF MU
a FN Brno
Černopolní
9
625
00 Brno
e-mail:
pavel.zerhau@tiscali.cz
Přijato
k recenzi: 5. 11. 2010
Přijato
do tisku: 10. 1. 2011
Sources
1. Kaňovský P.Cervikální dystonie. Cesk Slov Neurol N 2007, 70/103(4): 358–370.
2. Dykstra DD, Sidi AA, Scott AB, Pagel JM, Goldish GD. Effects of botulinum A toxin on detrusor sphincter dyssynergia in spinal cord injury patients. J Urol 1988, 139(5): 919–922.
3. Schurch R, Stöhrer M, Kramer G, Schmid DM, Gaul G, Hauri D. Botulinum-A toxin for treating detrusor hyperreflexia in spinal cord injured patients – a new alternative to anticholinergic drugs? Preliminary results. J Urol 2000; 164(1): 692–697.
4. Krhut J, Zachoval R, Hradílek P, Havránek O, Zapletalová O. Botulotoxin v léčbě detruzorové hyperaktivity u pacientek s roztroušenou sklerózou. Cesk Slov Neurol N 2008; 71/104(4): 429–434.
5. Schulte-Baukloh H, Michael T, Schubert J, Stolze T, Knispel HH. Efficacy of botulinum-A toxin in children with detrusor hyperreflexia due to myelomeningocele: preliminary results. Urology 2002; 59(3): 325–328.
6. Krhut J, Kopecký J, Mainer K. Transuretrální injekce botulinumtoxinu v léčbě neurogenní hyperaktivity detruzoru. Čes Urol 2003, 7(1): 29–32
7. Riccabona M, Koen M, Schindler M, Goedele B, Pycha A, Lusuardi L et al. Botulinum-A toxin injection into the detrusor: a safe alternative in the treatment of children with myelomeningocele with detrusor hyperreflexia. J Urol 2004; 171/2(1): 845–848.
8. Altaweel W, Jednack R, Bilodeau C, Corcos J. Repeated intradetrusor botulinum toxin type A in children with neurogenic bladder due to myelomeningocele. J Urol 2006; 175/3(1): 1102–1105.
9. Chenet A, Perrouin-Verbe B, Le Normand L, Labat JJ, Brunel P, Lefort M et al. Efficacy of repeat injections of botulinum A toxin to the detrusor in neurogenic bladder overactivity. Ann Readapt Med Phys 2007, 50(8): 651–660.
10. Do Ngoc Thanh C, Audry G, Forin V. Botulinum toxin type A for neurogenic detrusor overactivity due to spinal cord lesions in children: a retrospective study of seven cases. J Pediatr Urol 2009, 5(6): 430–436.
11. Hoebeke P, De Caestecker K, Vande Walle J, Dehoorne J, Raes A, Verleyen P et al. The effect of botulinum-A toxin in incontinent children with therapy resistant overactive detrusor. J Urol 2006; 176(1): 328–331.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery
2011 Issue 4
Most read in this issue
- Porucha pozornosti s hyperaktivitou (attention deficit/hyperactivity disorder – ADHD)
- Opožděný akutní subdurální hematom
- Neurologické komplikace při onemocnění herpes zoster – kazuistika
- Vrozená myotonie na podkladě mutací v genu pro chloridový kanál ClC-1
