Antikoagulační terapie v prevenci a léčbě ischemických iktů
Anticoagulant Therapy in the Prevention and Treatment of Ischemic Stroke
Anticoagulant therapy plays an important role in thromboembolic disorders, in primary and secondary prevention as well as treatment, and especially in the prevention of brain systemic embolism in patients with non-valvular atrial fibrillation and other sources of cardioembolic strokes. Unless contraindicated, warfarin is recommended for the treatment of these patients. Warfarin significantly reduces the risks of stroke and death, but increases that of haemorrhage. Life-threatening intracerebral haemorrhage is the most serious complication of oral anticoagulant therapy, with a mortality that can exceed 50%. The need for frequent laboratory monitoring, a narrow therapeutic window, and a plethora of interactions with food and drugs are also reasons to seek new, safe, effective anticoagulant agents that are convenient to use. New oral direct thrombin inhibitors and factor Xa inhibitors present promising alternatives to warfarin. Unfractionated heparin or low-molecular-weight heparins are not recommended for the prevention of early stroke recurrence in patients with acute ischemic stroke of cardioembolic origin. Low-dose unfractionated subcutaneous heparin or low-molecular-weight heparins should be considered for patients with acute ischemic stroke at high risk of deep venous thrombosis or pulmonary embolism.
Key words:
anticoagulant therapy – stroke – warfarin – heparin – low-molecular-weight heparins – direct thrombin inhibitors – direct Xa factor inhibitors
Authors:
J. Bauer
Authors‘ workplace:
Neurologická klinika, 1. LF UK a VFN v Praze
Published in:
Cesk Slov Neurol N 2010; 73/106(5): 480-491
Category:
Minimonography
Overview
Antikoagulační léčba hraje důležitou roli v primární i v sekundární prevenci a léčbě tromboembolických příhod, především v prevenci systémové embolizace do mozkových tepen u pacientů s nevalvulární fibrilací síní a jinými zdroji kardioembolických iktů. Pokud není kontraindikováno, je pro léčbu těchto nemocných doporučován warfarin. Tento lék významně snižuje riziko iktu i mortalitu, ale zvyšuje riziko krvácení. Život ohrožující intracerebrální hemoragie je nejzávažnější komplikace perorální antikoagulační terapie, s mortalitou přesahující 50 %. Potřeba častého laboratorního monitorování léčby, úzké terapeutické okno, mnohé potravinové a lékové interakce jsou rovněž důvod pro hledání nových, účinných, bezpečných a snadno použitelných antikoagulancií. Nové, přímé inhibitory trombinu a plazmatického faktoru Xa jsou slibnou alternativou léčby warfarinem. Nefrakciovaný heparin a nízkomolekulární hepariny nejsou v prevenci časné recidivy u nemocných s akutním ischemickým iktem kardioembolického původu doporučeny. Nefrakciovaný heparin v nízkých dávkách podaný subkutánně nebo nízkomolekulární hepariny jsou vhodné u nemocných s akutním iktem při vysokém riziku hluboké žilní trombózy a plicní embolie.
Klíčová slova:
antikoagulační terapie – iktus – warfarin – heparin – nízkomolekulární hepariny – přímé inhibitory trombinu – přímé inhibitory faktoru Xa
Vytvořeno s podporou výzkumného záměru MSM 0021620807
Úvod
Ischemické cévní mozkové příhody (iCMP) jsou onemocnění, která lze v současnosti již v mnohých případech nejen úspěšně léčit, ale vhodnými preventivními opatřeními jim lze i předcházet. Antikoagulační terapie má bezpochyby své významné postavení jak v primární, tak i v sekundární prevenci iktu, pokud je přítomen natolik závažný hyperkoagulační stav, že antiagregační léčba nemůže být dostatečně účinná a hrozí nebezpečí trombotických komplikací, především kardioembolizmu. Antikoagulační léčba je v cerebrovaskulární problematice jedna z nejúčinnějších preventivních terapií, její přínos však může být znehodnocen rizikem závažných komplikací, zejména hemoragického charakteru. Proto před jejím zahájením je nutno nejen správně pochopit princip této léčby, ale i pečlivě zvážit její indikace a rizika.
Minimonografie je zaměřena především na problematiku klinické praxe se zdůrazněním těch situací, kdy antikoagulační léčba vyvolává rozpaky nebo se v ní chybuje, tak jak se autor opakovaně přesvědčil v průběhu svého mnohaletého působení na Hennerově klinice.
Mechanizmus hemokoagulace
V hemostáze se uplatňují přednostně tři složky: endotel, trombocyty a hemokoagulace. Jejich působení je vzájemné, navzájem propojené (schéma 1). Spouštěcím mechanizmem hemostázy je poškození endotelu, umožňující kontakt aktivních krevních elementů s hlouběji uloženými trombogenními tkáněmi. V místě poškozeného endotelu dochází za spoluúčasti von Willebrandova faktoru a trombinu k adhezi, aktivaci a agregaci trombocytů. Tím je vytvářena labilní primární hemostatická zátka. Zároveň je z buněk poškozeného endotelu exprimován tkáňový faktor, který je primárním fyziologickým iniciátorem plazmatické hemokoagulační kaskády. Klíčovým článkem této kaskády je aktivace plazmatického faktoru X (schéma 2). K té dochází jednak prostřednictvím plazmatického faktoru VII, který je aktivován uvolněným tkáňovým faktorem (zevní koagulační systém), jednak prostřednictvím komplexu plazmatických faktorů VIII, IX, XI, XII a kallikreinu (vnitřní koagulační systém). Plazmatický faktor IX je rovněž aktivován uvolněným tkáňovým faktorem, čímž jsou oba systémy vzájemně propojeny. Aktivovaný plazmatický faktor X za spoluúčasti fosfolipidů, kalciových iontů a plazmatického faktoru V aktivuje protrombin (plazmatický faktor II) na trombin, který následně konvertuje fibrinogen na fibrin. Ten je stabilizován aktivovaným faktorem XIII. V konečné fázi hemokoagulace fibrin zpevní primární hemostatickou zátku v definitivní koagulum. Trombin zároveň akceleruje primární hemostázu podporou agregace trombocytů. Všechny tyto pochody probíhají na povrchu aktivovaných krevních destiček.


Proti těmto prokoagulačním mechanizmům působí mechanizmy antikoagulační:
- a) antitrombin III – blokuje faktor Xa, trombin, ale též faktory XIIa, XIa a IXa,
- b) inhibitor tkáňového faktoru – blokuje aktivovaný faktor X,
- c) trombomodulin – blokuje trombin.
Komplex trombin-trombomodulin zároveň aktivuje C protein, který spolu s proteinem S inaktivují plazmatické faktory V a VIII. Trombin tedy hraje důležitou roli jak v koagulaci, tak, navázaný na trombomodulin, i v antikoagulaci. Hemokoagulační kaskáda je složitý systém vzájemně se ovlivňujících koagulačních a antikoagulačních mechanizmů. Tyto systémy musí být v rovnováze. Utlumení nepřiměřeně aktivovaného koagulačního systému lze dosáhnout několika způsoby:
- a) potlačením tvorby funkčních vitamin K dependentních koagulačních faktorů (kumarinové preparáty),
- b) inhibicí iniciální fáze koagulace (inhibitor tkáňového faktoru, inhibitory jednotlivých koagulačních faktorů),
- c) zamezením konverze protrombinu na trombin (inhibitory faktoru Xa),
- d) blokádou účinku trombinu (inhibitory trombinu),
- e) posílením přirozené antikoagulační odpovědi organizmu (rekombinantní protein C, trombomodulin) [1].
Antikoagulancia
Méně závažný hyperkoagulační stav je indikací k léčbě antiagregační, potlačující tvorbu primárního koagula. Závažný hyperkoagulační stav již vyžaduje léčbu antikoagulační, cíleně inhibující plazmatickou hemokoagulační kaskádu, a to na její různé úrovni (schéma 3). V klinické praxi dnes používaná antikoagulancia v prevenci a terapii ischemického iktu jsou kumarinové deriváty (warfarin) a hepariny. Patří mezi nepřímé inhibitory hemokoagulace, potlačují srážení krve prostřednictvím různých kofaktorů.

Warfarin je kumarinový derivát, působí jako antagonista syntézy vitamin K dependentních koagulačních faktorů v játrech – faktoru VII, IX, X a protrombinu [2]. Klíčovou roli v syntéze těchto faktorů má vitamin K. Ten je ve své redukované formě důležitým katalyzátorem karboxylace výše zmíněných koagulačních faktorů, čímž umožňuje jejich transformaci z formy inaktivní na formu funkční, schopnou koagulační aktivity. Redukovaný vitamin K je přitom následně konvertován zpět na vitamin K1 pomocí enzymu epoxid reduktázy. Antikoagulační efekt warfarinu spočívá v inhibici tohoto enzymu, čímž je znemožněna recyklace vitaminu K, jehož následný deficit vede k jaterní produkci koagulačních faktorů s redukovanou koagulační aktivitou. Intenzita antikoagulační terapie warfarinem se hodnotí pomocí tromboplastinového testu vyjádřeného formou INR (International normalization ratio), obvyklá terapeutická hodnota je 2,0–3,0. Pro závažné riziko hemoragických komplikací léčba vždy vyžaduje přísné monitorování [3]. Antidotem warfarinu je vitamin K, dávka vyšší než 10 mg může však vyvolat dočasnou rezistenci na warfarin [4]!
Hepariny tvoří další široce užívanou skupinu nepřímých inhibitorů hemokoagulace. Jejich antikoagulační efekt spočívá v mohutném potencování antitrombinu III, a to až tisíceronásobně. Důsledkem je nejen vyvázání trombinu z koagulačního děje (zamezení konveze protrombinu na trombin), ale i výrazné omezení aktivace trombocytárního systému. Vedle nefrakciovaného heparinu (unfractionated heparin, UFH) jde především o skupinu nízkomolekulárních heparinů (low molecular weight heparin, LMWH): enoxaparin, nadroparin, dalteparin, parnaparin, reviparin, tinzaparin. V neurologii se nejčastěji používají první tři z výše jmenovaných. Tyto preparáty mají odlišnou farmakokinetiku (liší se různým poměrem účinku na plazmatický faktor X a trombin), a neměly by se proto vzájemně zaměňovat. LMWH se považují za bezpečnější a o něco účinnější než nefrakciovaný heparin, mají rovněž menší riziko vzniku heparinem indukované trombocytopenie II typu (HIT), imunitní reakce provázené tvorbou trombů v arteriálním i venózním řečišti (porucha se vyskytuje u 1–3 % pacientů léčených UFH a u necelých 0,8 % osob léčených LMWH). Nízkomolekulární heparin 2. generace – bemiparin – vysoce selektivně inhibuje aktivovaný plazmatický faktor X, v porovnání s nízkou inhibicí trombinu. Novými přípravky této skupiny jsou injekční syntetické sacharidy, které selektivně inhibují pouze samotný aktivovaný plazmatický faktor X: pentasacharid fondaparin a oligosacharid idraparin. Možno říci, že čím cílenější je inhibiční efekt, tím má daný preparát větší bezpečnostní profil. Idraparin, díky dlouhému poločasu, je možno podávat v týdenních intervalech, což je jistě výhodné, vyšší dávky jsou však provázeny vysokým rizikem hemoragických komplikací, jak prokázala studie AMADEUS u pacientů s fibrilací síní [5]. Studie BOREALIS, která rovněž testovala indraparin v prevenci iktu u pacientů s fibrilací síní, byla zcela nedávno pozastavena. Nevýhodou všech heparinů je nutnost jejich parenterální aplikace. Hemoragické komplikace při léčbě hepariny jsou méně časté než u warfarinu. Monitorování léčby UFH se provádí pomocí aktivovaného parciálního tromboplastinového testu (APTT), obvyklá terapeutická hodnota je 1,5–2,5krát vyšší než čas kontrolního vzorku krve. Monitorování léčby LMWH se provádí hodnocením aktivity anti-Xa, obvyklé rozmezí preventivních dávek je 0,2–0,4 anti-Xa j/ml, terapeutických dávek 0,3–0,7 anti-Xa j/ml. Až na výjimečné případy (děti, příliš štíhlí a nadmíru obézní jedinci, nemocní s renální insuficiencí, gravidní ženy) podávání LMWH v preventivních dávkách monitoring nevyžaduje [3]. Antidotem UFH je protamin sulfát, LMWH specifické antidotum nemají.
Příbuzná antikoagulancia – heparinoidy – mají v porovnání s UFH nižší antikoagulační aktivitu a vyšší toxicitu. Používají se proto převážně jen lokálně.
Dlouhodobá preventivní antikoagulační léčba ischemického iktu
V dlouhodobé preventivní antikoakulační terapii ischemického iktu je i dnes stále lékem volby warfarin. Je velmi účinný, zároveň však může být příčinou velmi závažných komplikací. Proto před zahájením warfarinizace musí být vždy pečlivě posouzeno, zda je tato léčba oprávněně indikována a jaká jsou rizika této terapie.
A. Indikace léčby warfarinem
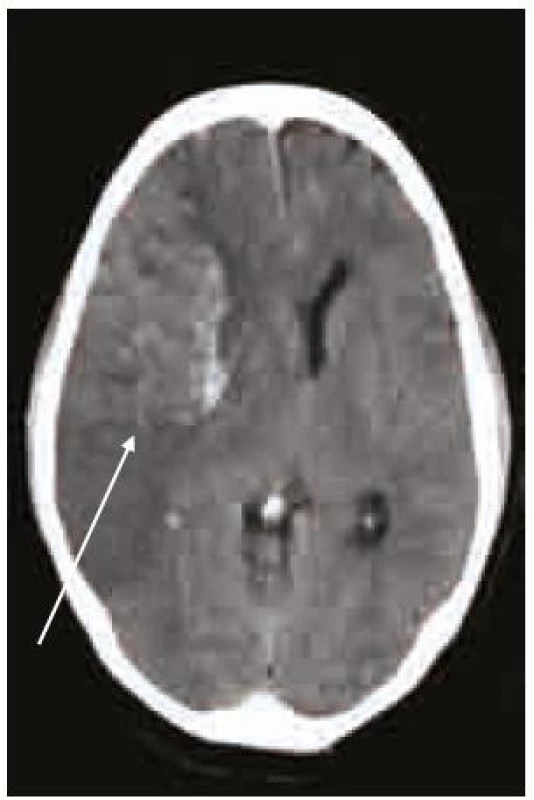
Léčba warfarinem je terapie výběrová, proto je nezbytné přísně respektovat její indikace [5–7]. Je vysoce účinná především v těch případech, kde je zvýšená intrakardiální a intravaskulární prokoagulační aktivita provázena tvorbou trombů s vysokým embolizačním potenciálem a významným rizikem kardioembolických cévních mozkových příhod. Ty tvoří 20–25 % všech ischemických iktů, jejich výskyt se po 80 letech věku zvyšuje až na 36 %. Jde většinou o klinicky závažné příhody (obr. 1). Indikací k léčbě warfarinem jsou tedy především ty klinické jednotky, které jsou nejčastějším zdrojem závažné embolizace.
Nerevmatická fibrilace síní (FS)
Jde o zdaleka nejčastější příčinu kardioembolizace. Podkladem je disociovaná elektrická aktivita v srdečních síních se ztrátou mechanické kontrakce. Jde o časté věkově vázané onemocnění přítomné u 0,5–1 % dospělé populace. V 9. deceniu však již u každého desátého jedince, počet nemocných stále pozvolně narůstá. FS zvyšuje riziko cévní mozkové příhody pětinásobně a zdvojnásobuje riziko úmrtí [8]. Průměrné roční riziko embolizace u neléčených osob je 5 %, v 90 % jde o embolizaci do mozku. Léčba FS sleduje tři cíle:
- a) normalizaci srdeční frekvence,
- b) verzi fibrilace na sinusový rytmus a jeho stabilizaci,
- c) prevenci tromboembolických komplikací.
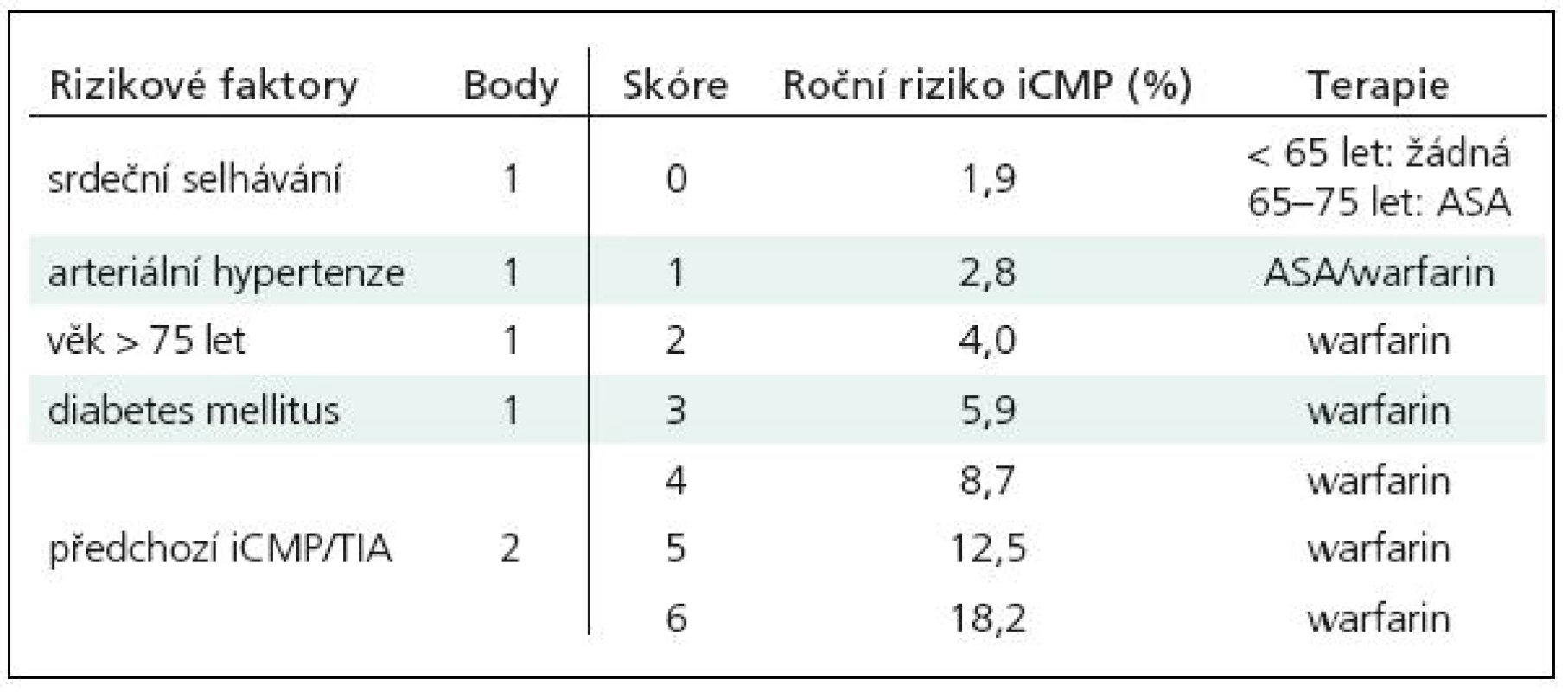
Léčba warfarinem je vysoce účinná jak v primární, tak i v sekundární prevenci kardioembolizmu. Podle preventivních studií snižuje relativní riziko iktu o 68 % (BAATAF, Boston Area Anticoagulation Trial for Atrial Fibrillation, CAFA, Canadian Atrial Fibrillation Anticoagulation; SPAF I–III, Stroke Prevention in Atrial Fibrillation; AFASAK, Atrial Fibrillation, Aspirin, Anticoagulation; SPINAF, Stroke Prevention in Nonvalvular Atrial Fibrillation) [9]. Podle současných doporučení ESO (European Stroke Organisation) z roku 2008 je u nemocných s fibrilací síní, včetně paroxysmální fibrilace síní, indikována antikoagulační léčba warfarinem s cílovou hodnotou INR 2,0–3,0 vždy po proběhlé embolizační cévní mozkové příhodě nebo tranzitorní ischemické příhodě (TIA, transient ischemic attack), rovněž tak, je-li fibrilace síní provázena závažnými vaskulárními rizikovými faktory [6]. Z praktického hlediska je pro jejich posouzení výhodné používat skóre CHADS2 (tab. 1). Nejzávažnější rizikové faktory – významná dysfunkce levé srdeční komory/srdeční selhávání, arteriální hypertenze, diabetes mellitus a věk nad 75 let, jsou ohodnoceny jedním bodem, ischemický iktus nebo TIA v anamnéze body dvěma. Součet bodů udává riziko embolizace: 0–1 nízké, 2 středně závažné, 3 a více významné. Skóre 0 terapii nevyžaduje, pokud jde o osoby mladší 65 let, u osob ve věkovém rozmezí 65–75 let je doporučována léčba kyselinou acetylsalicylovou (ASA), při skóre 1 je možná volba mezi léčbou ASA a warfarinem, antikoagulační terapie je však většinou preferována, při skóre 2 a vyšším je již léčba warfarinem indikována jednoznačně. Tento postup je ve shodě s mezinárodně uznávaným standardem ACCP (American College of Chest Physicians) z roku 2008, z kterého ve svých doporučeních vychází i Česká společnost pro trombózu a hemostázu [7,10].
Ostatní příčiny kardioembolizace
Fibrilace síní je zodpovědná za 50 % kardioembolických iktů. Existují tedy i jiné klinické jednotky, které mají vysoký kardioembolický potenciál. Ty jsou lépe specifikovány v doporučeních kardiologických společností než v doporučeních společností neurologických. Jde především o stavy po infarktu myokardu za přítomnosti perzistentní fibrilace síní, trombu v levé srdeční komoře, aneuryzmatu nebo závažné poruchy mobility stěny levé srdeční komory (ejekční frakce méně 25 %). V těchto případech je doporučena intenzivnější kombinovaná terapie warfarinem s ASA po dobu tří měsíců. Další indikací mohou být mechanické a biologické náhrady srdečních chlopní, porevmatická mitrální stenóza, dilatační kardiomyopatie, intraventrikulární trombus, zvláště v kombinaci s aneuryzmatem srdeční stěny, myxom levé síně a přítomnost mobilních trombů v ascendentní aortě. V případě mechanických chlopní je doporučována dávka warfarinu odpovídající rozmezí INR 2,5–3,5, u ostatních indikací je cílová hodnota INR v obvyklém rozmezí 2,0–3,0 [6]. Pokud jsou u těchto klinických jednotek současně přítomny i další rizikové faktory tromboembolizmu – fibrilace síní, hyperkoagulační stav, nízká srdeční ejekční frakce, je vhodné k léčbě warfarinem přidat ještě ASA v dávce 50–100 mg denně [7]. Je-li prokázáno foramen ovale patens v kombinaci s aneuryzmatem srdečního septa nebo hlubokou žilní trombózou a zvláště, předcházejí-li recidivující kryptogenní ikty a je-li přítomen pravolevý zkrat, je možno antikoagulační léčbu zvážit jako alternativu k chirurgickému řešení s použitím okludérů [11]. Indikaci antikoagulační léčby v těchto případech je rozumné konzultovat s kardiologem.
Jiné klinické jednotky
Důvodem dlouhodobé preventivní antikoagulační terapie mohou být vzácně i některé jiné klinické jednotky. Na základě praxe připouští doporučení ESO dlouhodobou warfarinizaci i po iktu, jehož příčinou je fuziformní aneuryzma bazilární arterie [6]. Jiným důvodem mohou být trombofilní stavy. Jde o vrozené nebo získané poruchy hemostázy, patofyziologicky asociované se zvýšeným rizikem trombózy [12]. Trombofilní stavy jsou většinou příčinou žilní trombózy, u některých z nich je však i vysoké riziko trombózy tepenné. V praxi jde nejčastěji o antifosfolipidový syndrom, hyperhomocysteinemii, vysokou hladinu faktoru VIII, „sticky platelet syndrom“, hyperfibrinogenemii, deficit inhibitorů koagulace (proteinu C, proteinu S, antitrombinu III) a některá myeloproliferativní onemocnění. Indikaci antikoagulační léčby v těchto případech musí posoudit hematolog [13].
B. Rizika léčby warfarinem
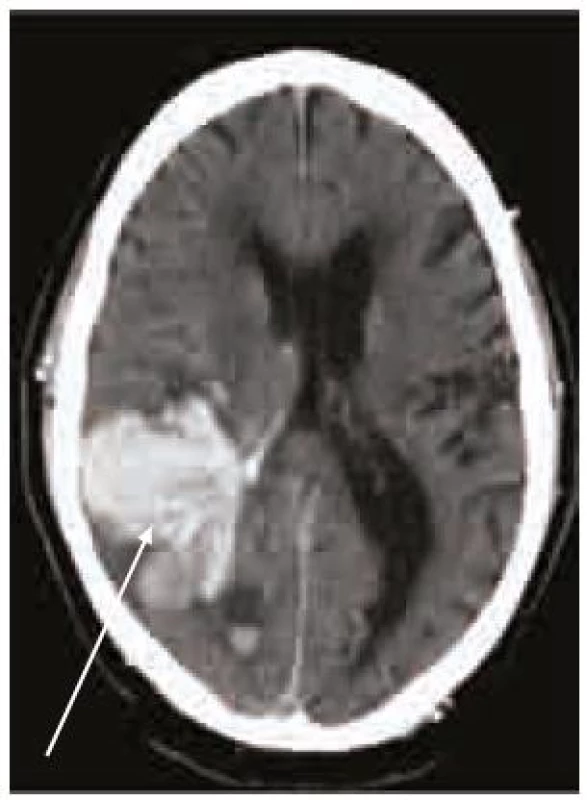
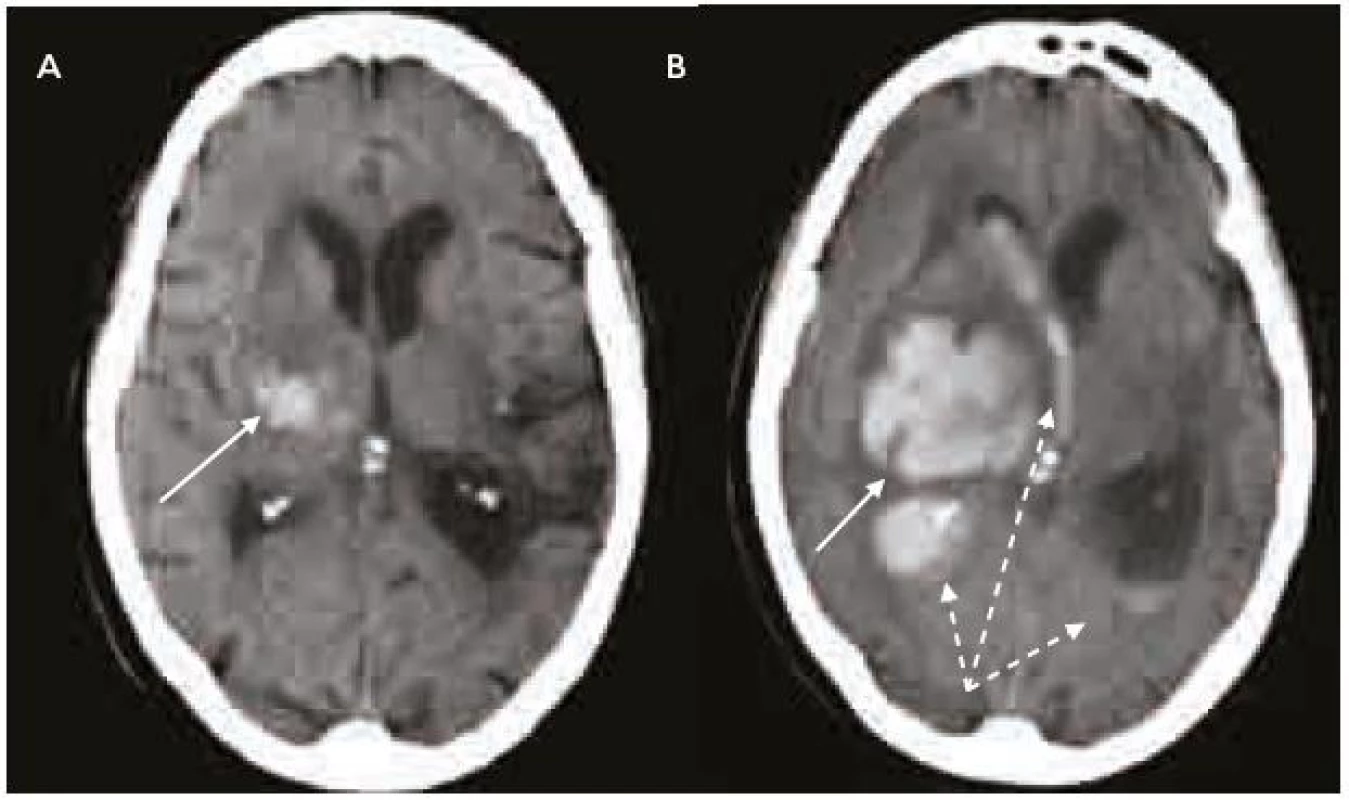
Splnění indikačních kritérií ještě k zahájení terapie warfarinem nestačí. Vždy je nutno pečlivě zvážit i rizika této léčby, která nejsou rozhodně zanedbatelná. Vedle vzácnější alopecie, gastrointestinálních potíží, osteoporózy, alergických reakcí a kožní nekrózy je potenciální hrozbou především krvácení, včetně nejobávanějšího krvácení intracerebrálního, které pro svou závažnost patří do kategorie život ohrožujících krvácení (obr. 2–4). Léčba warfarinem zvyšuje riziko intracerebrálního krvácení až desateronásobně, podle různých studií je v souvislosti s warfarinizací 15–20 % hemoragických iktů. Roční riziko hemoragických komplikací léčby warfarinem je 2 %, intracerebrálního krvácení 0,5 %, u starších pacientů narůstá až na 1,7 % [14]. V důsledku navozené perzistentní koagulopatie je krvácení často progredující, vícečetné a recidivující, především v prvních hodinách hemoragické příhody, což je provázeno postupným zvětšováním hematomu a časnou deteriorací klinického stavu (obr. 5) [15,16]. Není proto překvapující, že u tohoto typu krvácení je 30denní mortalita vyšší než 50 % [17].
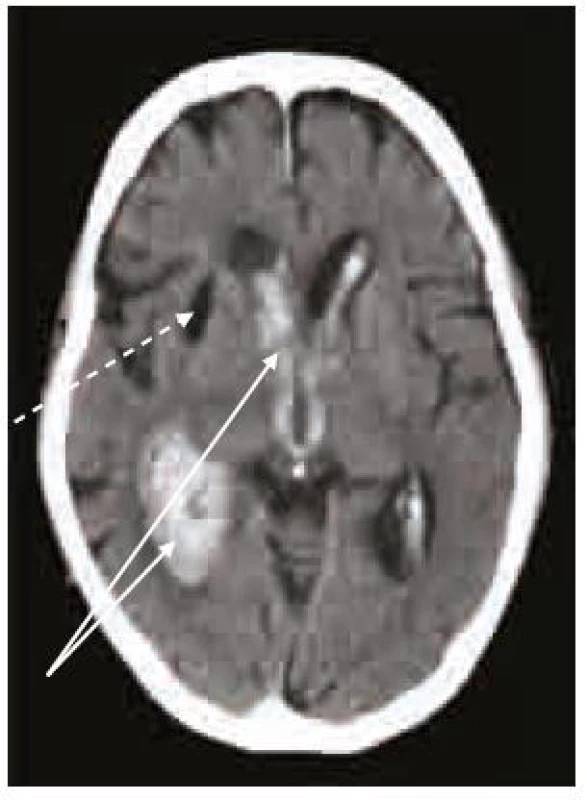
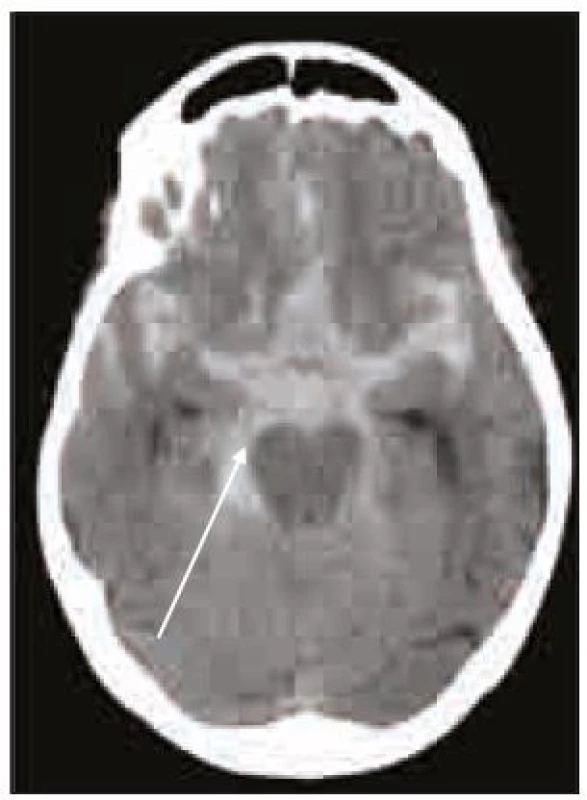
Příčinou hemoragických komplikací léčby warfarinem může být jeho předávkování, zvýšená citlivost pacienta k této léčbě nebo interakce warfarinu s jinou terapií.
Předávkováním warfarinu s hodnotami INR v rozmezí 3,0–4,0 se riziko závažného krvácení zdvojnásobuje, při hodnotách nad 4,0 již dramaticky narůstá, především pokud jde o krvácení intracerebrální. Nicméně i hodnoty INR v doporučovaném terapeutickém rozmezí nevylučují krvácivé komplikace, ty se mohou dokonce vyskytnout i při normálních hodnotách srážení krve, které tak nevylučují závažnou klinickou poruchu hemostázy [2]. V prevenci hemoragických komplikací je důležité nejen správné nastavení a dodržování optimální dávky warfarinu, ale i normalizace krevního tlaku [18]!
Kolísání hodnot INR v průběhu léčby je rovněž rizikem krvácení, především v úvodní fázi warfarinizace. Riziko krvácení je desateronásobně vyšší v prvním měsíci a trojnásobně vyšší v prvních třech měsících léčby v porovnání s rizikem po jednom roce warfarinizace. Příčinou předávkování nebo nestability léčby může být i horečka, průjem, nebo alkoholový exces. Vyráběné preparáty warfarinu jsou směsí dvou rozdílných složek S a R. S forma warfarinu je asi čtyřikrát antikoagulačně účinnější než forma R. Z těchto důvodů může docházet ke kolísání účinku warfarinu i při přechodu na jinou šarži produktu s jiným poměrem obou složek. Optimální terapeutické rozmezí není trvale udržováno až u 50 % léčených osob [19]. Pečlivé monitorování léčby je proto příkazem!
Zvýšené riziko krvácení může být i důsledkem geneticky podmíněné rozdílné individuální citlivosti k léčbě warfarinem [20]. Mutace genu VKORC1, C1 subjednotky cílového enzymu metabolického cyklu vitaminu K epoxid reduktázy, a mutace genu cytochromu P450 2C9, řídící biotransformaci warfarinu, způsobují zvýšenou reaktivitu na léčbu warfarinem, a zvyšují tak riziko hemoragických komplikací. Oba typy mutace se mohou vzájemně kombinovat. Funkce cytochromu P 450 může být souběžně ovlivněna působením některých léků. Genetické testy prokazují výskyt těchto mutací až u 40 % kavkazské populace. Pro snížení rizika hemoragických komplikací je v těchto případech nezbytné pečlivé monitorování hodnot INR v úvodu warfarinizace a zavedení genetických testů do běžné klinické praxe. Některé léky potencují účinek warfarinu, a mohou tak rovněž zvyšovat riziko hemoragických komplikací (viz dále).
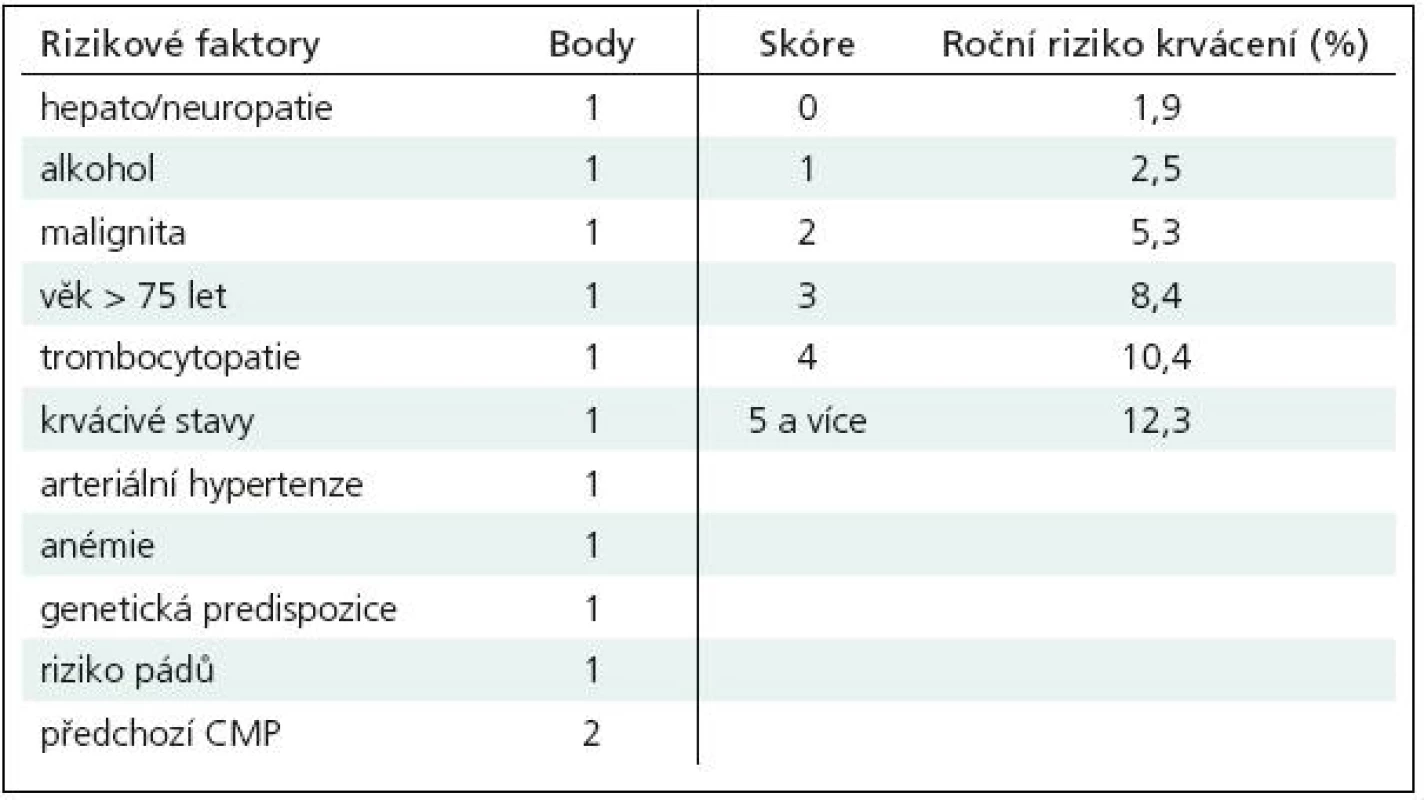
Riziko krvácení dnes nejčastěji hodnotíme podle skóre HEMORR2HAGES, které zahrnuje ve 12bodové stupnici nejzávažnější rizikové faktory této komplikace (tab. 2). Skóre vyšší než 3 představuje již riziko vysoké [21]. Vzájemné porovnání skóre CHADS2 a skóre HEMORR2HAGES zhodnotí přesněji poměr rizika embolizace a hemoragických komplikací, očekávaný benefit antikoagulační terapie musí převyšovat riziko krvácení.
V případě, že antikoagulační léčba nemůže být podána, je doporučena bezpečnější léčba antiagregační. Účinnost ASA je však asi o 2/3 nižší. Dnes se upřednostňuje kombinovaná terapie ASA s pomalu uvolňovaným dipyridamolem [6]. Tento postup je vhodný i při špatné compliance pacienta, pokud není jistota, že nemocný bude brát pravidelně medikaci a bude plně spolupracovat s ošetřujícím lékařem. Stejně postupujeme i v případě zvýšeného rizika pádů. Léčba warfarinem je po léčbě inzulinem druhou nejčastější příčinou emergentního příjmu nemocného z důvodu iatrogenního postižení.
C. Dávkování warfarinu a provádění léčby
Léčba warfarinem se obvykle zahajuje dávkou 5 mg denně, u osob starších 75 let je vhodnější dávka 3 mg denně, léčebný efekt lze očekávat s odstupem čtyř nebo více dní [4]. Zahájení léčby vyššími dávkami pro dosažení rychlejšího účinku vede snadněji k předávkování se zvýšeným rizikem hemoragických komplikací. Nevýhodou terapie warfarinem je jeho relativně pomalý nástup účinku, úzké terapeutické rozmezí a časté kolísání jeho hladiny v krvi. Monitorování hodnot INR se proto provádí v prvních dnech denně, po dosažení terapeutického rozmezí 2–3krát týdně po dobu 14 dní, později, při stabilizaci hodnot, v měsíčních intervalech. Vykompenzování optimální denní dávky může však trvat i několik týdnů [3]. Vhodné terapeutické rozmezí warfarinizace u většiny indikací odpovídá hodnotám protrombinového času 2,0–3,0 INR. U starších osob s vyšším rizikem krvácivých komplikací je doporučována dolní hranice tohoto rozmezí, naopak u pacientů s mechanickými chlopenními náhradami a u některých hyperkoagulačních stavů (deficit inhibitorů koagulace) s anamnézou mozkové ischemie je doporučováno rozmezí protrombinového času lehce vyšší, 2,5–3,5 INR. Neosvědčila se tzv. miniwarfarinizace s hodnotami protrombinového času 1,5–1,9 INR. Riziko kardioembolického iktu je při hodnotách INR 1,7 dvojnásobné a při hodnotách 1,5 dokonce trojnásobné v porovnání s hodnotou INR 2,0 [22]. Miniwarfarinizace je méně účinná i v případě její kombinace s terapií antiagregační a navíc tato kombinace nevede ke snížení rizika hemoragických komplikací. V případě velmi vysokého rizika kardioembolizmu je možno zahájit warfarinizaci současně s podáním UFH nebo LMWH v preventivních nebo léčebných dávkách pro zajištění období, než warfarin bude dostatečně účinný. Léčba hepariny se ukončí, jakmile hodnoty INR 2krát po sobě budou v očekávaném terapeutickém rozmezí (přemosťující terapie) [23]. Vzhledem k dlouhodobému biologickému poločasu warfarinu je možné pro optimální kompenzaci podávat obden různě velkou dávku, rozdíl by však neměl být větší než polovina jedné tablety. Někteří nemocní mohou být k léčbě warfarinem rezistentní a k dosažení terapeutického rozmezí je nutno podat dávky i několikanásobně vyšší, než je obvyklé [4].
Před zahájením léčby je nutno pacienta poučit o dietetických opatřeních. Zeleninová strava bohatá na vitamin K (špenát, kapusta, kysané zelí, petrželová nať, pažitka, kopr, méně i jiné druhy zeleniny, též bylinné čaje, olivový a slunečnicový olej) může inhibovat efekt warfarinu a zvyšovat riziko tromboembolizmu. Úplné vynechání zeleniny se však nedoporučuje pro nebezpečí hypovitaminózy K, příjem zeleniny má však být v jídelníčku vyrovnaný, denní dávka vitaminu K při léčbě warfarinem by neměla překročit 250 μg [24].
Provádění warfarinizace ve specializovaných centrech (antikoagulační kliniky) zaručuje její větší bezpečnost s redukcí počtu hemoragických komplikací zhruba o polovinu. Využívá se zde principu point-of-care, pomocí příručního přístroje (např. Coagu Check S) si pacient sám průběžně stanovuje hodnotu INR a výsledek konzultuje se svým lékařem (self-testing) nebo si dávku i sám upravuje (self-management). Léčba warfarinem vyžaduje v každém případě velmi dobrou spolupráci pacienta [2].
D. Specifické situace při terapii warfarinem
Při léčbě warfarinem mohou nastat situace, které vyžadují okamžitou reakci a úpravu léčby. V praxi se nejčastěji setkáváme s následujícími stavy: předávkování warfarinu, změna medikace, výskyt ischemického nebo hemoragického iktu, nutnost operačního zákroku, těhotenství a laktace.
Předávkování warfarinu může nastat z mnoha důvodů, jak již bylo uvedeno. V terapii této komplikace se řídíme hodnotami INR a stupněm rizika krvácení. Při lehce zvýšených hodnotách INR je obvykle postačující snížení dávky warfarinu nebo velmi krátkodobé přerušení léčby, při vysokých hodnotách INR je nutno navíc jednorázově podat vitamin K [2]. Doporučený postup je uveden v tab. 3.
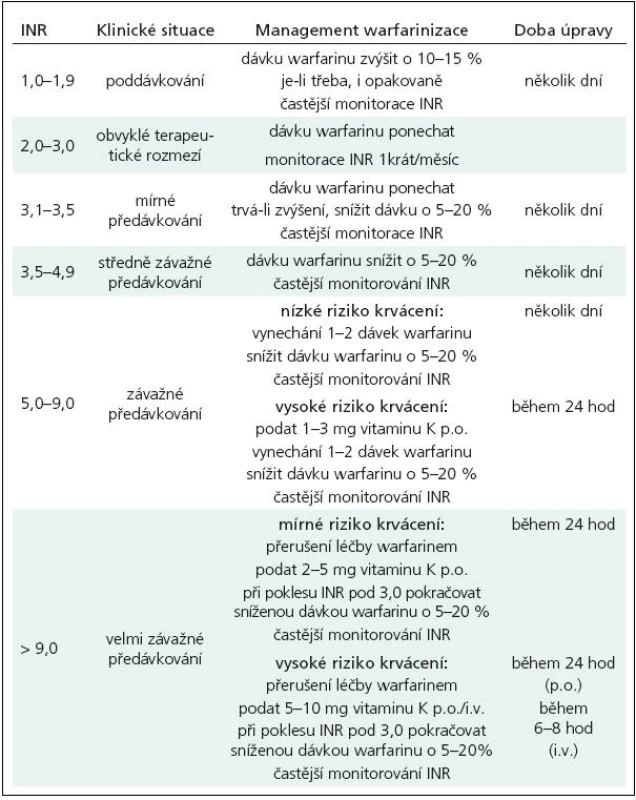
Změna medikace u warfarinizovaného pacienta může nepříjemně zkomplikovat průběh léčby v důsledku lékové interakce. Salicyláty, nesteroidní antirevmatika, některá antibiotika (cefalosporiny, penicilin, erytromycin, tetracykliny), sulfonamidy, perorální antidiabetika, amiodaron, cimetidin, acetaminofen, anabolické steroidy, chinidin, ale i ginkgo biloba a některé další léky potencují antikoagulační efekt warfarinu a zvyšují riziko závažných hemoragických komplikací. V případě nezbytnosti podání těchto léků se doporučuje přechodné snížení denní dávky warfarinu o 30 % za současného monitorování hodnot INR 2–3krát týdně. Barbituráty, karbamazepin, fenytoin, orální kontraceptiva, kortikosteroidy, antihistaminika, diuretika, sukralfát a některé další medikamenty naopak efekt warfarinu inhibují a zvyšují riziko kardioembolického iktu. Jejich nasazení vyžaduje zintenzivnění kontrol INR, alespoň 1krát týdně. Každého polymorbidního pacienta s bohatou terapií je nutno považovat za rizikového z hlediska možných lékových interakcí s warfarinem.
Kardioembolický iktus u warfarinizovaného pacienta může být důvod poddávkování léčby, potom je nutno zvýšit dávku warfarinu, nebo embolizace vznikne přesto, že hodnoty INR jsou v doporučeném terapeutickém rozmezí. V těchto případech se s určitými rozpaky většinou doporučuje zvýšit dávku warfarinu odpovídající cílovému rozmezí INR 3,0–3,5 než kombinovat léčbu s ASA. V obou případech se však zvyšuje riziko hemoragických komplikací. Antikoagulační léčba je kontraindikací trombolytické terapie, pokud hodnoty INR jsou vyšší než 1,7 [25].
Intracerebrální krvácení u warfarinizovaného pacienta je zpravidla velmi závažný stav, který vyžaduje okamžité přerušení léčby a v případě hodnot INR nad referenčním rozmezím podat pomalou infuzi 10 mg vitaminu K a současně zajistit substituci plazmatických koagulačních faktorů podáním čerstvě mražené plazmy v dávce 10–15 ml/kg nebo lépe koncentrátu koagulačních faktorů (Protromplex Total TIM 4) v dávce 25–50 IU/kg podle hodnoty INR. V závažných případech lze též podat rekombinantní plazmatický faktor VIIa (NovoSeven) v dávce 90 µg/kg [2,26–30]. V léčbě warfarinem je možné zpravidla pokračovat po 7–10 dnech, v případě vysokého rizika embolizace se dá toto období překrýt podáním LMWH v preventivní nebo nižší terapeutické dávce s odstupem 2–4 dní po krvácení [23,31–33]. Stejně se postupuje v případě závažného, eventuálně život ohrožujícího krvácení v jiných lokalizacích. V současnosti však stále chybí jednoznačné doporučení, jak dále dlouhodobě postupovat u pacienta s FS, který prodělal hemoragickou komplikaci. I když se uvádí, že takový pacient je v budoucnu více ohrožen tromboembolickou příhodou než recidivou krvácení, v praxi se většinou od pokračování v antikoagulační léčbě upouští [34].
Operační výkony a invazivní intervence u warfarinizovaného pacienta jsou spojeny jak s rizikem většího krvácení při vlastním zákroku, tak se vznikem tromboembolických komplikací v souvislosti s přerušením antikoagulační terapie. Proto tyto výkony vyžadují vždy individuální posouzení podle rizika krvácení, velikosti zákroku a jeho urgentnosti [35]. Malý stomatochirurgický, dermatologický nebo oftalmologický výkon (zubní extrakce, kožní excize, operace katarakty), podobně jako méně zatěžující endoskopická intervence, nejsou důvodem k přerušení warfarinizace, pokud hodnoty INR jsou v terapeutickém rozmezí 2–3. Vysazení léčby před plánovanou extrakcí zubu bývá nezřídka příčinou těžkého kardioembolického iktu. Doprovodné krvácení při tomto výkonu je pouze kapilární a pacienta významněji neohrožuje, lokální ošetření rány hemostyptiky je dostatečné (tampon namočený v 10% roztoku kyseliny tranexamové, výplach úst kyselinou ε-aminokapronovou). Větší operační výkon je však již rizikový a přerušení léčby vyžaduje. U plánované operace se warfarin vysazuje pět dní před zákrokem, dva dny po vysazení terapie se zahájí překlenovací léčba LMWH v preventivní nebo terapeutické dávce v závislosti na riziku tromboembolie. Poslední dávka LMWH se podá 12–24 hod před výkonem. Je-li hodnota INR 24 hod před operací 1,5 nebo vyšší, je na místě perorální podání 1–2 mg vitaminu K. Po operačním výkonu lze zahájit léčbu LMWH za 12–24 hod v preventivních nebo terapeutických dávkách spolu s warfarinem v původní dávce. Stejný postup je vhodný i u warfarinizovaného pacienta v případě elektivní karotické endarterektomie nebo perkutánní transluminální angioplastiky a stentingu. Následující měsíc po těchto výkonech se doporučuje přidat k warfarinu clopidogrel v dávce 75 mg denně. Podle doporučení amerických a evropských odborných společností z roku 2006 je vysazení warfarinu u osob s FS po dobu jednoho týdne z důvodu chirurgického zákroku nebo diagnostické intervence spojeno jen s malým rizikem embolizační příhody [36]. Moje osobní zkušenost je jiná a doporučuji toto období překlenout podáním LMWH. V případě urgentní operace postupujeme stejně jako u závažného krvácení (vitamin K, čerstvě mražená plazma, protrombinový koncentrát).
Gravidita je sama o sobě nezávislý rizikový faktor tromboembolie, neboť indikuje stav relativní hyperkoagulability, zvláště u jedinců s vrozeným deficitem přirozených inhibitorů koagulace nebo jiným typem trombofilie. Warfarin má teratogenní efekt, proto v těhotenství je nutno okamžitě tuto medikaci vysadit a léčbu nahradit podáním UFH nebo lépe LMWH, které neprostupují placentární bariérou [7]. Tato strategie je vhodná po celou dobu těhotenství za předpokladu monitorace aktivity anti-Xa [4,7,37]. Je-li důvodem antikoagulační léčby antifosfolipidový syndrom, je výhodné kombinovat profylaktické dávky LMWH s dávkou 100 mg kyseliny acetylsalicylové denně. U gravidních žen s mechanickými chlopenními náhradami nemusí být léčba LMWH dostatečná, proto při vysokém riziku embolizace je možný v druhém trimestru návrat k léčbě warfarinem. Před plánovaným porodem se postupuje stejně jako před plánovanou operací. Vzhledem ke skutečnosti, že warfarin přechází do mateřského mléka jen ve velmi malém množství, není užívání warfarinu v době laktace kontraindikováno [38].
Časná preventivní antikoagulační léčba ischemického iktu
Důvodem preventivní antikoagulační terapie v akutní fázi ischemického iktu, jehož příčina je indikací k této léčbě, je obava z časné recidivy iktu. Velmi závažným rozhodnutím je otázka, kdy tuto léčbu zahájit. Základním lékem časné rychlé antikoagulace jsou hepariny, warfarin je pro pomalý nástup účinku nevhodný. Antikoagulační léčba v akutním stadiu iktu vyvolávala vždy rozpaky. Pamatuji éru, kdy tato terapie byla zcela běžná, pro častá zhoršení klinického stavu a náhlá úmrtí od ní bylo zcela upuštěno. Zavedení CT a později MR do běžné klinické praxe kvalitativně změnilo náš pohled na tuto problematiku a otázkou již není, zda antikoagulační léčbu podávat či nepodávat, ale komu ji podávat. Bohužel ani dnes není tato otázka jednoznačně zodpovězena.
Podle současně platných doporučení ESO nejsou UFH, LMWH ani heparinoidy pro prevenci a léčbu iktu v jeho akutní fázi doporučeny [6,39–42]. Tento názor vychází se závěrů 24 studií a jejich metaanalýzy, které prokázaly, že časná antikoagulační léčba sice snížila riziko recidivy iktu, ale tento benefit byl znehodnocen větším výskytem hemoragických komplikací. Doporučení však není jednotně přijímáno, jeho kritici poukazují na skutečnost, že jednotlivé studie byly značně nejednotné, lišily se typem sledovaných souborů, etiologií ischemie, včetně zařazení pacientů s nekardioembolickými ikty, různou šíří terapeutického okna (24–48 hod), druhem heparinu i kvalitou vyšetření. Za těchto okolností není relativně vysoký výskyt hemoragických komplikací překvapující.
Dnes je obvyklé zahájení preventivní antikoagulační terapie, pokud je indikována, v případě TIA nebo malého iktu a za předpokladu dobře kompenzované arteriální hypertenze co nejdříve (3 dny po iktu), u rozsáhlého iktu nebo špatně kontrolované hypertenze s odstupem 10–14 dnů, po odeznění rizika hemoragické transformace a krvácení do oblasti ischemie [43,44]. Podle názoru některých expertů je v akutní fázi iktu doporučována antikoagulační léčba i v dávkách léčebných (plná heparinizace), pokud je příčina iktu kardioembolická, riziko recidivy vysoké, riziko hemoragických komplikací nízké, nejsou kontraindikace klinické (těžký iktus, nekontrolovatelná arteriální hypertenze, dekompenzovaný diabetes mellitus) ani radiologické (rozsáhlejší ischemie, významná leukoaraióza) [6]. Nicméně platí základní pravidlo, že antikoagulační léčbu nelze v žádném případě považovat za rutinní léčbu akutního stadia ischemických iktů, ale pouze za léčbu vysoce výběrovou. Pozornost se nyní soustřeďuje na velmi časné podání heparinů. Ve studii RAPID (Rapid Anticoagulation Prevents Ischemic Damage) zahájení plné heparinizace do tří hod po začátku iktu snížilo počet recidiv a nezvýšilo počet hemoragických komplikací u pacientů s nelakunárními ikty v porovnání s léčbou ASA [45].
Časná preventivní antikoagulační léčba žilního tromboembolizmu
Zatímco preventivní antikoagulační léčba kardioembolizace v akutní fázi iktu vyvolává rozpaky, preventivní léčba žilního tromboembolizmu je u rizikových pacientů plně akceptována (doporučení ESO, CHEST) [6,7,46–48]. Tromboembolická nemoc (TEN) je příčinou 12 % všech úmrtí, je jednou z nejzávažnějších komplikací akutního stadia iktu. Riziko vzniku hluboké žilní trombózy (HŽT) je u ischemického iktu 68 %, u hemoragického iktu dokonce 76 %. Průběh je většinou asymptomatický, i tito nemocní jsou však ohroženi plicní embolizací. V nejvyšším riziku jsou imobilní obézní nemocní vyššího věku. Je-li současně přítomno srdeční nebo respirační selhávání, akutní infekce, hyperkoagulační stav, dehydratace, žilní insuficience nebo HŽT v anamnéze, diabetes mellitus, nefrotický syndrom, myeloproliferativní syndrom nebo malignita, riziko vzniku hluboké žilní trombózy se ještě významně zvyšuje a pravděpodobnost rozvoje následných komplikací (plicní embolie) je značná [49,50]. Preventivní opatření spočívají ve fyzikálních metodách (časná rehabilitace, elastické antitrombotické punčochy, intermitentní pneumatická komprese) a léčbě antikoagulační. Antikoagulační terapie snižuje relativní riziko vzniku HŽT o 64–79 % a výskyt plicní embolie o téměř 40 %. LMWH v preventivní dávce jsou pro větší účinnost, lepší toleranci a menší riziko komplikací vhodnější než UFH (5–15 000 j. denně), jehož rizikem je především možnost vzniku heparin indukované trombocytopenie, obvykle kolem desátého dne léčby [48]. UFH je vhodnější jen v případě významnější renální insuficience. Při vysokém riziku tromboembolie (u většiny nemocných s iktem) je obvyklá doporučovaná denní dávka nadroparinu 0,4 ml, enoxaparinu 40 mg a dalteparinu 5 000 anti-Xa j., což odpovídá plazmatické aktivitě anti-Xa 0,4 j./ml (odběr krve provést 3–5 hod po subkutánním podání LMWH). Účinnost těchto léků je podmíněna dostatečnou hladinou antitrombinu III. U nemocných s HIT v anamnéze nebo u vysoce rizikových pacientů je vhodný fondaparin v dávce 2,5 mg denně. Je-li antikoagulační léčba kontraindikována (akutní krvácivý stav, nekontrolovatelná arteriální hypertenze), doporučuje se použití samotných fyzikálních metod. Tento postup je vhodný i v prvních dvou dnech u nemocných s hemoragickým iktem, od třetího dne lze již podat antikoagulancia v preventivní dávce. V neurologii není vzácná situace, kdy u pacienta, který je léčen LMWH, je nutno provést lumbální punkci. Pro snížení rizika epidurálního krvácení je vhodné realizovat tento výkon s odstupem 12–24 hod (podle intenzity léčby) od poslední aplikace LMWH. Antikoagulační léčbu je možno opět nasadit 2–4 hod po punkci. V případě vysokého rizika žilního tromboembolizmu a současné kontraindikaci antikoagulační terapie, jejím selhání nebo vzniku komplikací při této léčbě je indikováno zavedení dočasných kaválních filtrů [51]. Adekvátní preventivní léčba TEN u hospitalizovaných pacientů s ischemickým iktem je obecně podhodnocena a je poskytována méně než 45 % nemocných (ENDORSE Global Survey) [18]. V současnosti probíhají studie s novými perorálními antikoagulačními přípravky v prevenci žilního tromboembolizmu u akutních onemocnění interního charakteru s omezením mobility (studie MAGELLAN s rivaroxabanem a studie RE-MEDY a RE-SONATE s dabigatranem).
Antikoagulační léčba akutního stadia ischemického iktu
Antikoagulační léčba v akutní fázi iktu nemusí být podávána pouze z preventivních důvodů, ale ve specifických případech též jako součást léčby již manifestní cévní mozkové příhody. Nejčastěji půjde o arteriální disekci nebo o trombózu intrakraniálních žilních splavů. V těchto případech antikoagulační léčba zabraňuje nárůstu trombu, embolizaci a progresi mozkové ischemie [40]. Disekce extrakraniálního úseku přívodných mozkových tepen (karotické tepny, vertebrální tepny) je indikací pro okamžité zahájení antikoagulační terapie, nejprve hepariny v plné terapeutické dávce, později warfarinem (INR 2,0–3,0), který se podává po dobu 6–24 měsíců, podle výsledku kontrolní angiografie. Ve vhodných případech lze disekci tepny řešit i endovaskulární intervencí se zavedením stentu, výjimečně i operačně [52]. Trombóza intrakraniálních žilních splavů, kauzálně často v souvislosti s trombofilií, má obdobný terapeutický protokol s trváním léčby obvykle šest měsíců. Antikoagulační léčba je zde indikována i v případě již vyvinutého hemoragického iktu.
Nemocný s progredujícím iktem, pokud zhoršení není způsobeno extracerebrálními faktory nebo hemoragickou transformací mozkové ischemie, ale nárůstem trombu, by mohl též profitovat z antikoagulační terapie, chybí však vědecké ověření této hypotézy.
Nové trendy v antikoagulační terapii
Hlavním záměrem antikoagulační léčby je co nejrychlejší dosažení stabilní účinné léčebné dávky, udržení této dávky v terapeutických mezích a vyloučení významnějšího předávkování.
Léčba warfarinem, který je po dobu posledních 60 let stále jediným perorálním antikoagulačním lékem, není z tohoto pohledu ideální. Neznalost správných indikací, nutnost monitorování léčby, riziko hemoragických komplikací, špatná compliace a nedokonalá organizace léčebné péče jsou hlavní důvody, proč je léčba warfarinem stále trvale podhodnocena, léčeno je pouze 15–44 % vhodných pacientů [53]. Proto se intenzivně hledají nová antikoagulancia, která by byla dostatečně účinná, relativně bezpečná a léčba jimi snadno proveditelná. Příslibem jsou přímé inhibitory koagulace [54,55]. Probíhají studie s rekombinantním inhibitorem tkáňového faktoru a se syntetickým inhibitorem aktivovaného faktoru IX. Největší pozornost je však dnes soustředěna na perorální antikoagulancia ze skupiny xabanů (rivaroxaban, apixaban, edoxaban, betrixaban, otamixaban), jež přímo inhibují plazmatický faktor Xa, a dále antikoagulancia ze skupiny gatranů (dabigatran), která jsou spolu s rekombinantním hirudinem a argatrobanem přímými inhibitory trombinu (ximelagatran byl pro hepatotoxicitu z klinické praxe vyloučen) (schéma 3). Použití rivaroxabanu a dabigatranu je již u nás schváleno v indikaci prevence žilního tromboembolizmu u dospělých pacientů po elektivní operativní náhradě kyčelního nebo kolenního kloubu, a to na základě studií RECORD 1, 2, 3, 4 s rivaroxabanem a RE-MODEL, RE-NOVATE, RE-MOBILIZE s dabigatranem [56–61]. Tyto studie prokázaly, že oba léky mají ve výše uvedených indikacích v porovnání s enoxaparinem stejnou nebo i vyšší účinnost a nezvyšují počet hemoragických komplikací. Oba přípravky se od sebe liší svými farmakologickými vlastnostmi a s tím souvisí i rozdíly v dávkování, zejména u starších pacientů, nemocných s renální nebo hepatální insuficiencí, či při současném podávání jiných léků.
V roce 2009 byly prezentovány výsledky studie RE-LY, která porovnávala účinnost a bezpečnost dabigatranu v dávce 110 mg a 150 mg podávaných 2krát denně s adjustovanou dávkou warfarinu s cílovou hodnotou INR 2,0–3,0 u nemocných s fibrilací síní a vysokým rizikem kardioembolizmu [62]. Jde o první dokončenou studii v této problematice, kde na souboru 18 113 pacientů bylo prokázáno, že dabigatran v dávce 110 mg má v porovnání s warfarinem srovnatelnou účinnost a signifikantně nižší počet hemoragických komplikací, v dávce 150 mg je signifikantně účinnější v redukci systémové embolizace a počet hemoragických komplikací není v porovnání s warfarinem vyšší. Výskyt intracerebrálního krvácení byl v obou dávkovacích schématech signifikantně nižší (3krát). Dvojí síla dávkování umožňuje volbu vhodné dávky v závislosti na poměru rizika embolizace a krvácení. S napětím jsou očekávány výsledky dalších studií hodnotících účinnost a bezpečnost nových antikoagulancií v prevenci kardioembolizmu u rizikových nemocných s fibrilací síní. Výsledky studie ROCKET-AF s rivaroxabanem mají být prezentovány již v tomto roce, probíhá studie ENGAGE-AF TIMI 48 s edoxabanem a studie ARISTOTLE s apixabanem [63]. Studie AVERROES byla předčasně ukončena, neboť jednoznačně prokázala vyšší účinnost apixabanu v porovnání s ASA u pacientů s kontraindikací léčby warfarinem. Probíhají rovněž studie hodnotící účinnost a bezpečnost přímých antikoagulancií v prevenci a léčbě tromboembolických komplikací u koronárních příhod nebo u závažných interních onemocnění.
Zásadním přínosem těchto nových perorálních antikoagulancií, v porovnání s warfarinem, je skutečnost, že léčba nevyžaduje monitoring hemokoagulace, interakce s ostatními léky jsou zanedbatelné, nejsou nutná dietní opatření a nástup účinku a jeho odeznívání jsou rychlé (2–4 hod) [19]. Oprávněně se tedy můžeme domnívat, že v brzké době budou k dispozici nová, velmi účinná a relativně bezpečná antikoagulancia, která se stanou významnou součástí léčebné strategie v prevenci kardioembolického iktu.
doc.
MUDr. Jiří Bauer, Csc.
Neurologická klinika
1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha 2
tel: 224 965 507
e-mail: jiri.bauer@lf1.cuni.cz
Přijato k recenzi: 14. 7. 2010
Přijato do tisku: 16. 9. 2010
Recenzenti:
doc. MUDr. David Školoudík, Ph.D.
prof. MUDr. Roman Herzig, Ph.D., FESO
doc. MUDr. Zbyněk Kalita, CSc.
doc. MUDr. Jiří Bauer, CSc. (1939)
Docent Jiří Bauer se narodil 12. srpna 1939 v Praze. Promoval s vyznamenáním na Fakultě všeobecného lékařství v Praze v roce 1963. Po promoci působil ve Fyziologickém ústavu ČSAV, kde se věnoval základnímu výzkumu v oblasti neurofyziologie vestibulárního systému. Od roku 1967 doposud pracuje na Neurologické klinice 1. LF UK a VFN v Praze. V roce 1974 obhájil titul CSc., habilitován byl v roce 1987. Doc. Bauer se dlouhodobě věnuje problematice cévních onemocnění nervového systému, intenzivní péči v neurologii a neuroradiologii. Na neurologické klinice vybudoval a dlouhodobě vedl oddělení výpočetní tomografie, později i jednotku neurointenzivní péče. Je autorem nebo spoluautorem více než 120 vědeckých publikací. Je členem výboru Cerebrovaskulární sekce České neurologické společnosti ČLS JEP, členem výboru České společnosti pro trombózu a hemostázu ČLS JEP, členem ČNS ČLS JEP a členem České neuroradiologické společnosti ČLS JEP. V letech 1982–1990 působil jako krajský odborník pro obor neurologie hl. m. Prahy, byl též delegátem ČR v EFNS pro obor neuroonkologie.
Vědomostní test
1. Antikoagulační efekt warfarinu spočívá v:
a) inhibici enzymu epoxyd reduktázy v játrech
b) inhibici plazmatického faktoru X
c) inhibici tkáňového faktoru
d) inhibici agregace trombocytů
2. Antidotem nefrakciovaného heparinu je:
a) vitamin K
b) protaminsulfát
c) kyselina tranexamová
d) kyselina ε-aminokapronová
3. Kardioembolizace po 80. roce věku je příčinou:
a) 10 % ischemických iktů
b) 25 % ischemických iktů
c) 36 % ischemických iktů
d) 45 % ischemických iktů
4. Co není kontraindikací léčby warfarinem:
a) časté pády
b) věk nad 80 let
c) bakteriální endokarditida
d) krvácivé projevy v anamnéze
5. Obvyklé rozmezí hodnot INR při léčbě warfarinem v prevenci kardioembolického iktu je:
a) 1,5–2,5
b) 2,0–3,0
c) 1,5–3,5
d) 2,0–4,0
6. Jak často by měla být kontrolována hodnota INR u kompenzovaného warfarinizovaného pacienta:
a) 1krát týdně
b) 1krát za 14 dní
c) 1krát za měsíc
d) 1krát za 3 měsíce
7. Při léčbě warfarinem má být příjem zeleniny:
a) zakázán
b) pouze nárazový
c) neomezený
d) vyrovnaný
8. Jednoznačnou indikací k antikoagulační terapii u pacientů s fibrilací síní je CHADS2 skóre:
a) 0
b) 1
c) 2
d) 7
9. Jaká je doporučená terapie u 70letého pacienta s fibrilací síní a CHADS2 skóre 0:
a) kyselina acetylsalicylová
b) warfarin s cílovou hodnotou INR 1,8–2,0
c) warfarin s cílovou hodnotou INR 2,0–3,0
d) žádná
10. Doporučené cílové rozmezí INR u warfarinizovaných nemocných s mechanickými chlopenními náhradami je:
a) 1,5–2,5
b) 2,0–3,0
c) 2,5–3,5
d) 3,5–4,5
11. Minivarfarinizace s cílovou hodnotou INR 1,5–1,9 v kombinaci s kyselinou acetylsalicylovou je v klinické praxi:
a) vhodná v graviditě
b) vhodná jen u osob starších 80 let
c) vhodná tam, kde je vyšší riziko krvácení
d) nevhodná
12. Při závažném předávkování warfarinu s hodnotou INR 6,5 a vysokém riziku krvácení je nezbytné:
a) vynechat 1–2 denní dávky a pokračovat dávkou sníženou o 5–20 %
b) podat 1–3 mg vitaminu K p.o., vynechat 1–2 denní dávky a pokračovat dávkou sníženou o 5–20 %
c) vynechat warfarin po dobu pěti dní
d) podat 5–10 mg vitaminu K i.v. a pokračovat ve warfarinizaci
13. Při život ohrožujícím krvácení u warfarinizovaného pacienta s hodnotou INR 3 a více je doporučená terapie:
a) mražená krevní plazma
b) vitamin K
c) koncentrát plazmatických koagulačních faktorů
d) kombinace vitaminu K s koncentrátem plazmatických koagulačních faktorů/mraženou krevní plazmou
14. Extrakce zubu u warfarinizovaného pacienta s hodnotami INR v terapeutickém rozmezí vyžaduje:
a) přerušení warfarinizace na tři dny
b) přechodnou náhradu warfarinu nízkomolekulárními hepariny
c) lokální ošetření rány hemostyptiky bez přerušení warfarinizace
d) zajištění pacienta 2 mg vitaminu K p.o. před operací
15. Větší operační výkon lze u warfarinizovaného pacienta provést při hodnotě INR:
a) nižší než 3,0
b) nižší než 1,9
c) nižší než 1,7
d) nižší než 1,5
16. Podle platných doporučení ESO je časná preventivní antikoagulační léčba v akutní fázi ischemického iktu:
a) nevhodná
b) vhodná
c) vhodná jen u kardioembolických iktů
d) vhodná jen za předpokladu sTK< 180 mmHg
17. Preventivní léčba nízkomolekulárními hepariny vyžaduje monitoraci anti-Xa jednotek:
a) vždy
b) v graviditě
c) u mužů starších 75 let
d) v akutní fázi ischemického iktu
18. Jak velké je riziko vzniku hluboké žilní trombózy u imobilního nemocného v akutním stadiu ischemického iktu:
a) 20–30 %
b) 30–40 %
c) 40–50 %
d) 60–70 %
19. Rivaroxaban je:
a) přímý inhibitor faktoru Xa
b) přímý inhibitor trombinu
c) rekombinantní inhibitor tkáňového faktoru
d) aktivátor antitrombinu
20. Studie RE-LY prokázala, že dabigatran je u rizikových pacientů s fibrilací síní v porovnání s warfarinem:
a) méně účinný, výskyt intracertebrálního krvácení je nízký
b) účinnější, výskyt intracerebrálního krvácení je vyšší
c) účinnější, bez rizika intracerebrálního krvácení
d) stejně účinný nebo účinnější, výskyt intracerebrálního krvácení je 3krát nižší
Sources
1. Hrachovinová I. Hemokoagulace. In: Vojáček J, Malý M et al (eds). Arteriální a žilní trombóza v klinické praxi. Praha: Grada Publishing 2004 : 45–50.
2. Gumulec J, Kessler P, Procházka V, Brejcha M, Penka M, Zänger M et al. Krvácivé komplikace a předávkování antikoagulační léčby. Vnitř Lék 2009; 55(3): 277–289.
3. Pecka M. Laboratorní monitorování antikoagulační léčby. Doporučení pro klinickou praxi. [online]. Dostupné z URL: http://www.onkologickécentrum.cz/downloads/prirucky/monitoring-antikoagulace-STH-III.06.pdf.
4. Hirsh J, Fuster V, Ansell J, Halperin JL. American Heart Association/American College of Cardiology Foundation guide to warfarin therapy. Circulation 2003; 107(12): 1692–1711.
5. Bousser MG, Bouthier J, Büller HR, Cohen AT, Crijns H, Davidson BL et al. Comparison of indaparinux with vitamin K antagonists for prevention of thromboembolism in patients with atrial fibrillation: a randomised, open-label, non-inferiority trial. Lancet 2008; 371(9609): 315–321.
6. European Stroke Organisation (ESO) Executive Committee, ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25(5): 457–507.
7. Hirsh J, Guyatt G, Albert GW, Harrington R, Schünemann HJ. Antithrombotic and thrombolytic therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Ed.). Chest 2008; 133 (Suppl 6): 110S–112S.
8. Wang TJ, Massaro JM, Levy D, Vasan RS, Wolf PA, D´Agostino RB et al. A risk score for predicting stroke or death in individuals with new-onset atrial fibrillation in the community: the Framingham Hearth Study. JAMA 2003; 290(8): 1049–1056.
9. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146(12): 857–867.
10. Singer DE, Albert GW, Dalen JE, Fang MC, Go AS, Halperin JL et al. Antithrombotic therapy in atrial fibrillation: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Ed.). Chest 2008; 133 (Suppl 6): 546S–592S.
11. Reková-Vymětalová P, Bauer J, Goláň L, Fiksa J, Sváčková D, Lakomý C et al. Abnormality srdečního síňového septa a cévní mozkové příhody. Cesk Slov Neurol N 2006; 69/102(1): 27–32.
12. Kvasnička J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada Publishing 2003.
13. Bulíková A, Smejkal P, Zavřelová J, Chlupová G, Penka M. Získané inhibitory krevního srážení. Intern Med 2008; 10(7 a 8): 336–339.
14. Fang MC, Go AS, Hylek EM, Chan Y, Henault LE, Jensvold NG et al. Age and the risk of warfarin-associated hemorrhage: the anticoagulation and risk factors in atrial fibrillation study. J Am Geriatr Soc 2006; 54(8): 1231–1236.
15. Steiner T, Rosand J, Diringer M. Intracerebral hemorrhage associated with oral anticoagulant therapy. Stroke 2006; 37(1): 256–262.
16. Huttner HB, Schellinger PD, Hartmann M, Köhrmann M, Juettler E, Wikner J et al. Hematoma growth and outcome in treated neurocritical care patients with intracerebral hemorrhage related to oral anticoagulant therapy: comparison of acute treatment strategies using vitamin K, fresh frozen plasma, and prothrombin complex concentrates. Stroke 2006; 37(6): 1465–1470.
17. Bauer J. Léčba intracerebrálního krvácení – skepse nebo optimizmus? Neurol prax 2006; 6 : 328–330.
18. Hart RG, Aguilar MI. Anticoagulation in atrial fibrillation: selected controversies including optima anticoagulation intensity, treatment of intracerebral hemorrhage. J Tromb Thrombolysis 2008; 25(1): 26–32.
19. Gross PL, Weitz JI. New anticoagulants for treatment of venous thromboembolism. Arterioscler Tromb Vasc Biol 2008; 28(3): 380–386.
20. Remková A. Farmakogenetický algoritmus stanovenia dávky warfarínu. Interná medicina 2008; 8(6): 3–5.
21. Kakar P, Lane D, Lip GY. Bleeding risk statification models in deciding on anticoagulation in patients with atrial fibrillation. Chest 2006; 130(5): 1296–1299.
22. Hankey GJ. Stroke: Your questions answered. Edinburgh: Churchill Livingstone 2002.
23. Deerhake JP, Merz JC, Cooper JV, Eagle KA, Fay WP. The duration of anticoagulation bridging therapy in clinical practice may significantly exceed that observe in clinical trials. J Thromb Thrombolysis 2007; 23(2): 107–113.
24. Matýšková M, Penka M. Interakce antikoagulačních léků s potravinami a potravinovými doplňky. Int Med 2000; 5(2): 20–23.
25. Cerebrovaskulární sekce České neurologické společnosti ČLS JEP. Protokol trombolytické terapie [online]. Dostupné z URL: http://www.cmp.cz/public/d4/9d/b3/3999_16382_protokol_trombolyticke_terapie.pdf
26. Morgenstern LB, Hemphill JC jr, Anderson C, Becker K, Broderick JP, Connolly ES et al. Guidelines for the management of spontaneous intracerebral hemorrhage. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2010; 41(9): 2108–2129.
27. Sørensen B, Johansen P, Nielsen GL, Sorensen JC, Ingerslev J. Reversal of the International Normalized Ratio with recombinant activated factor VII in central nervous system bleeding during warfarin thromboprophylaxis: clinical and biochemical aspects. Blood Coagul Fibrinolysis 2003; 14(5): 469–477.
28. Přibáň V, Holý M, Vonke I. Intrakraniální hematomy u warfarinizovaných pacientů – kazuistiky a doporučení léčby. Cesk Slov Neurol N 2009; 72/105(6): 570–574.
29. Lankiewicz MW, Hays J, Friedman KD, Tinkoff G, Blatt PM. Urgent reversal of warfarin with protrombin complex concentrate. J Tromb Haemost 2006; 4(5): 967–970.
30. Steiner T, Rosand J, Diringer M. Intracerebral hemorrhage associated with oral anticoagulant therapy. Stroke 2006; 37(1): 256–262.
31. Bauer J. Etiopatogeneze a současné možnosti terapie intracerebrálního krvácení. Cesk Slov Neurol N 2006; 69/102 (Suppl 2): 30–33.
32. Goldstein JN, Thomas SH, Frontiero V, Joseph A, Engel Ch, Snider R et al. Timing of fresh frozen plasma administration and rapid correction of coagulopathy in warfarin-related intracerebral hemorrhage. Stroke 2006; 37(1): 151–155.
33. Aguilar MI, Hart RG, Kase CS, Freeman WD, Hoeben BJ, García RC et al. Treatment of warfarin-associated intracerebral hemorrhage: literature review and expert opinion. Mayo Clin Proc 2007; 82(1): 82–92.
34. Wani M, Nga E, Navaratnasingham R. Should a patient with primary intracerebral haemorrhage receive antiplatelet or anticoagulant therapy? BMJ 2005; 331(7514): 439–442.
35. Brejcha M, Gumulec J, Penka M, Klodová D, Wróbel M, Bogoczová E. Příprava pacientů s antikoagulační léčbou k invazivním zákrokům. Vnitř Lék 2009; 55(3): 272–275.
36. ACC/AHA/ASC 2006 Guidelines for the Management of Patients With Atrial Fibrillation. Circulation 2006; 114(4): 257–354.
37. Sellman JS, Holman RL. Thromboembolism during pregnancy. Medicína po promoci 2002; 3(1): 54–61.
38. American Academy of Pediatrics Committee on Drugs. The transfer of drugs and other chemicals into human milk. Pediatrics 2001; 108(3): 776–789.
39. Hart RG, Palacio S, Pearce LA. Atrial fibrillation, stroke, and acute antithrombotic therapy: analysis of randomized clinical trials. Stroke 2002; 33(11): 2722–2727.
40. Coull BM, Williams LS, Golstein LB, Meschia JF, Heitzman D, Chaturvedi S et al. Anticoagulants and antiplatelet agents in acute stroke. Report of the Point Stroke Guideline Development Committee of American Stroke Association. Neurology 2002; 59(1): 13–22.
41. Sandercock P, Counsell C, Kamal AK. Anticoagulants for Acute Ischemic Stroke. Stroke 2009; 40(7): 483–484.
42. Paciaroni M, Agnelli G, Micheli S, Caso V. Efficacy and safety of anticoagulant treatment in acute cardioembolic stroke. A meta-analysis of randomized controlled trials. Stroke 2007; 38(2): 423–430.
43. Warlow CP, Dennis MS, van Gijn J, Hankey GJ, Sandercoock PA, Bamford JM et al. Stroke: a practical guide to management. 2nd. ed. Oxford: Blackwell Science 2001.
44. Kalita Z et al. Akutní cévní mozkové příhody. Praha: Jessenius Maxdorf 2006.
45. Chamorro A, Busse O, Obach V, Toni D, Sandercock P, Reverter JC et al. The rapid anticoagulation prevents ischaemic damage study in acute stroke – final results from the writing committee. Cerebrovasc Dis 2005; 19(6): 402–404.
46. Geerts WH, Bergqvist D, Pineo GF, Heit JA, Samana CM, Larsen MR et al. Prevention of venous thromboembolis: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Ed.). Chest 2008; 133 (Suppl 6): 381S–453S.
47. Kearon C, Kahn SR Angelli G, Goldhaber S, Raskob GE, Comerota AJ. Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-Based Clinical Praktice Guidelines (8th Ed.). Chest 2008; 133 (Suppl 6): 454S–545S.
48. Gumulec J, Penka M, Bezděk R, Wróbel M, Kessler P, Brejcha M et al. Prevence žilní tromboembolické nemoci: obecně platná pravidla. [online]. Dostupné z URL: http://www.onkologickecentrum.cz/downloads/prirucky/prevence-TEN-STH-V06.pdf.
49. Bergmann JF, Cohen AT, Tapson VF, Golhhaber SZ, Kakkar AK, Deslandes B. Venous tromboembolism risk and prophylaxis in hospitalised medically ill patients. The ENDORSE Global Survey. J Tromb Haemost 2010; 103(4): 726–748.
50. Poul H, Kessler P. Trombofilní stavy: Význam pro prevenci a léčbu žilního tromboembolizmu. Vnitř Lék 2009; 55(3): 242–252.
51. Čížek V, Kučera D, Válka M, Bartoš P, Maděrič D, Pleva M. Úloha kaválních filtrů v prevenci plicní embolie. Vnitř Lék 2009; 55(3): 267–271.
52. Kalina M et al. Cévní mozková příhoda v medicínské praxi. 1st ed. Praha: Triton 2008.
53. Somerfield J, Barber PA, Anderson NE, Kumar A, Spriggs D, Charleston A et al. Not all patients with atrial fibrillation-associated ischemic stroke can be started on anticoagulant therapy. Stroke 2006; 37(5): 1217–1220.
54. Nutescu EA, Shapiro NL, Chevalier A. New anticoagulant agents: direct thrombin inhibitors. Cardiol Clin 2008; 26(2): 169–187.
55. Zikria JC, Ansell J. Oral anticoagulation with factor Xa and thrombin inhibitors: on the threshold of change. Curr Opin Hematol 2009; 16(5): 347–356.
56. Eriksson BI, Kakkar AK, Turpie AGG, Gent M, Bandel TJ, Homering M et al. Oral rivaroxaban for the prevention of symptomatic venous thromboembolism after elective hip and knee replacement. J Bone Joint Surg Br 2009; 91(8): 634–644.
57. Turpie AG. New oral anticoagulants in atrial fibrillation. Eur Heart J 2008; 29(2): 155–165.
58. Turpie AG, Lassen MR, Davidson BL, Bauer KA, Gent M, Kwong LM. RECORD 4 Investigators. RECORD4 Study Investigators. Rivaroxaban – an oral, direct Factor Xa inhibitor – versus enoxaparin for thromboprophylaxis after total knee replacement. Lancet 2009; 373(9676): 1673–1680.
59. Eriksson BI, Dahl OE, Rosencher N, Kurth AA, van Dijk CN, Frostick SP et al. Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial. J Thromb Haemost 2007; 5(11): 2178–2185.
60. Eriksson BI, Dahl OE, Rosencher N, Kurth AA, van Dijk CN, Frostick SP et al. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomised, double-blind, non-inferiority trial. Lancet 2007; 370(9591): 949–956.
61. Ginsberg JS, Davidson BL, Comp PC, Francis CW, Friedman RJ, Huo MH et al. Oral thrombin inhibitor dabigatran etexilate vs North American enoxaparin regimen for prevention of venous thromboembolism after knee arthroplasty surgery. J Arthroplasty 2009; 24(1): 1–9.
62. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12): 1139–1151.
63. ROCKET AF Study Investigators. Rivaroxaban – once daily, oral, direct factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation: rationale and design of the ROCKET AF study. Am Heart J 2010; 159(3): 340–347.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 5
-
All articles in this issue
- Cievna mozgová príhoda a ischemická choroba srdca
- Konkomitantní chemoradioterapie a cílená biologická léčba u glioblastoma multiforme
- Syndrom útlaku ulnárního nervu v oblasti lokte – přehled operačních technik a srovnání jejich výsledků
- Analýza „default mode“ sítě u zdravých dobrovolníků
- Úloha predoperačného časového intervalu pri liečbe diskogenného syndrómu caudae equinae
- Výskyt psychogénnych porúch v neurológii
- Behaviorálne poruchy u pacientov s Parkinsonovou chorobou – anamnestický skríning za pomoci špecializovaného dotazníka
- Přítomnost tzv. typických MR nálezů u multisystémové atrofie a progresivní supranukleární paralýzy – retrospektivní pilotní studie
- Endoskopická transnazální chirurgie hypofýzy – výhody spolupráce otorinolaryngologa a neurochirurga
- Střelná poranění hlavy a mozku
- Hemangioblastom kaudy – kazuistika
- Neuralgie nervus pudendalis – kazuistika
- Bodná poranění míchy a míšních kořenů – kazuistiky
- Morbus Lhermitte-Duclos – kazuistika
- Vývoj Národní sady klinických standardů a ukazatelů zdravotní péče a první výsledky v oboru neurologie
- Standard pro léčbu pacientů s autoimunitními nervosvalovými onemocněními intravenózním lidským imunoglobulinem a plazmaferézou
- Antikoagulační terapie v prevenci a léčbě ischemických iktů
- Vývoj technik PLIF a TLIF
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Neuralgie nervus pudendalis – kazuistika
- Vývoj technik PLIF a TLIF
- Syndrom útlaku ulnárního nervu v oblasti lokte – přehled operačních technik a srovnání jejich výsledků
- Střelná poranění hlavy a mozku