Neobvyklé klinické obrazy u migrény – kazuistiky
Unusual Clinical Picture in Migraine – Case Reports
This paper deals with two unusual clinical pictures of migraine. In the first case report, a 10‑year-old boy suffered from an attack of hemiplegic migraine with headache and left-sided hemiplegia with persistent aura without infarction, and recovered almost completely within 6 months of onset. Repeated conventional magnetic resonance imaging revealed no structural lesion of the brain, merely a subsiding light hypoperfusion in the frontal precentral regions bilaterally evident in perfusion‑weighted imaging. Findings in diffusion-weighted imaging and ADC maps were repeatedly normal. Examination of cerebral blood flow with single proton emission computed tomography was repeatedly normal. In the second case report, a 14‑year‑old boy suffered from a severe attack of migraine accompanied by delirium. Subarachnoid haemorrhage, meningitis and other structural lesions of the CNS were ruled out, while a toxicological examination, including alcohol, proved normal. The patient recovered within 12 hours.
Key words:
hemiplegic migraine – persistent aura without infarction – migraine with delirium
Authors:
R. Kotas 1; J. Kastner 2; V. Amblerová 1; J. Rokytová 1; H. Vacovská 1; J. Polívka 1; J. Kobr 3; A. Malán 4
Authors‘ workplace:
FN Plzeň
Neurologická klinika LF UK v Plzni
1; FN Plzeň
Radiodiagnostická klinika LF UK v Plzni
2; FN Plzeň
Dětská klinika LF UK v Plzni
3; FN Plzeň
Oddělení nukleární medicíny
4
Published in:
Cesk Slov Neurol N 2010; 73/106(2): 178-186
Category:
Case Report
Overview
Práce se zabývá dvěma neobvyklými klinickými obrazy u migrény. V první kazuistice dostal 10letý chlapec záchvat hemiplegické migrény s bolestí hlavy a levostrannou hemiplegií s perzistující aurou bez infarktu, která se upravila téměř kompletně do šesti měsíců od počátku. Opakované konvenční vyšetření magnetickou rezonancí neprokázalo strukturální postižení mozku, byla patrná jen ustupující lehká hypoperfuze oboustranně frontálně precentrálně na perfuzně vážených obrazech, nálezy na difuzně vážených obrazech a ADC mapách byly opakovaně normální. Vyšetření mozkového krevního průtoku pomocí jednofotonové emisní počítačové tomografie bylo opakovaně normální. V druhé kazuistice 14letý chlapec dostal těžký záchvat migrény provázený deliriem. Nebyly prokázány subarachnoidální krvácení, meningitis ani jiná strukturální léze CNS, toxikologické vyšetření včetně alkoholu bylo negativní. Pacient se uzdravil do 12 hodin.
Klíčová slova:
hemiplegická migréna – perzistující aura bez infarktu – migréna s deliriem
Úvod
Migréna se projevuje záchvaty, jejichž klinický obraz je dobře znám, proto se o něm zmiňujeme jen ve stručnosti.
U některých pacientů se před záchvatem objevují prodromy. Asi u 30% pacientů následuje aura. Podle toho, zda aura je, nebo není přítomna, mluvíme o migréně s aurou, nebo bez aury. Aura je tvořena ložiskovými neurologickými příznaky. Obvykle předchází bolest hlavy, může však přetrvávat i ve fázi bolesti hlavy a vzácně i po jejím skončení. Nejčastější je zraková aura ve formě scintilačního skotomu nebo fotopsií. Častá je též aura senzitivní manifestující se pocity brnění nebo mravenčení, po kterých přetrvává znecitlivění. Méně časté jsou poruchy řeči, nejčastěji expresivní fatická porucha, nebo hemiparéza, což se označuje jako sporadická nebo familiární hemiplegická migréna. Mohou se vyskytnout též příznaky pocházející z mozkového kmene, tzv. migréna bazilárního typu, nebo monokulární zrakové poruchy u retinální migrény.
Bolest je při záchvatu migrény převážně jednostranná, může se rozšířit na strany obě, méně často je od počátku oboustranná. Je typicky pulzujícího charakteru, střední až silné intenzity a trvá obvykle 4–72 hod. Bolest je doprovázena nauzeou a/nebo zvracením, foto‑ a fonofobií. Následuje pozáchvatové období.
Komplikacemi migrény jsou vedle status migrenosus a chronické migrény vzácně se vyskytující migrenózní infarkt a velmi vzácně se vyskytující perzistující aura bez infarktu. Při migrenózním infarktu příznaky aury trvají déle než jednu hodinu a neuroradiologickými zobrazovacími metodami se prokáže infarkt v příslušné oblasti. U perzistující aury bez infarktu příznaky aury přetrvávají déle než jeden týden bez průkazu mozkového infarktu neuroradiologickými zobrazovacími technikami.
Kazuistika 1
Desetiletý chlapec si kolem 12. hodiny začal stěžovat na bolest v záhlaví a zátylku, přidala se bolest hlavy v čele a ve spáncích, bylo mu nepříjemné světlo a hluk. Současně jej začala brnět levá ruka, brnění se šířilo vzhůru po celé horní končetině, pak ji začal cítit ,,jako obalenou“. Matka si jej vyzvedla ze školy, cestou domů začal padat, padal i v autobusu. Na zdravotním středisku si stěžuje na slabost LHK a LDK, hroutí se při pokusu o chůzi, udává brnění LHK.
Je přijat na JIP dětského oddělení spádové nemocnice, konstatována středně těžká levostranná hemiparéza a parestezie LHK. Provedeno akutně nativní CT mozku s normálním nálezem, MR C‑páteře až k Th 5 rovněž s normálním nálezem. Likvor je cytochemicky normální. Základní laboratorní skríning je normální. Během noci chlapec zvracel, neurologický nález progreduje.
Následující den přeložen na naši kliniku, při přijetí je LHK plegická, LDK velmi těžce paretická, jen s náznakem flexe v koleni. Z anamnézy od matky zjišťujeme, že trpí na migrénu bez aury. Chlapec sám měl v posledním ¾ roku 3krát bolest hlavy v čele a ve spáncích, nesnášel hluk, při bolesti hlavy asi za půl hodiny vždy zvracel, poté došlo k úlevě. Jinak nebyl vážněji nemocen.
Indikujeme akutně MR mozku, tj. druhý den (24 hod po vzniku). Konvenční strukturální MR mozku – T2 a FLAIR byly s normálním nálezem, na perfuzně vážených obrazech (PWI) byla přítomna jen lehká hypoperfuze frontálně v precentrálních oblastech oboustranně v MTT (mean transit time) a TTP (time to peak). Difuzně vážené obrazy (DWI) a ADC mapy byly normální, MR angiografie rovněž s normálním nálezem (obr. 1a–d). EEG druhý den po vzniku potíží vykazuje jen nedokonalou organizaci pozadí. Sonografické vyšetření karotického a vertebrobazilárního povodí je v normě. Echokardiografické vyšetření je v normě. S ohledem na uvažovanou možnost vaskulitidy byl pacient v prvních dnech léčen kortikoidy – dexametazon (Dexona) a metylprednizolon (Solu Medrol), infuze s plazmalytem a Clexane s.c., avšak bez efektu.
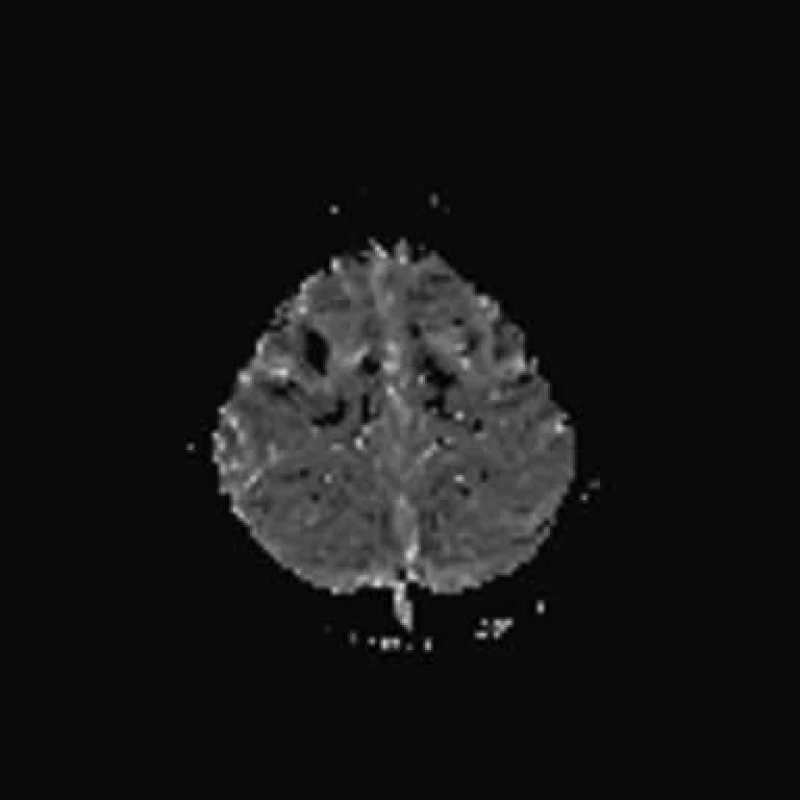
V následujících dnech trvá levostranná hemiplegie. Pátý den po vzniku provedeno kontrolní MR mozku: T2 a FLAIR s normálním nálezem, na PWI bylo patrné zvýraznění hypoperfuzních změn frontálně v precentrálních oblastech oboustranně, DWI a ADC mapy normální nálezy (obr. 2a–d). Šestý den po vzniku provedeno SPECT vyšetření mozku s 99mTcHMPAO, které neprokazuje ložiskovou poruchu relativní mozkové perfuze (obr. 3a–b). Motorické evokované potenciály (MEP) svědčily pro velmi těžkou lézi centrálního úseku motorické dráhy pro levostranné končetiny.
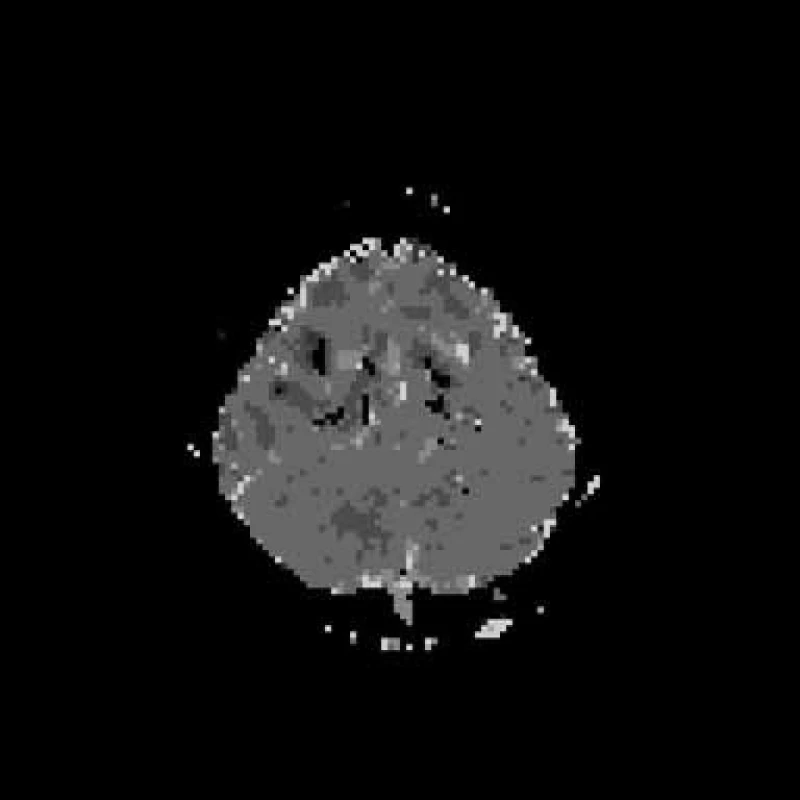


Jedenáctý den po vzniku zůstává LHK plegická, zřetelně se zlepšuje hybnost DK, začíná pareticky chodit s cirkumdukcí, objevuje se Babinského příznak vlevo. Dvanáctý den se uskutečnila 3. kontrola MR vyšetření. T2 a FLAIR jsou opět normální, na PWI je patrný ústup hypoperfuzních změn, DWI a ADC mapy jsou normální (obr. 4a–d). Podrobný laboratorní skríning včetně krevního obrazu s diferenciálem, biochemií a vyšetřením moče jsou normální, je pouze lehce vyšší cholesterol – 6,41 mmol/l. Kompletní imunologické vyšetření – CRP, imunoglobuliny, C3 a C4, cirkulující imunokomplexy, RF, ANF, ANCA‑P, ANCA‑C, APA IgG, APA IgM, ENA včetně podtříd, anti‑ds DNA jsou v normě. Virologické vyšetření svědčí jen pro anamnestické titry protilátek. ELISA Lyme IGG a IGM a WB Lyme IGG a IGM jsou negativní. APTT, INR, fibrinogen, aktivita proteinu C a S jsou v normě. Homocystein je v normě. Pouze molekulárně genetické vyšetření prokazuje Leidenskou mutaci v genu pro faktor V v heterozygotním stavu.
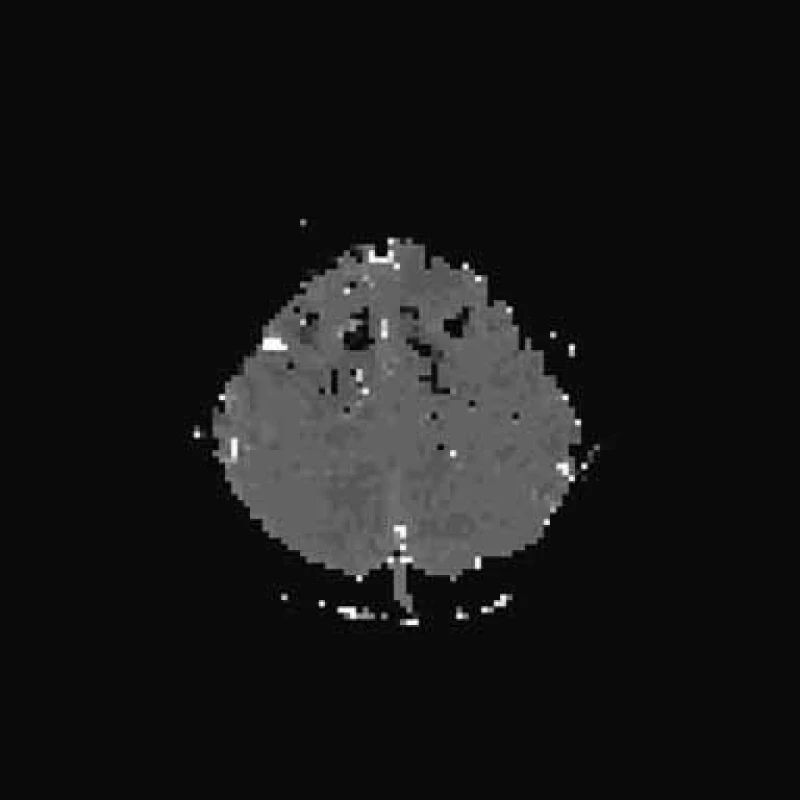
Další zlepšení patrno 25. den. Objevuje se slabá aktivní flexe a extenze v lokti, je naznačen stisk levé ruky. LDK lehce klesá v Mingazzinim. 26. den provedeno další MR mozku. T2 a FLAIR normální nález, je zjevná další regrese hypoperfuzních změn na PWI, DWI a ADC mapy jsou normální. Strukturální léze mozku neprokázána (obr. 5a–d). Stejný den při kontrolním vyšetření na MEP již naznačeny motorické odpovědi z levostranných končetin. Kontrolní EEG s fotostimulací bez podstatných změn, jen nedokonalá organizace pozadí. 28. den kontrolní SPECT s 99mTc bicisátem je opět normální (obr. 6a–b).
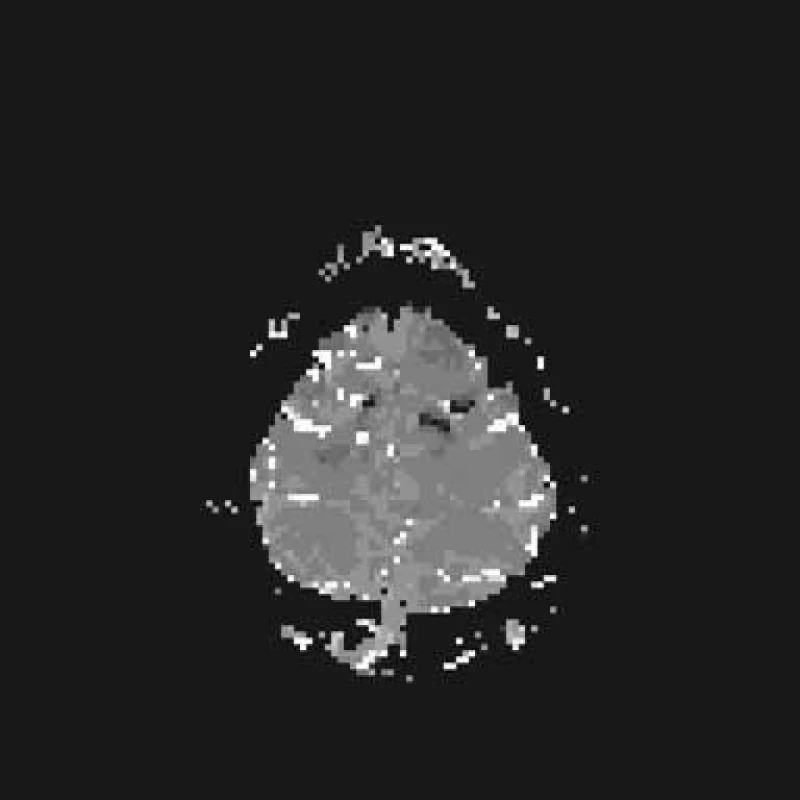


33. den propuštěn do domácí péče, trvá středně těžká paréza LHK a lehká LDK. Při kontrole za dva měsíce je pacient dále zlepšen, je patrna lehká paréza LHK a instabilita LDK, pozitivní Babinski vlevo. Absolvoval lázeňskou léčbu. Za šest měsíců od vzniku onemocnění jsou levostranné končetiny již bez poklesu, ale přetrvává menší síla stisku levé ruky a lehce paretická chůze vlevo. Drobný neurologický levostranný nález pokračuje i v dalším průběhu. Kontrolní konvenční MR mozku je v normě.
Diskuze
Podrobným vyšetřením jsme vyloučili strukturální lézi mozku včetně vaskulitidy. Proto jsme diagnostickou úvahu směřovali směrem k hemiplegické migréně s perzistující aurou bez infarktu.
Perzistující aura bez infarktu je velmi vzácnou komplikací migrény. Příznaky aury zde trvají déle než jeden týden bez neuroradiologického průkazu mozkového infarktu. Perzistující aura bez infarktu může trvat týdny, měsíce nebo dokonce i roky. Příznaky mohou být zrakové, motorické nebo senzitivní, pozitivní nebo negativní [1,2].
V zahraniční literatuře je popsáno asi 30 případů perzistující zrakové aury, z toho pouze polovina měla konvenční MR vyšetření mozku [3]. Autoři Jager et al popsali čtyři případy perzistující zrakové aury, u nichž byla provedena konvenční MR, PWI, DWI a ADC mapy s normálním nálezem [4]. Normální nálezy měli i autoři San‑Juan a Zermeno u své pacientky s perzistující zrakovou aurou [3].
Někteří autoři nalezli na SPECT mozku nebo PWI u perzistující zrakové aury přechodnou hypoperfuzi v korespondující oblasti mozkového kortexu bez vzniku mozkového infarktu [5–7].
Nálezy u hemiplegické migrény jsou ještě méně početné. Byla popsána naopak hyperperfuze kontralaterální hemisféry u tří případů. U dvou z nich byla užita PWI a u jedné SPECT [8–10]. Autoři Chabriat et al demonstrovali přechodný, asi 25% pokles v difuzi v postižené hemisféře u hemiplegické migrény s mutací CACNA1A genu [11]. Po klinické úzdravě došlo k normalizaci DWI nálezu. Autoři Lindahl et al nenalezli žádnou abnormalitu na DWI u pacienta s prolongovanou hemiplegickou migrénou 6 hod, 4 dny a 3 měsíce od začátku příznaků [8].
Za podstatu migrény se dnes považuje paroxyzmální porucha funkce mozkového parenchymu, zvaná korová šířící se deprese elektrické aktivity – cortical spreading depression (CSD), která je rovněž podstatou aury. Šíří se jako koncentrická vlna depolarizace neuronů po mozkové kůře od okcipitální krajiny směrem dopředu provázena přechodným zastavením všech typů elektrické aktivity neuronů [12]. Studie s pomocí SPECT u typické aury ukázaly, že s touto poruchou se vyskytuje hypoperfuze začínající vždy v zadní části mozku, která se postupně šíří vlnovitým způsobem dopředu nezávisle na oblastech zásobování velkých arterií a je omezena na tomografickou reprezentaci kůry [13–15 ]. U migrény bez aury byla tato šířící se hypoperfuze zachycena pomocí PET, což svědčí pro přítomnost klinicky němé CSD bez zjevného klinického korelátu [16,17]. Soudí se, že pokles rCBF je čistě sekundární k pokleslé neuronální funkci (metabolická deprese mozkového krevního průtoku). Některé práce poukazují na to, že po iniciální hypoperfuzi se v pozdní fázi mohou objevit arey hyperperfuze (hyperperfusion rebound) [18]. Studie pomocí dokonalejší funkční MR BOLD techniky (blood oxygen level dependent technique) svědčí pro to, že na předním okraji CSD je přítomna nejprve krátká fáze reflexní vazodilatace s hyperemií a pak stav přejde do fáze oligemické, neboť BOLD efekt je nejdříve na předním okraji poruchy aktivován a poté potlačen, což na SPECT není zachytitelné [19]. Jiné studie s DWI nenašly ve fázi oligemie žádné změny, takže vše nasvědčuje tomu, že jde o oligemickou, ale nikoliv ischemickou fázi.
CSD je pak schopna stimulovat bolestivá vlákna tzv. trigeminovaskulárního systému, která jsou součástí trojklanného nervu a inervují cerebrální, piální a durální arterie. Tím se přenášejí bolestivé signály do mozku [20].
Patofyziologie perzistující aury nebyla dosud dostatečně objasněna. Patofyziologické mechanizmy uplatňující se u typické aury se zde mohou pravděpodobně kombinovat a způsobovat perzistující auru. Existuje též hypotéza, že u perzistující aury se může jednat o reverberační vlny CSD [5]. Byla zkoušena řada léků k ovlivnění perzistující aury. Pouze dva pacienti s perzistující zrakovou aurou příznivě reagovali na valproát a u dvou pacientů perzistující zrakovou auru potlačil lamotrigin [7,21]. Jako velmi účinný se popisuje nově furosemid podaný intravenózně nebo perorálně, který způsobil vymizení perzistující zrakové aury během několika dnů. Pravděpodobně se zde uplatňuje jeho účinek na kalium, které hraje klíčovou roli v korové šířící se depresi [21].
Zatímco u typické aury byly zjištěny celkem jednoznačné a charakteristické nálezy specifické poruchy CBF, u perzistující aury to byly pomocí PWI nebo SPECT nálezy různé – od hypoperfuze přes normální nálezy až po hyperperfuzi. Příčiny těchto různých nálezů nejsou zatím jasné. Možná jsou důvodem různé fáze perzistující aury podobně jako u typické aury. U našeho pacienta byla při všech vyšetřeních zjištěna lehká hypoperfuze frontálně precentrálně oboustranně. Proč byl její výskyt oboustranný při těžké jednostranné symptomatologii, nedokážeme vysvětlit. Možná že tyto lehké změny perfuze neměly ani přímý vztah k onemocnění. Podstatné je, že u našeho pacienta lehké změny perfuze při těžké ložiskové symptomatologii nebyly provázeny změnami v difuzi, a tedy je vyloučen infarkt mozku jako příčina hemiplegie. Rovněž MR angiografie byla zcela normální. Zjištěnou Leidenskou mutaci pro faktor V v heterozygotním stavu považujeme z klinického obrazu za vedlejší nález nesouvisející s onemocněním. Rovněž vaskulitida byla vyloučena. Případ jsme uzavřeli jako sporadickou hemiplegickou migrénu s perzistující aurou bez infarktu. Normální nálezy na DWI a ADC mapách spolu s normálními nálezy při konvenční MR jsou charakteristickým znakem perzistující migrenózní aury a diferenciálně diagnostickým kritériem.
Kazuistika 2
Čtrnáctiletý chlapec byl přivezen vozem RZP na centrální příjem s tím, že ráno kolem deváté hodiny normálně vstal a byl v pořádku. Asi během 10 minut poté si začal stěžovat na bolest hlavy frontálně, opakovaně zvracel, byl afebrilní. Pak si lehl a usnul. Poté podle sestry začal ,,vyvádět“. Když na něho sestra promluvila, nesrozumitelně křičel. Po příchodu matky kolem 13.15 hod toto chování pokračovalo, byl obtížně probuditelný, při pokusu o fyzický kontakt se nemocný začal zmítat a křičel bolestí. Proto matka volala RZP, při příjezdu je popisována kvalitativní i kvantitativní porucha vědomí (somnolence střídající se s agresivitou). Nemocný zvracel, proto byl podán Torecan 1 amp. i.v.
Na centrálním příjmu je somnolentní, polohuje se spontánně na bok, při pokusu o slovní kontakt nebo na dotyk je extrémně agresivní, nadává a brání se vyšetření. Přes obtížnou vyšetřitelnost je bez zjevné lateralizace, meningeální příznaky nelze spolehlivě vyšetřit. Matka udává, že sama trpí na migrény bez aury, chlapec byl vyšetřován a léčen pro bolesti hlavy spojené se zvracením, frekvence bolestí byla nepravidelná, většinou při změně barometrického tlaku. Pomáhal Algifen nebo ibuprofen a vyspání. Poslední příhoda byla před 14 dny. Na centrálním příjmu je subfebrilní. Sedace diazepamem 10mg i.v. je nedostatečná, proto podán ještě Diprivan 100mg i.v. Byla odebrána kompletní laboratoř včetně toxikologie a alkoholu. Vysloveno podezření na počínající meningitidu nebo subarachnoidální krvácení. Provedeno akutní CT mozku nativně a po aplikaci kontrastní látky s normálním nálezem. Jako vedlejší nález je přítomen venózní angiom pravé mozečkové hemisféry a empty sella. Laboratorní vyšetření je v normě s nízkými zánětlivými parametry, toxikologický skríning a hladina alkoholu jsou negativní.
Pacient byl přijat na JIP dětské kliniky a tam absolvoval lumbální punkci. Provedené vyšetření mozkomíšního moku prokazuje laboratorní příměs arteficiální krve, pediatr zjišťuje lehkou tonsilofaryngitidu. Pro trvající kvalitativní poruchu vědomí s neklidem až agresivitou je pokračováno v sedaci chlorpromazinem (Plegomazin), který současně tlumí i bolest hlavy, podávány infuze krystaloidů, dexametazon (Dexona) a G‑Penicilin i.v.
Do 12 hodin od přijetí dochází k postupné úpravě vědomí a ústupu bolesti hlavy, kontrolní likvor s odstupem 48 ho-din je zcela v normě, MR angiografie mozku je kromě zmíněného venózního angiomu pravé mozečkové hemisféry rovněž v normě. EEG ukazuje abnormní graf pro delta aktivitu nad zadními kvadranty bilaterálně a ojedinělé ostré grafoelementy parietálně bilaterálně. Echokardiografické vyšetření je v normě. Chlapec byl přeložen zcela bez obtíží na standardní oddělení a po týdnu propuštěn.
Diskuze
Vyšetření vyloučilo subarachnoidální krvácení, meningitidu i ostatní organická postižení mozku. Naši diagnostickou úvahu jsme tedy směřovali k migréně.
Při zadání hesla ,,migraine and delirium“ jsme v internetových zdrojích nenalezli v posledních deseti letech žádný popis případu. Renomované monografie týkající se migrény však popisují, že může být alterované chování pacienta během ataky různého typu.
Pacienti mohou být při záchvatu zvýšeně dráždiví, mohou se obtížně slovně vyjadřovat, mohou mít zhoršenou paměť a koncentraci. Byly popsány stavy zmatenosti (acute confusional migraine) během atak migrény, zejména u dětí a adolescentů. Typickými příznaky jsou akutně vzniklá dezorientace, často agitace, neklid, neúčelné iracionální chování, někteří pacienti se chovají násilně, může se vyvinout delirium. Tento stav může být krátkodobý nebo může trvat až 12 hod. Pacienti se ovšem uzdraví bez následků. Tato alterace chování se obvykle vyvine po nástupu bolesti hlavy. Pacienti mají často na tuto epizodu amnézii. Byly popsány i jiné poruchy vědomí, jako snové stavy, automatizmy a stupor [22,23].
V literatuře jsme nenalezli vysvětlení příčiny výskytu delirantního stavu u migrény. Sami se domníváme, že výskyt deliria by mohl souviset s postižením některých struktur temporálního laloku korovou šířící se depresí. Je známo, že delirium se vyskytuje u organických postižení mozku různého charakteru, při nichž je často postižen temporální lalok. Agitovaným deliriem se často manifestují temporální hematomy. Kontuze mozkové, u nichž bývá časté postižení temporálního a frontálního laloku, se projevují kvalitativní poruchou vědomí, kde v popředí je psychomotorický neklid, agitovanost a zmatenost. Epidurální hematom, který bývá často lokalizován temporálně, může být rovněž provázen deliriem. Pro možné postižení temporálního laloku u migrény nasvědčují i jiné již uvedené příznaky, jako jsou snové stavy, automatizmy a také přechodné význačné poruchy paměti, které se mohou sporadicky vyskytnout v průběhu záchvatu. Jsme si však vědomi, že naše úvaha je pouze hypotetická.
Vzhledem k tomu, že jsme nezjistili žádnou organickou příčinu a stav kompletně odezněl, uzavřeli jsme tento případ jako migréna s deliriem.
Závěr
Práce popisuje dva neobvyklé klinické obrazy u migrény. V prvním případě jde o hemiplegickou migrénu s perzistující aurou bez infarktu s téměř úplnou úzdravou do šesti měsíců od vzniku, v druhém případě jde o adolescenta se záchvatem migrény s deliriem. Pokud je nám známo, popisy takových případů jsou v literatuře sporadické. Naším cílem je upozornit, že v obdobných případech bychom měli pomýšlet také na migrénu.
Práce vznikla s podporou grantu VZ 0021620816
Přijato k recenzi: 23. 9. 2009
Přijato do tisku: 11. 2. 2010
as. MUDr. Rudolf Kotas, Ph.D.
Neurologická klinika
LF UK a FN Plzeň
Alej Svobody 80
323 00 Plzeň
e-mail: kotas@fnplzen.cz
Sources
1. Headache Classification Subcommittee of International Headache Society. The International Classification of Headache Disorders: 2nd Edition. Cephalalgia 2004; 24 (Suppl 1): 1–160.
2. Agostoni E, Aliprandi A. The complications of migraine with aura. Neurol Sci 2006; 27 (Suppl 2): S91–S95.
3. San‑Juan OD, Zermeno PF. Migraine with persistent aura in a Mexican patient: case report and review of the literature. Cephalalgia 2007; 27(5): 456–460.
4. Jager HR, Giffin NJ, Goadsby PJ. Diffusion‑ and perfusion‑weighted MR imaging in persistent migrainous visual disturbances. Cephalalgia 2005; 25(5): 323–332.
5. Relja G, Granato A, Ukmar M, Ferretti G, Antonello RM, Zorzon M. Persistent aura without infarction: description of the first case studied with both brain SPECT and perfusion MRI. Cephalalgia 2005; 25(1): 56–59.
6. Liu, Schatz NJ, Galetta SL, Volge NJ, Skobieranda F, Kosmorski GS. Persistent positive visual phenomena in migraine. Neurology 1995; 45(4): 664–668.
7. Chen WT, Fuh JL, Lu SR, Wang SJ. Persistent migrainous visual phenomena might be responsive to lamotrigine. Headache 2001; 41(8): 823–825.
8. Lindahl AJ, Allder S, Jefferson D, Moody A, Martel A. Prolonged hemiplegic migraine associated with unilateral hyperperfusion on perfusion weighted magnetic resonance imaging. J Neurol Neurosurg Psychiatry 2002; 73(2): 202–203.
9. Masuzaki M, Utsunomiya H, Yasumoto S, Mitsudome A. A case of hemiplegic migraine in childhood: transient unilateral hyperperfusion revealed by perfusion MR imaging and MR angiography. AJNR Am J Neuroradiol 2001; 22(9): 1795–1797.
10. Barbour PJ, Castaldo JE, Shoemaker EI. Hemiplegic migraine during pregnancy: unusual magnetic resonance appearance with SPECT scan correlation. Headache 2001; 41(3): 310–316.
11. Chabriat H, Vahedi K, Clark CA, Poupon C, Ducros A, Denier C et al. Decreased hemispheric water mobility in hemiplegic migraine related to mutation of CACNA1A gene. Neurology 2000; 54(2): 510–512.
12. Eikermann‑Haerter K, Moskowitz M. Pathophysiology of Aura. In: Silberstein SD, Lipton RB, Dodick DW (eds). Wolff’s Headache and Other Head Pain. New York: Oxford University Press 2008: 121–123.
13. Olesen J, Larsen B, Lauritzen M. Focal hyperemia followed by spreading oligemia and impaired activation of rCBF in classic migraine. Ann Neurol 1981; 9(4): 344–352.
14. Lauritzen M, Olesen J. Regional cerebral blood flow during migraine attacks by Xenon 133 Inhalation and Emission Tomography. Brain 1984; 107(2): 447–461.
15. Kotas R, Záhlava J, Kastner J. Zobrazovací metody u migrény (SPECT, angiografie, MRI). Bolest 1998; 1(4): 105–111.
16. Woods RP, Iacoboni M, Mazziotta JC. Brief report: bilateral spreading hypoperfusion during spontaneous migraine headache. N Engl J Med 1994; 331(25): 1689–1692.
17. Geraud G, Denuelle M, Fabre N, Payoux P, Chollet F.Positron emission tomographic studies of migraine. Rev Neurol (Paris) 2005; 161(6–7): 666–670.
18. Andersen AR, Friberg L, Olsen TS, Olesen J. Delayed hyperemia following hypoperfusion in classic migraine: Single photon emission computed tomographic demonstration. Arch Neurol 1988; 45(2): 154–159.
19. Cao Y, Autiora S, Vikingstad E, Welch KM. Functional MRI (fMRI) of visually triggered headache: stimulation, suppression and propagation of the bold effect. J Cereb Blood Flow Metab 1997; 17 (Suppl): S176.
20. Moskowitz MA. The neurobiology of vascular head pain. Ann Neurol 1984; 16(2): 157–168.
21. Almeida RF, Leão IAT, Gomes JBL, da Silva AA jr, Teixeira AL. Migraine with persistent visual aura: response to furosemide. Clinics (Sao Paulo) 2009; 64(4): 375–376.
22. Davidoff RA. Migraine: manifestations, pathogenesis and management. Philadelphia: F. A. Davis Company 1995.
23. Lance JW, Goadsby PJ. Mechanisms and management of headache. 6th ed. Oxford: Butterworth Heinemann 1998.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 2
Most read in this issue
- Huntingtonova nemoc
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Neurorehabilitace












