Srovnání české verze Montrealského kognitivního testu s Mini‑Mental State pro stanovení kognitivního deficitu u Parkinsonovy nemoci
A Comparison of the Czech Version of the Montreal Cognitive Assessment Test with the Mini Mental State Examination in Identifying Cognitive Deficits in Parkinson’s Disease
Objective:
Comparison of two brief screening tests for the detection of cognitive deficits in Parkinson’s disease.
Introduction:
The Montreal Cognitive Assessment (MoCA) was developed as a screening tool for the identification of cognitive deficits in Alzheimer’s disease and its use has been proposed in Parkinson’s disease (PD). Cognitive deficit is common in PD and its early detection improves the prospects for medical intervention. The Czech version of MoCA is freely available, but its validity has not yet been demonstrated. We therefore compared the sensitivity of MoCA with that of the mini mental state examination (MMSE), currently the representative screening test for the detection of cognitive deficit. Unlike MMSE, MoCA contains subtests of executive functions and sustained attention as well employing more extensive tasks in naming and word recall.
Methods:
MMS and MoCA were administered in alternating order to 81 randomly selected PD patients and to 34 age‑matched normal controls (NC).
Results:
Total raw scores of MoCA and MMS differed significantly between NC and PD. The total score for MoCA significantly differed from MMSE (p <0.0005) in PD as well as in NC (p <0.0005). Using the same cut‑off score of less than 26, in the PD patient subgroup MoCA detected cognitive deficit in 74.1% of patients as against 38.3% judging by MMSE. In comparison to NC, about twice as many PD patients failed in executive functions subtests, which are not covered by MMSE. PD patients also failed more frequently than NC in the “naming subscale” (20 vs 3%) and “attention subscale” (41 vs 6%) of MoCA. Test‑retest reliability of MoCA was 0.82, internal consistency (split‑half) was 0.69, Cronbach’s α = 0.72. Convergent validity between MoCA and MMSE was 0.73. The administration time of MoCA was approximately two times longer than that for MMSE (ca. 10 vs 5 min, p < 0.005).
Conclusion:
Our results indicate that MoCA may be a more efficient indicator of cognitive deficit than MMSE in PD, especially in executive functions, naming and attention. The Czech version of MoCA has shown good psychometric properties, comparable to those reported in previous studies. It can henceforth be viewed as an appropriate screening test of cognitive deficit in PD.
Key words:
cognitive impairment – Parkinson’s disease – Mini-Mental State Examination – Montreal Cognitive Assessment – neuropsychology
Authors:
O. Bezdíček; P. Balabánová; P. Havránková; J. Štochl; J. Roth; E. Růžička
Authors‘ workplace:
Neurologická klinika 1. LF UK a VFN v Praze
Published in:
Cesk Slov Neurol N 2010; 73/106(2): 150-156
Category:
Original Paper
Overview
Cíl:
Srovnání citlivosti dvou krátkých testů pro skríning kognitivního deficitu u Parkinsonovy nemoci (PN).
Úvod:
Montreal Cognitive Assessment (MoCA) byl vyvinut jako krátký test pro orientační diagnostiku poruch poznávacích funkcí u Alzheimerovy nemoci, s možnou využitelností i u Parkinsonovy nemoci. Kognitivní deficit je u PN častý a jeho včasná detekce zlepšuje možnost léčebného ovlivnění. Česká verze MoCA je volně dostupná, ale její validita u PN dosud nebyla ověřena. Proto bylo naším záměrem srovnat MoCA s běžně užívaným testem Mini‑Mental State (MMS) pro zachycení kognitivních změn. MoCA oproti MMS obsahuje subtesty exekutivních funkcí, zaměřené pozornosti a rozsáhlejší subtesty pojmenování i oddáleného vybavení.
Metodika:
MMS a MoCA byly vždy v střídavém pořadí administrovány u 81 náhodně vybraných pacientů s PN a u 34 věkově odpovídajících kontrol (NK).
Výsledky:
Celkové hrubé skóry testů MoCA i MMS se významně lišily mezi skupinami PN a NK. Statisticky významné rozdíly byly prokázány také při srovnání mezi celkovými hrubými skóry MoCA a MMS u pacientů s PN (p < 0,0005) i u NK (p < 0,0005). Při použití stejné hranice pod 26 bodů celkového skóru vykázala MoCA ve skupině pacientů s PN vyšší záchyt kognitivního deficitu (74,1 % ) oproti 38,3 % v MMS. Zhruba dvojnásobek pacientů s PN oproti NK ztratil body v subtestech exekutivních funkcí MoCA, které nejsou vyšetřovány MMS, výrazné rozdíly ve výkonech pacientů s PN a NK byly rovněž v úkolech MoCA Pojmenování (20 oproti 3 % chyb) a Zaměřená pozornost (41 oproti 6 %). Test‑retestová reliabilita MoCA je 0,82; vnitřní konzistence (split‑half) 0,69; Cronbachovo α = 0,72. Konvergentní validita MoCA s MMS je 0,73. Časová náročnost testu MoCA je oproti MMS přibližně dvojnásobná (cca 10 min oproti 5 min, p < 0,0005).
Závěr:
Naše výsledky naznačují, že MoCA může být u pacientů s PN citlivějším indikátorem kognitivního deficitu, zejména exekutivních funkcí, zaměřené pozornosti a pojmenování, než je MMS. MoCA v české verzi disponuje dobrými psychometrickými vlastnostmi, které se shodují se zahraničními studiemi. Lze jej tedy považovat za vhodnou skríningovou zkoušku kognitivního deficitu u PN.
Klíčová slova:
kognitivní deficit – Parkinsonova nemoc – Mini-Mental State – MoCA test – neuropsychologie
Úvod
Z nedávných studií vyplývá, že již v době stanovení diagnózy Parkinsonovy nemoci (PN) trpí 20–30% pacientů kognitivním deficitem [1–5] a nejméně u 30% pacientů se v průběhu onemocnění rozvine syndrom demence (PN‑D) [3–7]. Demence u PN se pojí s nižší průměrnou délkou života [8], významně přispívá k negativnímu stresu pečovatele [9] a je spojena s vyšším výskytem nežádoucích účinků antiparkinsonské medikace [10]. Proto je i rozpoznání kognitivního deficitu, který nesplňuje kritéria syndromu demence, důležité z prognostického hlediska. Existuje rovněž několik studií navrhujících aplikaci pojmu mírné kognitivní poruchy (mild cognitive impairment, MCI) u Parkinsonovy nemoci, aby takto vymezily jednotku PN‑MCI v rámci kontinua mezi PN a PN‑D [11–13]. Přestože frekvence kognitivního deficitu je u PN vysoká, nedisponujeme přesnou orientačnízkouškou pro jeho měření. Skríningové nástroje, jako je Mini-Mental State (MMS)[14,15], se nepovažují za dostatečně citlivé na kognitivní deficit u PN, protože nezachycují jeho dysexekutivní složku a další poruchy spojené s postižením subkortikálních mozkových struktur [16,17]. Autoři záměrně používají originální zkratky pro test Mini-Mental State (MMS), který byl v původní podobě publikován v roce 1975, aby se vymezili oproti verzi komerční i oficiální verzi testu MMSE® od téhož autora, který je však licencován společností Psychological Assessment Resources, a jehož oficiální verze dosud nebyla převedena do češtiny ani validována. Délka a metodická náročnost komplexních neuropsychologických baterií zase znemožňuje jejich použití jako orientačního nástroje v neurologické praxi. Nově byly publikovány testy vyvinuté přímo pro měření kognitivního deficitu u Parkinsonovy nemoci: PD‑CRS (Parkinson’s disease – cognitive rating scale), PANDA (Parkinson neuropsychometric dementia assessment) a SCOPA‑COG (Scales for outcomes of Parkinson’s disease – cognition) [18]. V současné době však nedisponujeme jejich českým převodem a pilotní studií na české populaci. Další krátké škály sice byly validovány na české populaci: 7MST (7 minute neurocognitive screening battery), ACE‑R (ACE: Addenbrooke’s cognitive examination; ACE‑R: Addenbrooke’s cognitive examination‑revised), ale pouze u pacientů s Alzheimerovou nemocí [19,20], přičemž pro ACE‑R existuje pouze jedna zahraniční studie u pacientů s PN [21]. Montrealský kognitivní test (MoCA, Montreal cognitive assessment) původně vznikl jako orientační zkouška kognitivních funkcí pro zachycení MCI a byl ověřen na souboru pacientů s MCI a Alzheimerovou nemocí [22]. Ukázalo se, že MoCA je pro diagnostiku MCI citlivější než MMS [23]. Jedná se o krátký test podobný MMS, určený pro klinické použití, je volně dostupný v české verzi (příloha 1) [24] a doporučován jako alternativa i v českém prostředí [25]. MoCA není oproti oficiální verzi Mini‑Mental State Examination (MMSE) [15] zatížen poplatky za autorská práva. MoCA obsahuje úkoly zaměřené na řadu kognitivních domén: zaměřenou pozornost, pracovní paměť, bezprostřední verbální paměť, vybavení po oddálení i vybavení s nápovědou, verbální fluenci, exekutivní funkce, pojmenování, orientaci v prostoru a čase, verbální abstrakci, zrakově prostorové a zrakově konstrukční schopnosti. Právě z důvodu, že domény exekutivních funkcí, pracovní paměti a zrakově prostorových schopností jsou často postiženy již v raných stadiích PN, zdá se být test MoCA zvláště vhodný pro použití u PN [2,26,27].

Pokusili jsme se stanovit základní psychometrické vlastnosti české verze testu MoCA na populaci pacientů s PN. Zejména se jednalo o spolehlivost testu při opakovaném vyšetření (test‑retestovou reliabilitu) a o konvergentní validitu (shodují‑li se různé metody měření téže vlastnosti), abychom ověřili, zda se česká verze MoCA hodí pro detekci kognitivního deficitu u pacientů s PN.
Soubor a metodika
Všechny testované osoby podstoupily vyšetření jako součást ambulantní neurologické kontroly. Znáhodnění výběru bylo provedeno tak, že byl zařazen každý první vyšetřený pacient s diagnózou PN, který se dostavil v příslušný den na specializovanou ambulanci Neurologické kliniky 1. LF UK a VFN. Všichni vybraní pacienti splňovali Klinická diagnostická kritéria UK Parkinson’s Disease Society Brain Bank [28] a byli v době vyšetření v „on“ stavu. Celkový počet zařazených pacientů s PN činil n = 81 (tab. 1). Údaje o délce onemocnění a o aktuálních dávkách antiparkinsonské medikace byly doplněny z karet pacientů. Celkem 22 pacientů bylo léčeno pouze L‑DOPA, 49 kombinací L‑DOPA a agonistů dopaminu, sedm pacientů bylo léčeno jen agonisty dopaminu, u tří pacientů se nepodařilo zjistit aktuální léčbu. Celková dávka dopaminergní léčby byla vypočtena převedením dávky agonistů dopaminu na ekvivalent L‑DOPA. Škála UPDRS byla administrována vyškoleným neurologem bezprostředně před neuropsychologickým vyšetřením. Kontrolní skupina pro neuropsychologická vyšetření byla složena z 34 zdravých osob netrpících PN (rodinných příslušníků pacientů nebo zaměstnanců kliniky), srovnatelného věku a délky vzdělání. Do skupiny pacientů ani kontrol nebyly zařazeny osoby trpící vážným smyslovým poškozením, floridní depresí, vnitřní nemocí s významným vlivem na psychickou výkonnost či abúzem psychoaktivních látek. Protokol vyšetření sestával z testů MoCA, MMS [24,14] a zkrácené 15položkové verze Geriatrické škály deprese (GDS‑15) [29]. Čtrnáct osob z obou skupin NK i PN podstoupilo opakované vyšetření MoCA pro zjištění test‑retestové reliability (průměrný odstup retestu činil 76 dní).
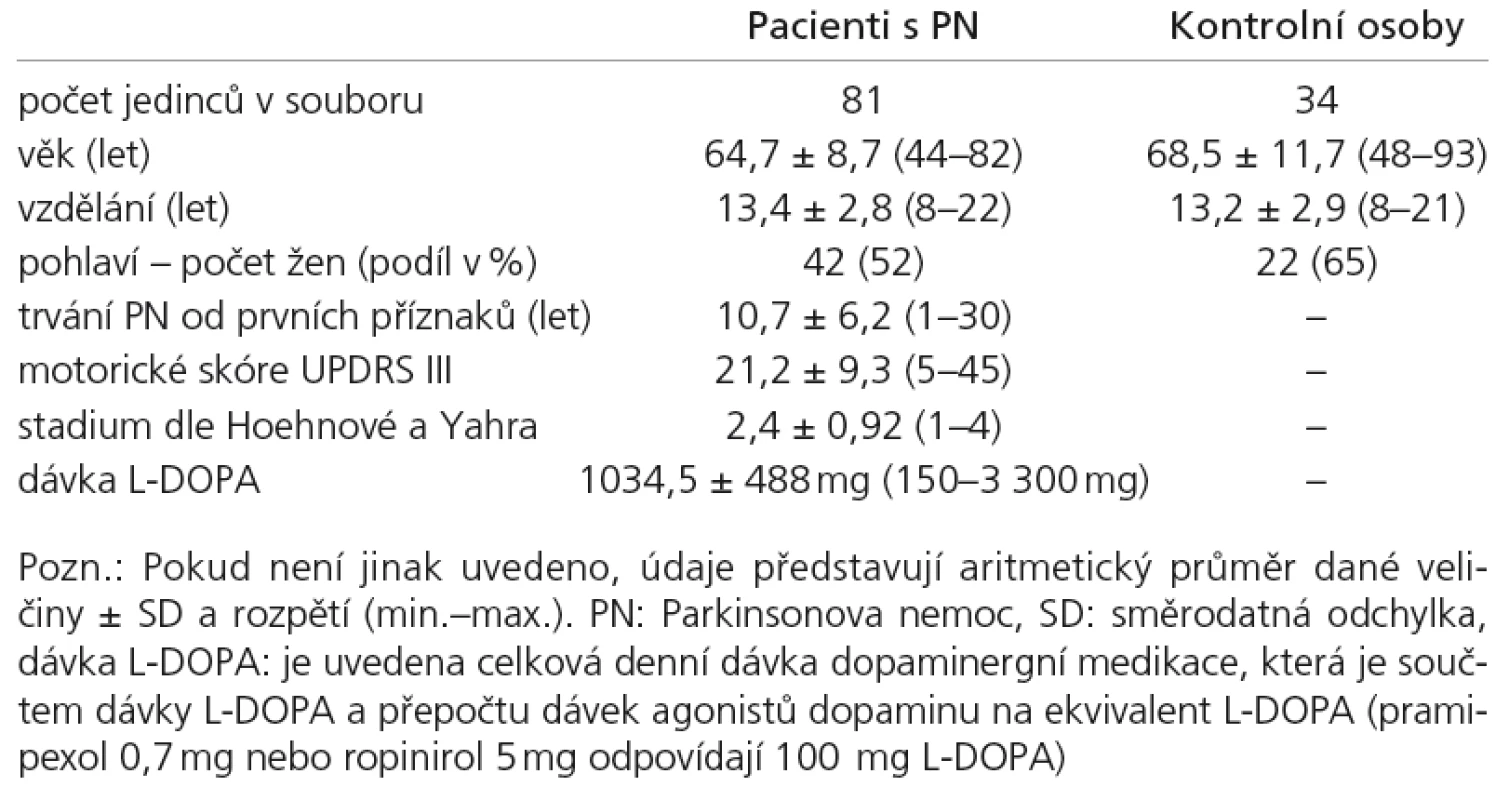
Sběr dat probíhal od června 2008 do dubna 2009. Všem probandům bylo administrováno MMS a MoCA ve střídavém pořadí (tj. prvnímu MMS‑MoCA, druhému MoCA‑MMS atd.), aby nedocházelo k efektu adaptace na testovou situaci u druhého testu v pořadí a zkreslení výsledků. U skupiny 14 retestovaných osob bylo rovněž při testu a retestu pořadí vždy obrácené, aby se vyrovnával efekt učení zejména u úkolů na paměťové schopnosti, protože ani MMS, ani MoCA nedisponují paralelními formami. V obou testech lze dosáhnout výsledku mezi 0–30 body. Shodné otázky na Orientaci v čase a prostoru a Odečítání čísla 7 byly administrovány vždy pouze jedenkrát, v průběhu prvního testu v pořadí, a skórovány dle rozdílných kritérií pro MoCA i MMS, abychom eliminovali vlivy opakování a adaptace na testovou situaci.
Vyšetření prováděli dva psychologové, kteří se předem zacvičili v administraci všech testů a shodli se na skórování. Retest byl administrován vždy stejným psychologem. Statistická analýza výsledků byla provedena pomocí programu SPSS 16 pro Windows [30]. Použili jsme deskriptivní statistiku a pro srovnání mezi skupinami vzhledem k nenormální distribuci dat neparametrických metod inferenční statistiky. Za hladinu statistické významnosti jsme zvolili a = 0,05.
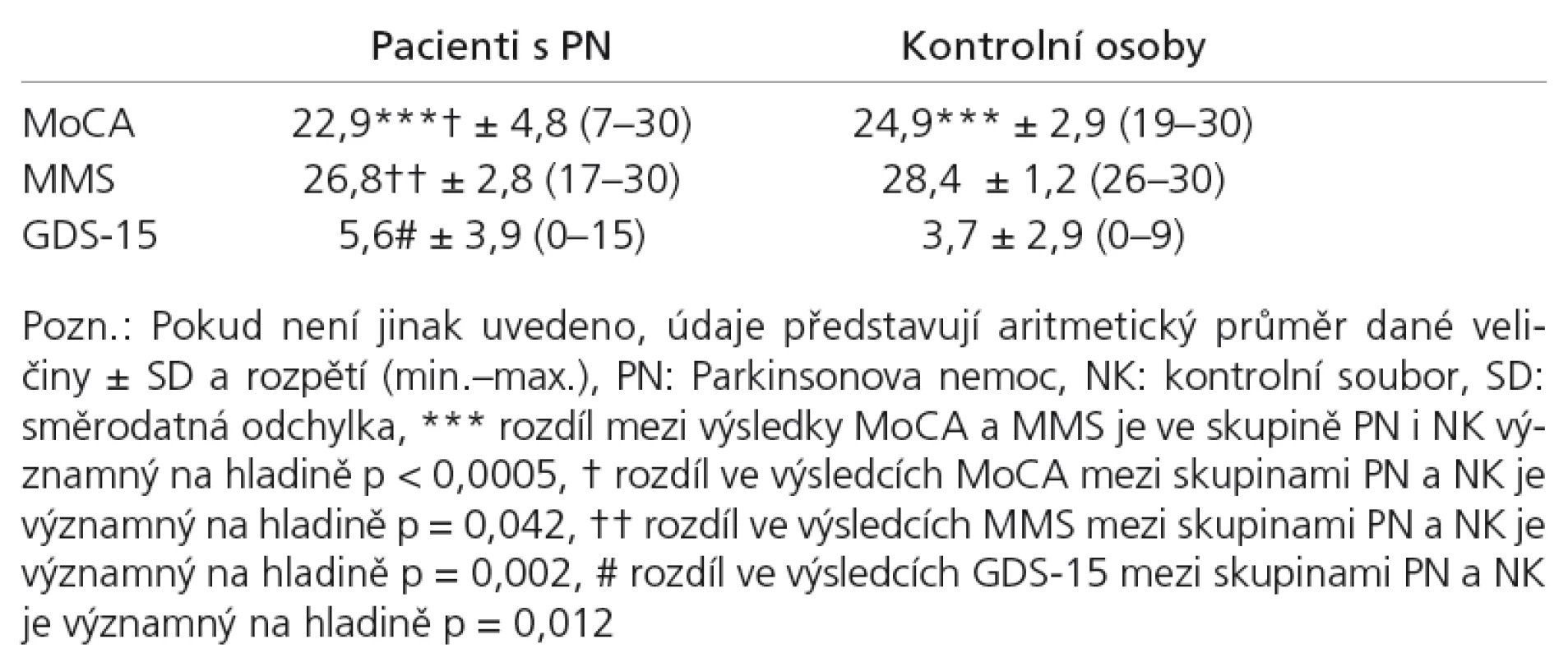
Výsledky
Data MoCA jen chabě splňovala nároky kladené na normální rozložení podle Kolomogorov‑Smirnovova testu v souboru PN (p = 0,098) i v souboru NK (p = 0,2). Data MMS v souboru PN (tentýž test, p < 0,0005) ani u NK (p = 0,001) tyto nároky nesplňovala. Proto jsme použili neparametrických metod analýzy dat, v případě korelační analýzy Spearmanova koeficientu korelace a při porovnání rozdílů mezi skupinami Mann‑Whitneyho U testu pro dva nezávislé výběry, pro rozdíly v testových výsledcích uvnitř skupin Wilcoxonova testu pro dva závislé výběry.
V tab. 2 je uveden přehled základních výsledků jednotlivých testů u obou sledovaných skupin. Z přehledu vidíme u skupin PN i NK podstatně vyšší variační rozpětí v testu MoCA oproti MMS (graf 1).

Srovnání mezi skupinami NK a PN
Celkové hrubé skóry MoCA se mezi skupinami NK a PN jen hraničně statisticky lišily: NK (medián = 25, n = 34) a PN (medián = 23, n = 81), p = 0,042, velikost účinku dle Cohena = 0,2. Celkové hrubé skóry MMS se mezi skupinami NK a PN lišily statisticky významně: NK (medián = 29, n = 34) a PN (medián = 27, n = 81), p = 0,002 (srov. graf 1). Velikost účinku = 0,3.
Srovnání výsledků MoCA a MMS
V testech MoCA a MMS je sice nutno předpokládat různou distribuci hrubých skórů, ale při použití neparametrické metody, konkrétně Wilcoxonova testu pro dva závislé výběry, který převádí hrubé skóry na pořadí, nemá aktuální distribuce skórů na výsledky vliv, a mohli jsme proto provést srovnání mezi výsledky obou testů. Celkové hrubé skóry MoCA se významně lišily od MMS jak ve skupině NK (z = –4,8; p < 0,0005; velikost účinku 0,6), tak ve skupině PN (z = –7,3; p < 0,0005; velikost účinku 0,2). Jedná se tedy o odlišně obtížné metody, jak již naznačily popisné charakteristiky v tab. 2. Pokud vymezíme výskyt kognitivního deficitu u PN hranicí méně než 26 bodů v obou testech [17], vykázala MoCA ve srovnání celkových skórů s MMS vyšší záchyt (74,1% v MoCA oproti 38,3% v MMS).
Vztah MoCA k demografickým charakteristikám
Věk má statisticky významný vliv na vý-kon v MoCA (ve smyslu čím starší jedinec, tím horší výkon) u PN (Spearmanův rho = –0,34; p < 0,002), ale nikoliv u NK (rho = 0,17; p = 0,34). Obdobně v případě MMS u PN rho = –0,27; p = 0,016, u NK rho = 0,004; p = 0,98. Výsledky též naznačily hraničně signifikantní vliv vzdělání na výkon v MoCA (ve smyslu čím vyšší vzdělání, tím lepší výkon) v MoCA (rho = 0,2; p = 0,03), ale v MMS byl výsledek statisticky nevýznamný (rho = 0,12; p = 0,2). Neprokázali jsme významný rozdíl v kognitivním výkonu pro muže a ženy (p = 0,27; velikost efektu dle Cohena = 0,1 byla malá). Obdobné výsledky platí pro vliv pohlaví v MMS (p = 0,51; velikost efektu = 0,06).
Vztah ke klinickým údajům
Neprokázali jsme žádný statistický vztah mezi dobou trvání PN a kognitivním výkonem (rho = –0,17; p = 0,89) v MoCA ani MMS (rho = –0,07; p = 0,55). Nalezli jsme však signifikantní korelaci mezi kognitivním výkonem v MoCA a tíží pohybového postižení dle UPDRS (část III, suma položek 18–31), která přetrvávala i po korekci na trvání PN (pacientů, pro něž byly k dispozici všechny údaje, bylo n = 43, parciální korelační koeficient z korektně vypočítaných pořadí, rho = –0,37; p = 0,012; podobně u MMS rho = –034; p = 0,02).
Výše dávek dopaminergní medikace neměla statisticky významný vliv na kognitivní výkon pro MoCA (rho = –0,03; p = 0,79) ani pro MMS (rho = –0,14; p = 0,25).
Vztah k výsledkům GDS‑15
Celkové hrubé skóry GDS‑15 se mezi skupinami NK a PN statisticky lišily: NK (medián = 3, n = 34) a PN (medián = 4, n = 81), p = 0,012. V souboru PN jsme nalezli statisticky významnou korelaci mezi skóre depresivních symptomů ve zkrácené škále deprese GDS‑15 a kognitivním výkonem v testu MoCA (rho = –0,39; p < 0,0005) i v testu MMS (rho = –0,27; p = 0,02), obdobně i v souboru NK pro MoCA (rho = –0,49; p < 0,0005), avšak u MMS byla tato korelace nízká a nebyla statisticky významná (rho = –0,13; p = 0,47). Významný vliv deprese na celkový kognitivní výkon přetrvává i po korekci skóre GDS‑15 na věk u PN pro MoCA (parciální koeficient korelace z korektně vypočítaných pořadí, n = 43, rho = –0,37; p = 0,001) a MMS (rho = –0,27; p = 0,02), u NK pro MoCA (rho = –0,42; p = 0,02), avšak v MMS byla tato korelace opět velmi nízká a statisticky nevýznamná (rho = –0,07; p = 0,69). Rovněž jsme se snažili popsat vliv „subjektivní stížnosti na paměť“ dle položky 10 v GDS‑15: „Máte pocit, že v poslední době máte s pamětí více problémů než ostatní? Korelace po korekci na věk je střední a statisticky významná: činí u PN v MoCA (rho = –0,42; p < 0,0005) a MMS (rho = –0,35; p = 0,002), avšak u NK je velmi nízká a statisticky nevýznamná v MoCA (rho = –0,06; p = 0,75) a MMS (rho = –0,12; p = 0,51).
Psychometrické charakteristiky MoCA
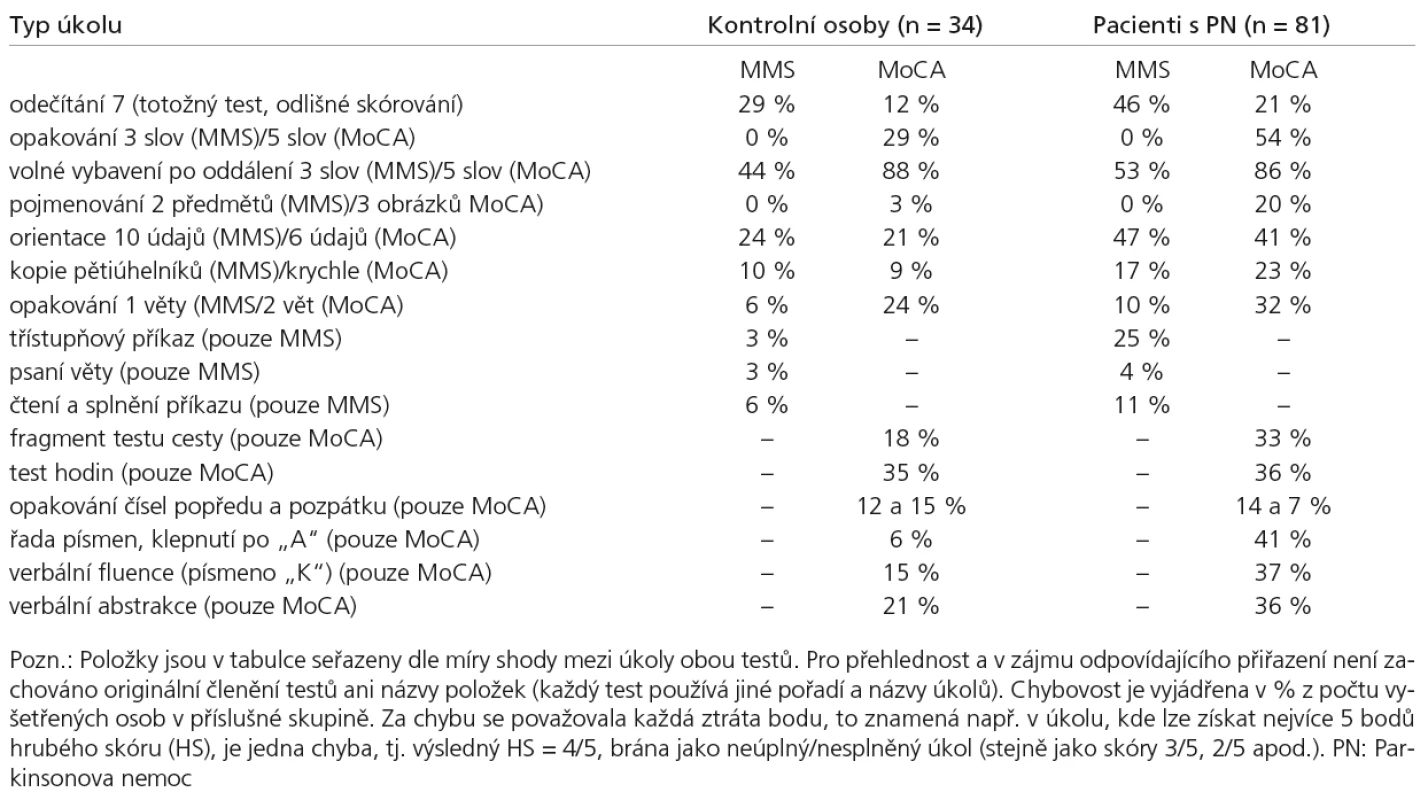
Ověření vnitřní konzistence (jednotlivé položky mezi sebou korelují, protože měří tutéž vlastnost) testu MoCA jsme provedli metodou split‑half r = 0,69. Rovněž Cronbachův koeficient alfa prokázal ve skupině PN dobrou konzistenci škály (a = 0,72). Test‑retestová reliabilita byla také vysoká (rho = 0,82; p < 0,0001). Konvergentní validita mezi MoCA a MMS v obou skupinách činila rho = 0,73 (p < 0,0001). Obsahovou validitu MoCA vzhledem k diagnostice kognitivního deficitu u PN podporuje, že skupina PN udělala více chyb v doménách typicky postižených u PN, které nejsou vyšetřovány v MMS (pro detailní přehled slouží tab. 3). V částech MoCA postihujících exekutivní funkce (v dílčích položkách prostorové orientace a řeči odvozených od testu cesty a testu verbální fluence) ztratilo body 33 a 37% pacientů s PN oproti 18 a 15% NK; 41% PN versus 6% NK chybovalo v zaměřené pozornosti (klepnutí po „A“), a 36% PN versus 21% NK ve verbální abstrakci. Některé z úkolů vyskytujících se v odlišné podobě v obou testech se v MoCA ukázaly být citlivější na průkaz kognitivního deficitu než v MMS , např. úloha Pojmenování ve skupině PN vykázala 20% chybovost v MoCA oproti 0% v MMS, v Opakování slov v MoCA chybovalo 54% pacientů s PN (ale též 29% NK) vůči 0% a 0% v MMS a v Opakování věty byl u PN výskyt chyb 32% v MoCA oproti 10% v MMS (ale též 24 a 6% u NK). Úkol Volného vybavení po oddálení ve variantě MoCA s pěti slovy nevykázal výrazně vyšší záchyt chyb než obdobný úkol s třemi slovy v MMS, a to ve stejné míře ve skupině PN i NK.
Časová efektivita testu MoCA
Průměrná doba administrace testu MoCAčinila 10,3 min, SD = 2,9 min, rozpětí5,2–18,7 min; MMS 4,8 min, SD = 2,3 min, rozpětí 2,5–17,3 min, (p < 0,0001). Administrace testu MoCA tedy vyžaduje v průměru přibližně dvakrát delší čas než v případě MMS. U obou testů byla ve skupině PN nalezena negativní korelace mezi dobou administrace testu a kognitivním výkonem MoCA (r = –0,63, p < 0,0005) a MMS (r = –0,52, p < 0,0005).
Diskuze
Výsledky naší studie naznačily, že test MoCA nemá výraznější diskriminační schopnost mezi skupinami NK a PN než test MMS. Ve srovnání s MMS však MoCA vykázal u pacientů s PN vyšší záchyt kognitivního deficitu vymezeného u obou testů hranicí méně než 26 bodů. Pacienti v MoCA více chybovali v doménách typicky postižených u PN, které nejsou vyšetřovány v MMS. Zároveň se ukázalo, že průměrný výkon v MoCA byl u skupiny NK o 5,1 bodu nižší, než je maximum bodového zisku v této škále, v MMS to bylo pouze o 1,6 bodu. Výkon v MoCA je tedy méně ovlivněn „efektem stropu“ (nižší počet vyšetřených osob získá výsledky u horní hranice testu) než MMS (graf 1). Tyto vlastnosti naznačují, že MoCA může být vhodnějším indikátorem kognitivního deficitu u PN a hodí se rovněž lépe jako skríningový test pro osoby s vyšším vzděláním.
Při interpretaci našich výsledků MoCA u PN se ukázaly být významnými činiteli věk (čím starší jedinec, tím nižší výkon) i vzdělání (čím vyšší, tím lepší výkon v testu). Toto zjištění se shoduje s obecnými poznatky u výkonových testů [31]. Podobně byla těsná závislost na věku doložena i normativní studií MMSE [15]. Tyto souvislosti je nutné brát v úvahu zejména při interpretaci výsledků u pacientů s extrémními hodnotami vzdělání či věku.
Z klinických parametrů se podobně jako v jiných studiích [32] jevila jako významná souvislost tíže motorických symptomů s parametry kognitivního výkonu. Obě složky postižení jsou ovšem zřejmě odrazem rozsahu a tíže neurodegenerativního poškození mozku [33].
Depresivní symptomy měřené GDS‑15 měly významný vliv na celkový kognitivní výkon v MoCA u obou našich vyšetřených skupin, v souladu s popsaným negativním vlivem depresivních symptomů na psychickou výkonnost a kvalitu života u starších osob [34,35]. Je proto důležité znát míru depresivity pacienta při interpretaci celkového hrubého skóru MoCA. Na rozdíl od MMS, korelace mezi kognitivním výkonem podle MoCA a depresivními symptomy přetrvávala u pacientů i u kontrol po korekci na vliv věku, což svědčí pro vyšší citlivost MoCA na projevy deprese a její vliv na kognitivní výkon. Výsledky je však nutno interpretovat opatrně vzhledem k omezené velikosti zkoumaného souboru a k citlivosti zkrácené verze GDS‑15 [36,37].
V souladu se zahraničními studiemi [16,17,38] jsme prokázali dobrou vnitřní konzistenci i test‑retestovou reliabilituMoCA, což značí, že test je metodou stabilní v čase a poskytuje spolehlivá měření kognitivního deficitu. MoCA měl dálevelmi vysokou konvergentní validitu s MMS. Tento výsledek je očekávaný, neboť oba testy se do jisté míry překrývají (stejné a podobné úkoly). Avšak teprve validační studie, která zhodnotí konvergentní validitu české verze MoCA s neuropsychologickou baterií (zlatým standardem neuropsychologického vyšetření), umožní stanovit diskriminační potenciál (senzitivitu a specificitu) MoCA pro detekci kognitivního deficitu u PN. Výsledky recentní zahraniční studie srovnávající MoCA a MMS s neuropsychologickou baterií naznačují, že MoCA disponuje velmi dobrou senzitivitou, avšak suboptimální specificitou pro diagnostiku mírné kognitivní poruchy a syndromu demence u PN [39].
Naše studie trpí několika omezujícími nedostatky. Nedisponujeme normativní studií testu MoCA (bohužel ani MMS) na české populaci, která by umožnila stanovení vážených skórů, jež by adekvátněji postihovaly pravý výkon v testu (vliv věku a vzdělání). Není ověřeno, zda cut‑off skóre < 26 bodů arbitrárně zvolené v předchozích pracích [17,40,21] je vhodnou hranicí pro detekci pacientů s ranou formou kognitivního deficitu u PN. Další omezení je dáno faktem, že česká verze MoCA [24] je doslovným překladem verze anglické a nebere ohled na vliv slovní délky na paměťové procesy. Např. z jednoslabičného „red“ ve verzi původní se stalo tříslabičné „červená“ ve verzi české. Tak došlo k prodloužení sylabického rozsahu subtestu Paměť z původních sedmi slabik u pěti anglických slov na dvanáct slabik u pěti slov českých, které mohlo být zdrojem vyššího počtu chyb u probandů z naší kontrolní skupiny. Tím mohl být způsoben i náznak nižší diskriminační schopnosti MoCA ve srovnání s MMS.
Za nevýhodu testu MoCA lze pokládat dobu jeho administrace, která byla v naší studii ve shodě se zahraničními pracemi významně delší než u MMS [16,17]. Výhody MoCA ve srovnání s MMS však převažují. Jsou jimi nejen existence jednotné české verze a její volná dostupnost, ale také vyšší záchyt typického kognitivního deficitu u PN (zejména díky subtestům na exekutivní funkce, pojmenování a zaměřenou pozornost). Test MoCA lze tedy považovat za vhodnou skríningovou zkoušku kognitivního deficitu u PN.
Podpořeno: VZ MSM0021620849, IGA MZ ČR NR 9220- 3
Přijato k recenzi: 4. 11. 2009
Přijato do tisku: 22. 1. 2010
prof. MUDr. Evžen Růžička, DrSc.
Neurologická klinika
1. LF UK a VFN v Praze
Kateřinská 30
128 21, Praha 2
e-mail: eruzi@lf1.cuni.cz
Sources
1. Foltynie T, Brayne CE, Robbins TW, Barker RA. The cognitive ability of an incident cohort of Parkinson’s patients in the UK. The CamPaIGN study. Brain 2004; 127(3): 550–560.
2. Muslimovic D, Post B, Speelman JD, Schmand B. Cognitive profile of patients with newly diagnosed Parkinson disease. Neurology 2005; 65(8): 1239–1245.
3. Riedel O, Klotsche J, Spottke A, Deuschl G, Förstl H,Henn F et al. Cognitive impairment in 873 patients with idiopathic Parkinson’s disease. Results from the German Study on Epidemiology of Parkinson’s Disease with Dementia (GEPAD). J Neurol 2008; 255(2): 255–264.
4. Aarsland D, Brønnick K, Larsen JP, Tysnes OB, Alves G; Norwegian ParkWest Study Group. Cognitive impairment in incident, untreated Parkinson disease: the Norwegian ParkWest study. Neurology 2009; 72(13): 1121–1126.
5. Aarsland D, Andersen K, Larsen JP, Lolk A, Kragh‑-Sørensen P. Prevalence and characteristics of dementia in Parkinson disease: an 8‑year prospective study. Arch Neurol 2003; 60(3): 387–392.
6. Sutcliffe RL, Meara JR. Parkinson’s disease epidemiology in the Northampton District, England, 1992. Acta Neurol Scand 1995; 92(6): 443–450.
7. Emre M, Aarsland D, Brown R, Burn DJ, Duyckaerts C,Mizuno Y et al. Clinical diagnostic criteria for dementia associated with Parkinson’s disease. Mov Disord 2007; 22(12): 1689–1707.
8. Marder K, Leung D, Tang M, Bell K, Dooneief G, Cote L et al. Are demented patients with Parkinson’s disease accurately reflected in prevalence surveys? A survival analysis. Neurology 1991; 41(8): 1240–1243.
9. Aarsland D, Larsen JP, Karlsen K, Lim NG, Tandberg E. Mental symptoms in Parkinson’s disease are important contributors to caregiver distress. Int J Geriatr Psychiatry 1999; 14(10): 866–874.
10. Holroyd S, Currie L, Wooten GF. Prospective study of hallucinations and delusions in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2001; 70(6): 734–738.
11. Dubois B. Is PD‑MCI a useful concept? Mov Disord 2007; 22(9): 1215–1216.
12. Janvin CC, Larsen JP, Aarsland D, Hugdahl K. Subtypes of mild cognitive impairment in Parkinson’s disease: progression to dementia. Mov Disord 2006; 21(9): 1343–1349.
13. Caviness JN, Driver‑Dunckley E, Connor DJ, Sabbagh MN, Hentz JG, Noble B et al. Defining mild cognitive impairment in Parkinson’s disease. Mov Disord 2007; 22(9): 1272–1277.
14. Folstein MF, Folstein SE, McHugh PR. “Mini‑mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12(3): 189–198.
15. Folstein MF, Folstein SE, McHugh PR. Mini‑Mental® State Examination (MMSE™). Lutz: Psychological Assessment Resources 2000.
16. Gill DJ, Freshman A, Blender JA, Ravina B. The Montreal cognitive assessment as a screening tool for cognitive impairment in Parkinson’s disease. Mov Disord 2008; 23(7): 1043–1046.
17. Zadikoff C, Fox SH, Tang‑Wai DF, Thomsen T, de Bie RM, Wadia P et al. A comparison of the Mini mental state exam to the Montreal cognitive assessment in identifying cognitive deficits in Parkinson’s disease. Mov Disord 2008; 23(2): 297–299.
18. Kulisevsky J, Pagonabarraga J. Cognitive impairment in Parkinson’s disease: tools for diagnosis and Assessment. Mov Disord 2009; 24(8): 1103–1110.
19. Hummelová‑Fanfrdlová Z, Rektorová R, Sheardová K, Bartoš A, Línek V, Ressner P et al. Česká adaptace Addenbrookského kognitivního testu. Cesk psychol 2009; 53(4): 376–388.
20. Topinková E, Jirák R, Kožený J. Neurokognitivní baterie pro screening demence v klinické praxi: Sedmiminutový screeningový test. Neurol pro praxi 2002; 3(6): 323–328.
21. Robben SH, Sleegers MJ, Dautzenberg PL, van Bergen FS, Ter Bruggen JP, Rikkert MG. Pilot study of a three‑step diagnostic pathway for young and old patients with Parkinson’s disease dementia: screen, test and then diagnose. Int J Geriatr Psychiatry 2010; 25(3): 258–265.
22. Nasreddine ZS, Phillips NA, Bedirian V, Charbonneau S, Whitehead V, Collin I et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005; 53(4): 695–699.
23. Nazem S, Siderowf AD, Duda JE, Have TT, Colcher A, Horn SS et al. Montreal cognitive assessment performance in patients with Parkinson’s disease with “normal” global cognition according to mini‑mental state examination score. J Am Geriatr Soc 2009; 57(2): 304–308.
24. Montrealský kognitivní test. 2010. Dostupné z URL: http://www.mocatest.org/pdf_files/MoCA‑Test‑Czech.pdf.
25. Rektorová, I. Neurodegenerativní demence. Cesk Slov Neurol N 2009; 72/105(2): 97–109.
26. Mahieux F, Fénelon G, Flahault A, Manifacier MJ, Michelet D, Boller F. Neuropsychological prediction of dementia in Parkinson’s disease. J Neurol Neurosurg Psychiatry 1998; 64(2): 178–183.
27. Lewis SJ, Dove A, Robbins TW, Barker RA, Owen AM. Cognitive impairments in early Parkinson’s disease are accompanied by reductions in activity in frontostriatal neural circuitry. J Neurosci 2003; 23(15): 6351–6356.
28. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico‑pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992; 55(3): 181–184.
29. Sheik JI, Yesavage JA, Geriatric Depression Scale. Recent Evidence and Development of a Shorter Version. In: Brink TL, Editor. Clinical gerontology: a guide to assessment and intervention. New York: Howarth Press 1986: 165–173.
30. Statistical Package for the Social Sciences 16.0 SPSS Inc. Chicago, Illinois 2007.
31. Lezak MD, Howieson DB, Loring DW, Hannay HJ, Fischer JS. Neuropsychological Assessment. 4th ed. New York: Oxford University Press 2004.
32. Glatt SL, Hubble JP, Lyons K, Paolo A, Tröster AI, Hassanein RE et al. Risk factors for dementia in Parkinson’s disease: effect of education. Neuroepidemiology 1996;15(1): 20–25.
33. Beach TG, Adler CH, Lue L, Sue LI, Bachalakuri J, Henry‑Watson J et al. Unified staging system for Lewy body disorders: correlation with nigrostriatal degeneration, cognitive impairment and motor dysfunction. Acta Neuropathol 2009; 117(6): 613–634.
34. Zakzanis KK, Leach L, Kaplan E. On the nature and pattern of neurocognitive function in major depressive disorder. Neuropsychiatry Neuropsychol Behav Neurol 1998; 11(3): 111–119.
35. Cubo E, Bernard B, Leurgans S, Raman R. Cognitive and motor function in patients with Parkinson’s disease with and without depression. Clin Neuropharmacol 2000; 23(6): 331–334.
36. Kafonek S, Ettinger WH, Roca R, Kittner S, Taylor N,German PS. Instruments for screening for depression and dementia in a long‑term care facility. J Am Geriatr Soc 1989; 37(1): 29–34.
37. Schrag A, Barone P, Brown RG, Leentjens AFG, McDonald WM, Starkstein S et al. Depression rating scales in Parkinson’s disease: critique and recommendations. Mov Disord 2007; 22(8): 1077–1092.
38. Lee JY, Dong Woo Lee, Cho SJ, Na DL, Hong Jin Jeon, Kim SK et al. Brief screening for mild cognitive impairment in elderly outpatient clinic: validation of the korean version of the montreal cognitive assessment. J Geriatr Psychiatry Neurol 2008; 21(2): 104–110.
39. Hoops S, Nazem S, Siderowf AD, Duda JE, Xie SX, Stern MB et al. Validity of the MoCA and MMSE in the detection of MCI and dementia in Parkinson disease. Neurology 2009; 73(21): 1738–1745.
40. Dubois B, Burn D, Goetz C, Aarsland D, Brown RG, Broe GA et al. Diagnostic procedures for Parkinson’s disease dementia: recommendations from the movement disorder society task force. Mov Disord 2007; 22(16): 2314–2324.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 2
Most read in this issue
- Huntingtonova nemoc
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Neurorehabilitace
