Indikace dekompresivní kraniektomie u traumat mozku
Indication of Decompressive Craniectomy in Traumatic Brain Injury
Backgrounds:
Decompressive craniectomy (DC) is a type of neurosurgical operation performed for the purpose of radical reduction of intracranial pressure, which enables sufficient cerebral perfusion and prevents from brain ischaemia. In severe traumatic brain injuries (Glasgow Coma Scale 3–8), the indication depends on the clinical status of the patient, findings of CT scans, on intracranial and perfusion pressure and on perioperativefindings.
Aim:
To identify the group of patients which most benefit from DC. To evaluate the significance of intracranial monitoring and level of decrease of intracranial pressure after DC. To summarize the main operation diagnoses and review the area of the performed DC.
Patient group and methods:
The study is based on three-year prospective monitoring of 81 patients undergoing DC after severe brain injury in 2003–2005. Control group was formed by 68 retrospectively analyzed patients who had undergone DC in the years 1996–1998. In both groups we analyzed age, sex, anamnesis, operative diagnosis, performed monitoring, timing of the operation, localization and the area of DC, GCS at the time of indication of DC and GOS 12 months after injury.
Results:
The group of patients younger than 50 years of age had good recovery (GOS 4–5) in 45% of cases and if these patients had even ICP monitoring, good recovery was present in 70% of cases, which was statistically significant (α < 0.05). After DC there was a statistically significant reduction in intracranial pressure from a mean of 31.8 mmHg to 9.2 mmHg 2 hours after the operation, and 11.0 mmHg 24 hours after the operation (p < 0.01), respectively. Most frequent operative diagnoses were: acute subdural haematoma in 56% of cases, and cerebral contusion in 25% of cases. Mean area of performed DC was 157 cm2.
Conclusion:
Good recovery in patients with severe traumatic brain injury is conditioned by early indication of DC according to ICP monitoring, by age under 50 years, and by performing sufficiently large decompression.
Key words:
decompressive craniectomy – traumatic brain injury – indicati on – monitoring
Authors:
V. Juráň 1; M. Smrčka 1; K. Svoboda 1; P. Fadrus 1; A. Šprláková 2; R. Gál 3
Authors‘ workplace:
Neurochirurgická klinika LF MU a FN Brno, 2Radiodi agnostická klinika LF MU a FN Brno, 3Klinika anesteziologi e, resuscitace a intenzivní medicíny LF MU a FN Brno
1
Published in:
Cesk Slov Neurol N 2009; 72/105(5): 439-445
Category:
Original Paper
Overview
Úvod:
Dekompresivní krani ektomi e (DK) je typ ne urochirurgické operace, která se provádí za účelem radikálního snížení nitrolebečního tlaku, což umožní obnovení dostatečné perfuze krve mozkem a zabrání jeho ischemizaci. U těžkých tra umat mozku (Glasgow Coma Scale 3– 8 b) se indikace DK opírá o klinický stav paci enta, CT nález, monitoring nitrolebečního a perfuzního mozkového tlaku a peroperační nález.
Cíl:
Určit skupinu paci entů, u kterých má DK největší léčebný efekt. Zhodnotit význam monitoringu nitrolebí a velikost poklesu nitrolebečního tlaku po provedení DK. Shrno ut hlavní operační di agnózy a poso udit plochu provedených DK.
So ubor a metodika:
Práce vychází z tříletého prospektivního sledování 81 paci entů, kterým byla v letech 2003– 2005 provedena DK po těžkém tra umatu mozku. Kontrolní so ubor tvořilo 68 retrospektivně vyhodnocených paci entů, kterým byla provedena DK v letech 1996– 1998. U obo u so uborů jsme vedle věku a pohlaví hodnotili anamnézu úrazu, operační di agnózu, zavedený monitoring, timing operace, lokalizaci a plochu DK, GCS v době indikace DK a GOS 12 měsíců od úrazu.
Výsledky:
Skupina paci entů stáří do 50 let měla dobrý výsledek léčby (GOS 4 a 5) ve 45 % případů, a pokud měli zaveden ICP monitoring, pak byl dobrý výsledek léčby dokonce v 70 % případů, což bylo statisticky významné (α < 0,05). Po provedení DK došlo u monitorovaných paci entů ke statisticky významnému poklesu nitrolebečního tlaku z průměrných 31,8 mmHg na 9,2 mmHg 2 hod po DK, resp. 11,0 mmHg 24 hod po DK (p < 0,01). Hlavní operační di agnózo u byl akutní subdurální hematom v 56 % případů a kontuze mozku v 25 % případů. Průměrná plocha provedené DK byla 157 cm2.
Závěr:
Dobré výsledky léčby paci entů po těžkém tra umatu mozku jso u podmíněny časno u indikací DK dle monitoringu ICP, věkem do 50 let a provedením dostatečně rozsáhlé dekomprese.
Klíčová slova:
dekompresivní kraniektomi e – úraz mozku – indikace – monitoring
Úvod
Dekompresivní kraniektomie (DK) je typ neurochirurgické operace, která se provádí za účelem radikálního snížení patologicky zvýšeného nitrolebečního tlaku (ICP) a současně dosažení dostatečně vysokého mozkového perfuzního tlaku (CPP). Bez této operace by u mnohých pacientů po těžkém traumatu mozku došlo velmi rychle k ireparabilnímu ischemickému poškození mozkové tkáně. Přestože se tento typ operace v posledních dvou desetiletích na většině neurochirurgických pracovišť indikuje častěji než v minulosti, panuje v indikačních kritériích nejednota. Důkazem toho jsou četné multicentrické studie, které v uplynulých letech proběhly, probíhají nebo se připravují. V posledních deseti letech máme díky technickému pokroku v medicíně mnohem větší možnosti monitorovat některé nitrolebeční parametry. Využití všech dostupných možností monitoringu je nutné i s ohledem na časté zavádění farmakologického kómatu u pacientů, čímž jsou běžná klinická vyšetření (neurologické vyšetření, Glasgow Coma Scale – GCS) znemožněna nebo značně zkreslena. Nezbývá, než se ve sledování pacienta opřít o monitoring výpočetní tomografií (CT), nitrolebečního tlaku (ICP), mozkového perfuzního tlaku (CPP) a saturace v jugulárním bulbu (SjO2). V klinických studiích se stále častěji uplatňuje i měření tkáňové oxymetrie (PtbO2) a mozkového krevního proudu (Cerebral Blood Flow – CBF).
Cílem práce bylo:
- určit, kteří pacienti po DK mají nejlepší výsledky léčby (GOS)
- zhodnotit velikost poklesu nitrolebečního tlaku po provedení DK
- zhodnotit význam monitoringu nitrolebí pro GOS
- shrnout hlavní operační diagnózy před DK
- porovnat plochu provedených DK s literárními doporučeními.
Soubor a metodika
V prospektivním souboru jsme hodnotili pacienty, u kterých byla provedena DK po těžkém traumatu mozku (GCS 3–8 b) v letech 2003–2005. Celkem bylo zařazeno 81 pacientů. DK jsme kontraindikovali pouze u pacientů moribundních (oboustranná areaktivní mydriáza, výrazná hypotenze, areflexie nad C1, závažná porucha koagulace). Pacienti splňující kritéria indikace DK (CT, monitoring, GCS, neurolog. stav) byli zařazeni. Věk nebyl vylučovacím kritériem.
Jako kontrolní soubor bylo retrospektivně vyhodnoceno 68 pacientů, u kterých byla provedena DK po těžkém traumatu mozku v letech 1996–1998.
Sledované parametry v obou souborech:
- věk a pohlaví pacienta
- anamnéza úrazu
- hlavní diagnóza indikující DK
- lokalizace provedené DK
- doba od úrazu po provedení DK
- použití ICP monitoringu
- GCS v době indikace DK nebo před farmakolog. ztlumením
- GOS 12 měsíců od úrazu
- přítomnost alkoholu v době úrazu
- plocha provedené DK v cm2.
Použitá indikační kritéria k provedení DK:
- GCS 3–8 b od úrazu nebo zhoršení klin. stavu k této hodnotě během hospitalizace
- závažný ložiskový neurologický nález
- areaktivní jedna nebo obě zornice
- CT nález hyperdenzní nebo smíšené parenchymové léze o objemu nad 30 ml
- CT nález extracerebrálního hematomu nad 10 mm šíře a objemu nad 50 ml
- CT přesun střední čáry nad 5 mm
- CT komprese či obliterace bazálních cisteren, III. nebo ipsilaterální postranní komory
- CT dilatace kontralaterální postranní komory
- CT nález hypodenzit jako projev proběhlé ischemie mozku
- ICP vzestup nad 25 mmHg déle než 60 min nebo opakované vzestupy nad 40 mmHg trvající déle než 5 min přes max. konzervativní terapii
- CPP pod 60 mmHg (do 15 let pod 50 mmHg) přes maximální konzervativní terapii
- operační nález – edém mozku s prominencí parenchymu nad úroveň durotomie.
Pacienti byli posuzováni v indikaci DK individuálně a splňovali vždy několik indikačních kritérií. Výjimkou byl operační nález, který mohl rozhodnout samostatně.
Dekompresivní kraniektomii jsme označili jako:
- primární, pokud byla provedena do 24 hodpo úrazu
- sekundární, pokud byla provedena později než 24 hod po úrazu.
Lokalizace, velikost a postup při provedení DK
U pacientů, kde byl patrný středočárový přesun, jsme indikovali dekompresivní kraniektomii na straně chirurgické léze. U pacientů bez stranového přesunu jsme indikovali bifrontální kraniektomii. U hemisferální DK zahrnovalo odstranění kosti frontální, parietální, okcipitální a temporální mozkový lalok, šupinu temporální kosti jsme vyštípali nebo odfrézovali až k bázi střední jámy, abychom uvolnili mediální část temporálního mozkového laloku komprimujícího zadní mozkovou tepnu o volný okraj tentoria a také abychom uvolnili tlak na mozkový kmen (obr. 1).
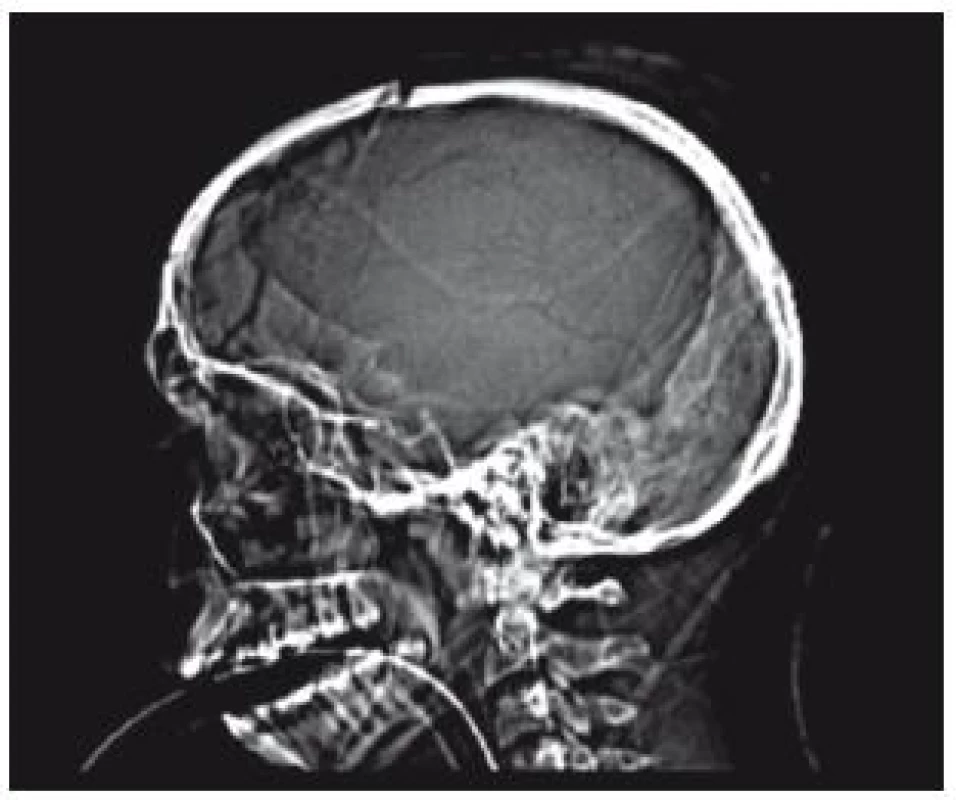
Frontální okraj kraniektomie zasahoval optimálně až k sinům v kosti čelní a mediální okraj byl necelé 2 cm od střední čáry. Celková plocha defektu kalvy se pohybovala v rozmezí 130–160 cm2. Po odklopení kosti a durotomii jsme obvykle odstranili u akutně indikovaných DK i expanzivní lézi (akutní subdurální hematom, prokrvácené kontuze, traumatický intracerebrální hematom – obr. 2).
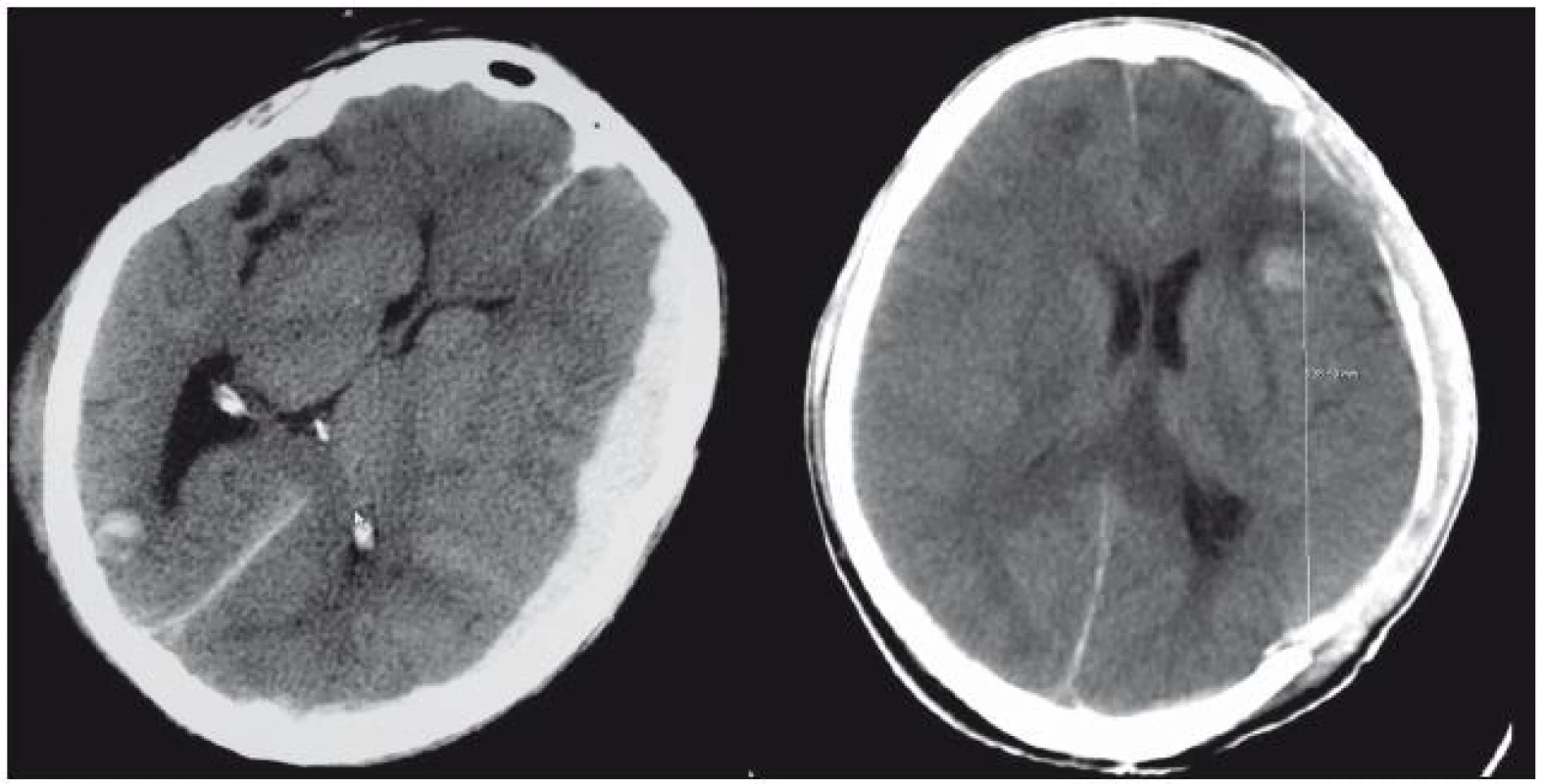
U sekundárně indikovaných DK nebyla u části pacientů expanzivní léze přítomna, byl zde pouze edém mozku, který způsoboval expanzi mozkové tkáně do durotomie. Durotomii jsme vedli ve tvaru písmene „U“ se stopkou při střední čáře s přidáním několika radiálních nástřihů k okraji kraniotomie. Výkon pokračoval po stavění zdrojů krvácení v intradurálním prostoru všitím široké plastiky do durotomie ve fronto-temporální oblasti periostem staženého z kožně‑svalového laloku nebo použitím umělé náhrady dury. V několika případech bylo nutno odsát část edematózní nebo kontuzemi změněné mozkové hmoty (vnitřní dekomprese), abychom mohli provést plastiku dury a sešití kůže. Pokud byla indikována DK po předchozí operaci provedené z kraniotomie, bylo nutno nejprve uskutečnit v návaznosti na původní kožní incizi nový řez kůží směrem parieto-okcipitálním a kranionožem odstranit další část kosti směrem parieto-okcipito-temporálním ve tvaru srpku měsíce. Původní kraniotomie má většinou podstatně menší rozměry (80–100 cm2) než doporučovaných 130–160 cm2 pro DK.
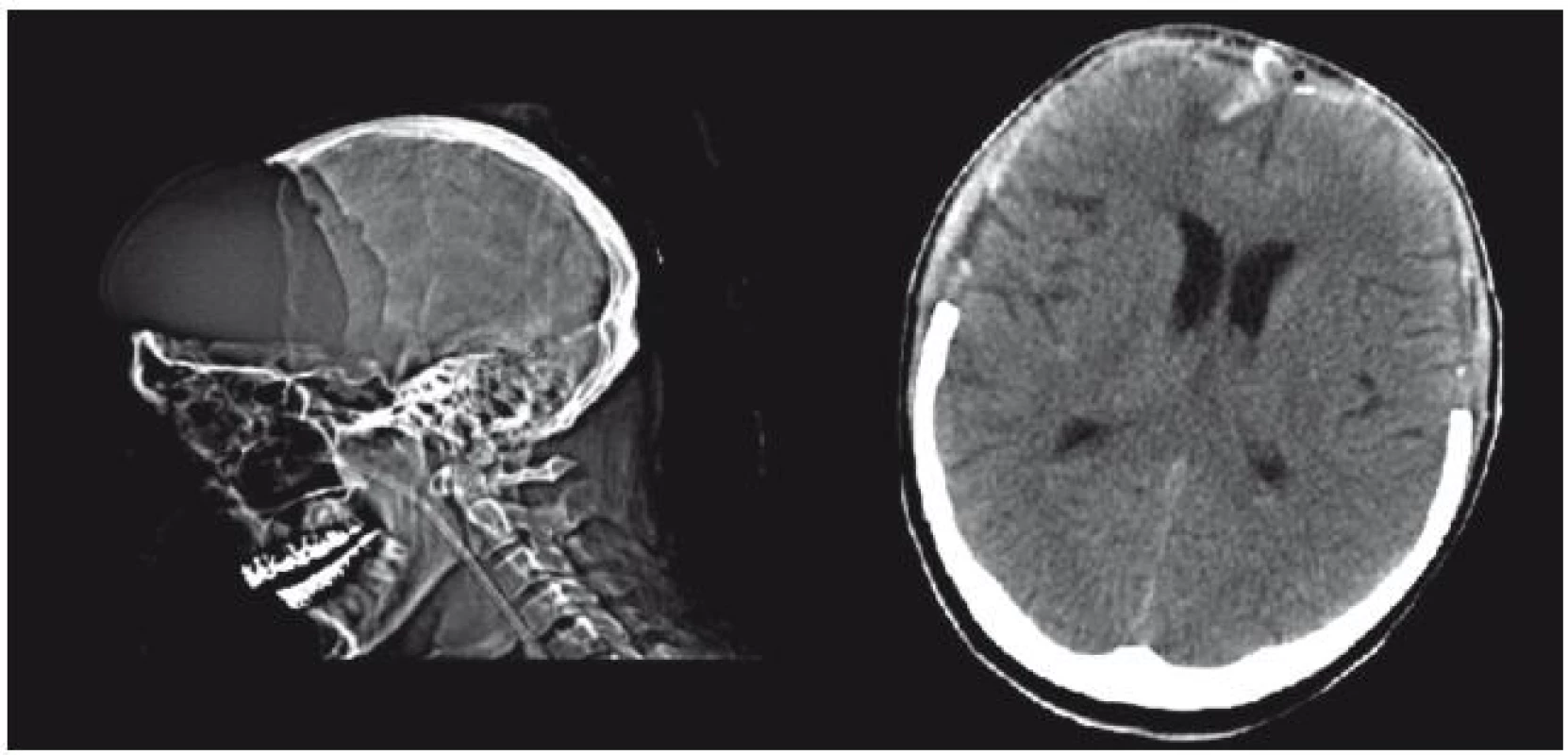
U bifrontální kraniektomie jsme podvázali sagitální splav u báze přední jámy a spolu s falxem jsme ho prostřihli, abychom zabránili traumatizaci edémem mozku elevovaného corpus calosum o dolní okraj falxu. Durotomii jsme prováděli ve tvaru písmene „U“ se základnou při koronárním švu a nástřihy jsme vedli k oblasti křídel klínové kosti. Plocha DK u bifrontálních dekompresí dosahovala velikosti až 200 cm2 (obr. 3).
Pacienti byli v pooperačním období vždy několik dnů tlumeni a uměle ventilováni, kontrolní CT jsme indikovali nejčastěji do 24 hod po dekompresivní operaci a dále s odstupem 2–3 dnů dle klinického průběhu. Parenchymové čidlo na měření nitrolebečního tlaku, pokud nebylo zavedeno již před operací, jsme zavedli na sále po ukončení DK do druhostranné mozkové hemisféry z předního Kocherova bodu. Čidlo jsme obvykle ponechali zavedeno 7–10 dnů, pouze v případech rychlého zlepšení bylo zrušeno následující den po extubaci. U prolongovaného komatózního stavu bylo čidlo kolem 10. dne zrušeno a bylo zavedeno čidlo nové.
Část pacientů tlumených při umělé plicní ventilaci jsme uvedli do mírné hypotermie (34 °C) na dobu 4–6 dnů. Pokud se pacient po farmakologickém odtlumení neprobíral a CT nález neobjasnil příčinu prolongovaného kómatu, bylo v některých případech plánováno MR vyšetření, aby bylo potvrzeno difuzní axonální poranění (DAP).
Výsledek léčby byl hodnocen s odstupem 12 měsíců dle škály GOS: 1 smrt, 2 perzistující vegetativní stav (není kortikální aktivita), 3 těžká invalidita (pacient je při vědomí, ale závislý), 4 mírná až střední invalidita (pacient je nezávislý, ale neschopen se vrátit k předchozím aktivitám), 5 zotavení (návrat k předchozím aktivitám). Výsledek léčby byl hodnocen jako dobrý při GOS 4, 5 a špatný při GOS 3–1.
Informace o GOS jsme získali několika způsoby. Některé pacienty jsme kontaktovali telefonicky, část jsme pozvali na vyšetření. V několika sporných případech jsme o vyjádření požádali rodinu, ošetřujícího lékaře nebo ambulanci spádové nemocnice.
Výsledky
Průměrný věk pacientů byl v obou souborech shodně 45,8 roků. Podmínka normálního rozložení dat byla splněna (KS test). Poměr žen a mužů byl 6 : 75, což je důsledek obecně nižšího zastoupení žen mezi pacienty s traumatem mozku v České republice, než je obvyklé v Evropské unii, kde ženy tvoří až čtvrtinu pacientů (graf 1).

V souboru pacientů byla provedena pravostranná DK v 37 %, levostranná DK v 57 % a bifrontální DK v 6 % případů. Oboustrannou DK jsme neindikovali u žádného z pacientů, pouze u kontrolního souboru se tato indikace objevila 3krát (1krát při jedné operaci, 2krát jako doplnění jednostranné DK pro progresi klinického a CT nálezu).
Hlavními operačními diagnózami u akutně provedených primárních DK byly akutní subdurální hematomy (ASH, 56 %) a akutní epidurální hematomy (AEH, 5 %).
Kontuze mozku v kombinaci s traumatickým intracerebrálním hematomem (K + ICH, 25 %) měly v polovině případů vliv na indikaci primární DK, v polovině případů vedly k sekundární DK.
Difuzní axonální poranění (DAP, 7 %) a traumatický edém mozku (BE, 7 %) byly většinou při indikacích sekundární DK (graf 2).

Podíl sekundárních DK stoupl z 12 % u retrospektivního souboru na 28 % u prospektivního souboru, což bylo statisticky významné (α < 0,05) a potvrzuje to aktivnější chirurgický přístup v posledních letech, který byl částečně umožněn nárůstem počtu zaváděného monitoringu z 5 % u retrospektivního souboru na 30 % u prospektivního souboru.
GCS bylo při indikaci DK nebo před uvedením do farmakologického kómatu u všech pacientů v rozmezí 3–8 b a z toho bylo 75 % případů dokonce ve stavu kmenového kómatu nebo s decerebrační symptomatikou (GCS 3–4 b). Více než polovina těchto pacientů měla jednu nebo obě zornice areaktivní. Plochu odstraněné kosti jsme vypočítali z rozměrů části lebky odeslané do tkáňové banky nebo uložené do podkožní tkáně v podbřišku pacienta s připočtením 10 % na průřez kosti kranionožem a vyštípání šupiny spánkové kosti k bázi střední jámy lebeční.
Průměrná plocha odstraněné kalvy byla 157 cm2 při velikostech od 80 cm2 do 216 cm2.
U 23 pacientů prospektivního souboru jsme sledovali pokles ICP 2 hod, resp. 24 hod po provedení DK (graf 3). Průměrná hodnota ICP před DK byla 31,8 mmHg, 2 hod po DK pokleslo ICP na 9,2 mmHg (24 hod po DK bylo ICP 11,0 mmHg), což byl statisticky velmi významný pokles (p < 0,01).

Porovnání dobrého výsledku léčby (GOS 4–5) a špatného výsledku léčby (GOS 1–3) s věkem pacienta v dekádách zobrazuje graf 4.

V porovnání dobrého a špatného GOS nebyl nalezen statisticky významný rozdíl mezi oběma soubory. Dobrý výsledek léčby byl však v obou souborech výrazně limitován 5. dekádou věku. Nejstarší pacient, který přežil s dobrým výsledkem léčby, měl 46 roků.
Porovnání GOS u pacientů s monitoringem a bez monitoringu v prospektivní skupině pacientů do 50 let věku zobrazuje graf 5.

Byl prokázán statisticky významný rozdíl v hodnotě GOS mezi skupinou pacientů bez monitoringu a s monitoringem ICP (α < 0,05).
Diskuze
Chirurgická léčba úrazů hlavy byla poprvé zaznamenána v papyrusu Edwina Smithe z roku kolem 1700 před naším letopočtem a popisuje tyto operace prováděné v období 3000–2500 před naším letopočtem [1]. Roku 1901 Kocher jako první chirurg publikoval dekompresi nitrolebí u posttraumatického otoku mozku [2]. V roce 1905 popsal Cushing subtemporální kraniektomii provedenou ke snížení nitrolebečního tlaku u pacienta s inoperabilním tumorem mozku [3].
V 70. letech minulého století, kdy končila éra neurochirurgie bez CT, bylo publikováno několik prací o dekompresivních kraniektomiích, které měly vysokou mortalitu, a možná proto zájem o tyto operace nebyl velký [4]. Práce prof. Mračka z roku 1977 popisuje provádění dekompresivních kraniektomií u poúrazového edému mozku indikovaných podle angiografie [5].
V posledních dvou dekádách 20. století byla léčbě úrazů hlavy a mozku věnována zvýšená pozornost. Byl postupně pochopen mechanizmus primárního a sekundárního poškození mozku, což vedlo k většímu tlaku na neurochirurgy, aby řešili nejen následky primárního poškození, ale věnovali pozornost i sekundárnímu poškození mozku [6].
Došlo k masivnímu rozšíření a zdokonalení CT diagnostiky, která je dosud zcela zásadní pro léčbu úrazů hlavy [7]. V roce 1974 byla publikována Glasgowská škála popisující kvantitativní poruchu vědomí a ta tvoří dodnes základ klinického sledování pacientů po traumatu mozku [8]. Byla vytvořena podrobná CT klasifikace závažnosti kraniocerebrálního poranění [9]. Nitrolebeční monitoring je nyní doporučován u všech pacientů s traumatickým poškozením mozku, kde GCS je mezi 3–8 b [10]. Je kladen důraz na udržování hodnoty perfuzního tlaku nad 60 mmHg, u pacientů do 15 let nad 50 mmHg. Nové technologie, které se zatím uplatňují v klinických studiích, umožňují měření různých parametrů v mozkové tkáni, jako jsou CBF, PtbO2, hladina glukózy a laktátu. Stále více se užívá v časném poúrazovém období mírná hypotermie [11]. Objevují se četné experimentální práce, které studují na krysích modelech dočasnou ischemizaci mozku [12], případně efekt následně provedené dekompresivní kraniektomie [13].
V první dekádě 21. století zájem o DK pokračuje a výsledky probíhajících randomizovaných studií snad sjednotí pohled na tuto, pro některá pracoviště stále ještě kontroverzní léčebnou metodu.
RESCUEicp (Randomised Evaluation of Surgery with Craniectomy for Uncontrollable Elevation of Intracranial Pressure) je mezinárodní multicentrická studie realizovaná ve spolupráci mezi univerzitou v Cambridge a EBIC (European Brain Injury Consortium). Kritéria pro zařazení jsou těžké trauma mozku, věk mezi 10–65 lety, nitrolebeční hypertenze nad 25 mmHg přes maximální konzervativní terapii s vyloučením barbiturátů. Pacienti jsou randomizováni do skupiny medikamentózní terapie (již s použitím barbiturátů) a do chirurgické skupiny s provedením DK a následnou terapií bez barbiturátů. Primární outcome je hodnocen dle GOS. Sekundární outcome zahrnuje dotazník kvality života, ICP hodnoty, trvání hospitalizace a ekonomickou analýzu. Bude randomizováno 600 pacientů, v březnu 2009 jich bylo randomizováno 178 [14].
DECRA (The DEcompressive CRAniectomy) je randomizovaná multicentrická studie probíhající v Austrálii. Vstupními kritérii jsou těžké trauma mozku a vzdorující nitrolebeční hypertenze nad 20 mmHg. Cílem je randomizovat 210 pacientů, konec studie je očekáván v roce 2010 [15].
V Číně proběhla randomizovaná studie hodnotící efekt velikosti kraniektomie na výsledný outcome. V pěti centrech bylo randomizováno celkem 486 pacientů s refrakterní nitrolebeční hypertenzí po traumatu mozku. Populace pacientů byla rozdělena na skupinu léčenou standardní kraniektomií o rozměrech 12 × 15 cm a na skupinu léčenou kraniektomií o limitovaných rozměrech 6 × 8 cm, běžných pro klasickou kraniotomii. Výsledek byl hodnocen dle GOS ve škále dobrý výsledek (GOS 4, 5) a špatný výsledek (GOS 1–3). Skupina se standardní DK měla dobrý výsledek ve 39,8 % proti 28,6 % u limitované DK, což bylo statisticky významné (p < 0,05) [16].
V našem souboru byla průměrná plocha DK 157 cm2 (u kontrolního 140 cm2), tedy plně v souladu s doporučovanými rozměry.
Pediatrická randomizovaná-kontrolovaná studie proběhla v Austrálii [17]. Studie hodnotila 27 pacientů ve věku 1–15 let. Zpočátku byli pacienti léčeni dle protokolu ventrikulostomií, sedací, relaxací, osmoterapií, mírnou hypotermií, elevací těla a hlavy. Sledovaly se příznaky herniace mozku a prolongované elevace ICP. Čtrnáct pacientů bylo léčeno jen konzervativně, u 13 byla provedena bitemporální kraniektomie bez plastiky dury. Randomizace byla provedena v časovém rozpětí mezi 3–29 hod od úrazu a operace proběhla do 3 hod po randomizaci. Výsledky studie potvrdily nižší riziko smrti a trvalého těžkého postižení u skupiny s dekompresivní kraniektomií.
V roce 1997 publikovali Polin et al retrospektivní studii, v níž prokazovali snížení ICP, příznivější GOS a snížení mortality u pacientů s nitrolebeční hypertenzí po traumatu mozku, u kterých byla provedena bifrontální DK [18].
Compagnone et al ve studii z roku 2005 hodnotili retrospektivně 181 DK [10]. Střední věk byl 45 roků, což se shoduje s našimi soubory. Primárních DK bylo 134 s průměrným věkem 46 roků, sekundárních DK bylo 47 s průměrným věkem 37 roků. Prakticky stejný poměr primárních a sekundárních DK vyšel i v našem souboru (72, resp. 28 %). Dosud je široce probírána otázka ideálního timingu DK [19,20]. Pacienty je možno na základě CT, klinického stavu a monitoringu rozdělit na dvě poněkud odlišné skupiny:
První skupinu tvoří pacienti, kteří mají dle akutního CT nejčastěji intrakraniální expanzivní lézi (akutní subdurální hematom, kontuzi mozku, traumatický intracerebrální hematom), a ti jsou pak indikováni k akutní (primární) dekompresivní kraniektomii do 24 hod po úrazu [10].
Indikací k primární DK byla shodně nejčastěji nutnost eliminovat expanzivní efekt (přesun střední čáry mezi 5 a 20 mm), odstranit expanzivní lézi (nejčastěji ASH 56 %) a reagovat na špatný klinický stav. Některým pacientům je intrakraniální léze odstraněna nejprve z klasické kraniotomie nebo dekompresivní kraniotomie [21], protože klinický stav, CT ani peroperační nález nenutily neurochirurga provést DK již při akutním výkonu. V časném pooperačním období však probíhající sekundární poškození mozku někdy zhorší klinický stav, CT nález a hodnoty monitoringu natolik, že je nutno DK provést jako druhý výkon.
Otázka indikace akutní operace nebo primárního konzervativního postupu je velmi diskutabilní zvláště u hraničních objemů hematomů, kontuzí a edémů mozku. Chirurg musí volit mezi akutní operací (která ale nemusí být vždy nezbytná) a konzervativním postupem, který může skončit náhlou neurologickou deteriorací a operace pak již přichází pozdě. Zvláště zákeřné jsou v tomto směru bifrontální a bitemporální kontuze. Zde bychom měli aktivně zasáhnout, pokud je GCS 8 b a méně, objem kontuze je větší než 20 cm3, je přítomna komprese bazálních cisteren či komor nebo při přítomnosti přesunu střední čáry nad 5 mm [20].
Nevyřešenou zůstává skupina pacientů s bifrontálními nebo bitemporálními kontuzemi nechirurgické velikosti s GCS 9–14 b, kterým se monitoring nitrolebí většinou nezavádí. CT nález je na kontrolních vyšetřeních bez zřetelné progrese a 6.–10. den po úrazu dochází u malé části pacientů k náhlému zhoršení stavu, kdy ani urgentní operace pacienta vždy nezachrání. Zde by snad bylo řešením od určitého objemu kontuze (např. 25 cm3) na CT indikovat monitoring nitrolebí, přestože klinický stav pacienta není příliš závažný.
Druhá skupina pacientů je bez expanzivní léze, je přítomen pouze otok mozku na CT a nízké GCS. Zde je metodou volby indikováno zavedení ICP čidla (parenchymové nebo s měřením přes zevní komorovou drenáž) a dle hodnot během prvních hodin nebo dnů maximální konzervativní terapie rozhodnout o dalším postupu.
V prospektivním souboru pacientů se sekundární DK byla primárně konzervativní terapie zavedena u 23 pacientů (28 %) a monitoring tvořil vedle CT nálezu jednu z hlavních indikačních modalit. Další, méně používanou možností je volit i u těchto pacientů DK jako jednu z prvních léčebných metod [22]. Časová ztráta u primárně konzervativního postupu může být někdy fatální, jiní autoři ale poukazují na akceleraci edému mozku u některých pacientů po provedení DK [23].
Vzestup ICP bez souvislosti s intrakraniální hemoragií je hlavní faktor zvyšující mortalitu a morbiditu po těžkém úrazu mozku. U těchto pacientů doporučuje EBIC (European Brain Injury Consortium) a AANS (American Association of Neurological Surgeons) několik léčebných postupů na úrovni „options“: barbiturátové kóma, řízená hyperventilace, mírná hypotermie a chirurgická dekomprese.
Léčba vysokého ICP se v první řadě zaměřuje na redukci objemu jednotlivých kompartmentů. Užití osmotické terapie nebo resekce patologické mozkové tkáně redukuje kompartment parenchymu. Zevní drenáží likvoru redukujeme prostor vyplňující mozkomíšní mok. Intravaskulární kompartment je redukován zlepšením venózní drenáže elevací těla a hlavy, zlepšením krevní reologie a vaskulární konstrikcí při hypokapnii. Když tyto postupy neuspějí v redukci ICP, dekompresivní kraniektomie odstraní mechanické omezení rigidní lebky [6,18]. Efekt DK na hodnotu ICP prokázala i retrospektivní studie Coopera hodnotící pokles ICP s odstupem 24 hod po DK. Pokles z 29 na 14 mmHg byl statisticky významný a velikost poklesu korelovala s velikostí plochy DK [23], což bylo potvrzeno i výsledky v našem prospektivním souboru (graf 3). Pozitivní přínos sledování ICP pro prognózu pacienta vidíme v možnosti kdykoliv během 24 hod neodkladně zahájit výše uvedenou léčbu vysokého ICP, a pokud nedojde k rychlé odpovědi (do 60 min u ICP nad 25 mmHg, do 5 min u ICP nad 40 mmHg), pak indikovat urgentní DK (graf 5).
Samostatnou skupinu tvoří pacienti s abúzem alkoholu a porušenou hemostá-zou. U pacientů s chronickým abúzem alkoholu vedle hypokoagulační situace dochází rychle k poklesu trombocytů a stav může progredovat k DIK. Závažná porucha koagulace je natolik nepříznivým prognostickým faktorem, že nás zvláště u starších pacientů s těžším poškozením mozku vede k rozhodnutí o pasivním nebo paliativním způsobu léčby [20,24]. V prospektivním souboru pacientů byl podíl alkoholu v anamnéze úrazu vedoucího k DK 35 %, což překračuje údaje většiny prací [10]. Nízká míra spoluúčasti pacientů na léčbě úrazů v České republice může podle našeho názoru přispívat k nezodpovědnému chování části populace.
Věk pacienta by neměl být rozhodující, pokud se jedná o operaci odstraňující expanzivní lézi (ASH, AEH, K+ICH) radikálně z „klasické kraniotomie“. Věk pacienta nad 60 let je však okolností, která by měla podle četných prací i podle výsledků v našich obou souborech indikovat způsob léčby bez dekompresivní kraniektomie.
U sekundární DK bychom pak měli považovat za kontraindikační kritérium již věk pacienta nad 50 let [25–28].
V prospektivním souboru pacientů byl nejstarší pacient s provedenou DK, který přežil při hodnocení (GOS 2–5), ve věku 46 let. Všichni starší pacienti v prospektivním souboru zemřeli (GOS 1). V kontrolním souboru byl nejstarší pacient s dobrým výsledkem léčby (GOS 4 a 5) ve věku 49 let. Pět pacientů ve věku mezi 49–59 roky, měli GOS 3, ale tuto hodnotu považujeme za špatný výsledek léčby. Ostatní pacienti nad 59 let měli GOS 1 [29,30].
Věk je tedy velmi silným prediktorem výsledku léčby po těžkém traumatu mozku a pacienti nad 50 roků by měli být indikováni k DK výjimečně.
Závěry
- Dekompresivní kraniektomie není indikována u pacientů:
- nad 60 roků, kde je přítomna expanzivní léze (většina primárních DK)
- nad 50 roků, kde není přítomna expanzivní léze (většina sekundárních DK).
- Byl prokázán statisticky významný rozdíl výsledků léčby
mezi pacienty s monitoringem a bez monitoringu ve prospěch
monitorovaných (α < 0,05).
Byl prokázán statisticky velmi významný pokles nitrolebečního tlaku, který následuje bezprostředně po provedení DK (p < 0,01). - Vzestup ICP nad 25 mmHg trvající déle než 60 min nebo opakované vzestupy nad 40 mmHg trvající déle než 5 min, stejně tak pokles CPP pod 60 mmHg (do 15 let pod 50 mmHg) přes maximální konzervativní terapii jsou indikací pro urgentní DK.
- Nejčastější příčinou úrazů vedoucích k těžkému poškození mozku a indikaci DK byly pády (32 %), dopravní úrazy (31 %) a sportovní úrazy (7 %). Přítomnost alkoholu byla prokázána u 35% pacientů.
- Nejčastějšími hlavními diagnózami, které vedly k indikaci DK, byly akutní subdurální hematomy (56 %) a kontuze mozku (25 %).
- Plocha dekompresivní kraniektomie, která byla provedena v prospektivním souboru, měla průměrně 157 cm2 (80–216 cm) a pouze u sedmi pacientů byla pod doporučovanou minimální hodnotu 130 cm2.
MUDr. Vilém Juráň, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e‑mail:
vjuran@fnbrno.cz
Sources
1. Bre asted JH. The Edwin Smith Surgical Papyrus. Chicago: Chicago University Press 1930.
2. Kocher T. Di e Therapi e des Hirndruckes. In: Hölder A (ed). Hirnerschütterung, Hirndruck und chirurgische Eingriffe bei Hirnkrankheiten. Wi en: Hölder 1901: 262– 266.
3. Cushing H. The establishment of cerebral herni a as a decompressive me asure for inaccessible brain tumor, with the descripti on of intramuscular methods of making the bone defect in temporal and occipital regi ons. Surg Gynecol Obstet 1905; 1: 297– 314.
4. Clark K, Nash TM, Hutchison GC. The failure of circumferenti al crani otomy in acute tra umatic cerebral swelling. J Ne urosurg 1968; 29(4): 367– 371.
5. Mraček Z. Význam veliké dekompresivní krani ektomi e při edému mozku u těžkých krani ocerebrálních poranění. Rozhl Chir 1977; 56(9): 597– 605.
6. Smrčka M et al. Patofyzi ologi e poranění mozku. Edice kontinu álního vzdělávání. Brno: LF a MU v Brně 2002.
7. French BN, Dublin AB. The value of computerized tomography in the management of 1000 consecutive he ad injuri es. Surg Ne urol 1977; 7(4): 171– 183.
8. Te asdale G, Jennett B. Assessment of Coma and Impaired Consci o usness. A Practical Scale. Lancet 1974; 2(7872): 81– 84.
9. Marshall LF, Marshall SB, Kla uber M, Braakman R. A new Classificati on he ad injury based on computerized tomography. J Ne urosurg 1991; 75 (Suppl): S14– S20.
10. Compagnone C, Murray GD, Te asdale GM, Maas AIR, Esposito D, Princi P et al. The management of pati ents with intradural post‑tra umatic mass lesi ons: a multicenter survey of current appro aches to surgical management in 729 pati ents co ordinated by the EBIC. Ne urosurgery 2005; 57(6): 1183– 1192.
11. Gál R, Čundre I, Zimová I. Řízená hypotermi e u paci entů s těžkým poraněním mozku. Anest Ne odkl Péče 2000; 11: 174– 175.
12. Smrčka M, Otevřel F, Kuchtičková Š, Horký M, Juráň V, Duba M et al. Experimental Model of Reversible Focal Ischemi a in the Rat. Scripta Medica 2001; 74(6): 391– 398.
13. Weiwei H, Yu Y, Weiguo L. Decompressive crani ectomy as tre atment for a rat model of “malignant” middle cerebral artery infarcti on. Cesk Slov Ne urol N 2007; 70/ 103(4): 388– 391.
14. Hutchinson PJ, Corteen E, Czosnyka M, Mendelow AD, Menon DK, Mitchell P et al. Decompressive crani ectomy in tra umatic brain injury: the randomized multicenter RESCUEicp study (www.RESCUEicp.com). Acta Ne urochir Suppl 2006; 96: 17– 20.
15. Co oper DJ. The DECRA tri al: e arly decompressive crani ectomy in pati ents with severe tra umatic brain injury (Clinical Tri al Feeds website). Available at: http:/ / clinicaltri alsfeeds.org/ clinical- tri als/ show/ NCT00155987.
16. Ji ang JY, Xu W, Li WP, Xu WH, Zhang J, Bao YH et al. Efficacy of standard tra uma crani ectomy for refractory intracrani al hypertensi on with severe tra umatic brain injury: a multicentre, prospective, randomized controlled study. J Ne urotra uma 2005; 22(6): 623– 628.
17. Taylor A, Butt W, Rosenfeld J, Shann F, Ditchfi eld M,Lewis E et al. A randomized tri al of very e arly decompressive crani ectomy in children with tra umatic brain injury and sustained intracrani al hypertensi on. Childs Nerv Syst 2001; 17(3): 154– 162.
18. Polin RS, Shaffrey ME, Bogaev CA, Tisdale N, Germanson T, Bocchicchi B et al. Decompressive bifrontal crani ectomy in the tre atment of severe refractory posttra umatic cerebral edema. Ne urosurgery 1997; 41(1): 84– 94.
19. Chesnut RM, Marshall SB, Pi ek J, Blunt BA, Kla uber MR, Marshall LF. Early and late systemic hypotensi on as a frequent and fundamental so urce of cerebral ischemi a following severe he ad injury in the Tra uma Coma Data Bank. Acta Ne urochir Suppl (Wi en) 1993; 59: 121– 125.
20. Valadka AB, Robertson CS. Surgery of cerebral tra uma and associ ated critical care. Ne urosurgery 2007; 61 (Suppl 1): 203– 221.
21. Mraček J, Choc M, Mraček Z. Oste oplastická dekompresivní krani otomi e. Cesk Slov Ne urol N 2007; 70/ 103(3): 290– 293.
22. Albanèse J, Le one M, Alli ez J, Kaya J, Antonini F, Alli ez B, Martin C. Decompressive crani ectomy for severe tra umatic brain injury: Evalu ati on of the effects at one ye ar. Crit Care Med 2003; 31(10): 2535– 2538.
23. Co oper PR, Hagler H, Clark WK, Barnett P. Enhancement of experimental cerebral edema after decompressive crani ectomy: Implicati ons for the management of severe he ad injuri es. Ne urosurgery 1979; 4(4): 296– 300.
24. Juráň V, Smrčka M, Vidlák M. Programy kvality a standardy léčebných postupů, Chirurgi e/ 11. Poranění mozku. Praha: Verlag Dashöfer 2004.
25. Skoglund TS, Eriksson- Ritzén C, Jensen C, Rydenhag B. Aspects on decompressive crani ectomy in pati ents with tra umatic he ad injuri es. J Ne urotra uma 2006; 23(10): 1502– 1509.
26. Münch E, Horn P, Schürer L, Pi epgras A, Pa ul T, Schmidec P. Management of severe tra umatic brain injury by decompressive crani ectomy. Ne urosurgery 2000; 47(2): 315– 323.
27. Pi ek J. Decompressive surgery in the tre atment of tra umatic brain injury. Curr Opin Crit Care 2002; 8(2): 134– 138.
28. Mei er U, Gräwe A. The importance of decompressive crani ectomy for the management of severe he ad injuri es. Acta Ne urochir (Suppl) 2003; 86: 367– 371.
29. Jennett B, Bond M. Assessment of o utcome after severe brain damage. Lancet 1975; 1(7905): 480– 484.
30. Navrátil L. Dekompresivní krani otomi e u krani ocerebrálních poranění – hodnocení přežití a jeho kvality po jednom roce od úrazu. Cesk Slov Ne urol N 2007; 70/ 103(3): 294– 301.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2009 Issue 5
Most read in this issue
- Lumbální spinální stenóza a neurogenní klaudikace
- Disoci ativní křeče
- Indikace dekompresivní kraniektomie u traumat mozku
- Genetika Parkinsonovy nemoci
