Lumbální spinální stenóza a neurogenní klaudikace
Lumbar Spinal Stenosis and Neurogenic Claudicati on
Lumbar spinal stenosis (LSS) is an osteo‑ligamentous narrowing of the spinal or nerve root canal in the lumbar area. Most frequently, LSS results from secondary spondylotic and spondylarthrotic changes. Congenital stenosis is one of the less frequent causes of nerve structure compression but represents an important risk factor in the development of secondary changes. Neurogenic claudication is a typical pathognomic sign of LSS. According to our experience, LSS is often under- diagnosed, it is a frequent cause of lower back pain and contributes to impaired mobility in older age. Clinical picture can be divided into three main areas: 1. neurogenic claudication; 2. low back pain or nerve root pain; 3. signs of permanent multiple nerve root damage (chronic cauda equine syndrome). Magnetic resonance is the main imaging examination technique that facilitates evaluation of the entire spinal canal in the lumbar area, enables measurement of the dural sac area and high quality evaluation of soft structures (intervertebral discs, ligamentum flavum, contact with nerve roots etc). Conservative treatment, including exercise, ortheses, analgesics when needed for pain, non‑steroidal anti‑inflammatory drugs and muscle relaxants, is recommended in mild to moderate forms of the disease without progression. More severe forms with progression require surgical treatment (decompression, stabilization).
Key words:
lumbar spinal stenosis – ne urogenic cla udicati on – gait disorders – low back pain
:
S. Voháňka; B. Mičánková Adamová
:
Neurologická klinika LF MU a FN Brno
:
Cesk Slov Neurol N 2009; 72/105(5): 405-417
:
Minimonography
Lumbální spinální stenóza (LSS) je oste oligamentózní zúžení páteřního nebo kořenového kanálu v bederním úseku. Nejčastěji jde o sekundární spondylotické a spondylartrotické změny. Vrozená stenóza patří mezi méně časté příčiny komprese nervových struktur, může být ale významným rizikovým faktorem při rozvoji druhotných změn. Patognomickým znakem LSS jso u ne urogenní kla udikace. Dle vlastních zkušeností bývá LSS poddi agnostikována, je často u příčino u bolestí dolní části zad (low back pain) a přispívá k omezení mobility ve vyšším věku. Klinický obraz lze so ustředit do tří okruhů: 1. ne urogenní kla udikace; 2. bolesti dolní části zad (lumbalgi e) a kořenové bolesti (lumbo ischi algi e); 3. trvalé známky vícekořenového postižení (chronický syndrom ka udy equiny). Základním zobrazovacím vyšetřením je magnetická rezonance, která umožňuje poso udit celý páteřní kanál v bederní oblasti, změřit plochu durálního vaku a kvalitně zhodnotit měkké struktury (ploténky, žluté vazy, vztah ke kořenům atd.). U lehkých a středně těžkých forem onemocnění bez progrese je doporučována konzervativní léčba: cvičení, ortézy, při bolestech analgetika, nestero idní antiflogistika, myorelaxanci a. U těžších forem s progresí je léčebno u metodo u operace (dekomprese, stabilizace).
Klíčová slova:
lumbální spinální stenóza – ne urogenní kla udikace – poruchy chůze – bolesti v zádech
Vymezení pojmu
Za lumbální spinální stenózu (LSS) je označována nediskogenní komprese kaudy equiny způsobená nejčastěji spondylózními změnami, v některých případech se na klinických projevech významně podílí vrozeně úzký páteřní kanál [1]. Jde tedy o zúžení páteřního nebo kořenového kanálu osteoligamentózního původu v bederním úseku páteře [2]. Za lumbální stenózu se nepovažuje zúžení páteřního kanálu na podkladě akutního výhřezu meziobratlového disku. Typickým příznakem LSS jsou neurogenní klaudikace (NK). Někdy se LSS a NK považují za synonyma, nicméně termín LSS je vhodné spíše rezervovat pro označení morfologických změn. Pokud je páteřní kanál zúžen, ale postižení se klinicky nemanifestuje, je lépe používat termín „úzký páteřní kanál“ než „lumbální spinální stenóza“ [3]. Zúžení páteřního kanálu jako příčinu NK poprvé popsal Verbiest v roce 1954 [4].
Epidemiologie a společenský význam
Přesné údaje o incidenci lumbální stenózy nejsou známy. Bolesti v zádech jsou druhou nejčastější chorobou po infektech horních cest dýchacích a určitý stupeň spondylózy a degenerativních změn je ve vyšším věku spíše pravidlem než výjimkou. Boden et al [5] našli na MR u 20 % asymptomatických jedinců nad 60 let známky lumbální stenózy. Tato východiska ukazují na metodické problémy při epidemiologických šetřeních. Většina autorů se domnívá a vlastní klinická praxe potvrzuje, že se jedná o častou chorobu vyššího věku. Berney [6] udává incidenci LSS v Evropě 11,5/100 tis. obyvatel/rok. Tyto údaje se nám však jeví značně podhodnocené. Degenerativní spinální stenóza je nejčastější diagnóza v chirurgii bederní páteře u osob starších 65 let [7]. Frekvence výskytu stoupá s věkem, typicky postihuje osoby starší 50 let, převažují muži [8]. Dle našich zkušeností bývá LSS poddiagnostikována, je častou příčinou bolestí dolní části zad („low back pain“) a přispívá k omezení mobility ve vyšším věku.
Anatomické a vývojové poznámky
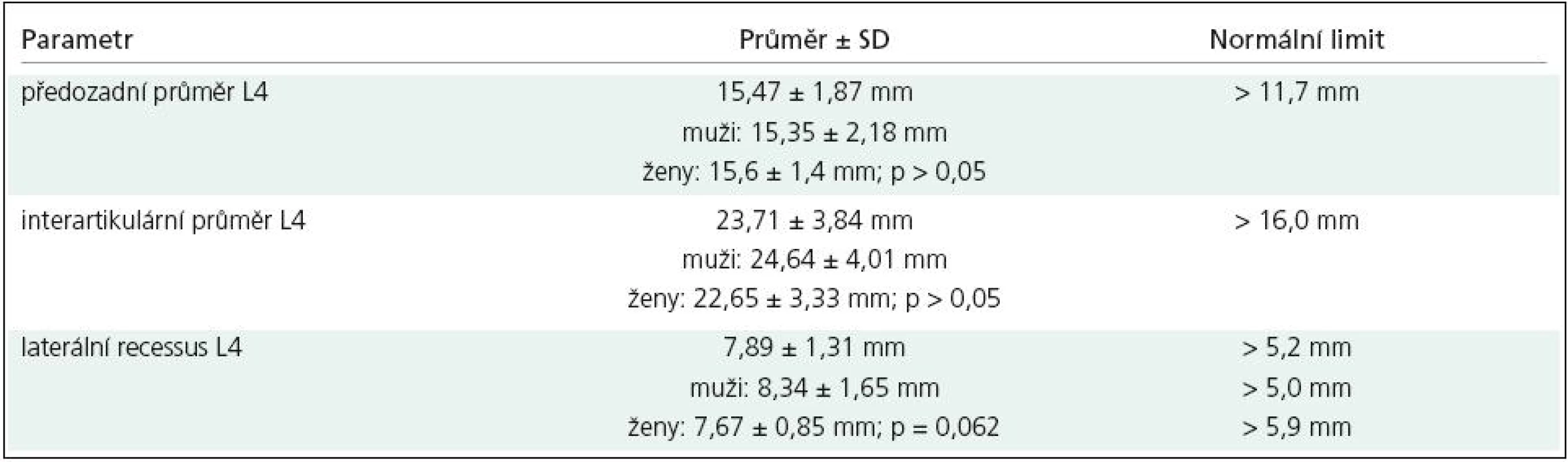
V axiální rovině hodnotíme tři hlavní rozměry páteřního kanálu: předozadní, transverzální (interpedikulární) a šíři laterálních recesů (obr. 1). Nejmenší sagitální rozměr má v bederní oblasti spinální kanál v úrovni 3. lumbálního obratle (předozadní průměr se od L1 k L3 snižuje, v úrovni L4 a L5 se opět zvyšuje) s dolním limitem normy 11,8mm (95 %) [9]. Této hodnoty dosahuje již v časném dětství; ve věku jednoho roku má kanál na úrovni L3 a L4 90 % svého konečného „průsvitu“, což platí jak pro sagitální rozměr, tak pro plochu [10]. Jde o podobný vývoj, jaký prodělávají parametry lidského krania.
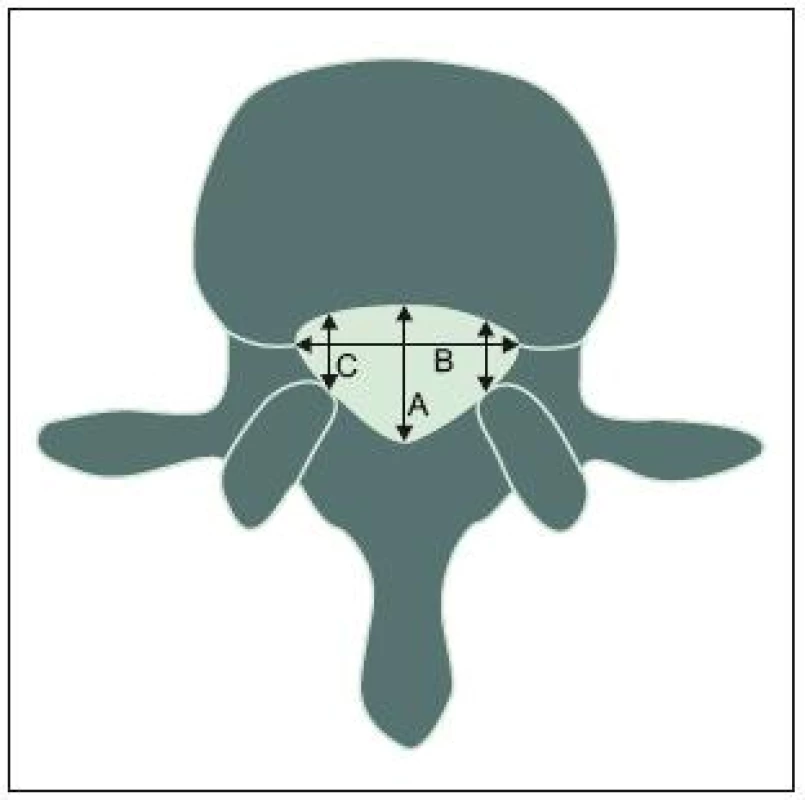
Byl studován vliv různých faktorů na primární šíři páteřního kanálu [11]: užší rozměr na úrovni L3 je asociován s nízkou hmotností placenty, vyšším věkem matky, primiparitou, nízkou porodní hmotností a nízkým socioekonomickým stavem.
Tyto primární rozměry jsou však izolovanou příčinou LSS spíše vzácně, představují ale rizikový terén při rozvoji sekundární stenózy.
Pro sekundární stenózu je typická především redukce transverzálního (interpedikulárního) rozměru páteřního kanálu, která je projevem artrotických změn facetových kloubů a největší měrou přispívá k redukci plochy spinálního kanálu.
Tvar lumbálního kanálu je v horním bederním úseku oválný, v dolní části má spíše trojúhelníkový tvar, což je dáno především tvarem zadní plochy obratle. Akcentace této „trojúhelníkovitosti“ do tvaru přirovnávanému k třírohému klobouku nebo trojlístku („trefoilness“) je typická pro obratel L5 (někdy L4) a svědčí vždy pro získanou sekundární laterální stenózu. Spinální kanál ve tvaru trojlístku nebyl nalezen u novorozenců, v tomto věku je tvar převážně klenutý („dome-shaped“) [12]; 65 % nemocných s kanálem tvaru trojlístku má příznaky LSS. Vidíme tedy, že rozvoj LSS není spojen jen s redukcí rozměrů a plochy, ale i s tvarovou dekonfigurací kanálu.
Primární centrální vývojová stenóza je nejčastější v úrovni L3 a prakticky se nevyskytuje v úrovni L5. Získaná sekundární centrální i laterální stenóza je nejčastější v oblasti obratle L5, event. L4.
Sagitální rozměr páteřního kanálu je dále ovlivněn i dynamicky: při předklonu (flexi, anteflexi) se rozšiřuje a v záklonu (extenzi, retroflexi) se zužuje, což se klinicky projevuje jako provokační a úlevové situace u neurogenních klaudikací (viz dále). Největší vliv na zužování kanálu v extenzi má řasení žlutých vazů [13]. Tento sagitální rozměr je zužován i tzv. degenerativní spondylolistézou (tedy posunem obratlů vůči sobě v sagitální rovině), která je způsobena artrotickými změnami meziobratlových kloubů. Degenerativní skolióza (zakřivení páteře ve frontální rovině) zužuje především transverzální průsvit kanálu a foramina. Istmická spondylolistéza způsobená lýzou (přerušením) obratlového oblouku zpravidla nevede k centrální kompresi nervových struktur. Dochází naopak k rozšíření páteřního kanálu, někdy ovšem (zvláště při vzniku kalusu v místě přerušení oblouku) k tísnění v oblasti vstupu do kořenového kanálu.
Nervové kořeny tvořící kaudu equinu procházejí páteřním kanálem a postupně opouštějí tzv. kořenovým kanálem mezi jednotlivými obratli páteřní prostor (obr. 2a, b).


Kořenový kanál dělíme anatomicky na tři zóny:
- vstupní zóna odpovídající laterálnímu recesu (mediálně od pediklu);
- vlastní kořenový kanál (subpedikulárně);
- výstupní zóna (laterálně od pediklu; exit zóna).
Normální výška foramina je od 20 do 23 mm, plocha je od 40 do 160 mm2 [14]. Vlastní nervový kořen potom vyplňuje asi 30 %. Zmenšení foramina je primárně způsobeno degenerací disku a snížením meziobratlové ploténky. Studie na kadaverózním materiálu ukazují, že kritickou hodnotou je zadní výška disku 4 mm nebo méně a výška foramina 15 mm a méně [15]. Tato vertikální stenóza je kombinována se zužováním v sagitální rovině, kdy je nervový kořen navíc tísněn mezi horní kloubní facetou a zadní částí obratlového těla. Nervový kořen je zpravidla utlačen mezi posterolaterálními osteofyty, které prominují do foramina, a hypertrofickými artroticky změněnými meziobratlovými klouby. Tyto statické faktory jsou potom dynamicky modifikovány – při flexi dochází k 12% zvětšení plochy a při extenzi k její 15% redukci [15]. Stenóza v prostorech L4/5 a L5/S1 tvoří 90 % všech postižení. Důležitý je také vztah dorzálních spinálních ganglií ke kořenovému kanálu: ganglion kořene S1 je lokalizováno intraspinálně, kdežto ganglia kořenů L4 a L5 jsou lokalizována zpravidla intraforaminálně.
Lze tedy shrnout, že morfologickým podkladem LSS je převážně degenerace komplexu tří kloubů (disk + dva facetové klouby) spolu se změnami měkkých tkání (hypertrofie žlutých vazů) a negativním vlivem statických (skolióza, degenerativní spondylolistéza) a dynamických (retroflexe) změn. Vrozené zúžení páteřního kanálu hraje roli jen v omezeném počtu případů.
Klasifikace a etiologie
Lumbální stenózu lze klasifikovat podle anatomické lokalizace a etiologie.
Anatomická klasifikace lumbální stenózy
Modifikováno dle Anderssona a McNeilla [16] a Zinreicha et al [17] (v grafické podobě ilustrují obr. 2a, b.)
1. Centrální
- a) anteroposteriorní (obvykle kongenitální)
- b) transverzální (vzácně kongenitální)
2. Laterální (zúžení tzv. kořenového kanálu)
- a) stenóza laterálního recesu (subartikulární)
- b) stenóza kořenového kanálu
- c) stenóza exit zóny
Etiologická klasifikace – dle Arnoldiho [18]
1. Kongenitální – vývojová
- a) idiopatická
- b) achondroplastická
2. Získaná
- a) degenerativní
- degenerativní spondylolistéza (vede k centrální stenóze)
- spondylolytická (istmická) spondylolistéza (vede k laterální stenóze)
- b) iatrogenní
- postlaminektomická
- po fúzi
- po chemonukleolýze
- c) potraumatická
- d) metabolická
- Pagetova choroba
3. Kombinace kongenitální a degenerativní stenózy
Získaná stenóza představuje asi 75 % všech případů. Vrozená stenóza je příčinou potíží pouze ve 3–13 %, u ostatních nemocných se jedná o kombinaci získané a vrozené stenózy [19].
Patofyziologie
Zúžený páteřní kanál je hlavním, ale ne jediným patologickým faktorem, který vede k neurogenním klaudikacím a dalším příznakům LSS. K tomuto závěru opravňuje, že spinální stenóza je někdy zcela asymptomatická a klaudikační příznaky jsou neobvyklé před 6. dekádou života. Porter [8] na základě experimentálních prací formuloval tzv. dvouetážovou vaskulární hypotézu vzniku NK. K jejich vzniku je třeba, aby se stenóza vyskytovala alespoň ve dvou úrovních, přičemž alespoň na jedné úrovni se musí jednat o stenózu centrální. Patofyziologickým základem neurogenních klaudikací je potom vaskulárně ischemický blok vláken kaudy způsobený venózní kongescí žilních pletení (obr. 3a, b). Vlastní klinické zkušenosti a prospektivní studie však ukazují, že pacientovy potíže i elektrofyziologické změny korelují především se stupněm stenózy v nejvíce postižené etáži. A naopak: vztah mezi počtem úrovní stenózy a klinickými potížemi či tíží elektrofyziologických změn nalezen nebyl [20–22].
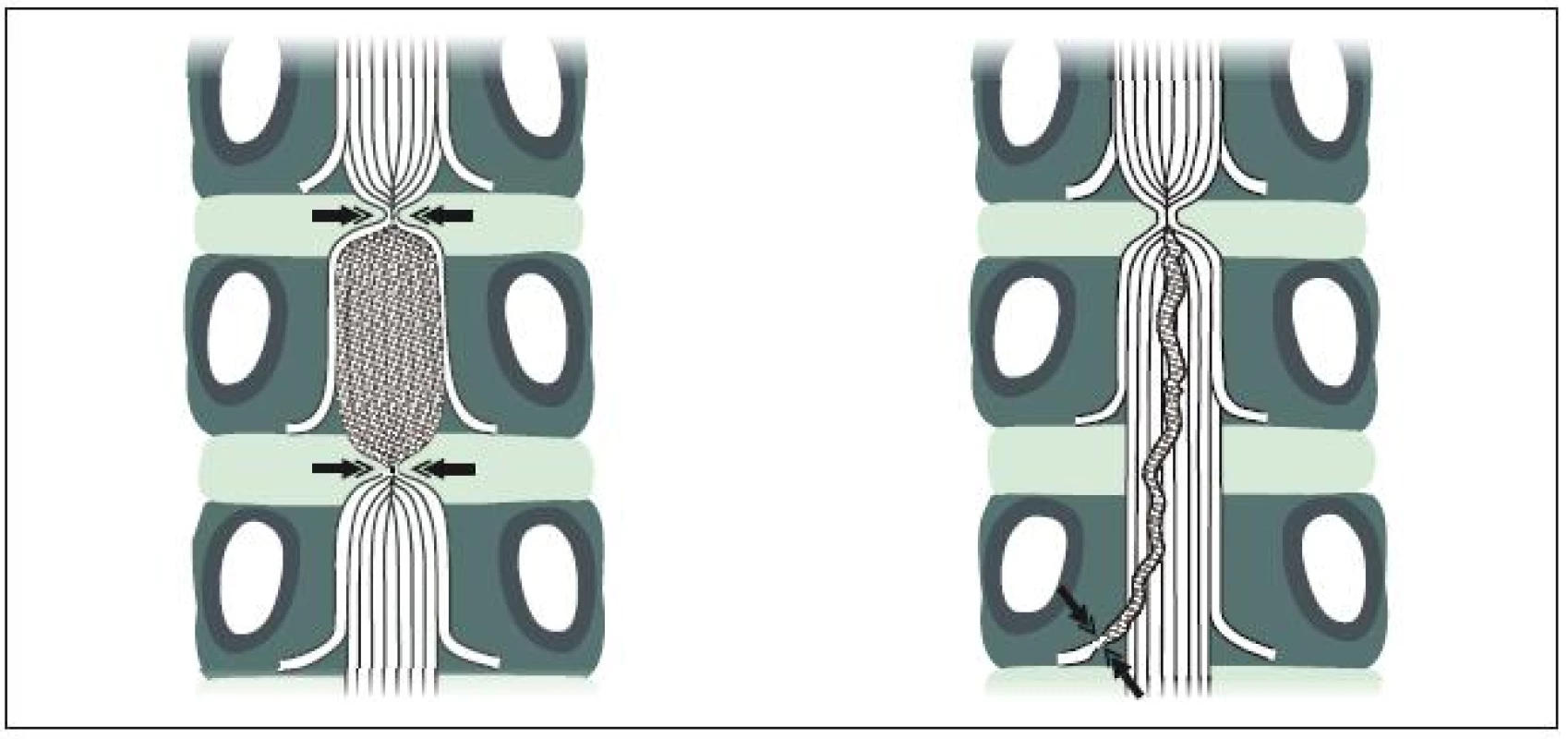
Izolovaná foraminální stenóza bývá asymptomatická nebo způsobuje příležitostně kořenové bolesti konstantního nebo posturálně akcentovaného charakteru (posturální ischias), ale ne klaudikace. Nepříznivým faktorem, který zhoršuje poměry v páteřním kanálu, je degenerativní skolióza.
Vzácné příčiny komprese v bederním úseku
Bederní lipomatóza
Jde o abnormální ukládání tuku v epidurálním prostoru. Suverénní diagnostickou metodou, která rozhodujícím způsobem přispívá k záchytu této nemoci, je magnetická rezonance. Nejčastěji se jedná o sekundární fenomén při endokrinopatiích (hypotyreóza, Cushingova choroba), léčbě kortikoidy nebo tzv. morbidní obezitě (body mass index > 40kg/m2). Vztah mezi obezitou a epidurálním hromaděním tuku však není zcela jasný a neexistuje jasná lineární příčinná souvislost např. mezi obvodem pasu a tímto fenoménem. Velmi vzácná je tzv. idiopatická forma, při níž nenalezneme žádný z výše uvedených faktorů. Podobně jako u kostních degenerativních změn musíme posuzovat nález epidurálního tuku obezřetně, někdy jde pouze o náhodný nález bez klinické relevance. Lipomatóza se častěji vyskytuje u mužů. Léčba je konzervativní: redukce hmotnosti, nahrazení celkové aplikace kortikoidů jinými léky, úprava hormonální poruchy. Ve výjimečných případech se přistupuje k chirurgickému odstranění nahromaděného tuku.
Pagetova choroba
Jde o metabolické kostní onemocnění neznámé etiologie, při němž dochází k excesivní přestavbě kostí (obratlů) a tvarové dekonfiguraci páteřního kanálu. Incidence stoupá s věkem, nad 80 let se nachází až u 10% osob. Diagnózu potvrdí prostý RTG snímek nebo CT vyšetření. Laboratorně nacházíme zvýšení alkalické fosfatázy a zvýšené hodnoty hydroxyprolinu v moči. Terapeuticky se používají bifosfonáty a kalcitonin.
Achondroplazie
Jde o autozomálně dědičnou poruchu, jejímž výsledkem je disproporční nanizmus. Jde o mutace v genu FGFR3 (fibroblastový růstový faktor 3). Jedním z projevů je akcentace hrudní kyfózy a bederní lordózy a progredující transverzální stenóza, která vede k projevům LSS v časné dospělosti.
Klinický obraz
Subjektivní potíže
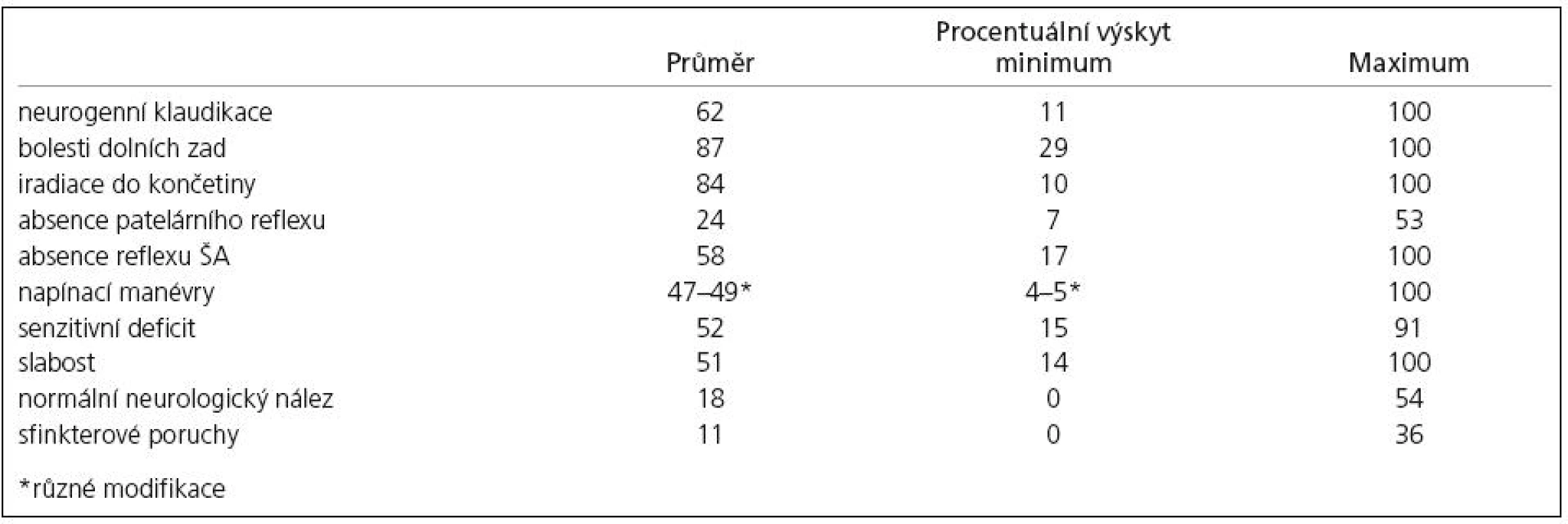
Klíčovým a nezaměnitelným (patognomickým) projevem LSS jsou neurogenní klaudikace. Jde o typický fenomén, který se vyznačuje tím, že po určité době stání či chůze ve vzpřímené poloze vznikají bolesti, parestezie a následně i slabost v dolních končetinách, která může vést až k pádům. Výskyt je udáván mezi 11–100 % nemocných s LSS, průměr z 32 studií je 62 % [23]. Jak již bylo uvedeno, potíže jsou typicky přítomny u starších mužů, kteří si stěžují na nepříjemné pocity v lýtkách, stehnech a chodidlech při chůzi. Oboustranné symptomy se nacházejí častěji u mužů než u žen, a to v poměru 8 : 1, kdežto jednostranné symptomy převažují u mužů v poměru pouze 3 : 1. Pro chorobu je charakteristické, že se příznaky nevyskytují v klidu, ale až po určitém intervalu chůze nebo stání [8].
Stav je zhoršován záklonem, naopak předklon, leh a sed pacientům přináší úlevu a postupné vymizení potíží do několika minut. Větší potíže způsobuje nemocným chůze z kopce (při které dojde k retroflexi a dalšímu zúžení páteřního kanálu), než chůze do kopce. Jízda na kole nečiní potíže a tuto skutečnost nemocní často udávají. Někteří zaujímají typický úlevový postoj v předklonu se semiflexí v kolenou (postura podobná semiflekčnímu držení při Parkinsonově chorobě). Někdy se označují jako neurogenní klaudikace i algie a dysestezie bez rozvoje slabosti. Pro tyto stavy je však vhodnější používat termíny jako posturální nebo pozátěžové lumbalgie a lumboischalgie. Sfinkterové potíže se vyskytují zřídka, ale někteří muži mohou mít problémy s močením ve stoje. Vzácně se objevuje spolu s NK nechtěná erekce při chůzi a ve stoje, která není doprovázena libidem. Současně jsou přítomny bolesti vyzařující do kyčlí, stehen a lýtek, brnění a tupost DK. Po posazení dojde k ústupu potíží a erekce během několika minut mizí. Erekce se také může objevit po 30 min klečení [24].
Často jsou přítomny chronické nebo recidivující ataky bolestí dolní části zad a nervových kořenů kostěnými strukturami, tak i instabilita lumbálních segmentů, popřípadě i akutní výhřez disku ve spondylotickém terénu.
Objektivní nález
Neurologický nález na končetinách v klidu bývá variabilní: může být zcela normální, mohou být přítomny reflexologické změny, část nemocných má parézy. Změny reflexů a parézy mohou být symetrické i asymetrické.
Trvalé poškození může narůstat nenápadně a postupně, nebo má naopak charakter náhlé dekompenzace se vznikem komprese nervových kořenů.
Asymetrické projevy v typické kořenové distribuci (nejčastěji L5 a S1) nečiní diagnostické potíže. Při pozvolném rozvoji vícekořenového symetrického postižení s akrálním maximem se nejčastěji chybně uvažuje o polyneuropatii.
Napínací manévry bývají negativní, jejich pozitivita spolu s klidovými bolestmi ukazuje na hernii disku. Výrazně bývá omezena extenze bederní páteře, flexe zůstává volná.
Cenné je objektivní vyšetření nemocného na pohyblivém chodníku („treadmill test“), které přesně kvantifikuje omezení chůze, objektivizuje neurogenní klaudikace a přímo v ordinaci umožňuje přesně analyzovat potíže udávané pacientem. Omezení kapacity chůze může mít řadu příčin (dušnost, cévní klaudikace, kloubní bolesti), které mohou být někdy nesprávně interpretovány jako NK [8,25].
Klinický obraz lze tedy shrnout do tří okruhů:
- neurogenní klaudikace;
- bolesti dolní části zad (lumbalgie) a kořenové bolesti (lumboischialgie);
- trvalé známky vícekořenového postižení (chronický syndrom kaudy equiny).
Variabilitu klinických projevů podle různých prací shrnuje tab. 1 [23].
K diagnostice a sledování nemocných jsou navrženy a používány různé dotazníky a hodnotící škály
Oswestry disability index (Oswestry: město v Anglii v hrabství Shropshire) hodnotí omezení běžných denních aktivit a dobře odráží přítomnost bolestí [26]. Existuje ve čtyřech revidovaných verzích [27–29]. Na webových stránkách věnovaným tomuto dotazníku (http://www.orthosurg.org.uk/odi/) je vedle celé řady jiných jazykových mutací uveden i anonymní český překlad. Sami používáme vlastní jazykovou verzi (příloha 1).
Druhým nejčastěji používaným je Dotazník nezpůsobilosti podle Rolanda a Morrise [30], který existuje v české verzi (http://www.mapi-institute.com/ – příloha 2). Oba dotazníky spolu dobře korelují [29]; vyplňují je sami pacienti a lze je použít i formou telefonického rozhovoru.

U nemocných po operaci se používá Stuckiho dotazník spokojenosti s operačním zákrokem [31].
Méně často je používán pro skórování LSS systém Beaujon (Beaujon: nemocnice v Clichy, Francie); (příloha 3) [32].

Míra bolesti se kvantifikuje obvykle pomocí vizuálně analogové škály. Vhodné je rozdělit ji na bolest v zádech a bolesti v končetinách.
Asociované choroby a diferenciální diagnostika
Diferenciální diagnostika neurogenních klaudikací zahrnuje [8]:
- Klaudikace cévního původu při ischemické chorobě DKK (tab. 2).
- Tzv. klaudikace sedacího nervu způsobené insuficiencí arteria glutealis inferior.
- Přenesené bolesti z lumbální krajiny (pseudoradikulární bolesti).
- Někteří pacienti s kořenovými bolestmi při výhřezu disku pociťují zhoršení potíží při stání nebo chůzi, ale bolesti mají i v klidu. Výhřez disku se vyskytuje častěji u osob mladších 55 let, neurogenní klaudikace jsou nejčastější po 60. roce věku.
- Klaudikační bolesti mohou být někdy příznakem psychogenním.
- Artrózu kolen nebo kyčlí.
- Vzácně může jít o klaudikace venózní po trombóze, klaudikace u myxedému či vzácně o klaudikace při hluboké arteriovenózní píštěli.

Neurogenní a vaskulární klaudikace se mohou vzhledem k věku pacienta vyskytovat současně, stejně je tomu u kombinace s artrózou kolen a kyčlí.
Zobrazovací metody
Velmi důležité je opatrné hodnocení zobrazovacích technik, protože i když je přítomna strukturální abnormita, nemusí to znamenat, že je odpovědná za klinické příznaky, jak je to patrné z vysokého počtu abnormálních nálezů u asymptomatických jedinců [33]. Dlouhá léta byla za zlatý standard v diagnostice LSS považována kontrastní myelografie (s nálezem blokády průchodu kontrastní látky), v pozdější době doplněná vyšetřením myelo-CT s měřením plochy durálního vaku. Tyto metody jsou vzhledem k určité invazivitě a radiační zátěži v současnosti nahrazeny magnetickou rezonancí.
RTG
Boční a předozadní snímek bederní páteře slouží k vyloučení sekundární příčiny zúžení páteřního kanálu (tumory, metastázy, Pagetova choroba apod.). Dobře také ukáže známky tzv. degenerativních změn: především osteochondrózu a degenerativní pseudolistézu či skoliózu. Dynamické snímky v předklonu a záklonu slouží k hodnocení instability a jsou důležité pro rozhodnutí o operační strategii. Za instabilitu je považován posun o více než 4mm nebo 10 st. mezi maximální flexí a extenzí.
CT
V literatuře se udává senzitivita tohoto vyšetření 70–100 %, falešná pozitivita 3,4 % [34]. Předností CT vyšetření je dobré zobrazení kostěných struktur, nevýhodou je zobrazení omezeného počtu etáží s možností „přehlédnutí“ stenózy zvláště ve vyšších etážích, méně kvalitní zobrazení stenózy způsobené měkkými tkáněmi a obtížné odlišení pooperační jizevnaté tkáně od hernie (obr. 4, 5).
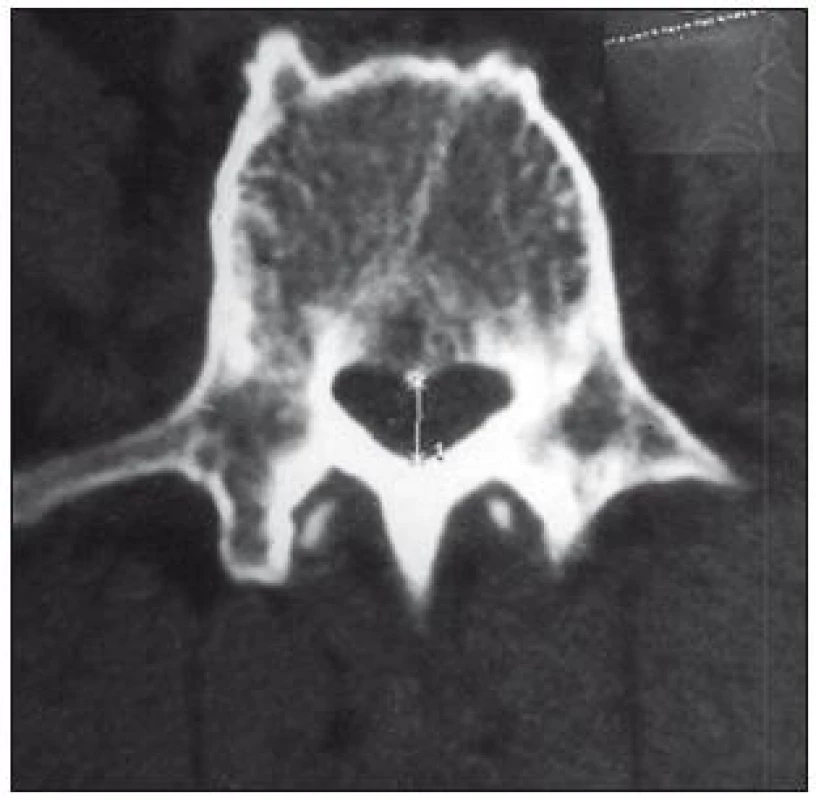
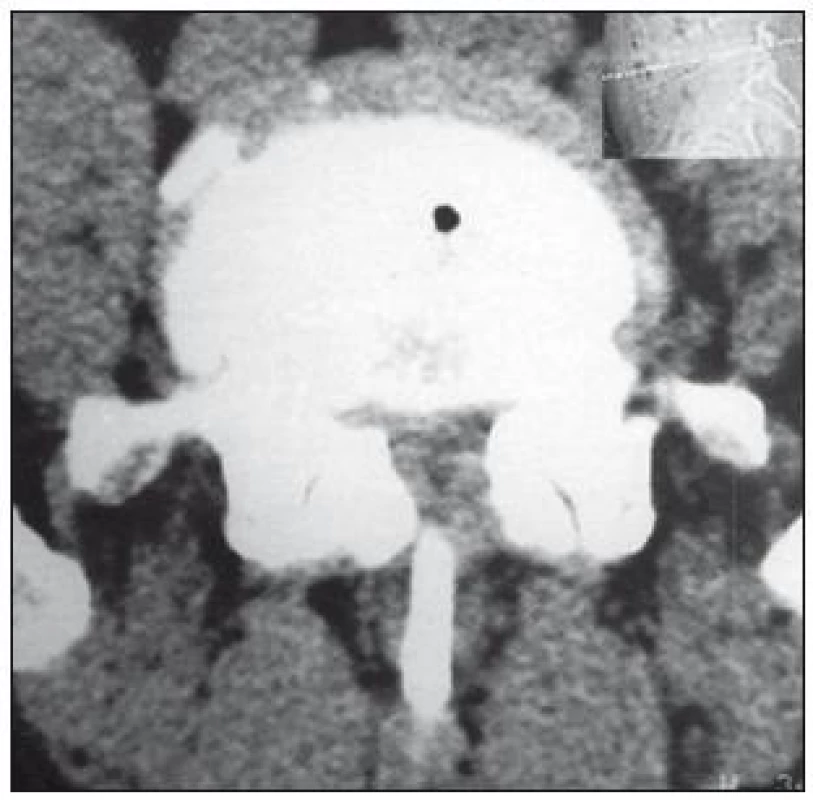
Za abnormální hodnoty je považován AP rozměr < 11,5 mm, area páteřního kanálu < 1,45 mm2, interpedikulární (transverzální) rozměr < 16,0 mm [35]. Tyto údaje dobře korelují s vlastními normativními daty (tab. 3) [36].
Magnetická rezonance
Senzitivita vyšetření je 81–97 %, falešná pozitivita, tedy nález lumbální stenózy u asymptomatických osob, dosahuje 7 až 21 % [1]. Výhodou tohoto vyšetření je přesné zhodnocení měkkých tkání (vazivové změny, hernie, stav meziobratlových disků, hypertrofie ligamentum flavum) a zobrazení celého rozsahu bederní páteře, a tedy větší citlivost v detekci víceetážové lumbální stenózy (obr. 6, 7). Výhodou MR myelografie je, že nevyžaduje podání kontrastní látky. Při MR vyšetření jsou často dobře patrné rozšířené venózní pleteně nad místem stenózy. Tento nález bývá někdy méně zkušeným pozorovatelem hodnocen jako AV malformace.
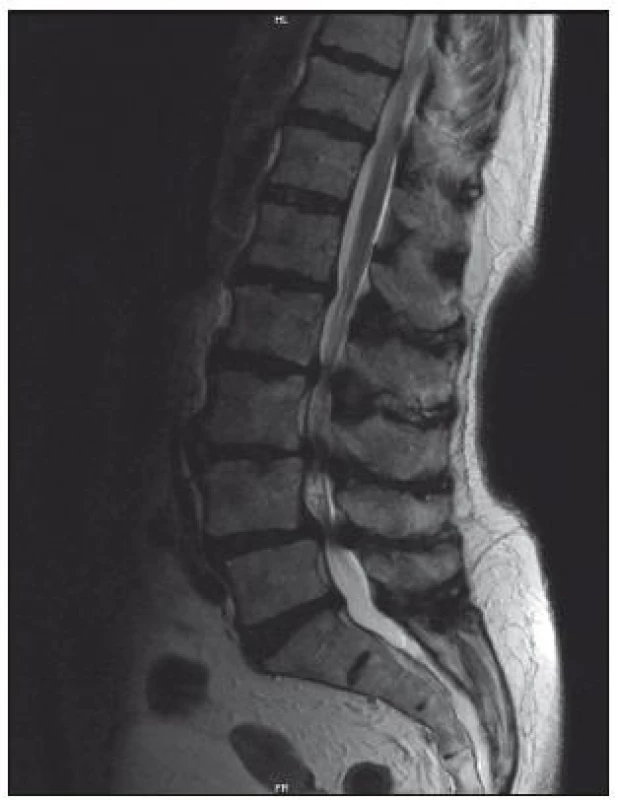
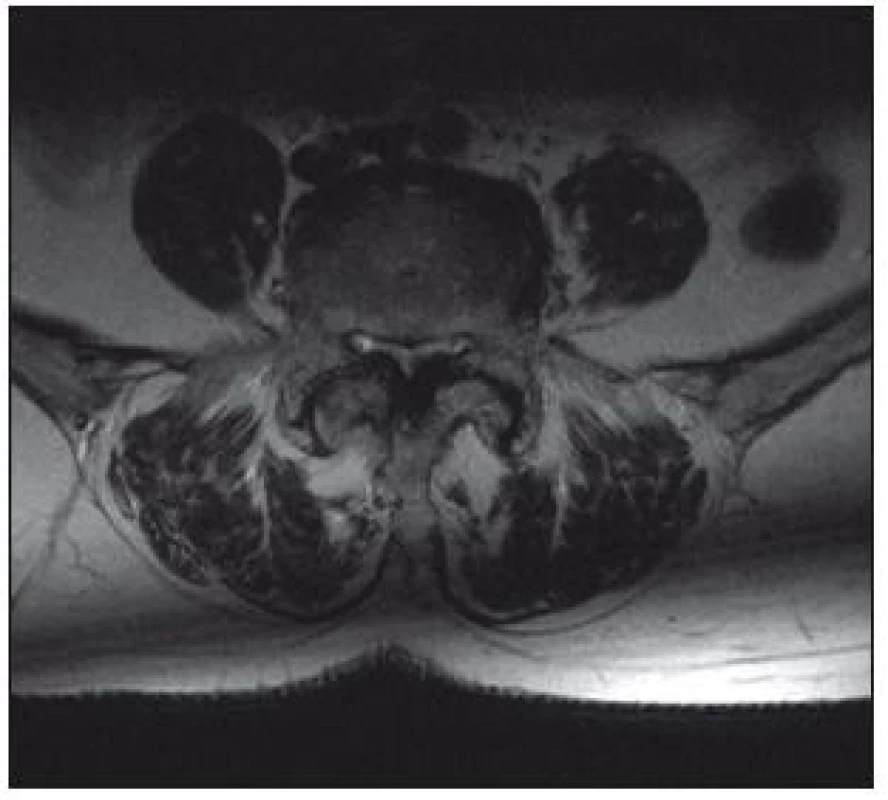
Rozhodujícím parametrem při hodnocení vyšetření MR je plocha durálního vaku v mm2. Za absolutní stenózu kanálu v bederním úseku je považována hodnota plochy durálního vaku < 75 mm2, hodnota pod 100 mm2 se hodnotí jako relativní [3].
Tato hodnota se mění podle toho, zda je vyšetření prováděno s pokrčenými nebo nataženými koleny. Při natažených DK dochází k zvýraznění bederní lordózy, a tím i k zmenšení plochy durálního vaku [37,38]. Tento test slouží k zvýšení senzitivity vyšetření, zvl. v případě hraničních hodnot [39]. Neexistuje ale jednotný názor, zda míra redukce plochy durálního vaku koreluje s rozsahem klinických potíží či ne [40,41].
Elektrofyziologie
Elektrodiagnostické vyšetření u pacientů s LSS je zaměřeno na průkaz postižení lumbosakrálních kořenů (radikulopatie). Za nejpřínosnější vyšetření při průkazu radikulopatie je shodně považována elektromyografie, a to zejména jehlová EMG. U pacientů s LSS může být EMG nález rozličný. Nejčastěji (asi u 50 % nemocných) to je oboustranná vícečetná lumbosakrální radikulopatie (postižení kaudy equiny). Nález je často asymetrický, dominuje postižení dolních lumbosakrálních kořenů, zejména kořene S1. V jehlové EMG převládají akční potenciály motorické jednotky (MUAP) se známkami chronické reinervace a abnormální spontánní aktivita je často omezena na distální svaly postiženého myotomu. Přibližně u 20 % pacientů se vyskytují známky monoradikulopatie, většinou L5 nebo S1. U části pacientů bývají EMG abnormality neinstruktivní. Častá je oboustranná absence H reflexu zm. soleus s normálním senzitivním neurogramem a normální jehlovou EMG z dolních končetin. Někdy se vyskytují fibrilace v jednom svalu z dolní končetiny, nejčastěji inervovaného z kořene S1. U některých pacientů může být EMG nález normální [42].
Ve vlastním souboru s klinicky symptomatickou LSS byla prokázána radikulopatie pomocí EMG (kondukční studie doplněné jehlovou EMG) u 70 % pacientů, převažovalo vícekořenové postižení (46 %) nad monoradikulárním (24 %). Postižení kořene L4 bylo prokázáno u 37 % pacientů, kořene L5 u 52 % a kořene S1 u 51 % pacientů s LSS [43].
Dále se v různé míře využívá vyšetření somatosenzitivních a motorických evokovaných potenciálů. Názory na význam evokovaných potenciálů v diagnostice LSS nejsou dosud ustáleny, ale jejich praktický význam je v této indikaci malý [44]. Dle výsledků naší vlastní studie je vyšetření evokovaných potenciálů (MEP a SEP) diagnosticky přínosné pouze u pacientů s normálním EMG, protože snížilo počet negativních elektrofyziologických nálezů z 19 na 13 % [43].
V literatuře se objevují i práce o využití pozátěžového elektrofyziologického vyšetření. Princip vyšetření spočívá v zjištění, zda bezprostředně po zátěži chůzí dochází k reverzibilním změnám elektrofyziologických parametrů, které by odrážely ischemický kondukční blok vláken kaudy equiny vznikající při chůzi. Po zátěži chůzí byly popsány změny následujících elektrofyziologických parametrů na dolních končetinách: F vlna, H reflex zm. soleus, SEP a MEP [45–51]. Naše vlastní studie prokazují, že u pacientů s LSS dochází po zátěži chůzí ke změnám v elektrofyziologických parametrech (prolongace minimální latence F vlny n. tibialis a latence H reflexu zm. soleus), ale tyto změny jsou nevýznamné. Pozátěžové elektrofyziologické vyšetření tedy může přispět k vysvětlení patofyziologie NK u LSS, ale z praktického hlediska přínos tohoto vyšetření v diferenciální diagnostice LSS je omezen pro nemožnost stanovení hraničních hodnot [52].
Elektrofyziologické vyšetření u LSS se z diferenciálně diagnostického hlediska používá k vyloučení jiného periferně neurogenního postižení (např. plexopatie, mononeuropatie, polyneuropatie), jehož symptomy se mylně přisuzují radikulopatii. V elektrofyziologické praxi se často setkáváme s požadavkem na odlišení polyneuropatie od postižení kořenů při LSS. Klinické odlišení lumbosakrálního vícekořenového postižení (typické pro LSS) a axonální distální polyneuropatie (typické např. pro pacienty s diabetem) může být obtížné. Obě nemoci se často objevují u starších pacientů, mohou se projevovat horší citlivostí a mravenčením nohou a typické klinické příznaky pro LSS, jako je bolest v kříži, proximální slabost a iradiace bolesti do dolních končetin, mohou chybět [53]. Zobrazovací vyšetření tento problém rovněž nemusí vyřešit vzhledem k časté přítomnosti degenerativních změn páteře i u asymptomatických jedinců. Z elektrofyziologického vyšetření je nejspolehlivější metodou k odlišení těchto dvou nemocí vyšetření horních končetin. U nemocných s lehčí formou LSS přispívá k diagnostice i vyšetření dolních končetin, kdy u nemocných s diabetem nacházíme významnější prolongaci minimální latence F vlny n. tibialis, H reflexum. soleus a spinální latence MEP km. abductor hallucis a nižší amplitudu SNAP (senzitivní nervový akční potenciál) n. suralis [54]. Elektrofyziologické vyšetření je rovněž přínosné při výskytu komplikujících faktorů, jako je hysterie, simulace a postižení horního motoneuronu. Dále často odhalí přítomnost subklinické radikulopatie (elektrofyziologický nález prokáže mnohdy vícekořenové postižení, přičemž v klinickém obraze dominuje postižení jednoho kořene), pomáhá při sledování dynamiky postižení a při určení rozsahu případné operace bederní páteře, kdy je nutné stanovit etáž, resp. etáže bederní páteře, ze kterých stenotické změny způsobují pacientovy obtíže.
V souhrnu lze konstatovat, že elektrofyziologické vyšetření doplňuje klinické neurologické vyšetření, pomáhá potvrdit klinickou relevanci radiologicky suspektní LSS a je schopno detekovat neuromuskulární onemocnění napodobující LSS [55–58].
Terapie
Waddell a Gibson [59] shrnuli vědecké důkazy o terapii LSS do nepříliš optimistických závěrů:
- neexistují žádné akceptovatelné vědecké důkazy o efektivitě jakéhokoli typu chirurgické či konzervativní léčby ve srovnání s přirozeným průběhem či placebem;
- chybí důkazy, zda je nějaká terapie (chirurgická či konzervativní) efektivní ve smyslu návratu pracovní schopnosti;
- nejsou důkazy o nákladové efektivitě jakékoli terapie;
- existují omezené důkazy o relativní efektivitě různých chirurgických postupů u různých typů patologií.
Přes tento pesimistický závěr můžeme formulovat určitý pohled na současné terapeutické možnosti.
Konzervativní terapie
U lehkých a středních forem bez progrese je doporučována konzervativní léčba: cvičení, ortézy, při bolestech analgetika, nesteroidní antiflogistika, myorelaxancia. Zkoušelo se také podávání kalcitoninu. To vedlo ke zmírnění bolestí a zlepšení chůze nejen u pacientů s Pagetovou chorobou, ale i u některých nemocných s klaudikacemi bez Pagetovy choroby. Mechanizmus efektu této léčby není znám [8]. Léčba bolesti se řídí obecnými zásadami analgetického žebříčku WHO, doporučení většinou vycházejí z obecných doporučení pro léčbu bolestí v zádech. Mezi nemocnými s bolestmi v bederní páteři představují pacienti s LSS většinou starší věkovou kohortu: k tomuto faktu je třeba přihlížet při volbě farmakoterapie a sledování nežádoucích účinků.
Efekt epidurální aplikace steroidů, které jsou široce používány, je dlouhodobě předmětem kontroverzí. Někteří autoři upozorňují na závažné vedlejší účinky, které převažují nad možným benefitem [60]. Poslední metaanalýza [61] přisoudila epidurální aplikaci steroidů určitý význam na úrovni důkazů třídy II. Pro léčbu chronických bolestí a dalších potíží u nemocných s LSS, ale neexistuje žádná randomizovaná klinická studie, která by jasně efekt prokázala.
Operace
U těžších forem s progresí je léčebnou metodou operace: posterolaterální dekomprese doplněná v indikovaných případech stabilizací s instrumentací či bez ní. Při správné indikaci operace dosahuje až u 85 % osob zlepšení, 12 % se nezlepší a 3 % se zhorší [62].
Některé práce však ukazují na podstatně horší výsledky operací: Airaksinen et al [63] prokázali v retrospektivní studii zlepšení pouze u 62 % osob, špatný nebo velmi špatný výsledek v 38 %. Prediktorem dobrého výsledku byly jasné známky stenózy dle perimyelografie, žádné předchozí chirurgické intervence, nepřítomnost diabetu a artrózy kyčlí a absence předoperačních fraktur bederní páteře.
Je třeba, aby dekomprese byla dostatečná, ale na druhé straně je nebezpečí zvýšení instability, zejména v případě degenerativní spondylolistézy. Sporným cílem operace je zabránit potenciální progresi choroby, protože potíže nemocných s neurogenními klaudikacemi po dosažení určitého plateau obvykle neprogredují.
V roce 2000 publikovali Amundsen et al [64] první klinickou studii, ve které byly randomizovány podskupiny pacientů pro chirurgickou a konzervativní léčbu. Soubor se skládal ze 100 osob, doba sledování byla 10 let. Na základně rozhodnutí lékaře bylo 19 pacientů vybráno pro chirurgickou léčbu, 50 pro léčbu konzervativní a skupina 31 pacientů se středními symptomy, u kterých byly pochyby o nejlepší léčbě, byla randomizována pro operační (n = 13) nebo konzervativní léčbu (n = 18). Konzervativní léčba zahrnovala nošení bederního pásu a jednoměsíční pobyt na nemocničním rehabilitačním oddělení.
Prokázalo se, že po čtyřech letech pacienti randomizovaní pro chirurgickou léčbu měli signifikantně lepší výsledek (v 90 % dobrý) než randomizovaní pro konzervativní léčbu (v 47 % dobrý). Při kontrole po 10 letech však došlo k setření rozdílů: všichni pacienti randomizovaní ke konzervativnímu léčení měli dobrý výsledek, stejně jako 91 % pacientů, kteří byli vybráni pro operaci. Ve skupině, která podstoupila operaci (u níž selhala konzervativní léčba), nebyl pozorován negativní vliv odkladu operace. To je druhé důležité poselství této průkopnické práce.
V roce 2008 publikovala rozsáhlá skupina výzkumníků vedená Jamesem Weinsteinem studii SPORT (Spine Patients Outcomes Research Trial) [65], v níž bylo randomizováno 289 pacientů a observováno dalších 365 nemocných. Délka sledování byla dva roky. Podle autorů vykázali operovaní nemocní signifikantně lepší výsledek než léčení konzervativně. Za hlavní slabiny této rozsáhlé práce lze považovat krátký čas sledování, poměrně velký odpad během studie (z 289 randomizovaných dokončilo studii 221 osob) a prakticky malý rozdíl mezi léčenými skupinami (i když statisticky signifikantní).
Z výše uvedeného vyplývá, že zatím stále nemáme dost spolehlivých ukazatelů, jak stratifikovat pacienty vhodné k operačnímu řešení tak, aby z výkonu maximálně profitovali.
Existuje rozsáhlé a stále expandující písemnictví, které hodnotí jednotlivé chirurgické postupy a metody [68,69]. Tyto práce však neodpovídají na otázku, zda je z dlouhodobého hlediska nějaký typ operace lepší než konzervativní postup a přirozený průběh.
Při zvažování léčebné strategie u starších nemocných hraje významnou roli posuzování dalších komorbidit, jako jsou kardiovaskulární choroby, diabetes či chronická obstrukční plicní nemoc. Také posouzení psychického stavu (deprese, nerealistické očekávání) hraje při rozhodování významnou roli.
Častým problémem je také současný výskyt LSS a artrózy nosných kloubů (asociace se týká asi poloviny nemocných). Nelze‑li jednoznačně určit, zda je porucha mobility způsobena postižením páteře či kyčlí nebo kolen, je vhodnější upřednostnit řešení problematiky nosných kloubů před operací páteře.
Průběh a prognóza
Přirozený průběh choroby není znám (nebyly provedeny rozsáhlejší prospektivní studie), dostupné údaje u většiny nemocných ukazují na spíše stacionární průběh [64,66,67].
Závěr
Lumbální stenóza je choroba, jejíž výskyt stoupá s věkem a významně se podílí na omezení mobility a zhoršení kvality života především seniorské populace. Po více než půlstoletí od Verbiestova popisu [4] nahromadily lékařské týmy rozsáhlou sumu poznatků z oblasti anatomie, patofyziologie a všech aspektů diagnostiky LSS. Současné možnosti zobrazovacích vyšetření umožňují přesné a rychlé stanovení rozsahu a stupně komprese. Došlo k významnému pokroku v léčbě bolesti, spondylochirurgických operačních technikách, anesteziologii i pooperační péči. Stále však není jasně rozřešena klíčová otázka: kdy, koho a jakým postupem léčit.
Použité zkratky
CT - výpočetní tomografie
DK, DKK - dolní končetina, dolní končetiny
EMG - elektromyografie
LSS - lumbální spinální stenóza
MEP - motorické evokované potenciály
MR - magnetická rezonance
NK - neurogenní klaudikace
SEP - somatosenzorické evokované potenciály
Autoři děkují PhDr. Mileně Košťálové za zpracování obrazové dokumentace.
MUDr. Stanislav Voháňka, CSc., MBA
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: svohanka@fnbrno.cz
Recenzenti:
prof. MUDr. Josef Bednařík, CSc.
doc. MUDr. Ivana Štětkářová, Ph.D.
doc. MUDr. Martin Häckel, CSc.
MUDr. Stanislav Voháňka, CSc, MBA
Dr. Voháňka promoval na Masarykově univerzitě v roce 1982, erudici zahájil na Klinice dětské neurologie FN Brno, od roku 1989 pracuje na Neurologické klinice LF MU a FN Brno, kde je od roku 1993 zástupcem přednosty pro LPP. Dlouhodobě se věnuje problematice nervosvalových onemocnění a chorobám bederní páteře. Vhled do této problematiky získal při pobytu na spinální jednotce Schulthessovy kliniky v Zurichu pod vedením prof. Dvořáka. Je zakládajícím členem Neuromuskulární sekce České neurologické společnosti a od roku 2005 jejím předsedou. Prezentoval 250 přednášek a posterů a je autorem nebo spoluautorem 220 publikací.
Vědomostní test
1. Při primární stenóze je páteřní kanál:
a) zúžen v rovině sagitální
b) zúžen v rovině transverzální
c) má tvar trojlístku
d) tato forma neexistuje
2. Sekundární stenóza páteřního kanálu je nejčastěji v úrovni obratle:
a) L3
b) L4
c) L5
d) S1
3. Při záklonu dochází k:
a) rozšíření páteřního kanálu
b) zúžení páteřního kanálu
c) žádným změnám
d) posunu meziobratlové ploténky
4. Příčinou neurogenních klaudikací je:
a) tísnění nervových kořenů kostními změnami
b) vaskulárně ischemický blok vláken kaudy
c) omezení cirkulace likvoru
d) napínání vláken kaudy při chůzi
5. K lumbální stenóze přispívá:
a) osifikace zadního podélného vazu
b) hypertrofie žlutých vazů
c) istmická spondylolistéza
d) ateroskleróza aorty
6. Mezi vzácné příčiny LSS nepatří:
a) Pagetova choroba
b) bederní lipomatóza
c) achondroplazie
d) ankylozující spondylitida
7. Neurogenní klaudikace:
a) jsou patognomické pro LSS
b) vyskytují se i u cervikální myelopatie
c) mají záchvatový charakter
d) odhalíme pomocí EMG
8. Neurogenní klaudikace:
a) jsou přítomny při jízdě na kole
b) zhoršují se při chůzi do kopce
c) zhoršují se při chůzi z kopce
d) jsou lokalizovány převážně v lýtkách
9. K hodnocení lumbální stenózy se nepoužívá:
a) dotazník Oswestry
b) dotazník podle Rollanda a Morrise
c) vizuální analogová škála bolesti
c) škála Japonské ortopedické asociace
(JOA)
10. Mezi obvykle používané zobrazovací metody v diagnostice LSS nepatří:
a) nativní RTG
b) CT bederní páteře
c) MR bederní páteře
d) scintigrafie
11. Za absolutní stenózu je považována plocha durálního vaku menší než:
a) 100 mm2
b) 75 mm2
c) 50 mm2
d) 25 mm2
12. Diabetickou polyneuropatii a LSS lze elektrofyziologicky spolehlivě odlišit:
a) jehlovou EMG z DKK
b) vyšetřením HKK
c) pozátěžovým vyšetřením
d) vyšetřením H reflexum. soleus
13. Léčebnou alternativou u LSS není:
a) operace
b) podávání analgetik
c) nošení bederního pásu
d) aplikace venofarmak
14. Lumbální stenóza není asociována s:
a) artrózou kolen
b) artrózou kyčlí
c) ischemickou chorobou dolních končetin
d) Bechtěrevovou nemocí
15. U nemocného s LSS a coxartrózou:
a) řešíme nejprve operativně problematiku kyčlí, potom páteře
b) indikujeme nejprve operaci bederní páteře, potom artrózu
c) takový pacient je kontraindikován k jakémukoliv
chirurgickému řešení
d) podáváme chondroprotektiva
16. K operačnímu zákroku nejsou indikováni nemocní:
a) s lehkou formou LSS
b) bez degenerativní spondylolistézy
c) s degenerativní skoliózou
d) s ischemickou chorobou DKK
17. Nejčastější příčinou LSS je:
a) primární stenóza páteřního kanálu
b) sekundární stenóza páteřního kanálu na podkladě
degenerativních změn
c) istmická spondylolistéza
d) achondroplastický nanizmus
18. Pacient zaujímá při neurogenních klaudikacích úlevovou polohou:
a) v předklonu s pokrčenými koleny
b) v záklonu
c) vleže na břiše
d) vestoje s napjatými koleny
19. Primární stenóza je nejčastější v úrovni obratle
a) L2
b) L3
c) L4
d) L5
20. Přirozený průběh LSS
a) je vždy postupně progredientní
b) je stacionární
c) není přesně znám
d) většinou dochází k postupnému samovolnému zlepšování
Sources
1. O’Duffy JD. Spinal stenosis: development of the lesi on, clinical classificati on, and presentati on. In: Frymoyer JW (ed). The adult spine: principles and practice. 2nd ed. Philadelphi a: Lippincott- Raven Publishers 1997: 769– 779.
2. Postacchini F. Management of lumbar spinal stenosis. J Bone Jo int Surg Br 1996; 78(1): 154– 164.
3. Schönström N, Willén J. Imaging lumbar spinal stenosis. Radi ol Clin North Am 2001; 39(1): 31– 53.
4. Verbi est H. A radicular syndrome from developmental narrowing of the lumbar vertebral canal. J Bone Jo int Surg Br 1954; 36– B(2): 230– 237.
5. Boden SD, Davis DO, Dina TS, Patronas NJ, Wi esel SW. Abnormal magnetic- resonance scans of the lumbar spine in asymptomatic subjects. A prospective investigati on. J Bone Jo int Surg Am 1990; 72(3): 403– 408.
6. Berney J. Epidemi ologi e des cana ux lombaires etro its. Ne urochirurgi e 1994; 40(3): 174– 178.
7. Turner JA, Ersek M, Herron L, Deyo R. Surgery for lumbar spinal stenosis. Attempted meta‑analysis of literature. Spine 1992; 17(1): 1– 8.
8. Porter RW. Spinal stenosis and ne urogenic cla udicati on. Spine 1996; 21(17): 2046– 2052.
9. Lee HM, Kim NH, Kim HJ, Chung IH. Morphometric study of the lumbar spinal canal in the Kore an populati on. Spine 1995; 20(15): 1679– 1684.
10. Papp T, Porter RW, Aspden RM. The growth of the lumbar vertebral canal. Spine 1994; 19(24): 2770– 2773.
11. Papp T, Porter RW, Craig CE, Aspden RM, Campbell DM. Significant antenatal factors in the development of lumbar spinal stenosis. Spine 1997; 22(16): 1805– 1810.
12. Atilla B, Yazici M, Kopuz C, Bariş S, Balçik C. The shape of the lumbar vertebral canal in newborns. Spine 1997; 22(21): 2469– 2472.
13. Hansson T, Suzuki N, Hebelka H, Ga ulitz A. The narrowing of the lumbar spinal canal during lo aded MRI: the effects of the disc and ligamentum flavum. Eur Spine J 2009; 18(5): 679– 686.
14. Jenis LG, An HS. Spine update: lumbar foraminal stenosis. Spine 2000; 25(3): 389– 394.
15. Hasegawa T, An HS, Ha ughton VM, Nowicki BH. Lumbar foraminal stenosis: critical heights of the intervertebral discs and foramina. A cryomicrotome study in cadavera. J Bone Jo int Surg Am 1995; 77(1): 32– 38.
16. Andersson GB, McNeill TW. Lumbar Spine Syndromes. Evalu ati on and Tre atment. 1st ed. Wi en, New York: Springer- Verlag 1989.
17. Zinreich SJ, Heithoff KB, Herzog RJ. Computed tomography of the spine. In: Frymoer SW (ed). The adult spine. Principles and practice. 2nd ed. Philadelphi a: Lippincott- Raven Publishers 1997: 467– 522.
18. Arnoldi CC, Brodsky AE, Ca ucho ix J, Crock HV, Dommisse GF, Edgar MA et al. Lumbar spinal stenosis and nerve ro ot entrapment syndromes. Definiti on and classificati on. Clin Orthop Relat Res 1976; 115: 4– 5.
19. Amundsen T, Weber H, Lilleås F, Nordal HJ, Abdelno or M, Magnaes B. Lumbar spinal stenosis. Clinical and radi ologic fe atures. Spine 1995; 20(10): 1178– 1186.
20. Adamová B, Voháňka S., Bednařík J, Kadaňka Z, Dušek L. Lumbar spinal stenosis: correlati on between clinical and radi ological data. J Ne urol 2001; 248 (Suppl 2): II/ 85.
21. Voháňka S, Adamová B, Bednařík J, Kadaňka Z, Dušek L. Lumbar spinal canal stenosis: correlati on between radi ological and electrophysi ological data. J Ne urol 2001; 248 (Suppl 2): II/ 101.
22. Ogikubo O, Forsberg L, Hansson T. The relati onship between the cross- secti onal are a of the ca uda equina and the pre operative symptoms in central lumbar spinal stenosis. Spine 2007; 32(13): 1423– 1428.
23. Turner JA, Ersek M, Herron L, Deyo R. Surgery for lumbar spinal stenosis. Attempted meta‑analysis of literature. Spine 1992; 17(1): 1– 8.
24. Hopkins A, Clarke C, Brindley G. Erecti ons on walking as a symptom of spinal canal stenosis. J Ne urol Ne urosurg Psychi atry 1987; 50(10): 1371– 1374.
25. Adamova B, Vohanka S, Dusek L. Differenti al di agnostics in pati ents with mild lumbar spinal stenosis – the contributi ons and limits of vari o us tests. Eur Spin J 2003; 12(2): 190– 196.
26. Baker D, Pynsent P, Fairbank J. The Oswestry Index revisited. In: Roland J, Jenner J, eds. Back pain: New Appro aches to Rehabilitati on and Educati on. Manchester, UK: Manchester University Press 1989: 174– 186.
27. Fairbank J, Co uper J, Davi es J, O‘Bri an JP. The Oswestry low back pain questi onnaire. Physi otherapy 1980; 66(8): 271– 273.
28. Fairbank JC, Pynsent PB. The Oswestry disability index. Spine 2000; 25(22): 2940– 2953.
29. Roland M, Fairbank J. The Roland- Morris Disability Questi onnaire and the Oswestry Disability Questi onnaire. Spine 2000; 25(24): 3115– 3124.
30. Roland M, Morris R. A study of the natural history of back pain. Part 1. Development of a reli able and sensitive me asure of disability in low- back pain. Spine 1983; 8(2): 141– 144.
31. Stucki G, Daltroy L, Li ang MH, Lipson SJ, Fossel AH, Katz JN. Me asurement properti es of a self- administered o utcome me asure in lumbar spinal stenosis. Spine 1996; 21(7): 796– 803.
32. Guigui P, Beno ist M, Deleco urt C, Delho ume J, Deburge A. Motor deficit in lumbar spinal stenosis: A retrospective study of a seri es of 50 pati ents. J Spinal Disord 1998; 11(4): 283– 288.
33. Greenberg JO, Schnell RG. Magnetic resonance imaging of the lumbar spine in asymptomatic adults. Co operative study – American Soci ety of Ne uro imaging. J Ne uro imaging 1991; 1(1): 2– 7.
34. Wi esel SW, Tso urmas N, Feffer, HL, Citrin CM, Patronas N. A study of computer- assisted tomography I. The incidence of positive CT scans in an asymptomatic gro up of pati ents. Spine 1984; 9(6): 549– 551.
35. Karantanas AH, Zibis AH, Papali aga M, Ge orgi o u E, Ro usogi annis S. Dimensi ons of the lumbar spinal canal: vari ati ons and correlati ons with somatometric parameters using CT. Eur Radi ol 1998; 8(9): 1581– 1585.
36. Adamová B, Bednařík J, Šmardová L, Moravcová E, Chvátalová N, Prokeš B et al. Asoci ace mezi cervikální a lumbální stenózo u páteřního kanálu. Cesk Slov Ne urol N 2000; 5: 261– 267.
37. Dani elson B, Willén J. Axi ally lo aded magnetic resonance image of the lumbar spine in asymptomatic individu als. Spine 2001; 26(23): 2601– 2606.
38. Willén J, Dani elson B. The di agnostic effect from axi al lo ading of the lumbar spine during computed tomography and magnetic resonance imaging in pati ents with degenerative disorders. Spine 2001; 26(23): 2607– 2614.
39. Cheng WY, Ming JC, Ying WC, Yun CH, Chi en HY, Jen WY et al. Dynamic effects of axi al lo ading on the lumbar spine during magnetic resonance imaging in pati ents with suspected spinal stenosis. J Formos Med Assoc 2008; 107(4): 334– 339.
40. Lohman CM, Tallroth K, Kettunen JA, Lindgren KA. Comparison of radi ologic signs and clinical symptoms of spinal stenosis. Spine 2006; 31(16): 1834– 1840.
41. Voháňka S, Adamová B, Dušek L. Lumbar spinal stenosis:correlati on between the degree of narrowing and walking ability. J Ne urol 2003; 250 (Suppl 2): 77.
42. Wilbo urn AJ, Aminoff MJ. AAEM minimonograph 32: the electrodi agnostic examinati on in pati ents with radiculopathi es. Muscle Nerve 1998; 21(12): 1612– 1631.
43. Micankova Adamova B, Vohanka S. The results and contributi on of electrophysi ological examinati on in pati ents with lumbar spinal stenosis. Scr Med (Brno) 2009; 82(1): 38– 45.
44. Dvorak J, Herdmann J, Vohanka S. Ne urophysi ologic Assessment in Pati ents with Lumbar Spinal Stenosis. In: Gunzburg R, Szpalski M (eds). Lumbar Spinal Stenosis. Philadelphi a: Lippincott Willi ams & Wilkins 2000: 125– 135.
45. Pastor P, Valls- Sole J. Recruitment curve of the sole us H reflex in pati ents with ne urogenic cla udicati on. Muscle Nerve 1998; 21(8): 985– 990.
46. London SF, England JD. Dynamic F waves in ne urogenic cla udicati on. Muscle Nerve 1991; 14(5): 457– 461.
47. Manganotti P, Zanette G, Tinazzi M, Polo A. Dynamic F wave from lower limbs: value and clinical applicati on. Electromyogr Clin Ne urophysi ol 1995; 35(6): 323– 329.
48. Bal S, Celiker R, Palaoglu S, Cila A. F wave studi es of ne urogenic intermittent cla udicati on in lumbar spinal stenosis. Am J Phys Med Rehabil 2006; 85(2): 135– 140.
49. Wallbom AS, Geisser ME, Haig AJ, Koch J, Guido C. Alterati ons of F wave parameters after exercise in symptomatic lumbar spinal stenosis. Am J Phys Med Rehabil 2008; 87(4): 270– 274.
50. Kondo M, Matsuda H, Kureya S, Shimazu A. Electrophysi ological studi es of intermittent cla udicati on in lumbar stenosis. Spine 1989; 14(8): 862– 866.
51. Baramki HG, Steffen T, Schondorf R, Aebi M. Motor conducti on alterati ons in pati ents with lumbar spinal stenosis following the onset of ne urogenic cla udicati on. Eur Spine J 1999; 8(5): 411– 416.
52. Adamova B, Vohanka S, Dusek L. Dynamic electrophysi ological examinati on in pati ents with lumbar spinal stenosis: Is it useful in clinical practice? Eur Spine J 2005; 14(3): 269– 276.
53. Berger AR, Sharma K, Lipton RB. Comparison of motor conducti on abnormaliti es in lumbosacral radiculopathy and axonal polyne uropathy. Muscle Nerve 1999; 22(8): 1053– 1057.
54. Adamova B, Vohanka S, Dusek L. Differenti al di agnostics in pati ents with mild lumbar spinal stenosis: the contributi ons and limits of vari o us tests. Eur Spine J 2003; 12(2): 190– 196.
55. Haig AJ, Tong HC, Yamakawa KS, Quint DJ, Hoff JT, Chi odo A et al. The sensitivity and specificity of electrodi agnostic testing for the clinical syndrome of lumbar spinal stenosis. Spine 2005; 30(23): 2667– 2676.
56. Haig AJ, Geisser ME, Tong HC, Yamakawa KS, Quint DJ, Hoff JT et al. Electromyographic and magnetic resonance imaging to predict lumbar stenosis, low- back pain, and no back symptoms. J Bone Jo int Surg Am 2007; 89(2): 358– 366.
57. Haig AJ, Tong HC, Yamakawa KS, Quint DJ, Hoff JT, Chi odo A et al. Spinal stenosis, back pain, or no symptoms at all? A masked study comparing radi ologic and electrodi agnostic di agnoses to the clinical impressi on. Arch Phys Med Rehabil 2006; 87(7): 897– 903.
58. Egli D, Ha usmann O, Schmid M, Bo os N, Di etz V, Curt A. Lumbar spinal stenosis: Assessment of ca uda equina involvement by electrophysi ological recordings. J Ne urol 2007; 254(6): 741– 750.
59. Waddell G, Gibson JN. Sci entific evidence on the Management of Lumbar Spinal stenosis. In: Gunzburg R, Szpalski M (eds). Lumbar Spinal Stenosis. Philadelphi a: Lippincott Willi ams § Wilkins 2000: 367– 371.
60. Nelson DA, Landa u WM. Intraspinal stero ids: history, efficacy, accidentality, and controversy with revi ew of United States Fo od and Drug Administrati on reports. J Ne urol Ne urosurg Psychi atry 2001; 70(4): 433– 443.
61. Conn A, Buenaventura RM, Datta S, Abdi S, Diwan S. Systematic Revi ew of Ca udal Epidural Injecti ons in the Management of Chronic Low Back Pain. Pain Physici an 2009; 12(1): 109– 135.
62. Katz JN, Lipson SJ, Lew RA, Grobler LJ, Weinstein JN, Brick GW et al. Lumbar laminectomy alone or with instrumented or noninstrumented arthrodesis in degenerative lumbar spinal stenosis. Pati ent selecti on, costs, and surgical o utcomes. Spine 1997; 22(10): 1123– 1131.
63. Airaksinen O, Herno A, Turunen V, Saari T, Suomlainen O. Surgical o utcome of 438 pati ents tre ated surgically for lumbar spinal stenosis. Spine 1997; 22(19): 2278– 2282.
64. Amundsen T, Weber H, Nordal HJ, Magnaes B, Abdelno or M, Lilleâs F. Lumbar spinal stenosis: conservative or surgical management? A prospective 10- ye ar study. Spine 2000; 25(11): 1424– 1436.
65. Weinstein JN, Tosteson TD, Luri e JD, Tosteson AN, Blo od E, Hanscom B et al. Surgical versus nonsurgical therapy for lumbar spinal stenosis. N Engl J Med 2008; 358(8): 794– 810.
66. Johnsson K, Rosén I, Udén A. The natural co urse of lumbar spinal stenosis. Acta Ortop Scand 1990; 251 (Suppl): 67– 68.
67. Herno A, Airaksinen O, Saari T, Luukkonen M. Lumbar spinal stenosis: a matched- pair study of operated and non‑operated pati ents. Br J Ne urosurg 1996; 10(5): 461– 465.
68. Hrabálek L, Rešková I, Bučil J, Vaverka M, Ho udek M. Po užití titanových a PEEKových implantátů při ALIF stand- alone u degenerativního onemocnění lumbosakrální páteře – prospektivní studi e. Cesk Slov Ne urol N 2009; 72/ 105(1): 38– 44.
69. Hrabálek L, Novotný J, Kolo uchová J, Vaverka M, Kalita O, Langová K. Změny parametrů páteře po implantaci bederní interspinózní rozpěrky DIAM. Cesk Slov Ne urol N 2009; 72/ 105(4): 337– 342.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2009 Issue 5
Most read in this issue
- Lumbar Spinal Stenosis and Neurogenic Claudicati on
- Dissoci ative Seizures
- Indication of Decompressive Craniectomy in Traumatic Brain Injury
- The Genetics of Parkinson’s Disease


