Peroperační monitoring tkáňové oxymetri e a peroperační užití hypotermi e v chirurgii mozkových ane uryzmat
Peroperative Monitoring of Tissue Oximetry and Peroperative Use of Hypothermi a in Surgery on Cerebral Ane urysms
Introducti on:
During surgery on cerebral artery ane urysm, there is a risk of ischaemi a ca used by the use of temporary clips, brain tissue retracti on or mechanically driven vasospasms ca used by the manipulati on of brain vessels. Nowadays, tissue oxymetry is experimentally used for e arly detecti on of ischaemi a conditi oned by vasospasms. The aim of the rese arch is to evalu ate the possible use of brain tissue oximetry during surgery on cerebral artery ane urysm.
Materi al and methods:
We enrolled 25 pati ents who had been operated on for ane urysm. Pati ents were maintained in mild controlled hypothermi a during the operati on. The monitored parameters were brain tissue oxygen pressure (PbtO2), jugular bulb oxygen saturati on (SvjO2), me an arteri al pressure (MAP), and fracti on of inspired oxygen (FiO2).
Results:
In the study gro up, no correlati on exists either between peroperative values of PbtO2 and age, sex, Hunt Hess score, o utcome, localizati on or side of ane urysm or between peroperative values of PbtO2 and the SvjO2 or FiO2. A correlati on between PbtO2 and MAP (R = 0.44; p < 0.001) in the study gro up has been demonstrated. The incre asing durati on of the manipulati on of brain vessels poses a significant risk factor for a fall in PbtO2 values (p < 0.001). In all cases, the PbtO2 values decre ased after applying a temporary clip. In pati ents with peroperatively recorded peri ods of PbtO2 decre ase, the occurrence of ischemic changes on postoperative CT was comparable to the gro up in which no PbtO2 decre ase was peroperatively recorded.
Conclusi on:
We consider PbtO2 monitoring of surgery on cerebral artery ane urysms to be benefici al as it informs the surge on abo ut the length and depth of ischaemi a, thus drawing attenti on to the need for a change in the tactic of the surgery.
Key words:
oxymetry – hypothermia – aneurysm
Authors:
M. Smrčka 1; K. Ďuriš 1; V. Juráň 1; E. Neuman 1; M. Kýr 2
Authors‘ workplace:
Neurochirurgická klinika LF MU a FN Brno, 2Institut biostatistiky a analýz MU, Brno
1
Published in:
Cesk Slov Neurol N 2009; 72/105(3): 245-249
Category:
Original Paper
Overview
Úvod:
U operací ane uryzmat mozkových tepen hrozí ischemi e vyvolaná po užitím dočasné svorky, retrakcí mozkové tkáně nebo mechanicky podmíněnými vazospazmy, ke kterým může dojít v důsledku manipulace s cévami. K časné detekci ischemi e podmíněné vazospazmy se v poslední době experimentálně po užívá tkáňová oxymetri e. Cílem výzkumu je zhodnotit možnosti využití tkáňové oxymetri e u paci entů v průběhu operace ane uryzmatu mozkové tepny.
Materi ál a metoda:
Do so uboru jsme zařadili 25 paci entů, kteří byli operováni pro ane uryzma. Paci enti byli během operace udržováni v mírné řízené hypotermii a byly zaznamenávány následující údaje: parci ální tlak kyslíku v mozku (PbtO2), saturace oxyhemoglobinu v jugulárním bulbu (SvjO2), střední arteri ální tlak (MAP), frakce kyslíku ve vdechované směsi (FiO2).
Výsledky:
U zko umaného so uboru není vztah peroperačních hodnot PbtO2 k věku, pohlaví, klinickému stavu při přijetí, výslednému stavu, lokalizaci či straně ane uryzmatu, ani k hodnotám SvjO2 a FiO2. U zko umaného so uboru jsme prokázali korelaci mezi PbtO2 a MAP (R = 0,44; p < 0,001). Rosto ucí doba manipulace s mozkovými cévami je rizikovým faktorem poklesu hladiny PbtO2 (p < 0,001). U všech paci entů došlo po naložení dočasné svorky k poklesu PbtO2. U paci entů, u kterých byly peroperačně zachyceny peri ody poklesu PbtO2, byl výskyt ischemických změn na po operačním CT srovnatelný se skupino u, u které pokles PbtO2 peroperačně zachycen nebyl.
Závěr:
U operací ane uryzmat mozkových tepen považujeme monitoring PbtO2 za přínosný, protože informuje operatéra o délce a hlo ubce ischemi e, a tím upozorní na nutnost změny operační taktiky.
Klíčová slova:
oxymetrie – hypotermie – aneuryzma
Úvod
U operací aneuryzmat mozkových tepen hrozí kromě ruptury aneuryzmatu mozková ischemie, která může být vyvolána manipulací s cévami, použitím dočasné svorky nebo retrakcí mozkové tkáně. Nejzávažnější vazospazmy po subarachnoidálním krvácení (SAK) jsou vyvolány rozpadovými produkty hemoglobinu [1]. Vrchol jejich výskytu spadá do 4.–14. dne po SAK. Vazospazmy jsou kromě rebleedingu nejobávanější komplikací u pacientů po SAK z ruptury aneuryzmatu. Tyto vazospazmy nesouvisí s operací.
Během operací, při kterých se manipuluje s mozkovými tepnami, mohou vzniknout vazospazmy, které jsou vyvolány mechanicky. Tyto vazospazmy nebývají tak těžké jako vazospazmy způsobené rozpadovými produkty hemoglobinu, mohou však vyvolat závažnou ischemii. Kromě mechanicky vzniklých vazospazmů může ischemie mozkové tkáně vzniknout na základě nežádoucí retrakce, na základě použití dočasných svorek nebo na podkladě chybné polohy trvalé svorky [2].
K časné detekci ischemických změn se v poslední době experimentálně používá monitoring mozkové oxygenace [3]. K monitoringu oxygenace mozkové tkáně se používá jugulární a tkáňová oxymetrie.
Jugulární oxymetrie měří saturaci oxyhemoglobinu v jugulárním bulbu, což je odrazem globální spotřeby kyslíku mozkovou tkání. Fyziologická hodnota SvjO2 je 50–65 %, hodnota signalizující ischemii je pod 50 %. Vzhledem ke skutečnosti, že jugulární oxymetrie poskytuje informaci o spotřebě kyslíku v celém mozku, nemusí být prostřednictvím této metody zachyceny regionální ischemie menšího rozsahu. Další nevýhodou jugulární oxymetrie je výskyt artefaktů spojený se změnou polohy čidla při polohování nebo pohybu pacienta. Dislokované čidlo často přestává poskytovat spolehlivé údaje [4,5].
Tkáňová oxymetrie slouží k lokálnímu měření parciálního tlaku kyslíku v mozku. Byly vyvinuty dva systémy měření tkáňové oxymetrie: Neurotrend (Codman) a Licox (GMS-Integra). Systém Neurotrend pracuje na bázi luminiscence, systém Licox funguje na principu polarografie. Mezi hodnotami naměřenými pomocí těchto dvou systémů existují určité rozdíly, dle dosud publikovaných studií přináší přesnější a stabilnější výsledky systém Licox [5–7], který byl použit i v rámci tohoto výzkumu. Čidlo tkáňové oxymetrie se zavádí do neelokventní oblasti cca 2 cm pod duru a měřená oblast činí 7–15 mm2 [5]. Monitoring parciálního tlaku kyslíku v mozku (PbtO2) se používá hlavně v neurotraumatologii, kde slouží k detekci ischemických změn vedoucích k sekundárnímu poškození mozku [4,5,8–11]. U pacientů se SAK z ruptury aneuryzmatu se tkáňová oxymetrie experimentálně užívá k časné detekci ischemických změn následkem vazospazmů [3,11,12] a používá se také v peroperačním monitoringu [13].
Fyziologické hodnoty by měly být vyšší než 20 torr [14–16], hodnoty pod 15 torr signalizují možnou ischemii [16]. Kromě absolutní hodnoty PbtO2 hraje roli i doba, po kterou je PbtO2 sníženo [14]. Vzhledem k tomu, že tkáňová oxymetrie měří lokální oxygenační parametry, může detekovat časné ischemické změny [4,17]. Podmínkou je samozřejmě zavedení čidla do příslušné oblasti. Asi dvě hodiny po zavedení není čidlo schopné poskytovat validní údaje [4], dle našich zkušeností může být doba ustalování čidla delší.
Mírná řízená hypotermie (34 °C) je v současnosti považována za účinnou neuroprotektivní metodu. Předpokládaný účinek spočívá ve snížení metabolizmu, supresi zánětu, tlumení vzniku volných radikálů, cytokinů a excitačních aminokyselin [5]. Na našem pracovišti tuto metodu využíváme peroperačně od roku 2003 a dle našich výsledků zlepšuje výsledný stav pacientů (Glasgow Outcome Score, GOS) ve skupinách HH I a II [18]. Monitoring PbtO2 nás může upozornit na probíhající ischemii peroperačně, což by umožnilo využít neuroprotektivní efekt hypotermie ve skutečně reálně detekovaných ischemických podmínkách.
Cílem projektu bylo zlepšení výsledků operační léčby pacientů s aneuryzmatem mozkových tepen snížením rizika mozkové ischemie. K tomuto účelu jsme využili mírnou řízenou hypotermii a monitoring oxygenace mozkové tkáně.
Materiál a metoda
Do souboru bylo zařazeno 25 pacientů, 9 mužů a 16 žen ve věku mezi 38 a 76 lety (průměr 53,8 let). Pro zařazení pacientů do studie byl získán informovaný souhlas pacienta, u pacientů v bezvědomí byl souhlas vyjádřen podpisem dvou lékařů nezávislých na studii. Charakteristika souboru dle závažnosti SAK: HH1: 6 pacientů, HH2: 6 pacientů, HH3: 11 pacientů, HH4: 2 pacienti, dle Fischerovy klasifikace: F2: 5 pacientů, F3: 13 pacientů, F4: 7 pacientů. Lokalizace aneuryzmatu: a. cerebri anterior/a. communicans ant.: 9 pacientů, arteria cerebri media: 16 pacientů. Dočasné svorky bylo užito u 17 pacientů. Operace byla ve všech případech provedena časně, tj. do čtvrtého dne po SAK, kdy začíná období největšího rizika vzniku vazospazmů. Čidlo pro tkáňovou oxymetrii bylo zavedeno do příslušného povodí alespoň tři hodiny před operací, aby byla zajištěna dostatečně dlouhá doba nutná pro stabilizaci čidla. Při monitoringu povodí arteria cerebri anterior bylo místo implantace mediálně od Kocherova bodu, při sledování povodí arteria cerebri media a a. carotis interna to bylo laterálně od Kocherova bodu. Kocherův bod představuje rozhraní mezi oblastmi vyživovanými arteria cerebri anterior a media a nachází se 2,5 cm laterálně od střední čáry a 2 cm ventrálně od koronárního švu. Poloha čidla byla zpětně ověřena na kontrolním CT.
Během operace byli pacienti udržováni v mírné řízené hypotermii 34 ºC a byly zaznamenávány tyto parametry: PbtO2, SvjO2, MAP, FiO2. Dále byly zaznamenány časové údaje následujících událostí: kraniotomie, durotomie, manipulace s cévami, použití dočasné svorky, naložení trvalé svorky, zvýšení krevního tlaku, plastika dury. Tyto parametry mimo jiné sloužily k modelování změn cerebrálního perfuzního tlaku.
Jako modelovou situaci snížení ICP jsme použili fázi operace, kdy po provedení kraniotomie, durotomie a vypuštěním likvoru z bazálních cisteren i pomocí spinální linky dochází ke snížení ICP na 0 torr a CPP = MAP. Pacient je během operace udržován v hypotenzi cca 90 mm syst. TK, čímž snižujeme riziko krvácivých komplikací. Po definitivním ošetření aneuryzmatu se tlak zvyšuje na normotenzi nebo mírnou hypertenzi za účelem kontroly stavění krvácení. Tuto fázi operace jsme použili jako modelovou situaci vlivu CPP na PbtO2.
Kromě výše uvedených parametrů byly v hodnocení použity tyto údaje: pohlaví, věk, lokalizace a strana aneuryzmatu, klinický stav při přijetí (HH), CT nález při přijetí (Fischer), výsledný stav pacienta a CT kontrola první a čtvrtý pooperační den.
Získaná data byla statisticky zpracována metodou Mixed models pomocí programu SAS.
Výsledky
Z 25 pacientů zkoumaného souboru tři pacienti zemřeli (GOS 1), výsledek léčby byl neuspokojivý u osmi pacientů (GOS 2, 3) a u 14 pacientů jsme zaznamenali uspokojivý výsledek léčby (GOS 4, 5).
U zkoumaného souboru jsme neprokázali vztah peroperačních hodnot PbtO2 k věku, pohlaví, klinickému stavu pacienta při přijetí (HH), výslednému stavu pacienta (GOS), lokalizaci či straně aneuryzmatu (u všech parametrů p = NS).
U zkoumaného souboru není vztah peroperačních hodnot PbtO2 k SvjO2 ani k FiO2 (p = NS v obou případech).
U zkoumaného souboru jsme prokázali statisticky významnou korelaci mezi PbtO2 a MAP (p < 0,001, R = 0,44, počet údajů 606).
U zkoumaného souboru nedochází k signifikantnímu nárůstu PbtO2 po provedení kraniotomie (p = NS).
U zkoumaného souboru nedochází k signifikantnímu nárůstu PbtO2 při zvyšování MAP po definitivním ošetření aneuryzmatu (p = NS).
V modelu vlivu manipulace s cévami se ukázal signifikantní pokles hladiny PbtO2 v době manipulace s cévami (p < 0,001). Rostoucí doba manipulace s mozkovými cévami je tedy rizikovým faktorem poklesu hladiny PbtO2.
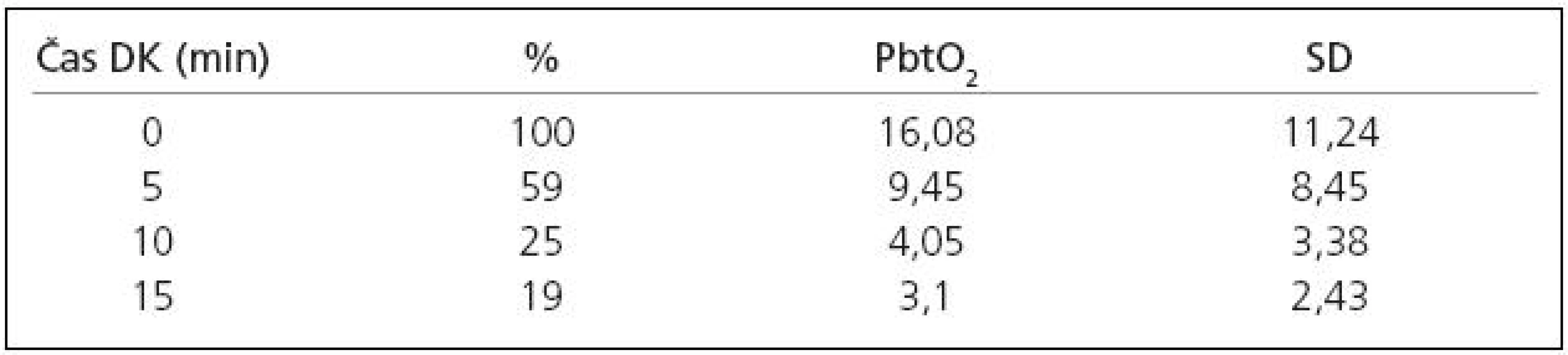
Po naložení dočasné svorky dochází u zkoumaného souboru k poklesu PbtO2. Průměrná doba naložení dočasné svorky činila 12,7 min (4,5–25 min). Průměrné hodnoty poklesu PbtO2 ukazuje tab. 1. Na CT kontrole první pooperační den jsme nezaznamenali ischemii v povodí operované tepny ani v jednom případě, na CT kontrole čtvrtý pooperační den jsme zaznamenali ischemii v povodí operované cévy u čtyřech ze 17 pacientů ve skupině s použitím dočasné svorky. U skupiny pacientů, kde dočasná svorka použita nebyla, jsme na CT kontrole první pooperační den také nezaznamenali ani jeden případ ischemie v příslušném povodí, zatímco na CT kontrole provedené čtvrtý pooperační den jsme zaznamenali ischemii ve sledovaném povodí u dvou z osmi pacientů. Nasazení trvalé svorky ani plastika dury nemá vliv na hodnotu PbtO2 (p = NS).
Diskuze
Ačkoliv monitoring mozkové oxygenace u pacientů po SAK se používá především v pooperačním období [3,11,12], peroperační použití může být také přínosné [13]. Přínos peroperačního monitoringu PbtO2 sledujeme ve dvou aspektech. Peroperační monitoring jednak přináší operatérovi informaci o oxygenaci mozkové tkáně a jednak nám umožňuje modelovat specifické situace.
V praxi monitoring PbtO2 poskytuje operatérovi cenné informace zejména v kritické fázi operace, kterou je naložení dočasné svorky. Po naložení dočasné svorky došlo ve všech případech k poklesu PbtO2, což je v souladu s publikovanými údaji [11]. Tato skutečnost slouží také k orientační kontrole lokalizace čidla, neboť CT mozku, na kterém je poloha čidla patrná, se provádí až v rámci pooperační kontroly. Nedojde‑li k poklesu PbtO2, je čidlo pravděpodobně zavedeno v jiném povodí nebo je výrazně suficientní kolaterální oběh. Dynamika poklesu pak poskytuje operatérovi představu o vlivu naložení dočasné svorky na mozkovou tkáň. V našem souboru došlo po 5 min naložení dočasné svorky k poklesu průměrné hodnoty PbtO2 na 59 %, po 10 min na 25 % a po 15 min na 19 % průměrné hodnoty před naložením dočasné svorky (tab. 1).
Pokles PbtO2 během operace byl zaznamenán u 17 pacientů. CT kontrola první pooperační den sloužila mimo jiné k vyloučení ischemie vzniklé před operací, neboť ischemii vzniklou v důsledku operace by toto CT ještě neukázalo. CT kontroly z prvního pooperačního dne byly ve sledovaném parametru ve všech případech negativní. CT kontrola ze čtvrtého pooperačního dne nám sloužila k detekci ischemických událostí vzniklých v důsledku operace. Na CT kontrole čtvrtý pooperační den byla zachycena ischemie ve sledovaném povodí u 24 % pacientů ze skupiny s dočasnou svorkou a u 25 % pacientů ze skupiny bez dočasné svorky. Domníváme se, že relativně malý výskyt ischemie v důsledku použití dočasné svorky, který je srovnatelný se skupinou, u níž dočasná svorka užita nebyla, by mohl mít souvislost s peroperačním použitím mírné řízené hypotermie. To by bylo v souladu s našimi dosavadními zkušenostmi [18]. Jsme si však vědomi, že tyto výsledky, vzhledem k rozsahu souboru, neumožňují učinit jednoznačný závěr.
V teoretické rovině může peroperační monitoring dále sloužit k hodnocení změn PbtO2 v situacích modelujících změny základních fyziologických parametrů. Předchozími studiemi byla prokázána korelace mezi PbtO2 a CPP [9,19]. V souladu s výše zmíněnými studiemi lze předpokládat růst hladin PbtO2 při zvýšení CPP.
Jako modelovou situaci zvýšení CPP jsme použili kraniotomii, kdy dochází ke snížení ICP na 0 torr. Snížením ICP dochází při konstantním MAP k nárůstu CPP (CPP = MAP – ICP), což by se mohlo projevit v nárůstu PbtO2. Zvýšení PbtO2 během kraniotomie při operacích aneuryzmatu již popsáno bylo [20]. Tento předpoklad se však u zkoumaného souboru nepotvrdil, i když jsme tento jev v individuálních případech zaznamenali. Avšak data naznačují, že k nárůstu PbtO2 dochází spíše v případech, kdy je iniciální PbtO2 nízké, zatímco v případech vyšších hodnot PbtO2 k nárůstu po provedení kraniotomie nedochází (graf 1).

V dalším průběhu operace je ICP rovno 0 torr, CPP je tedy rovno MAP. Změny CPP se v této fázi operace rovnají změnám MAP a korelují se změnami PbtO2, z čehož vyplývá, že CPP je důležitým předpokladem dodávky kyslíku mozku.
Zvyšování tlaku po definitvním ošetření aneuryzmatu jsme použili jako další modelovou situaci změny CPP. Při ICP = 0 se CPP = MAP a zvyšováním MAP tedy v této fázi operace přímo zvyšujeme CPP a stejně jako u kraniotomie i zde se dá předpokládat nárůst PbtO2, což jsme v individuálních případech také pozorovali. Ani v tomto případě se však předpoklad nepotvrdil a u zkoumaného souboru při zvyšování MAP po definitivním ošetření aneuryzmatu nedochází k signifikantnímu nárůstu PbtO2. Stejně jako v případě snižování ICP je i v případě zvyšování MAP naznačen nárůst PbtO2 spíše v případech, kdy jsou nízké hladiny PbtO2 před zvýšením MAP (graf 2). Obě modelové situace změny CPP tedy naznačují, že by PbtO2 mohlo v obou případech reagovat obdobně.

Potvrdil se předpoklad, že doba manipulace s cévami je u zkoumaného souboru rizikovým faktorem poklesu PbtO2. To si vysvětlujeme tím, že s prodlužující se dobou manipulace s cévami by mohlo růst riziko vzniku mechanicky podmíněných vazospazmů, které vedou k poklesu PbtO2. I při nekomplikovaném průběhu tedy může při prolongované manipulaci s cévami hrozit pokles PbtO2 a následná ischemie. Vliv manipulace s cévami na hodnotu PbtO2 byl hodnocen tím způsobem, že byl vytvořen jeden model hodnot PbtO2 z období, kdy se s cévami nemanipulovalo, a druhý model hodnot PbtO2 z období průběhu manipulace s cévami a tyto modely následně porovnány (graf 3).

Při zpracování dat jsme použili modely lineární. Jsme si vědomi, že lineární model představuje velké zjednodušení reálných dat, nicméně vzhledem k velké variabilitě dat a četným artefaktům lineární model určitým způsobem tyto nežádoucí jevy eliminuje a je lehce interpretovatelný. Závěry byly odvozeny z modelů vytvořených z dat, ze kterých byly vyřazeny suspektní artefakty.
Závěr
U operací aneuryzmat mozkových tepen považujeme monitoring PbtO2 za přínosný. Monitoring PbtO2 může operatérovi poskytnout informace o aktuální oxygenaci mozkové tkáně, což je cenné zejména při vlastní preparaci, při eventuální nevhodné retrakci mozkové tkáně a při naložení dočasné svorky. Protrahovaný pokles PbtO2 vede operatéra ke změně operační taktiky. Poklesy hodnot PbtO2 v průběhu operací aneuryzmat mozkových tepen mohou upozornit na riziko ischemie, jejíž následky by mohly být zmírněny použitím mírné řízené hypotermie.
Práce vznikla za podpory grantu IGA MZ ČR č. 8837-3.
prof. MUDr. Martin Smrčka, Ph.D., MBANeurochirurgická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: msmrcka@fnbrno.cz
Sources
1. Ohlstein EH, Storer BL. Oxyhemoglobin stimulati on of endothelin producti on in cultured endotheli al cells. J Ne urosurg 1992; 77(2): 274– 278.
2. Gelabert- González M, Fernández- Villa JM, Ginesta- Galan V. Intra- operative monitoring of brain tissue O2 (PtiO2) during ane urysm surgery. Acta Ne urochir 2002; 144(9): 863– 867.
3. Meixensberger J, Vath A, Jaeger M, Kunze E, Dings J, Ro osen K. Monitoring of brain tissue oxygenati on following severe subarachno id hemorrhage. Ne urol Res 2003; 25(5): 445– 450.
4. Stevens WJ. Multimodal monitoring: He ad injury management using SvjO2 and Licox. J Ne urosci Nurs 2004; 36(6): 332– 339.
5. Nortje J, Gupta AK. The role of tissue oxygen monitoring in pati ents with acute brain injury. Br J Anaesth 2006; 97(1): 95– 106.
6. Jaeger M, Soehle M, Meixensberger J. Brain tissue oxygen (PtiO2): a clinical comparison of two monitoring devices. Acta Ne urochir Suppl 2005; 95: 79– 81.
7. Hoelper BM, Alessandri B, Heimann A, Behr R, Kempski O. Brain oxygen monitoring: in‑vitro accuracy, long‑term drift and response- time of Licox and Ne urotrend sensors. Acta Ne urochir (Wi en) 2005; 147(7): 767– 774.
8. Sti efel MF, Spi otta A, Gracais VH, Garuffe AM, Guillamondegui O, Maloney- Wilensky E et al. Reduced mortality rate in pati ents with severe tra umatic brain injury tre ated with brain tisssue oxygen monitoring. J Ne urosurg 2005; 103(5): 805– 811.
9. Ki ening KL, Unterberg AW, Bardt TF, Schneider GH, Lanksh WR. Monitoring of cerebral oxygenati on in pati ents with severe he ad injuri es: brain tissue PO2 versus jugular vein oxygen saturati on. J Ne urosurg 1996; 85(5): 751– 757.
10. Meixensberger J, Ba unach S, Amschler J, Dings J, Ro osen K. Influence of body positi on on tissue PO2, cerebral perfusi on pressure and intracrani al pressure in pati ents with acute brain injury. Ne urol Res 1997; 19(3): 249– 253.
11. Kett- White R, Hutchinson PJ, Al- Rawi PG, Gupta AK, Pickard JD, Kirkaptrick PJ. Adverse cerebral events detected after subarachno id hemorrhage using brain oxygen and microdi alysis probes. Ne urosurgery 2002; 50(6): 1213– 1222.
12. Meixensberger J, Vath A, Jaeger M, Kunze E, Dings J, Ro osen K. Monitoring of brain tissue oxygenati on following severe subarachno id hemorrhage. Ne urol Res 2003; 25(5): 445– 450.
13. Kett- White R, Hutchinson PJ, Al- Rawi PG, Szosny ka M, Gupta AK, Pickard JD et al. Cerebral oxygen and microdi alysis monitoring during ane urysm surgery: effects of blo od pressure, cerebrospinal fluid drainage and temporary clipping on infarcti on. J Ne urosurg 2002; 96(6): 1013– 1019.
14. Lang EW, Mulvey JM, Mudali ar Y, Dorsch NW. Direct cerebral oxygenati on monitoring – a systematic revi ew of recent publicati ons. Ne urosurg Rev 2007; 30(2): 99– 107.
15. Maas A, Fleckenstein W, de Jong D, van Santbrink H. Monitoring cerebral oxygenati on: experimental studi es and preliminary clinical results of continuo us monitoring of cerebrospinal fluid and brain tissue oxygen tensi on. Acta Ne urochir Suppl (Wi en) 1993; 59: 50– 57.
16. Littlejohns LR, Bader MK, March K. Brain tissue oxygen monitoring in severe brain injury. I. Rese arch and usefulness in critical care. Crit Care Nurse 2003; 23(4): 17– 25.
17. Meixensberger J, Dings J, Kuhnigk H, Rossen K. Studi es of tissue PO2 in normal and pathological human brain cortex. Acta Ne urochir Suppl (Wi en) 1993; 59: 58– 63.
18. Gál R, Smrčka M. Ne uroprotektivní po užití mírné hypotermi e během intrakrani ální chirurgi e mozkových ane uryzmat. Cesk Slov Ne urol N 2006; 69/ 102(5): 371– 375.
19. Lang EW, Czosnyka M, Mehdorn HM. Tissue oxygen re activity and cerebral a utoregulati on after severe tra umatic brain injury. Crit Care Med 2003; 31(1): 267– 271.
20. Critchley GR, O’Neill KS, Bell BA. Cerebral blo od flow and tissue oxygenati on monitoring during ane urysm surgery. Ne urol Res 1998; 20 (Suppl 1): 44– 47.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2009 Issue 3
Most read in this issue
- Autologní transplantace kmenových krvetvorných buněk a její so učasná role v léčbě roztro ušené sklerózy
- Migréna
- Adultní forma glutarové aciduri e II. typu – nedostatečně di agnostikovaná příčina proximální myopati e – kazuistika
- Transpozice šlachy m. tibi alis posteri or – efektivní řešení parézy perone álních svalů
