Význam monitorování mozkové aktivity pomocí integrované amplitudy EEG aktivity u novorozenců s časným asfyktickým syndromem
The Importance of Brain Activity Monitoring with Integrated EEG Amplitude in Neonates with Early Asphyxia Syndrome
The aim of this study was to confirm the correlation between the type of amplitude-integrated EEG (aEEG) in neonates after perinatal or early postnatal asphyxia and the degree of subsequent hypoxic-ischaemic encephalopathy, and to introduce early aEEG monitoring into clinical practice.
Method and patients:
The aEEG was continually recorded in 45 neonates that had suffered from perinatal asphyxia and 2 neonates with early postnatal asphyxia. Average gestational age was 39 weeks, weight 3147 g, average cord pH was 6.95 and base excess was –17.26. Apgar score in 1st minute was 2, in 5th minute 5 and 10th minute 6. The aEEG traces were recorded with a Cerebral Function Monitor 6000 Olympic Medical and classified according to Hellstrom-Westas. The grade of hypoxic-ischemic encephalopathy was evaluated according to Sarnat-Sarnat classification. The assessment of neurological outcome was not included in this work.
Results:
Hypoxic-ischemic encephalopathy did not develop in 10 out of 47 neonates, 7 newborns had encephalopathy grade I, 15 cases developed encephalopathy grade II and 15 patients showed encephalopathy grade III. All of the neonates who had developed no hypoxic-ischaemic encephalopathy or encephalopathy grade I had “continuous normal voltage” or “discontinuous normal voltage” trace type. The negative predictive value (probability of cases with normal aEEG to develop maximally HIE grade I) was 0.75. All types of traces from “continuous normal voltage” to “flat trace” were recorded in neonates with hypoxic-ischaemic encephalopathy grade II. All cases with encephalopathy grade III showed an abnormal aEEG trace (“burst suppression”, “low voltage” and “flat trace”). The positive predictive value of abnormal aEEG trace to predict the development of HIE grade II or III was 0.92.
Conclusion:
In our study we confirmed the usefulness of aEEG assessment in predicting the development of subsequent hypoxic-ischemic encephalopathy in neonates that have suffered from early asphyxia. Introduction of early non‑invasive EEG monitoring into clinical practice might help to identify cases that could benefit from therapeutic hypothermia.
Key words:
neonate – hypoxic-ischaemic encephalopathy – EEG monitoring – integrated EEG amplitude – hypothermia
Authors:
J. Lukášková 1; Z. Tomšíková 2; Z. Kokštein 1
Authors‘ workplace:
Dětská klinika LF UK a FN Hradec Králové
1; Neonatologické oddělení, Nemocnice České Budějovice
2
Published in:
Cesk Slov Neurol N 2008; 71/104(5): 544-551
Category:
Original Paper
Overview
Cílem práce bylo potvrdit korelaci mezi typem integrované amplitudy EEG aktivity (aEEG) v prvních hodinách života novorozenců po proběhlé perinatální nebo časné postnatální hypoxii a stupněm následné hypoxicko‑ischemické encefalopatie (HIE), a dále zavedení metody monitorování aEEG aktivity do rutinní klinické praxe.
Metoda:
U 45 novorozenců po proběhlé perinatální hypoxii (průměrné pupečníkové pH 6,95, průměrný BE 17,26) a u dvou novorozenců po časné postnatální hypoxii byl kontinuálně monitorován aEEG záznam pomocí Cerebral Function Monitor 6000 Olympic Medical a klasifikován podle Hellström-Westasové. Stupeň hypoxicko‑ischemické encefalopatie byl hodnocen dle klasifikace Sarnat-Sarnat. V této práci není zahrnuto hodnocení dalšího neurologického vývoje.
Výsledky:
Ze 47 novorozenců nedošlo k rozvoji HIE u 10 z nich, sedm dětí mělo HIE I. stupně, 15 mělo HIE II. stupně a 15 HIE III. stupně. Novorozenci bez rozvoje HIE a s HIE I. stupně měli normální nebo mírně abnormální křivku. Negativní prediktivní hodnota (pravděpodobnost, že se u dětí s normální křivkou rozvine maximálně HIE I. stupně) byla 0,75. U dětí s rozvojem HIE II. stupně jsme zaznamenali všechny typy křivek od normální až po těžce patologickou. Ve skupině s HIE III. stupně měly všechny děti patologickou křivku typu “burst supression”, nízkovoltážní nebo plochou. Pozitivní prediktivní hodnota pro rozvoj alespoň HIE II. stupně u dětí s patologickou křivkou byla 0,92.
Závěr:
V naší práci jsme potvrdili význam aEEG při časné predikci rozvoje hypoxicko‑ischemické encefalopatie u novorozenců s časným asfyktickým syndromem. Zavedení monitorování aEEG do klinické praxe by mohlo napomoci výběru pacientů k terapeutické hypotermii.
Klíčová slova:
novorozenec – hypoxicko‑ischemická encefalopatie – EEG monitorování – integrovaná amplituda EEG aktivity – hypotermie
Úvod
Hypoxicko‑ischemická encefalopatie (HIE) jako následek proběhlé perinatální asfyxie představuje stále velký problém současné neonatologie a následné péče o děti se závažnými neurologickými následky. Vzhledem k rozvíjejícím se možnostem neuroprotektivní terapie u novorozenců s časným asfyktickým syndromem (ČAS) stoupá zájem o monitorování mozkové aktivity a jeho interpretaci v souvislosti s prognózou dalšího vývoje. V současné době se největší zájem obrací k metodám hypotermie, ať celotělové nebo selektivní, kdy na experimentální studie navázaly studie klinické [1–3]. Experimentální studie na zvířatech prokázaly, že redukce tělesné teploty o 3–4 °C po hypoxicko‑ischemickém nebo jiném neuronálním poškození chrání cerebrální energetický metabolizmus, redukuje cytotoxický edém, snižuje histologické poškození a zlepšuje tak neurologický vývoj. Na základě těchto výsledků lze předpokládat, že mírná hypotermie by mohla být klinicky užitečná neuroprotektivní metoda. Vzhledem k tomu, že úspěch hypotermie je vázán na velmi časné zahájení (nejpozději do 12 hod), objevuje se problém, zda je možné přesně a včas vybrat pacienty k zahájení hypotermie [4]. Výsledky zahraničních prací dokazují, že snímání integrované amplitudy EEG aktivity (aEEG) brzy po narození umožní přesnou predikci neurologického poškození po proběhlé hypoxii již v šesti hodinách věku a nabízí tak vhodnou metodu výběru pacientů k hypotermii. Z výsledků zahraničních studií vyplývá, že senzitivita této metody při predikci rozvoje závažné formy dětské mozkové obrny (DMO) je 91–100 % a specificita 82–89 % [5–7].
Metoda je založena na kontinuálním monitorování základní mozkové aktivity pomocí přístroje Cerebral Function Monitor (CFM), jehož výstupem je aEEG křivka [8,9]. Umožňuje dlouhodobé sledování změn mozkové aktivity a je dostupná u lůžka pacienta bezprostředně po přijetí na jednotku intenzivní péče (JIP). Podrobný popis metody, její výhody a limitace byly publikovány v časopisu Čs. pediatrie [9].
Cílem práce bylo:
- Prokázat vztah mezi typem aEEG křivky v prvních hodinách života a stupněm následné hypoxicko‑ischemické encefalopatie a tím prokázat vhodnost metody k časné predikci neurologického vývoje.
- Zavedení metody monitorování aEEG u hypoxických novorozenců do rutinní praxe.
Metoda a soubor
V období 4/2005–2/2007 jsme monitorovali a následně hodnotili kontinuální aEEG záznam u 47 donošených novorozenců s diagnózou perinatální nebo časné postnatální hypoxie hospitalizovaných na JIP v Perinatologickém centru FN Hradec Králové a v Perinatologickém centru Nemocnice České Budějovice. Průměrný gestační věk byl 39 týdnů (35–42), průměrná hmotnost 3 147 g (1 680–3 970), průměrné pupečníkové pH bylo 6,95 (6,51–7,32), průměrná hodnota Base Excess (BE) byla 17,26 (–26 až –6,7), průměrná skóre dle Apgarové v první minutě 2 (0–8), v páté minutě 5 (0–9), v desáté minutě 6 (0–10). Byli zahrnuti novorozenci s mírnou až těžkou perinatální hypoxií, kdy byla diagnóza stanovena na základě hodnot pupečníkového pH, BE, hodnocení dle Apgarové a/nebo poruchy poporodní adaptace s nutností zahájit resuscitaci na porodním sále. Tři novorozenci prodělali hypoxickou příhodu v postnatálním období ve věku 33, resp. 36 a 96 hod a vyžadovali zahájení resuscitace a následně péči na JIP (v tab. 2 pacienti č. 1, 13 a 44).
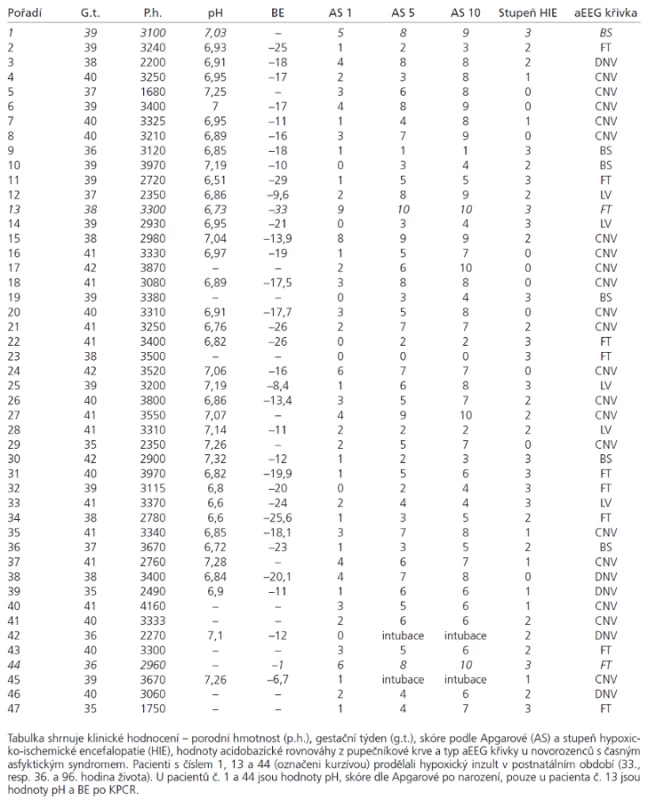
Mozková aktivita byla u všech dětí snímána přístrojem CFM 6000 (Olympic Medical) s použitím hydrogelových nebo kalíškových elektrod umístěných parietálně. Monitorování bylo zahájeno v prvních hodinách po přijetí novorozence na JIP, průměrně ve stáří 4,75 hodin (1,5–19). První odhad prognózy na základě aEEG záznamu byl proveden v šesté hodině po inzultu. Pokud nebylo z technických důvodů možné získat záznam do šesti hodin, potom byl hodnocen první získaný záznam (7–19 hod). Monitorování pokračovalo do objevení normální křivky nebo nejméně 72 hod, průměrná doba monitorování byla 50,7 hod (1,25–192).
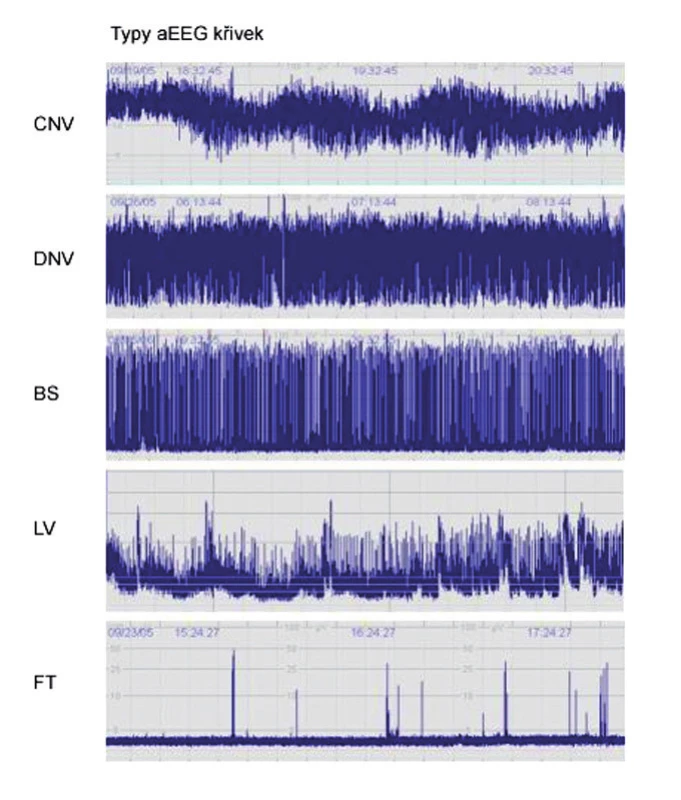
Při hodnocení aEEG záznamů byla sledována základní aktivita podle klasifikace Hellström-Westasové [10] a výskyt záchvatové aktivity. Jako normální křivka (CNV) byl hodnocen záznam s minimální amplitudou 7–10 µV a maximální 10–25 µV. Mírně abnormální křivka (DNV) s minimální amplitudou pod 5 µV a maximální amplitudou nad 10 µV. Jako patologický jsme hodnotili záznam s minimální amplitudou pod 5 µV a maximální nedosahující 10 µV. Mezi patologické záznamy patří křivka „výboj-oploštění“ (Burst-Supression, BS), nízkovoltážní křivka (LV) a plochá křivka (FT), (obr. 1) [10]. Stupeň HIE byl hodnocen standardně dle klasifikace Sarnat-Sarnat [11].
Výsledky
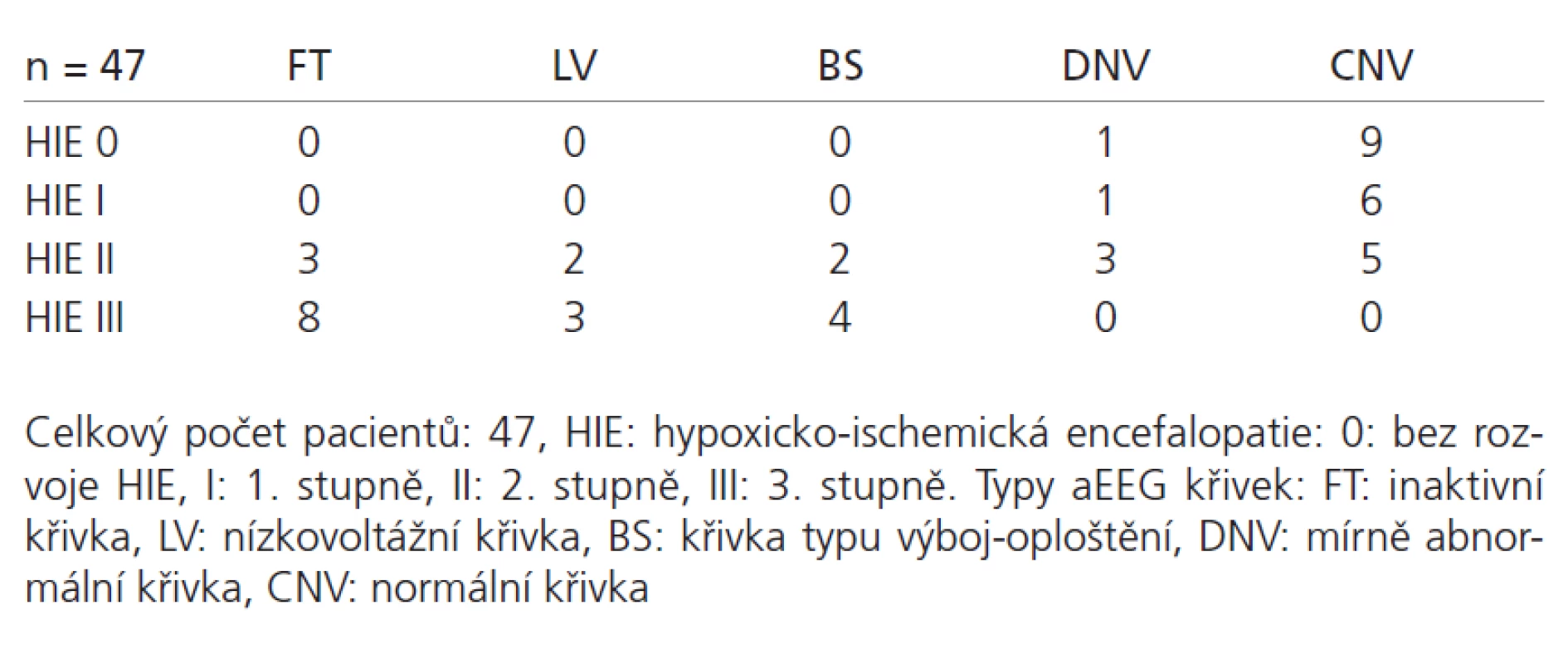
Z celkového počtu 47 novorozenců u 10 (21 %) nedošlo k rozvoji HIE, u sedmi dětí (15 %) došlo k rozvoji HIE I. stupně, u 15 dětí (32 %) vznikla HIE II. stupně a 15 dětí (32 %) mělo HIE III. stupně (graf 1).

Z 10 dětí, u kterých nedošlo k rozvoji HIE, mělo jedno dítě křivku mírně abnormální (10 %), s rychlou úpravou k normě a devět (90 %) dětí mělo normální křivku s přítomností cyklických změn, která je prognosticky příznivá.
Z celkového počtu sedmi dětí s diagnózou HIE I. stupně jsme u šesti dětí (86 %) zaznamenali křivku normální a jeden novorozenec (14 %) měl mírně abnormální křivku (DNV).
Z 15 novorozenců s HIE II. stupně mělo pět dětí (34 %) normální křivku, tři děti (20 %) měly mírně abnormální křivku, dvě děti (13 %) měly křivku typu BS, u dvou dětí (13 %) jsme zachytili nízkovoltážní křivku (LV) a u tří dětí (20 %) plochou křivku (FT).
U čtyř dětí s normální amplitudou na aEEG byla HIE II. stupně hodnocena pro přítomnost křečí v časném postnatálním období, dvě děti měly klinické křeče před zahájením aEEG monitorování. Křeče odezněly po jednorázovém podání fenobarbitalu, ostatní neurologický nález byl v normě. U dvou dětí bylo nutné opakované podání antikonvulziv a byla zaznamenána paroxysmální aktivita na aEEG.
Všechny děti s HIE III měly patologickou křivku, čtyři děti (27 %) měly křivku BS, u tří dětí (20 %) jsme křivku hodnotili jako nízkovoltážní a u osmi dětí (53 %) jako plochou (grafy 2–4, tab. 1).



Z uvedených výsledků vyplývá, že pokud byl v prvních hodinách záznam patologické křivky (BS, LV, FT), došlo k rozvoji nejméně HIE II. stupně. 53 % dětí s křivkou typu FT mělo HIE III. stupně. Pomocí Fischerova přesného testu nezávislosti byl prokázán vztah mezi typem křivky v prvních hodinách po inzultu (typ CNV, DNV, BS, LV, FT) a stupně následné hypoxicko‑ischemické encefalopatie (HIE 0, I, II, III) na hladině významnosti 0,05. Senzitivita (pravděpodobnost záznamu středně až těžce patologické křivky – DNV, BS,LV, FT – u dětí s rozvojem HIE II a III) byla 83%. Specificita (pravděpodobnost záznamu normální křivky u dětí bez HIE nebo s HIE I) byla 88%. Pozitivní prediktivní hodnota pro rozvoj alespoň HIE II. stupně u dětí s patologickou křivkou byla 0,92, negativní prediktivní hodnota (pravděpodobnost, že se u dětí s normální křivkou rozvine maximálně HIE I. stupně) byla 0,75. Koeficient shody (k) pro odhad prognózy metodou CFM a dle klasifikace Sarnat-Sarnat byl 0,66.
Diskuze
Výsledky podobně jako zahraniční práce ukazují, že pomocí aEEG lze poměrně přesně odhadnout tíži hypoxického postižení v krátké době po proběhlé hypoxii, dříve než dojde k plné manifestaci neurologických příznaků hypoxicko‑ischemické encefalopatie, a tím i časně určit prognózu dalšího neurologického postižení dítěte. V zahraničních studiích byl posuzován vztah mezi křivkou aEEG a neurologickým vývojem ve 12.–24. měsíci života [5–7], zatímco v naší práci jsme hodnotili vztah mezi aEEG křivkou a stupněm HIE jako metody odhadu další prognózy. Do naší práce jsme zařadili i novorozence s mírnou perinatální hypoxií, u kterých nedošlo k rozvoji HIE.
K hodnocení dlouhodobé prognózy dalšího psychomotorického vývoje je samozřejmě důležitý i další vývoj aEEG křivky, kdy sledujeme zejména nástup normální aktivity nebo alespoň postupnou úpravu křivky a také objevení se pravidelných cyklických změn. Vzhledem k nízkému věku sledovaných dětí jsme zatím nemohli zahrnout sledování dlouhodobého psychomotorického vývoje, abychom potvrdili korelaci mezi typem aEEG záznamu a následným neurologickým postižením.
aEEG záznam v prvních hodinách života dobře koreluje se stupněm HIE, proto by tato metoda mohla být vhodná k výběru novorozenců k časnému zahájení hypotermie. Jak uvádějí Azzopardi et al [4], k hypotermické léčbě je nutné indikovat děti, které budou mít pravděpodobně menší postižení, než by měly bez této léčby. Naopak je zbytečné vystavovat děti s dobrou prognózou potenciálně toxickému vlivu této terapie. K zajištění největší účinnosti je nutno zahájit hypotermii do šesti hodin od inzultu. Gluckman et al provedli první velkou multicentrickou studii s využitím selektivní hypotermie („head-cooling“), kdy do studie zařadili novorozence s mírnou až těžkou depresí EEG aktivity nebo záchvatovou aktivitou na aEEG. Ve skupině pacientů s hypotermií bylo těžce postižených nebo zemřelo 55 proti 66 % v normotermické skupině. Pokud z hypotermické skupiny vyřadili novorozence s těžce patologickou křivkou, u kterých lze předpokládat minimální efekt hypotermické léčby, byl výsledek 48 % postižených v hypotermické skupině verzus 66 % v normotermické skupině. Rozvoj motorického postižení byl snížen z 28 na 12 % dětí [12]. Shankaranová et al zařadili do multicentrické studie s celotělovou hypotermií 208 dětí podle laboratorních a klinických známek středně těžké až těžké hypoxie, bez monitorování aEEG aktivity. U 205 dětí byl neurologický vývoj sledován do 18 měsíců věku. Úmrtí nebo středně těžká až těžká retardace psychomotorického vývoje byla hodnocena u 44 % dětí v hypotermické skupině proti 62 % v normotermické skupině [2].
Podle výsledků těchto prací se zdá, že není výrazný rozdíl, zda je hypotermie indikována na základě klinických a laboratorních známek hypoxie nebo s použitím aEEG záznamu. V žádné z těchto prací však není zahrnuto hodnocení neurologického vývoje u dětí, které nesplňovaly kritéria k zařazení do studie (pH, skóre dle Apgarové, neurologické příznaky časně po narození). Na druhou stranu z naší skupiny pacientů bychom na základě laboratorních známek hypoxie, které použila Shankaranová jako hlavní kritérium při výběru pacientů [2], zařadili do hypotermické skupiny i novorozence s normální aEEG křivkou.
Sledování celé skupiny provedli v malé studii Azzopardi et al, kteří k selekci pacientů využili aEEG. U 10 dětí s patologickou aEEG křivkou (BS, LV, FT) zahájili hypotermii. Šest dětí mělo normální neurologický vývoj a tři děti zemřely. Šest dětí mělo normální aEEG křivku, proto nebyly vybrány k hypotermii, u žádného z těchto dětí nedošlo k rozvoji závažné encefalopatie a neurologický vývoj ve 12 měsících věku byl normální [4].
Z publikovaných prací se zdá, že k hypotermii by měli být indikováni novorozenci s mírně až těžce patologickou aEEG křivkou (DNV, BS, LV, FT), u kterých očekáváme redukci těžkých následků hypoxie v dalším neurologickém vývoji [1,3,4,12–14].
Další indikací k zahájení hypotermie by měl být záchyt paroxysmální záchvatové aktivity nebo klinické křeče. Dle studie Hellström-Westasové et al byly opakované křeče (klinické nebo subklinické) spojeny s horší prognózou dítěte, zatímco u dětí s jednou epizodou záchvatové aktivity byl u 50 % vývoj normální [6]. U novorozenců diagnostiku komplikuje časný výskyt subklinických nebo subtilních křečí, zejména u dětí s HIE, kdy se iniciální křeče velmi často klinicky projeví, ale následná záchvatová aktivita po podání první dávky antikonvulziv mívá subklinický průběh [15,16]. S ohledem na možné ovlivnění prognózy indikovanou antikonvulzivní terapií je přínosné kontinuální monitorování aEEG, které může odhalit paroxysmální záchvatovou aktivitu bez klinického korelátu a sledovat efekt antikonvulzivní terapie. Při hodnocení základní mozkové aktivity je nutné zahrnout i možný neurosedativní vliv antikonvulzivní terapie. Hellström-Westasová et al pozorovali u některých dětí s normálním neurologickým vývojem depresi základní aktivity a záznam typu „výboj-oploštění“ po podání fenobarbitalu. Dle klinického sledování však k výraznějšímu ovlivnění mozkové aktivity dochází zejména u dětí se závažným poškozením mozku [6].
Je nutné zdůraznit, že záznam aEEG je pouze jednosvodový, proto, jak uvádějí Rennie et al, ani při kontinuálním záznamu nemusíme zachytit velmi krátce trvající výboje záchvatové aktivity (méně než 30 s), stejně jako fokální křeče a záchvatovou aktivitu o velmi nízké voltáži [15].
Ve skupině našich pacientů byla u 20 dětí zachycena paroxysmální záchvatová aktivita, která byla u 13 novorozenců provázena klinickými křečemi. U jednoho dítěte došlo po podání antikonvulziv k ústupu klinických křečí, ale na aEEG křivce přetrvávala epileptiformní aktivita. Šest dětí mělo pouze subklinickou paroxysmální aktivitu na aEEG křivce bez klinického korelátu.
Domníváme se, že z výsledků dosud publikovaných prací nelze jednoznačně rozhodnout, zda výběr pacientů k terapeutické hypotermii pomocí aEEG může významně ovlivnit její efekt nebo je jen pomocnou metodou, která by mohla urychlit a usnadnit výběr pacientů. Je jisté, že podle publikovaných prací byl prokázán význam hodnocení aEEG v šesti a v jedné práci již ve třech hodinách života po proběhlé hypoxii [7]. Hodnocení další prognózy dítěte jen na základě klinického hodnocení nemusí být ve všech případech dostatečné, protože diagnózu hypoxicko‑ischemické encefalopatie s určením jejího stupně a tím i dlouhodobé prognózy lze někdy stanovit až s odstupem několika hodin.
Využití aEEG při indikaci terapeutické hypotermie zůstává tedy stále otevřenou otázkou. Je jisté, že má význam, pokud je monitorování zahájeno nejpozději do šesti hodin po inzultu. Mohlo by pomoci při selekci dětí, které i přes laboratorně těžkou hypoxii mají normální aEEG záznam a hypotermie tedy není indikovaná, protože další neurologický vývoj bude velmi pravděpodobně příznivý. Další otázkou je indikace u dětí s velmi těžkou depresí základní aktivity, kde očekáváme jen minimální efekt hypotermie [4]. Další důležitou indikací, kde selhává klinické hodnocení, je subklinicky probíhající paroxysmální aktivita, i přesto, že pomocí aEEG nejsme schopni zachytit 100 % záchvatové aktivity.
K rozšíření našich znalostí o roli hypotermie po perinatální hypoxii a významu aEEG monitorování při selekci pacientů by měly přispět výsledky dalších studií, které probíhají v současné době (TOBY – Velká Británie, ICE – Austrálie, Nový Zéland, Kanada).
Závěr
aEEG je jednoduchá neinvazivní metoda k monitorování mozkové aktivity a predikci dalšího neurologického vývoje. V naší práci jsme prokázali vztah mezi aEEG křivkou v prvních hodinách života a stupněm HIE dle klasifikace Sarnat-Sarnat, která je dlouho užívanou metodou k určení prognózy dalšího vývoje. Výhodou metody aEEG oproti standardnímu hodnocení stupně HIE je časnější odhad prognózy dalšího neurologického vývoje (optimálně již v šesti hodinách věku) a možnost záchytu subklinické záchvatové aktivity. Proto by aEEG mohlo být vhodnou metodou k výběru pacientů k terapeutické hypotermii. V naší skupině pacientů bychom po zhodnocení vstupních laboratorních výsledků, které byly např. hlavním kritériem pro zahájení hypotermie ve studii Shankaranové et al [2], zařadili do hypotermické skupiny i novorozence s normální aEEG křivkou, u kterých předpokládáme normální vývoj i bez intervence. Nicméně se jedná o předběžné hodnocení a bude nutné sledování větší skupiny pacientů a porovnání s dlouhodobým neurologickým vývojem. Přesněji vymezit roli aEEG při výběru pacientů k hypotermické terapii a indikační kritéria k zahájení této léčby v klinické praxi by měly výsledky dalších studií.
Použité zkratky:
aEEG integrovaná amplituda EEG
BE Base Excess
BS křivka „výboj-oploštění“ (Burst-Suppression)
CFM Cerebral Function Monitor
CNV normální křivka (Continuous Normal Voltage)
ČAS časný asfyktický syndrom
DMO dětská mozková obrna
DNV mírně abnormální křivka (Discontinuous Normal Voltage)
FT plochá křivka (Flat Trace)
HIE hypoxicko‑ischemická encefalopatie
JIP jednotka intenzivní péče
LV nízkovoltážní křivka (Low Voltage)
MUDr. Jana Lukášková
Dětská klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: j.lukaskova@centrum.cz
Přijato k recenzi: 26. 10. 2007
Přijato do tisku: 14. 7. 2008
Sources
1. Rutherford MA, Azzopardi D, Whitelaw A, Cowan F, Renowden S, Edwards D et al. Mild hypothermia and the distribution of cerebral lesions in neonates with hypoxic-ischemic encephalopathy. Pediatrics 2005; 116(4): 1001–1006.
2. Shankaran S, Laptook AR, Ehrenkranz RA, Tyson JE, McDonald SA, Donovan EF et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med 2005; 353(15): 1574–1584.
3. Thoresen M, Whitelaw A. Therapeutic hypothermia for hypoxic-ischaemic encephalopathy in tle newborn infant. Cur Opin Neurol 2005; 18(2): 111–116.
4. Azzopardi D, Robertson NJ, Cowan FM, Rutheford MA, Rampling M, Edwards AD. Pilot study of treatment with whole body hypothermia for neonatal encephalopathy. Pediatrics 2000; 106(4): 684–694.
5. Al Naqeeb N, Edwards AD, Cowan FM, Azzopardi D. Assesment of neonatal encephalopathy by amplitude-integrated electroencephalography. Pediatrics 1999; 103(6 Pt 1): 1263–1271.
6. Hellström-Westas L, Rosén I, Svenningsen NW. Predictive value of early continuous amplitude integrated EEG recordings on outcome after severe birth asphyxia in full term infants. Arch Dis Child Fetal Neonatal Ed 1995; 72(1): F34–F38.
7. Toet MC, Hellström-Westas L, Groenendaal F, Eken P, de Vries LS. Amplitude integrated EEG 3 and 6 hours after birth in full term neonates with hypoxic-ischaemic encephalopathy. Arch Dis Child Fetal Neonatal Ed 1999; 81(1): F19–F23.
8. Klebermass K, Kuhle S, Kohlhauser-Vollmuth C, Pollak A, Weninger M. Evaluation of the Cerebral Function Monitor as a tool for neurophysiological surveillance in neonatal intensive care patients. Childs Nerv Syst 2001; 17(9): 544–550.
9. Lukášková J. Kontinuální monitorování elektrické mozkové aktivity u novorozenců. Čes-slov Ped 2007; 62(2): 91–97.
10. Hellström-Westas L, Rosén I, de Vries LS, Greisen G. Amplitude-integrated EEG: classification and interpretation in preterm and term infants. NeoReview 2006; 7(2): 76–87.
11. Sarnat HB, Sarnat MS. Neonatal encephalopathy folowing fetal distress. A clinical and electroencephalographic study. Arch Neurol 1976; 33(10): 696–705.
12. Gluckman PD, Wyatt JS, Azzopardi D, Ballard R, Edwards AD, Ferriero DM et al. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomised trial. Lancet 2005; 365(9460): 663–670.
13. Shalak LF, Laptook AR, Velaphi SC, Perlman JM. Amplitude-integrated electroencephalography coupled with an early neurologic examination enhances prediction of term infants at risk for persistent encephalopathy. Pediatrics 2003; 111(2): 351–357.
14. Battin MR, Penrice J, Gunn TR, Gunn AJ. Treatment of term infants with head cooling and mild systemic hypothermia (35,0 degrees C and 34,5 degrees C) after perinatal asphyxia. Pediatrics 2003; 111(2): 244–251.
15. Rennie JM, Chorley G, Boylan G, Pressler R, Nguyen Y, Hooper R. Non-expert use of the cerebral function monitor for neonatal seizure detection. Arch Dis Child Fetal Neonatal Ed 2004; 89(1): F37–F40.
16. de Vries LS, Hellström-Westas L. Role of cerebral function monitoring in the newborn. Arch Dis Child Fetal Neonatal Ed 2005; 90: F201–F207.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2008 Issue 5
Most read in this issue
- Intradurální výhřez bederní meziobratlové ploténky manifestující se syndromem kaudy – kazuistika
- Neurologické poruchy v rámci kritického stavu
- Současná diagnostika a léčba oligodendrogliomů
- Neurosarkoidóza: zriedkavý prípad sarkoidózy krčnej miechy – kazuistika
