LGI1 encefalitida v dětském věku
Autoři:
E. Štěpánová 1,2,3; H. Medřická 1,2; I. Doležalová 4; P. Hanzlíková 5,6,7
Působiště autorů:
Oddělení dětské neurologie, FN Ostrava
1; Katedra neurověd, OU Ostrava
2; LF UP a FN Olomouc
3; I. neurologická klinika LF MU a FN u sv. Anny v Brně
4; Ústav radiodiagnostický, FN Ostrava
5; Ústav zobrazovacích metod, OU Ostrava
6; Radiologická klinika LF UP a FN Olomouc
7
Vyšlo v časopise:
Cesk Slov Neurol N 2023; 86(3): 208-210
Kategorie:
Dopis redakci
doi:
https://doi.org/10.48095/cccsnn2023208
Vážená redakce,
v kazuistice prezentujeme případ dětské pacientky, u které se rozvinula autoimunitní encefalitida s pozitivitou protilátek anti-LGI1 (leucine-rich glioma-inactivated 1). Jednalo se o doposud zdravou 4letou dívku přijatou na dětskou jednotku intenzivní péče pro kumulaci faciobrachiálních dystonických záchvatů (faciobrachial dystonic seizures; FBDS) s levostrannou převahou. Rozvoji obtíží předcházely známky febrilního virového onemocnění. CT mozku, lumbální punkce (LP) i neurologický nález vykazovaly negativní nález. Meningeální syndrom ani projevy nitrolební hypertenze nebyly vyjádřeny. Pacientka byla zaléčena levetiracetamem s příznivým efektem. Po 2 dnech došlo k recidivě levostranných FBDS. Byly podány midazolam a valproát do maximální terapeutické dávky, FBDS se nadále opakovaly 1× za 1–2 h. Po přidání topiramátu, záchvaty odezněly. Rozvinuly se psychoorganický syndrom s převahou excitační složky, deteriorace kognitivních funkcí, zejména paměťových, heteroagrese, automutilace, hyperfagie, užívání vulgarismů, byl narušen spánkový biorytmus. EEG vykazovala encefalopatický záznam. MR mozku byla negativní. Psychologické vyšetření potvrdilo kognitivní deterioraci přibližně o 1,5 roku oproti kalendářnímu věku. Základní onkologický screening vyloučil paraneoplastický proces. Opětovné vyšetření likvoru prokázalo pozitivitu protilátek anti-LGI1.
Na trojkombinaci protizáchvatové medikace došlo k vymizení záchvatů, kognitivní deteriorace však přetrvávala. Byly indikovány kortikoidy – methylprednisolon (Solu-Medrol) v dávce 30 mg/ kg/ den po dobu 5 dnů. Léčba byla bez efektu. Zahájili jsme podání imunoglobulinů v dávce 0,4 mg/ kg/ den v pěti pulsech s rychlou úpravou stavu.
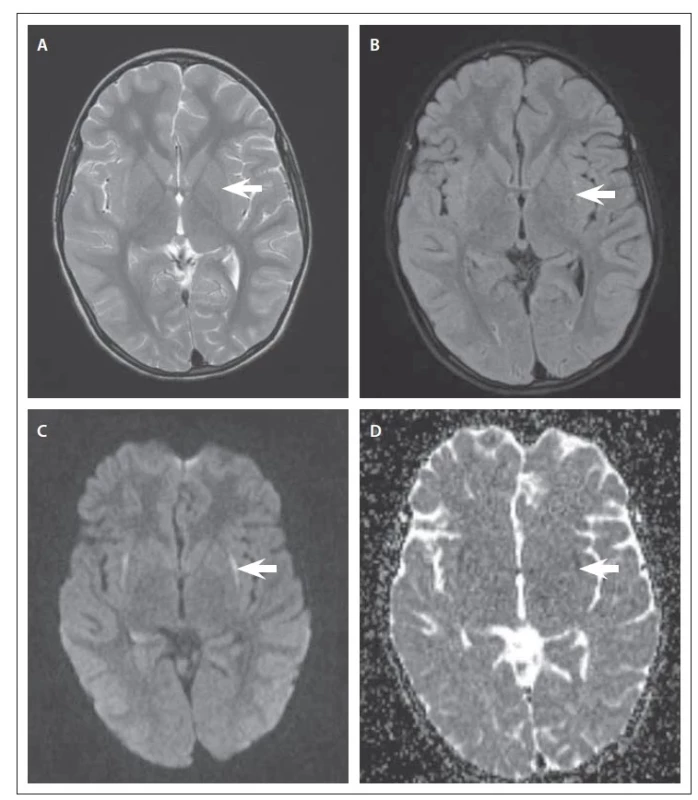
Zpětné druhé čtení MR mozku popsalo změny v oblasti zevních kapsul a klauster s T2 hypersignálním prosáknutím a restrikcí difuze (obr. 1).
DWI – difuzí vážený obraz; FLAIR – fluid attenuated
inversion recovery
Fig. 1. Brain MRI. (A) T2-weighted scan; (B)
FLAIR; (C) DWI with b 1000; (D) apparent diffusion coefficient map. In T2-weighted
image, there is evident oedema in the claustrum,
possibly also in the external capsules;
on DWI, there is a correlation of restriction
in diffusion (arrow), which confirms the
higher cellularity of the tissue.
DWI – diffusion-weighted image; FLAIR – fluid
attenuated inversion recovery
Autoimunitní limbická encefalitida je zánětlivé onemocnění postihující převážně korové oblasti CNS s akutním rozvojem, který je charakterizován změnou osobnosti (porucha chování, ztráta krátkodobé paměti, agresivní chování, halucinace, úzkost, deprese), poruchou spánku, výskytem refrakterních fokálních či generalizovaných epileptických záchvatů. Autoimunitní limbické encefalitidy dělíme do dvou skupin:
1. Paraneoplastické limbické encefalitidy asociované s nádorovým onemocněním, kdy dochází k reakci na epitop umístěný v nádorové tkáni, tvorbě autoprotilátek. Ty zkříženě reagují s podobnými epitopy CNS.
2. Neparaneoplastické autoimunitní limbické encefalitidy s etiopatogenezí odlišnou. Jedná se o protilátky cílené na povrch nervové tkáně – proti receptorům či komplexům iontových kanálů. Vyskytují se u 0,07–0,085 na 100 000 pacientů mladších 18 let, z 80 % procent převažují dívky.
Diagnostická rozvaha byla v našem případě tato: deteriorace celkového stavu, kognitivní deficit, agresivita.
Pro encefalitidu s protilátkami anti-LGI1 je příznačný rozvoj FBDS špatně reagující na běžnou medikaci. Definitivní stanovení diagnózy je vázáno na průkaz autoprotilátek.
Z diagnostických metod využíváme MR mozku, PET s fluorodeoxyglukózou (FDG-PET), vyšetření mozkomíšního moku a vyšetření EEG.
Kruciální roli v zobrazení hraje MR mozku, která prokazuje změny signálu v T2 vážených obrazech až v 70 % – v sekvencích FLAIR (fluid attenuated inversion recovery). Protokol MR při podezření na LGI1 encefalitidu zahrnuje axiální T2 váženou sekvenci, axiální a koronární FLAIR (optimálně 3D FLAIR), difuzí vážený obraz (diffusion weighted imaging; DWI) vč. aparentního difuzního koeficientu (apparent diffusion coefficient; ADC), 3D T1 váženou sekvenci nativně, vč. postkontrastních skenů. Postkontrastní 3D FLAIR vykazuje největší specificitu k postižení leptomening a juxtakortikálních oblastí.
Při negativní MR můžeme detekovat změny na FDG-PET mozku. Pro diagnostiku okultního tumoru má význam celotělová FDG-PET [1].
V mozkomíšním moku nacházíme zánětlivý obraz – mírnou lymfomonocytární pleocytózu, intratekální produkci protilátek (pozitivní IgG index a přítomnost oligoklonálních IgG pásů). Normální nález v likvoru diagnózu nevylučuje (až u 60 % pacientů anti-LGI1).
EEG vykazuje difuzní nespecifické zpomalení základní aktivity, popřípadě epileptiformní výboje.
Onkologický screening zahrnuje CT hrudníku, břicha a malé pánve, celotělovou PET/ CT. Kauzálním průkazem onemocnění je pozitivita protilátek anti-LGI1 v likvoru.
Diferenciální diagnostika klinických projevů zahrnuje řadu onemocnění. Nejčastěji se jedná o infekční onemocnění (klíšťová, herpetická encefalitida), akutní diseminovanou encefalomyelitidu (ADEM), Rasmussenovu encefalitidu, neurodegenerativní onemocnění, intoxikaci, polékové encefalopatie. Paraneoplastické encefalitidy bývají spojeny s přítomností autoprotilátek anti-Hu, anti-Yo nebo anti-Ri, neparaneoplastické např. s protilátkami proti glutamátovým a-amino-3-hydroxy-5-metyl-4-isoxazol propionát (AMPA) receptorům, receptorům typu B pro kyselinu g-aminomáselnou (GABABR), glycinovým receptorům nebo glutamátovým N-metyl-D-aspartátovým receptorům (NMDAR) [2,3].
Neparaneoplastické protilátky jsou namířeny proti extracelulárním antigenům, je možné očekávat příznivý efekt imunomodulační terapie. Pro úspěšnost léčby je nutné včasné zahájení terapie. Negativita protilátek onemocnění autoimunitní encefalitidou v žádném případě nevylučuje. Pozitivita protilátek může přetrvávat i po zlepšení stavu, neslouží k monitoraci efektu léčby ani k detekci recidivy.
Doporučené postupy léčby (zejména u dětských pacientů) nejsou k dispozici. Terapie může být rozdělena do tří linií (tab. 1). Léky I. linie (metylprednisolon, intravenózní imunoglobuliny [IVIG] a plazmaferéza) vedou k vymizení klinických projevů u 60–80 % pacientů.
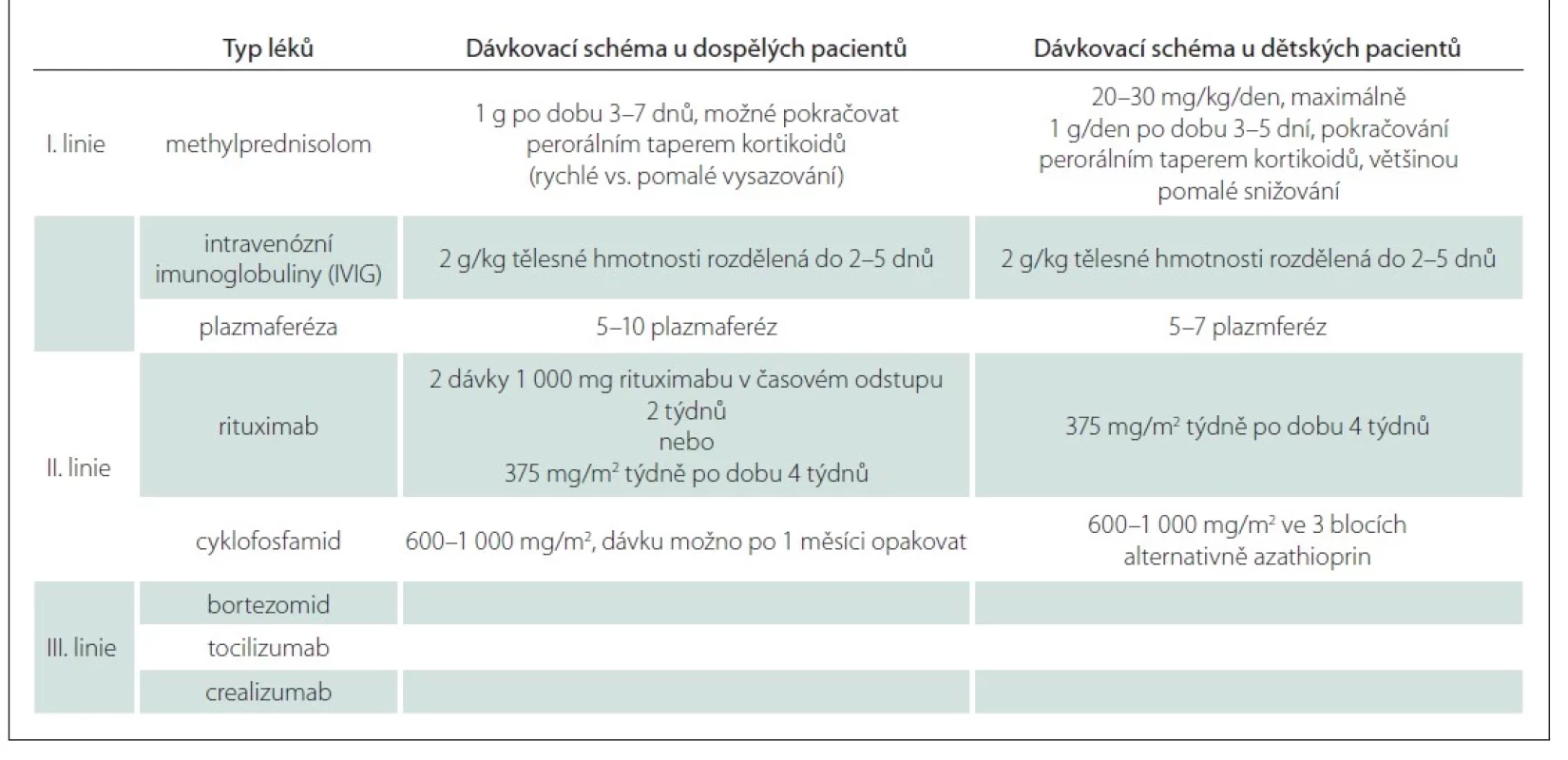
Na našem pracovišti se osvědčil efekt IVIG, z antikonvulziv topiramat. Předpokládaným mechanizmem účinku je blokace Na-kanálu, potencuje aktivitu GABA, antagonizuje excitační glutamátový receptor [3–5].
Léky I. linie představují intravenózní vysokodávkované kortikoidy, v případě jejich selhání jsou indikovány IVIG či plazmaferéza. U agresivních forem je indikována okamžitá kombinovaná terapie (kombinace intravenózních kortikoidů a IVIG nebo kombinace intravenózních kortikoidů a plasmaferézy).
Léky II. linie následují po selhání léků I. linie.
Léky III. linie jsou reprezentovány experimentálními postupy, např. bortezomibem (inhibitor proteazomu), tocilizumabem (inhibitor interleukinu 6) nebo ocrealizumabem (anti-CD20 monoklonální protilátka) [6].
Z dosavadních zkušeností se klinický průběh neliší v dětském a dospělém věku. U dospělých pacientů dominují akutní psychóza, kognitivní porucha, epileptické záchvaty či status epilepticus, progredující porucha vědomí až kóma. U limbických encefalitid poruchy paměti, epileptické záchvaty a psychiatrické příznaky.
V dětském věku se setkáváme s frekventovanějšími epileptickými záchvaty oproti psychiatrickým příznakům.
Autoimunitní encefalitidy jsou předmětem pokračujícího výzkumu zejména při objevech dalších neuronálních autoprotilátek. Až 60 % autoimunitních encefalitid zůstává s negativním likvorologickým nálezem. Podezření přetrvává u pacientů s pozitivním nálezem na strukturálních zobrazovacích metodách, s typickou klinickou symptomatologií a příznivým efektem zavedené doporučené terapie. Bez průkazu protilátek v likvoru tyto tvoří skupinu tzv. pravděpodobných autoimunitních encefalitid.
Brzká suspekce na diagnózu LGI1 encefalitidy a včasné zahájení zejména imunoterapie příznivě ovlivňuje prognózu a výskyt případného relapsu. Rozvoj hipokampální sklerózy snižuje následná udržovací kortikoterapie.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem nemají žádný konflikt zájmů.
MUDr. Eva Štěpánová
Oddělení dětské neurologie
FN Ostrava
17. listopadu 1790/5
708 52 Ostrava 8
e-mail: eva.stepanova@fno.cz
Přijato k recenzi: 13. 12. 2022
Přijato do tisku: 23. 5. 2023
Zdroje
1. Mayasi Y, Deepak T, Garg N. Leucine-rich glioma-inactivated protein 1 antibody encephalitis. Neurol Neuroimmunol Neuroinflamm 2014; 1(4): 51–54. doi: 10.1212/ NXI.0000000000000051.
2. Krýsl D, Elišák M. Autoimunitní encefalitidy. Cesk Slov Neurol N 2015; 78/ 111(1): 7–23. doi: 10.14735/ am csnn20151.
3. Doležalová I, Kuba R, Brázdil M et al. Neparaneoplastická limbická encefalitida s pozitivitou anti LGI 1 protilátek. Neurol Praxi 2012; 13(4): 221–224.
4. Krýsl D, Marusič P. Autoimunitní limbické encefalitidy. Neurol Praxi 2012; 13(3): 160–164.
5. Zborníková P, Krasulová E, Bušek P et al. Autoimunitní limbická encefalitida asociovaná s LGI1 protilátkami. Neurol Praxi 2012; 13(6): 343–346.
6. Abboud H, Probasco JC, Irani S et al. Autoimmun encephalitis: proposed best practice recommendations for diagnosis and acute management. J Neurol Neurosurg Psychiatry 2021; 92(7): 757–768. doi: 10.1136/ jnnp-2020-325300.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2023 Číslo 3
Nejčtenější v tomto čísle
- Overenie psychometrických vlastností slovenskej verzie Mattisovej škály demencie u zdravej populácie a pacientov s Parkinsonovou chorobou – pilotná štúdia
- Analýza souboru pacientů s poraněním hlavy a obličeje při úrazech na koloběžkách v letech 2010–2022 ošetřených v Ústřední vojenské nemocnici v Praze
- Totální locked-in syndrom u nemocného s těžkou formou akutní polyradikuloneuritidy
- Benefity a úskalia karotických stentov s dvojvrstvovým dizajnom – systematické review
