Mapování mozkové aktivity pomocí funkční magnetické rezonance během plnění močového měchýře
Evaluation of Cortical Activity Associated with Filling of Urinary Bladder Using Functional Magnetic Resonance Imaging
Aim:
The aim of the study was to assess: 1. the feasibility of a novel method combining functional magnetic resonance imaging (fMRI) evaluation of the central nervous system (CNS) with synchronously performed filling cystometry, 2. fMRI evaluation of brain cortical activity associated with filling of the urinary bladder.
Methods:
A urodynamic system was adapted to enable synchronous filling cystometry with fMRI. Fourteen female volunteers with no urological disorder (20–68 yrs) were enrolled. Standard filling cystometry protocol was extended to strengthen the afferent sensory signal: the sensory activation was elicited by cyclic phases of filling and emptying. Synchronously with extended cystometry, cortical activity was evaluated using fMRI. To yield representative data, we repeated each examination after 4–6 weeks having 28 data sets for analysis at the end. All examinations were performed on 3T scanner (Siemens Trio) using gradient-echo EPI sequence with the following parameters: TE = 30 ms, TR = 2 s, voxel = 3 × 3 × 3 mm.
Results:
Adjustments of the urodynamic system enabled successful implementation of synchronous filling cystometry with fMRI evaluation of cortical activity. All urodynamic records presented normal findings. Twenty four data sets were evaluated by an independent component analysis. The fMRI data were interpreted considering the synchronous cystometry record. The following cortical activity was detected: middle and inferior frontal gyrus, angular gyrus, posterior and anterior cingulate gyrus and subcortical grey nuclei.
Conclusion:
fMRI evaluation of cortical activity associated with evaluation of the lower urinary tract function is an experimental method with a number of technical difficulties. Synchronous urodynamic examination is a feasible method that facilitates precise interpretation of fMRI data acquired. The presented study demonstrates the activity of the central nervous system structures associated with filling of the urinary bladder.
Key words:
functional magnetic resonance imaging – urodynamics – lower urinary tract
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
P. Holý 1; J. Krhut 2; Jaroslav Tintěra 3; P. Zvara 4; R. Zachoval 1,5
Působiště autorů:
Urologické oddělení, Thomayerova nemocnice, Praha
1; Urologické oddělení, FN Ostrava
2; IKEM Praha
3; Division of Urology, University of Vermont, Burlington, USA
4; 1. LF UK v Praze
5
Vyšlo v časopise:
Cesk Slov Neurol N 2013; 76/109(1): 45-51
Kategorie:
Původní práce
Souhrn
Cíle:
Výzkumu neurální kontroly funkce dolních močových cest (DMC) je v posledních třech desetiletích věnována velká pozornost. Funkční magnetická rezonance (fMR) umožňuje identifikaci mozkových struktur podílejících se na neurální kontrole DMC. Cílem práce je mapping aktivace mozkových struktur během plnění močového měchýře pomocí fMR a ověření nové metodiky využívající synchronní provedení fMR mozku a urodynamické vyšetření.
Soubor a metodika:
Do studie bylo zařazeno 14 ženských dobrovolnic (20–68 let). Byla provedena průtokově-manometrická studie podle zásad správné urodynamické praxe, rozšířená za účelem posílení aferentní senzorické aktivace o cyklické fáze plnění/odsátí močového měchýře. Během plnění močového měchýře byla sledována pomocí fMR aktivace relevantních mozkových struktur. Při hodnocení fMR měření jsme využili časovou korelaci urodynamického záznamu, který dokumentoval sledovaný děj, tedy aktivitu a změnu náplně detruzoru.
Výsledky:
Vyšetření proběhlo u 14 dobrovolnic. Celkem bylo vykonáno 24 fMR měření. U všech pacientek byl proveden synchronní urodynamický záznam. Modelové porovnání aktivity CNS při náplni močového měchýře bylo analyzováno pomocí obecného lineárního modelu. Detekovali jsme aktivace v gyrus parietalis superior, frontálním laloku a gyrus postcentralis. Nemodelové změny v závislosti na opakovaném částečném plnění a vypouštění močového měchýře byly zpracovány pomocí analýzy nezávislých komponent (ICA). Urodynamický záznam byl rozhodující pro výběr reprezentativní komponenty. Aktivace byly detekovány v oblastech frontálního laloku, limbické oblasti, periakveduktální šedi, somatomotorického kortexu a inzuly.
Závěry:
Naše práce ověřila proveditelnost metodiky zpřesňující interpretaci fMR dat využitím synchronního urodynamického záznamu. Prokázali jsme aktivaci CNS související s plněním močového měchýře, a to v oblastech frontálního laloku, limbické oblasti, periakveduktální šedi, somatomotorického kortexu a inzuly.
Klíčová slova:
funkční magnetická rezonance – urodynamika – dolní močové cesty
Úvod
Výzkumu neurální kontroly funkce dolních močových cest (DMC) je zejména v posledních třech desetiletích věnována velká pozornost. Funkční zobrazovací metody, pozitronová emisní tomografie (PET) a fMR, umožňují identifikaci mozkových struktur podílejících se na neurální kontrole DMC [1,2].
PET je zobrazovací metoda, která generuje 2D nebo 3D obraz zachycením emise radioaktivně značené metabolicky aktivní látky podané do krevního oběhu a koncentrované v metabolicky aktivních oblastech mozku. Nevýhodou PET je invazivita, cena a praktická omezení vyplývající z nutnosti přípravy radioaktivní vody H215O v místě podání s ohledem na krátký poločas rozpadu radioizotopu.
Funkční magnetická rezonance (fMR) využívá naproti tomu diamagnetické vlastnosti oxyhemoglobinu a paramagnetické vlastnosti deoxyhemoglobinu (tzv. BOLD efekt), jehož množství se mění v závislosti na lokální změně perfuze v dané oblasti mozku vyvolané aktivací neuronů (díky neurovaskulární vazbě). To umožňuje zobrazení aktivních mozkových struktur asociovaných s právě prováděnou činností.
Nejčastěji používané prostorové rozlišení fMR je kolem 2–3 mm v každém směru voxelu. Určitou nevýhodou metody je relativně nízký poměr signál-šum, citlivost vůči různým fyziologickým artefaktům (pohybové artefakty, vliv dýchání a pulzace během srdečního cyklu), velké interindividuální rozdíly ve změně signálu BOLD efektem a také obtížná kvantifikace. Výhodou je především neinvazivita, snadná opakovatelnost a relativní cenová dostupnost.
Pomocí PET a fMR byly teprve nedávno identifikovány struktury asociované s centrální kontrolou funkce DMC u člověka. Jedná se zejména o periakveduktální šeď středního mozku (PAG), pontinní mikční centrum (PMC), lobus insularis (LI), gyrus cinguli anterior (ACG) a prefrontální kortex (PFC). Na základě těchto poznatků byl vytvořen hypotetický model cerebrálního řízení DMC [3].
V poslední dekádě se věnovalo několik prací experimentálnímu vyšetření CNS pomocí funkční magnetické rezonance zejména v plnící fázi mikčního cyklu. Práce využívající fMR mozku v kontextu dysfunkcí dolních močových cest jsou výjimečné [4].
Cílem práce je zmapovat aktivace mozkových struktur během plnění močového měchýře pomocí fMR a zejména ověřit přínos nové metodiky vyšetření za synchronního použití fMR a urodynamického vyšetření.
Materiál a metodika
Pacienti
Do hodnocení bylo zahrnuto 14 ženských dobrovolnic ve věku 20–68 let. Před zařazením do studie byly všechny pacientky podrobně poučeny o způsobu provedení studie a případných rizicích s ní spojených. Všechny pacientky vyjádřily souhlas s účastí podepsáním písemného informovaného souhlasu. Studijní protokol byl schválen příslušnou etickou komisí. U všech účastnic byla před zařazením do studie provedena uroflowmetrie s měřením postmikčního rezidua. Pacientky s patologickou uroflowmetrickou křivkou a/nebo významným postmikčním reziduem (více než 10 % mikčního objemu) nebyly do studie zařazeny. Dalšími vylučujícími kritérii pro zařazení do studie byly uroinfekce, neurogenní dysfunkce DMC, demence, urolitiáza, historie předchozího nádorového onemocnění v pánvi, předchozí ozařování pánve, klaustrofobie, metalické nebo elektronické implantáty a pozitivní těhotenský test.
Design studie
Vyšetření bylo u všech dobrovolnic provedeno v antibiotické profylaxi (ofloxacin 200 mg po 12 hodinách). Před začátkem vyšetření byl do močového měchýře zaveden dvoukanálový katétr Ch6 umožňující opakované plnění močového měchýře a měření intravezikálního tlaku. Do rektální ampuly byl zaveden katétr sloužící k měření intraabdominálního tlaku. Hlava subjektů byla fixována v hlavové snímací RF cívce tak, aby byly maximálně omezeny nežádoucí pohyby. Měřící katétry byly propojeny s urodynamickým přístrojem (MMS, Nizozemí) umístěným mimo vyšetřovací místnost tomografu MR. Po zahájení vyšetření byla provedena průtokově-manometrická studie podle zásad správné urodynamické praxe [5]. Bylo použito plnící rychlosti 50 ml/min, subjektivní parametry (první nucení na močení, normální nucení na močení, silné nucení na močení) indikovala pacientka pomocí signalizačního zařízení.
První fMR měření bylo prováděno po naplnění močového měchýře na 100 ml a během tohoto měření byly proběhly dva bloky cyklického rychlého plnění a odsátí močového měchýře podle Griffithsova schématu k posílení senzorické aktivace. [6]. Cyklus plnění/odsátí se uskutečnil v následujícím pořadí: pauza (12 s); plnění (25 ml ve 12 s); pauza (12 s); odsátí (15 ml ve 12 s). Dále pokračovalo, bez měření fMR, plnění močového měchýře do dosažení maximální cystometrické kapacity. Při tomto naplnění probíhalo opět měření fMR, kdy byly doplněny další dva až čtyři bloky cyklické fáze plnění/odsátí.
Celé měření bylo opakováno po čtyřech až šesti týdnech pro možnost posouzení inter- a intraindividuálních rozdílů.
Všechna vyšetření byla provedena na systému MR s magnetickým polem 3T (Siemens Trio Tim 3T) za použití gradient--echo EPI sekvence (FOV = 192 × 192 mm, voxel 3 × 3 × 3 mm, skl. úhel 70°, TR/TE = 2 000/30 ms, šířka pásma 2 790 Hz/pixel, PAT faktor 2). Celé vyšetření sestávalo z 210 dynamických skenů (dynamik), každý z nich pokrýval objem mozku 35 vrstvami.
Při hodnocení fMR měření jsme využili časovou korelaci urodynamického záznamu, který dokumentoval sledovaný děj, tedy aktivitu a změnu náplně detruzoru.
Statistické zpracování
Ke zpracování dat byl použit program SPM8. Naměřená data z obou měření (prázdný a naplněný močový měchýř) byla nejprve zřetězena [6] a dále korigována na pohyb hlavy (realignment), korigována na časový posun náběru vrstev (slice timing), vyhlazena prostorovým filtrem s Gaussovským jádrem 6 × 6 × 6 mm (smoothing) a normalizována do prostoru MNI-152. Statistické zpracování modelu porovnání stavu prázdný a plný močový měchýř bylo provedeno pomocí obecného lineárního modelu. Na individuální úrovni byl použit model s dvěma nezávislými časovými průběhy:
- stav prázdný a naplněný močový měchýř (skoková funkce) a
- cyklická změna (modulace).
U individuálních statistických map byl použit práh signifikance p = 0,05 s korekcí na mnohočetná pozorování FWE (Family Wise Error). Do skupinové statistiky byly nejprve vzaty pouze výsledné individuální mapy efektu prázdný-naplněný močový měchýř a poté i efektu cyklické změny. Skupinová statistika (t-test) pro oba efekty pak byla prahována na nekorigovaném p = 0,001.
S přihlédnutím na obtížně predikovatelný tvar hemodynamické odpovědi (HRF) během cyklických fází plnění a odsávání náplně močového měchýře, kdy nebylo snadné zvolit validní model pro univariantní statistiku pomocí obecného lineárního modelu, byla navíc pro zpracování dat na individuální úrovni použita analýza nezávislých komponent (ICA, Independent Component Analysis) v programu GIFT v. 1.3i (všechny parametry byly voleny v základním (default) nastavení, použitý algoritmus Infomax). ICA byla provedena nezávisle pro každou osobu a také pro skupinovou analýzu s identickým počtem 20 nezávislých vypočtených komponent. Jak na individuální, tak na skupinové úrovni byly vizuální komparací s výsledkem souběžně provedeného urodynamického záznamu vybrány jedna až dvě komponenty, které svým časovým průběhem nejlépe vystihovaly aktivitu detruzoru dokumentovanou urodynamickým záznamem. Vzhledem k ne zcela přesné synchronii MR skeneru s urodynamickým záznamovým zařízením (časové osy jsou pouze orientačně sjednoceny pomocí manuálních časových značek, které jen přibližně vystihují okamžiky plnění a vyprazdňování), byla použita jen vizuální komparace, nikoli přímá modifikace modelové HRF pomocí urologického záznamu. Výsledné aktivace skupinové statistiky ICA jsou ukázány v hodnotách Z skóre a jsou prahovány na úrovni Z = 1,0.
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v r. 2000.
Výsledky
Soubor subjektů
Vyšetření bylo provedeno u 14 dobrovolnic. Deset pacientek bylo vyšetřeno podle protokolu studie dvakrát s časovým odstupem čtyř až šesti týdnů, avšak u opakovaných vyšetření nebyly zatím nalezeny žádné rozdíly, a proto nebyla opakovaná měření zahrnuta do celkové statistiky. U čtyř pacientek jsme vyšetření provedli pouze jednou. Celkem jsme provedli 24 měření, z toho bylo do prezentovaných výsledků zahrnuto 14 měření (pouze 1. vyšetření u každé pacientky). K topografickému popisu aktivací byl použit standardní prostor MNI-152 [7].
Výsledky urodynamického vyšetření
U všech pacientek, které podstoupily fMR měření, byl vyhotoven urodynamický záznam. Průměrná cystometrická kapacita byla 201 ml (87–400 ml). Průměrný maximální detruzorový tlak na konci plnění byl 7,77 cm H2O (3–25 cm H2O) s průměrnou compliance 21,54 ml/cm H2O (8,1–44,1 ml/cm H2O). V sedmi případech byla zachycena netlumená fázická kontrakce detruzoru. Ani v jednom případě jsme nezaznamenali asociovanou aktivaci CNS. Nebyla zachycena terminální kontrakce s přechodem do mikční fáze.
Detekovaná aktivita CNS pomocí fMR
Pro modelové porovnání aktivity CNS při prázdném a plném močovém měchýři jsme analyzovali všech 14 získaných měření z 1. vyšetření pomocí obecného lineárního modelu. U čtyř měření nebyla možná interpretace získaných aktivací (buď nebyly žádné signifikantní detekovány, nebo byly zcela zřejmě arteficiální). Zbývajících 10 reprezentativních měření bylo zařazeno do skupinové statistiky. Detekované aktivace v parietálním laloku vlevo (gyrus parietalis superior), frontálním laloku (olfaktorický kortex, hraničí s předním cingulem) a centrální oblasti vlevo (gyrus postcentralis) shrnuje tab. 1
Tyto výsledky také dokumentují obr. 1 a 2. Aktivace zobrazené na obr. 1 jsou výsledkem vyhodnocení modelem 1, tedy hodnotícím rozdíl v prázdném a naplněném měchýři. Obr. 2 pak ukazuje výsledky druhého paralelního modelu, tedy změny při cyklickém plnění a vyprazdňování měchýře.
![Výsledné aktivace vyvolané rozdílem v náplni močového měchýře vypočtené pomocí obecného lineárního modelu – GLM (označený jako model 1).
Obr. 1a) Projekce maximální intenzity (zleva frontální, sagitální, transverzální) skupinové statistické mapy prahované na p = 0,001 bez korekce na mnohočetná pozorování (počet subjektů 10).
Obr. 1b–d) Multi-planární rekonstrukce (opět zleva frontální, sagitální, transverzální) v souřadnicích:
b) [–5, 20, –10] – orbitální povrch inferiorního frontálního laloku, olfaktorní kortex,
c) [–25, –60, 52] – laterální povrch parietálního laloku, gyrus parietalis superior vlevo,
d) [–5, –35, 60] – centrální oblast, post-centrální gyrus vlevo.
Všechny obrázky jsou v neurologické konvenci (tj. levá hemisféra je zobrazena vlevo).](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/5870a56e912a73b33c1d376b132f6435.jpg)
![Obr. 2. Výsledné aktivace vyvolané cyklickým plněním a vyprazdňováním močového měchýře 20 ml fyziologického roztoku, a to jak při minimální, tak při
maximální náplni vypočtené pomocí GLM (označený jako model 2).
Obr. 2a) Projekce maximální intenzity (zleva frontální, sagitální, transverzální) skupinové statistické mapy prahované na p = 0,001 bez korekce na mnohočetná pozorování (počet subjektů 10).
Obr. 2b, c) Multi-planární rekonstrukce (opět zleva frontální, sagitální, transverzální) v souřadnicích:
b) [7, –10, –10] – oblast mozkového kmene,
c) [10, –15, 0] – oblast thalamu a subkortikálních jader šedé hmoty.
Všechny obrázky jsou v neurologické konvenci (tj. levá hemisféra je zobrazena vlevo).](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/e0b433c8decf9ab1559e3b5f9d657c15.jpg)
Obecně obtížně modelovatelné změny mozkové aktivace v závislosti na opakovaném částečném plnění a vypouštění močového měchýře jsme též paralelně analyzovali pomocí analýzy nezávislých komponent (ICA). Na každém ze získaných 14 měření bylo provedeno vyhodnocení ICA. Vizuální komparací jsme identifikovali pro každé měření jednu reprezentativní komponentu, která nejlépe korelovala se souběžně získaným urodynamickým záznamem. Tento výběr nám posloužil k zařazení subjektů do skupinové analýzy. U čtyř subjektů, u nichž GLM neposkytl interpretovatelné výsledky, se nám ani nepodařilo komponentu asociovanou s cyklickou změnou objemu močového měchýře identifikovat. Vybraných 10 subjektů (stejných jako u GLM) bylo zahrnuto do skupinové analýzy pomocí ICA. Z tohoto vyhodnocení byly nakonec vybrány dva komponenty, které opět celkem úspěšně korelují s alespoň hrubě očekávanou aktivační odpovědí. Obr. 3 a 4 ukazují tyto dvě vybrané komponenty. Tyto aktivace CNS asociované se změnou objemu močového shrnuje tab. 2.
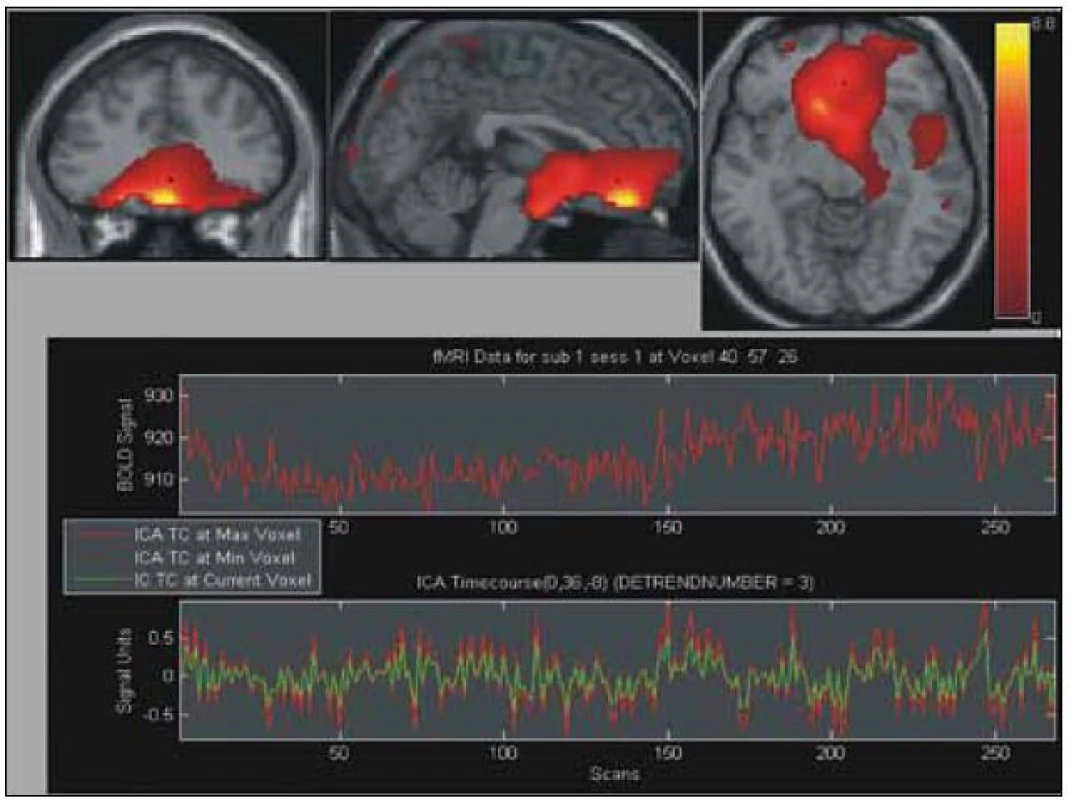
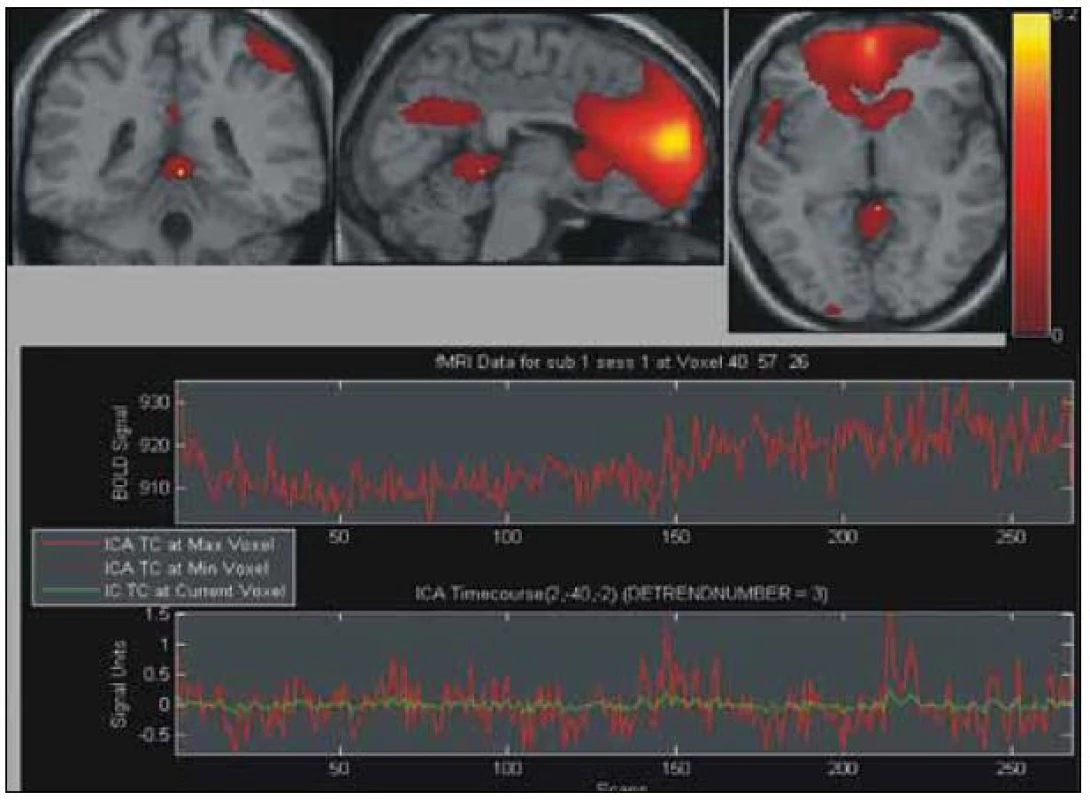
Diskuze
Námi použitá metodika přináší poprvé možnost porovnání fMR signálu se synchronním urodynamickým záznamem. Tato metodika vyšetření nebyla dosud popsána. Možnost porovnání fMR a urodynamického záznamu umožňuje především objektivizovat senzorický vjem pacienta související s plněním močového měchýře a zejména významně zpřesňuje analýzu relevantních fMR signálů z hlediska časové identifikace.
Neurální kontrola dolních močových cest je velmi dobře popsána na periferní úrovni. Během plnící fáze musí být detruzor relaxovaný, aby umožnil zvětšení objemu močového měchýře při zachování nízkého intravezikálního tlaku. To je zajištěno na periferní úrovni autonomním (sympatickým) reflexem, který je spuštěn při plnění močového měchýře. Aferentní inervace je vedena do míchy. Aktivací sympatického lumbálního regionu (L1–L3) dochází k potlačení excitačních parasympatických vstupů zvyšujících aktivitu detruzoru. Somatický, tzv. guarding reflex je odpovědný za udržení moči při náhlém zvýšení intraabdominálního tlaku např. při kašli, smíchu apod.
Aferentně je informace o náplni močového měchýře kontinuálně předávána do mezencefalické periakveduktální šedi (PAG) a odtud do pontinního mikčního centra (PMC) [8,9]. Z tohoto centra jsou eference vedeny k motoneuronu předních rohů sakrální míchy. Axony těchto neuronů jsou vedeny pudendálním nervem, který zajišťuje kontrakci rabdosfinkteru.
Naše znalosti mechanizmů kontroly funkce DCM na centrální úrovni jsou omezené. Předpokládáme, že kontrola mikčního cyklu je realizována střídavou inhibicí nebo aktivací pontinního mikčního centra ze strany vyšších mozkových center. Základem současného funkčního modelu jsou teoretické předpoklady a data ze zvířecích modelů.
fMR je metoda umožňující zobrazení aktivace mozkových struktur. Pro potřeby popisu neurální kontroly mikčního cyklu však neumožňuje rozlišit inhibiční/aktivační vliv na pontinní mikční centrum (PMC). Tuto funkci odvozujeme pouze z teoretických a zvířecích modelů [10,11]. Předpokládáme, že prefrontální kortex zajišťuje volní kontrolu mikčního cyklu. Rozhodnutí potlačit mikci nebo močit v sociálně vhodnou chvíli je umožněno inhibiční/disinhibiční eferentací směrem k PMC. V oblasti PAG se soustředí aferentace z močového měchýře, inzuly a frontálního kortexu. Kontrolní úloha je dána přímou inhibiční eferentací PMC. Gyrus cinguli anterior (ACG) hraje roli ve vedení a přepojování aferentací a eferentací z/do PAG a PMC. V inzule probíhá monitorování viscerálních signálů a zprostředkování těchto vjemů do frontálního kortexu. V somatomotorické oblasti předpokládáme ovládání svalů pánevního dna a zajištění mechanizmu kontinence.
Na základě našich zkušeností považujeme fMR za vhodnou metodu k popisu aktivity CNS související s funkcí dolních močových cest. Funkce DMC a její ovládání je dynamický děj a fMR na rozdíl od PET umožňuje získání dynamického zobrazení. Metodou PET máme možnost pouze statického porovnání dvou stavů, např. plný//prázdný močový měchýř. Technické omezení fMR je dáno zejména nízkým poměrem signál-šum a různými artefakty (pulzace mozku, susceptibilní artefakty atd.) v oblastech prodloužené míchy a baze lební. Senzorické viscerální aktivace CNS vyvolané náplní močového měchýře a souvisejícím pocitem náplně močového měchýře či urgence (pocit velmi silného nucení na močení) jsou relativně slabé v porovnání s aktivací motorickou. Sledované struktury navíc nejsou uloženy povrchově, ale v evolučně starších částech mozku. Tyto fyziologické aspekty tak dále zvyšují efektivní šum pozadí, ve kterém je pak obtížné detekovat subtilní změny neurální aktivity (prokrvení a oxygenace).
Při použití naší metodiky jsme získali reprodukovatelná data a popsali aktivitu CNS související s náplní močového měchýře ve výše popsaných oblastech.
Naše výsledky korespondují s prvotními pracemi Griffithse et al [12,13]. Dospěli jsme k rovněž koherentním výsledkům s dřívějšími pracemi využívajícími PET. V těchto publikacích byla popsána aktivace v oblasti inzuly, cinguly, PAG, mozečku a okcipitoparietální oblasti během senzorické stimulace použitím chladné vody při plnění močového měchýře [14–16].
Přínos použití synchronního urodynamického záznamu vidíme ve zpřesnění interpretace získaných fMR dat. Urodynamický záznam dokumentující změny v aktivitě detruzoru umožňuje díky porovnání časové souvislosti spolehlivější identifikaci ICA komponenty asociované s pozorovaným dějem. Výše citované publikace dokumentují aktivace CNS na úrovni individuální analýzy – kdy se tedy podařilo vzhledem k již zmíněným omezením interpretovatelný signál vůbec získat. Naše výsledky rozšířené o informace získané paralelním urodynamickým měřením považujeme s ohledem na možnost časové korelace s pozorovaným dějem za spolehlivější.
Urodynamický záznam navíc umožnil detekci netlumených kontrakcí detruzoru při plnící fázi. Díky tomu jsme mohli cíleně pátrat po případné asociované aktivaci CNS, kterou jsme nezaznamenali. Proto usuzujeme, že netlumené kontrakce detruzoru jsou děj probíhající na úrovni samotného detruzoru nebo autonomního reflexu bez regulačního vstupu CNS do tohoto děje.
Pochopení role jednotlivých struktur CNS v kontrole mikčního cyklu má svůj nejen teoretický, ale i praktický význam. Dysfunkce DCM (ztráta kontroly funkce močového měchýře) je běžný a velmi obtěžující stav s významnými zdravotními i sociálními dopady. U části pacientů s dysfunkcí DCM se předpokládá abnormální aktivita kontrolních center na úrovni CNS. Současná farmakologická léčba umožňující ovlivnění na periferní úrovni je u některých pacientů nedostatečně efektivní. Identifikace nových „treatment targets“ v CNS dává do budoucna naději na adekvátní léčbu i této početné skupině pacientů.
fMR je metoda, kterou lze (i přes technickou obtížnost a složitost paradigmatu aktivace a inhibice mikce) provádět mapování center CNS souvisejících s funkcí DMC. Dalším směrem v této oblasti je porovnání CNS aktivity pacientů s dysfunkcí DMC se zdravou populací a posouzení vlivu farmakoterapie primárně určené k ovlivnění dynamiky DCM na činnost mozkových center.
Závěr
Naše práce ověřila proveditelnost experimentální metodiky zpřesňující interpretaci fMR dat využitím synchronního urodynamického záznamu, který umožňuje dokumentaci časové korelace se změnou objemu močového měchýře a samotnou aktivitou detruzoru.
Prokázali jsme aktivaci CNS související s plněním močového měchýře, a to v oblastech frontálního laloku, limbické oblasti, periakveduktální šedi, somatomotorického kortexu a inzuly. Tyto výsledky jsou koherentní se současným hypotetickým funkčním modelem neurální kontroly DMC.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
P. Holý1, J. Krhut2, J. Tintěra3, P. Zvara4, R. Zachoval1,5
1 Urologické oddělení, Thomayerova nemocnice, Praha
2 Urologické oddělení, FN Ostrava
3 IKEM Praha
4 Division of Urology, University of Vermont, Burlington, USA
5 1. LF UK v Praze
MUDr. Petr Holý
Urologické oddělení
Thomayerova nemocnice
Vídeňská 800
140 53 Praha 4
e-mail: petr.holy1@ftn.cz
Přijato k recenzi: 4. 8. 2011
Přijato do tisku: 15. 6. 2012
Zdroje
1. Blok BF, Sturms LM, Holstege G. Brain activation during micturition in women. Brain 1998; 121(Pt 11): 2033–2042.
2. Seseke S, Baudewig J, Kallenberg K, Ringert RH, Seseke F, Dechent P. Gender differences in voluntary micturition control: an fMRI study. Neuroimage 2008; 43(2): 183–191.
3. Fowler CJ, Griffiths DJ. A decade of functional brain imaging applied to bladder control. Neurourol Urodyn 2010; 29(1): 49–55.
4. Tadic SD, Griffiths D, Schaefer W, Cheng CI, Resnick NM. Brain activity measured by functional magnetic resonance imaging is related to patient reported severity of urgency urinary incontinence. J Urol 2010; 183(1): 221–228.
5. Schäfer W, Abrams, Liao L, Mattiasson A, Pesce F, Spangberg A et al. Good urodynamic practisces: uroflowmetry, filling cystometry and pressure-flow studies. Neurourol Urodyn 2002; 21(3): 261–274.
6. Griffiths D, Derbyshire S, Stenger A, Resnick N. Brain control of normal and overactive bladder. J Urol 2005; 174(5): 1862–1867.
7. Talairach J, Tournoux P. Co-planar stereotaxic atlas of the human brain. Stuttgart: Thieme 1988.
8. Holstege G. Micturition and the soul. J Comp Neurol 2005; 493(1): 15–20.
9. Kuipers R, Mouton LJ, Holstege G. Afferent projections to the pontine micturition center in the cat. J Comp Neurol 2006; 494(1): 36–53.
10. De Groat WC. Nervous control of the urinary bladder of the cat. Brain Res 1975; 87(2–3): 201–211.
11. Blok BF, Holstege G. Direct projections from the periaqueductal gray to the pontine micturition center (M-region): an anterograde and retrograde tracing study in the cat. Neurosci Lett 1994; 166(1): 93–96.
12. Griffiths D, Tadic DS, Schaefer W, Resnick NM. Cerebral control of the bladder in normal and urge-incontinent woman. Neuroimage 2007; 37(1): 1–7.
13. Griffiths D, Tadic SD. Bladder control, urgency and urge incontinence: evidence from functional brain imaging. Neurourol Urodyn 2008; 27(6): 466–474.
14. Blok BF, Sturms LM, Holstege G. Brain activation during micturition in women. Brain 1998; 121(Pt 11): 2033–2042.
15. Athwal BS, Berkley KJ, Hussain I, Brennan A, Craggs M, Sakakibara R et al. Brain responses to changes in bladder volume and urge to void in healthy men. Brain 2001; 124(Pt 2): 369–377.
16. Matsuura S, Kakizaki H, Mitsui T, Shiga T, Tamaki N, Koyanagi T. Human brain region response to distention or cold stimulation of the bladder: a positron emission tomography study. J Urol 2002; 168(5): 2035–2039.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2013 Číslo 1
Nejčtenější v tomto čísle
- Použití botulotoxinu v neurologii
- Pripomienky k neurogénnemu tetanickému syndrómu a simultánnym stavom zvýšenej neuromuskulárnej excitability
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Tetanus – staronová diagnóza? Kazuistika
