Variabilita genu pro angiotenzinogen a vnímavost k roztroušené skleróze
Variability of Angiotensinogen and Susceptibility to Multiple Sclerosis
Aim:
To investigate whether there is an association between (–6)A/G a M235T polymorphisms of angiotensinogen (ATG) and susceptibility to multiple sclerosis and/or the course of the disease.
Materials and methods:
A total of 195 patients (49 men and 146 women) with multiple sclerosis (MS) and 126 healthy controls were investigated for two angiotensinogen polymorphisms using PCR and restriction analysis. The data were analysed with the support Statistica software, version 8.0 (StratSoft, Inc., Tulsa, OK, USA) and using the Fisher’s, Chi-squared and Holm’s tests.
Results:
We observed no significant differences in genotype or allelic distribution between groups of patients and control subjects for tested ATG polymorphisms. Double homozygotes MMGG were less frequent in the group of MS patients (p = 0.029, Odds ratio = 0.57, CI 0.33–0.98). However, using the Holm’s test for multiple comparisons, the results lacked statistical significance (pcorr= 0.17). We did not find significant differences either in genotype distribution or in allele frequencies among MS patients with the different disease courses.
Conclusions:
Our study did not find an association between (–6)A/G a M235T polymorphisms of ATG and susceptibility to multiple sclerosis or the course of this disease.
Key words:
multiple sclerosis – renin-angiotensin system – angiotensinogen – polymorphism
Autoři:
M. Hladíková 1; P. Štourač1 ,2; A. Vašků 3; Y. Benešová 1
Působiště autorů:
Neurologická klinika LF MU a FN Brno
1; CEITEC MU, Brno
2; Ústav patologické fyziologie LF MU, Brno
3
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(1): 38-43
Kategorie:
Původní práce
Souhrn
Cíl:
Zjistit, zda existuje asociace mezi (–6)A/G a M235T polymorfizmy genu pro angiotenzinogen (ATG) a vnímavostí k roztroušené skleróze a/nebo formou tohoto onemocnění.
Soubor a metodika:
Celkem 195 nepříbuzných pacientů (49 mužů, 146 žen) s diagnózou roztroušené sklerózy a 126 zdravých kontrol bylo genotypizováno pro dva ATG polymorfizmy metodou polymerázové řetězové reakce s následnou restrikční analýzou. Konečné výsledky byly získány pomocí těchto statistických testů:xFisherův exaktní test, chí-kvadrát a Holmova testu mnohonásobného srovnání. Pro další statistické zpracování bylo využito programu Statistica, verze 8.0 (StratSoft, Inc., Tulsa, OK, USA).
Výsledky:
Neprokázali jsme statisticky signifikantní rozdíl v genotypové či alelické distribuci pro zkoumané polymorfizmy mezi skupinou nemocných a kontrolními osobami. Ve skupině pacientů se sice dvojnásobní homozygoti MMGG vyskytovali méně často (p = 0,029; OR = 0,57; CI 0,33–0,98), ale přepočtem pomocí Holmova testu výsledky pozbyly signifikance (pcorr = 0,17). Nenalezli jsme statisticky významné rozdíly v distribuci genotypů mezi pacienty s rozdílnými formami onemocnění.
Závěr:
Naše studie neprokázala, že by (–6)A/G a M235T ATG polymorfizmy měly vliv na vnímavost k roztroušené skleróze, ani že by asociovaly s různými formami tohoto onemocnění.
Klíčová slova:
roztroušená skleróza – renin-angiotenzinový systém – angiotenzinogen – polymorfizmus
Úvod
Roztroušená skleróza (RS) se řadí mezi autoimunitní onemocnění centrálního nervového systému (CNS), které postihuje především mladší věkové skupiny. Podkladem této choroby je chronický zánět, jenž vede nejen k poškození myelinových obalů nervových vláken, ale také k poškození vlastních axonů. Zánětlivý proces probíhá i v době klinické remise, což je dobře dokumentováno pomocí MR, kde je možné odhalit tvorbu nových demyelinizačních zánětlivých lézí [1,2].
Jedním ze systémů, jenž je v posledních několika málo letech spojován se zánětem, je i renin-angiotenzinový systém (RAS). Již dlouhou dobu stojí v popředí zájmu kardiologů, a to nejen ve spojitosti s regulací krevního tlaku a hospodaření se solemi, ale zkoumán je právě i jeho podíl v zánětlivém procesu na různých systémových úrovních v celém organizmu [3,4]. Základní představa byla odvozena od aterosklerózy, na kterou je v současné době již pohlíženo jako na chronický autoimunitní proces s imunitní odpovědí k antigenům, jako jsou angiotenzin I konvertující enzym (ACE), LDL či proteiny teplotního šoku [5]. Intralezionální Th1 polarizace CD4+ buněk s následnou aktivací tumor nekrotizujícího faktoru (TNF) a interferonu gama (INF gama) představuje styčné body s ostatními autoimunitními procesy, jako je např. revmatoidní artritida či právě RS [6]. Nedávná pozorování zabývající se tkáňovou expresí mRNA pro renin, angiotenzinogen (ATG) a angiotenzin I konvertující enzym naznačují, že všechny komponenty RAS existují lokálně a pracují samostatně na parakrinně/autokrinní a intrakrinní úrovni [7,8]. Spolu s jedním ze svých produktů – angiotenzinem II (AT II) – může ATG hrát roli v procesech, jakými jsou regulace propustnosti cévní a hematoencefalické bariéry, aktivace infiltrujících imunokompetentních buněk, nábor zánětlivých buněk do tkání, exprese prozánětlivých (monocytární chemotaktický protein 1, interleukin 6, tumor nekrotizující faktor alfa, adhezivní molekuly, inhibitor plazminogenového aktivátoru, prostaglandiny, osteopontin) a prooxidačních genů, zesílení fagocytární aktivity u makrofágů [3,4]. ATG a AT II jsou tak dnes jednoznačně definovány jako prozánětlivé mediátory. I další metabolicky aktivní produkty ATG, jako je AT III a AT IV, se podílejí na modulaci zánětlivého procesu a mohou vést k jeho posílení [7].
K aktivaci RAS na úrovni imunitního systému dochází cestou angiotenzinových receptorů typu 1 (AT1R) s následnou modulací antigen prezentujících buněk a prozánětlivých cytokinů. Děje se tak nezávisle na regulaci krevního tlaku a na rozdíl od kardiovaskulárního a vylučovacího systému zde klíčovou roli hraje především AT1bR (nikoli AT1aR), jehož výrazně zvýšená exprese (7krát) byla prokázána v zánětem zasažené míše u myších pacientů [9]. Proteomické analýzy zánětlivých plak u pacientů s RS shodně prokázaly změněnou expresi nejen AT1R, ale i dalších proteinů RAS (ATG, ACE), a potvrdily tak klíčovou úlohu RAS u autoimunitního procesu CNS [10]. Na zvířecích modelech pak léčba inhibitory reninu, ACE inhibitory a antagonisty AT1R vedla ke značnému zlepšení průběhu experimentální alergické encefalomyelitidy (EAE). Dělo se tak cestou potlačení autoreaktivních Th1 a Th17 buněk a prostřednictvím podpory Treg buněk, ale i cestou potlačení nukleárního faktoru kappa B (NF-kappa B) signální cesty s následnou redukcí prozánětlivých chemokinů (CCL2, CCL3, CXCL10), potlačením antigen prezentujících buněk a snížením migrace monocytů [9–11]. V práci z roku 2010 švédských autorů Ottervald et al, jež se zabývala identifikací nových likvorových biomarkerů u RS s využitím technologie imunoesejí, byly potvrzeny vyšší hladiny u sedmi z konečných deseti proteinů, které byly autory postupně selektovány z původních 1 499 proteinových spotů. Zkoumán byl nejen rozdíl hladin vybraných proteinů u pacientů s RS oproti kontrolním osobám, ale též mezi kontrolami a pacienty s rozdílnými RS formami. Nejvýraznější rozdíl (až 3krát vyšší hladina v likvoru) byl zjištěn u pacientů se sekundárně progresivní formou choroby oproti zdravým kontrolám právě pro angiotenzinogen [12]. Tato studie potvrdila výsledky dvou předešlých výzkumů, které již dříve prokázaly zvýšené hladiny ATG v likvoru u RS pacientů a pacientů s klinicky izolovaným syndromem [13,14].
ATG
ATG je 60kD α-2-globulin, který je produkován konstitutivně především v játrech. Je členem rodiny serpinů. Lokálně v CNS může být exprimován buňkami glie, neurony a makrofágy [8,15,16]. Gen pro ATG je lokalizován na dlouhém raménku prvního chromozomu (1q41–42). Studovali jsme dva funkční polymorfizmy. Prvním z nich byla mutace v promotorové oblasti genu (–6) A/G a druhým byl M235T polymorfizmus (exon 2), který vede k záměně jedné z aminokyselin. Jedná se o funkční polymorfizmy, kdy alely A i T byly ve studiích u pacientů s hypertenzí i u zdravých kontrol spojeny se zvýšenou expresí daného genu a vyšší konečnou plazmatickou hladinou ATG [17–19].
Cílem studie bylo zjistit, zda existuje asociace mezi zkoumanými ATG polymorfizmy a formou onemocnění a/nebo vnímavostí k roztroušené skleróze.
Soubor a metodika
Pacienti a kontrolní osoby
Jedná se o studii typu case-control, do které bylo zařazeno celkem 195 nepříbuzných pacientů s diagnózou roztroušené sklerózy, jež byla diagnostikována na základě revidovaných McDonaldových kritérií [20]. Šlo o pacienty z RS centra Neurologické kliniky FN Brno. Kohorta obsahovala 146 žen a 49 mužů s věkovým průměrem 37,6 ± 9,3 let SD. Poměr mužů a žen s diagnózou RS tak korespondoval s jejím přirozeným rozložením v populaci. V celém souboru bylo 156 pacientů s remitentně-relabující (RR) formou choroby, 27 s formou sekundárně progresivní (SP) a 12 s formou primárně progresivní (PP). MR nálezy všech pacientů korelovaly s diagnózou RS.
Kontrolní soubor tvořilo 126 osob párovaných dle věku a pohlaví (44 mužů a 82 žen) s negativní diagnózou autoimunitních chorob. Jednalo se osoby s věkovým průměrem 37,0 ± 11,4 let SD a byly vybrány převážně z řad pacientů chirurgických oborů, nejčastěji z Kliniky ústní a čelistní chirurgie. Kromě věkových požadavků byly při výběru zohledněny informace stran závažných chronických interních onemocnění, především chorob kardiovaskulárního a vylučovacího systému a již výše zmíněných autoimunitních procesů. Malou část kontrol tvořili přímo zaměstnanci FN Brno a pacienti s vertebrogenními obtížemi z Neurologické kliniky. Od všech vyšetřovaných osob byl získán písemný informovaný souhlas a studie byla schválena etickou komisí LF MU pod pořadovým číslem 48/2003.
Genotypizace
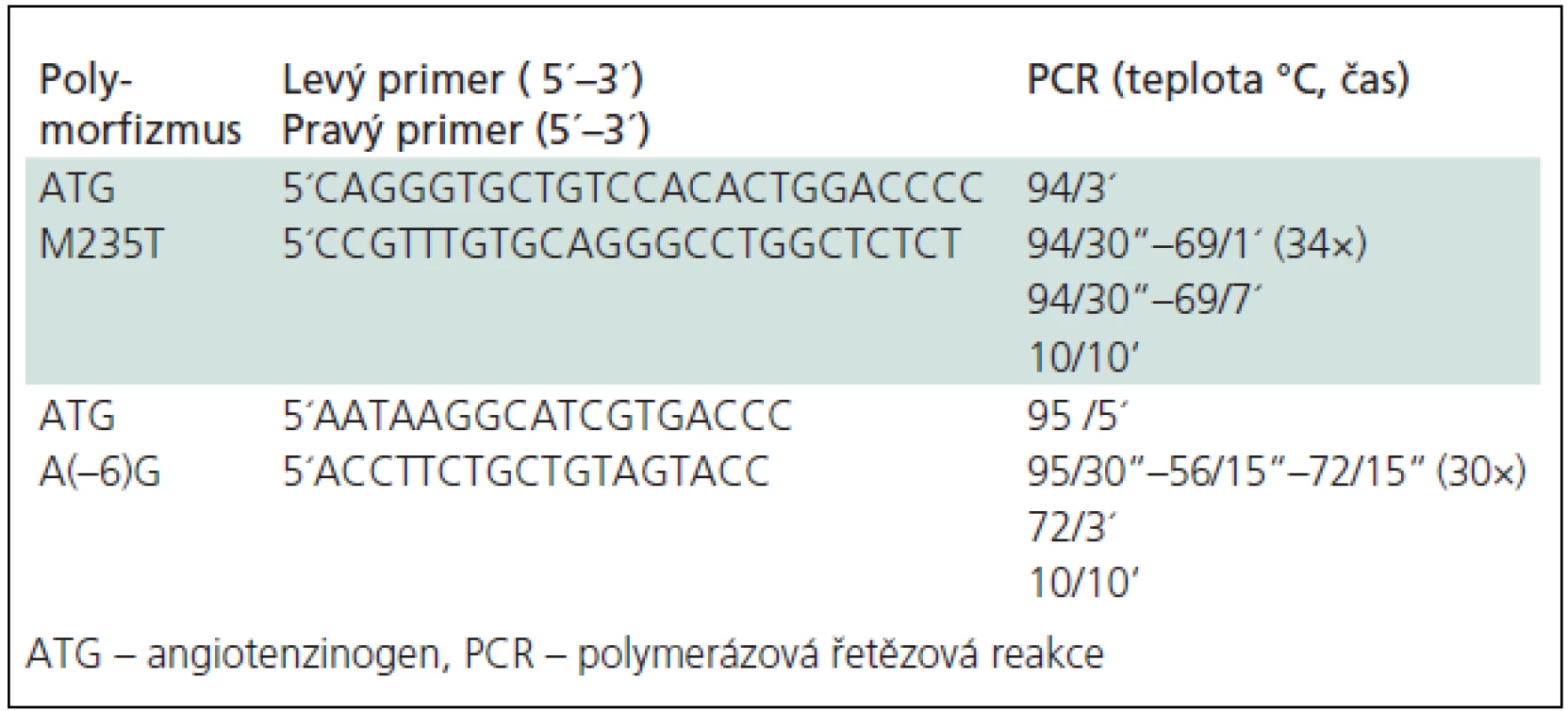
Genomová DNA byla izolována z leukocytů periferní krve standardní technikou pomocí proteinázy K dle Sambrooka et al [21]. Tato DNA byla použita jako templátová DNA pro polymerázovou řetězovou reakci (PCR). Dva známé polymorfizmy (–6)A/G a M235T genu pro ATG byly zkoumány podle Russe a Hegeleho et al [22,23]. Primery a podmínky amplifikace jsou podrobněji znázorněny v tab. 1.
PCR o objemu 15 µl pro ATG M235T obsahovala 1 µl genomické DNA, 0,5 µl dNTP, 0,5 µl každého primeru, 1,5 µl pufru, 0,1 µl Taq polymerázy a 1,3 µl 25 mm MgCl2, pro ATG (–6)A/G 3 µl genomické DNA, 0,3 µl dNTP, 0,75 µl každého primeru, 0,084 µl Taq polymerázy, 1,5 µl pufru a 1,2 µl 25mm MgCl2. Následnou restrikční analýzou, kdy bylo stejné množství 15 µl PCR produktů inkubováno s konkrétními endonukleázami (tab. 2), jsme získali konečné fragmenty. Výsledné genotypy byly detekovány v UV světle pomocí ELFO na 3,5% MetaPhore agarózovém gelu s ethidium bromidem.
Statistická analýza
Pro zjištění rozdílů v zastoupení jednotlivých genotypů mezi skupinou pacientů a kontrol i pro určení, zda jsou studované soubory v Hardy-Weinbergově (H-W) rovnováze, byly tyto testovány pomocí chí-kvadrát testu. Hodnota p < 0,05 byla považována za statisticky významnou. Srovnání frekvencí alelických variant i porovnání zastoupení jednotlivých dvojgenotypů bylo provedeno pomocí Fisherova exaktního testu. Pro stanovení konečných p hodnot byly tyto následně korigovány s užitím Holmova testu pro mnohonásobné srovnání, a byly tak získány konečné hodnoty pcorr. Pro statistické výpočty byl použit softwarový program Statistica, verze 8.0 (StratSoft, Inc., Tulsa, OK, USA).
Výsledky
Polymorfizmy a vnímavost k RS (studie case-control)
Genotypové a alelické frekvence ATG polymorfizmů jsou uvedeny v tab. 3.
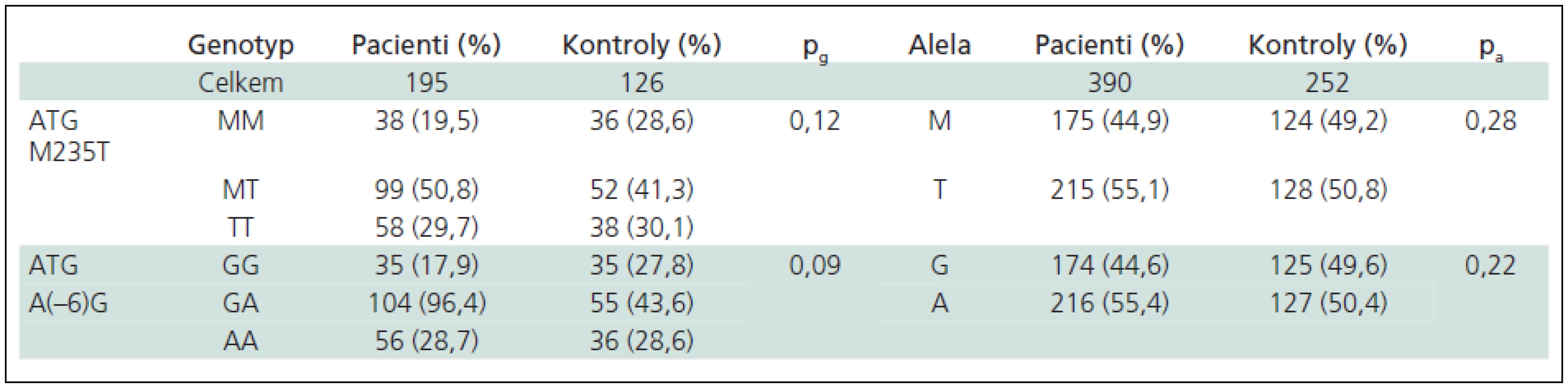
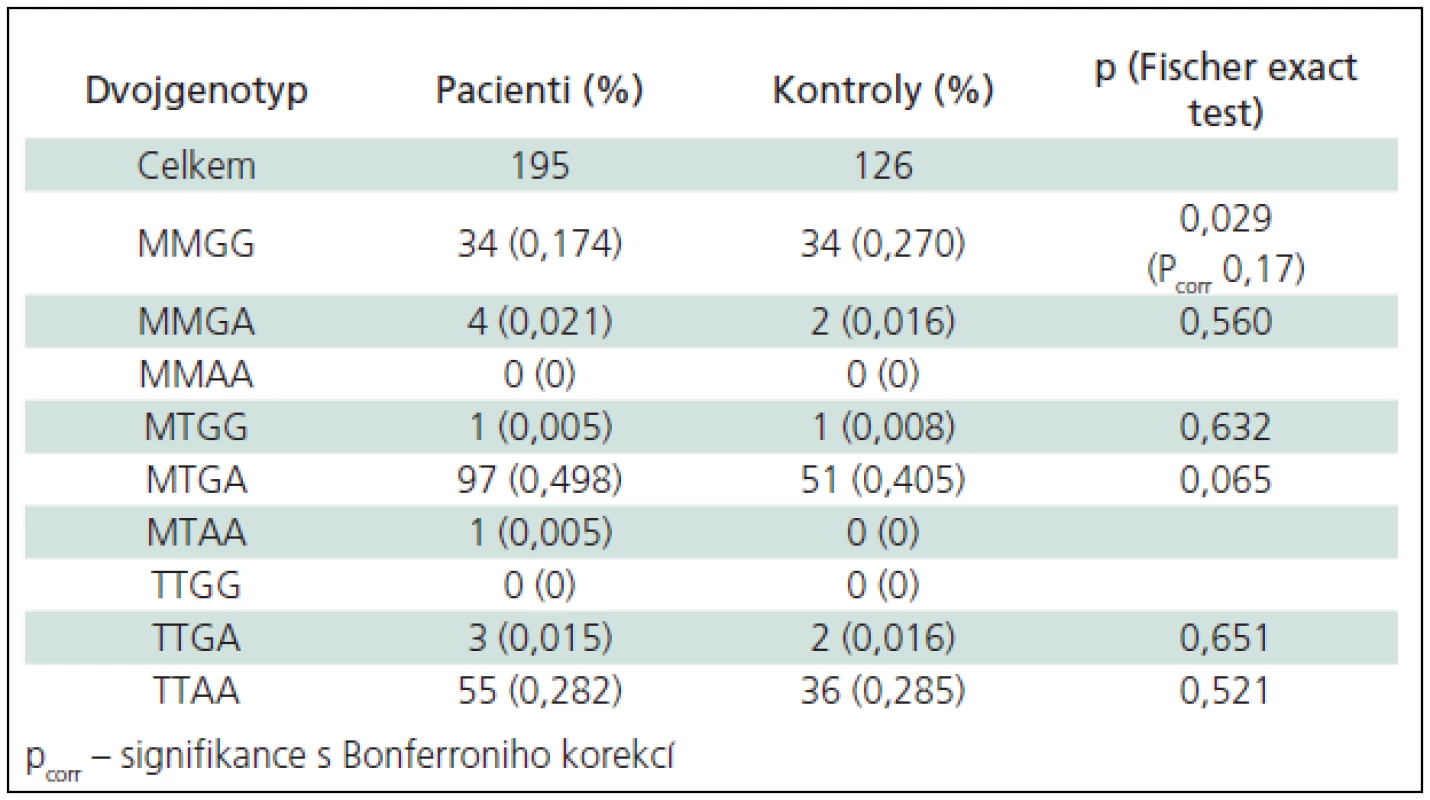
Studované soubory byly v H-W rovnováze. Pro dané polymorfizmy nebyly zjištěny žádné významné rozdíly v genotypové či alelické distribuci mezi skupinami pacientů s roztroušenou sklerózou a kontrolními osobami, pokud byly tyto osoby testovány jednotlivě. Při zpracování výsledků v podobě dvojgenotypů se ve skupině pacientů s RS dvojnásobní homozygoti MMGG vyskytovali méně často než v souboru kontrolních osob (p = 0,029; OR = 0,57; CI 0,33–0,98). Údaje znázorňuje tab. 4. Po přepočtu výsledků pomocí Holmova testu mnohonásobného srovnání ztratily výsledky statistickou signifikanci (pcorr = 0,20).
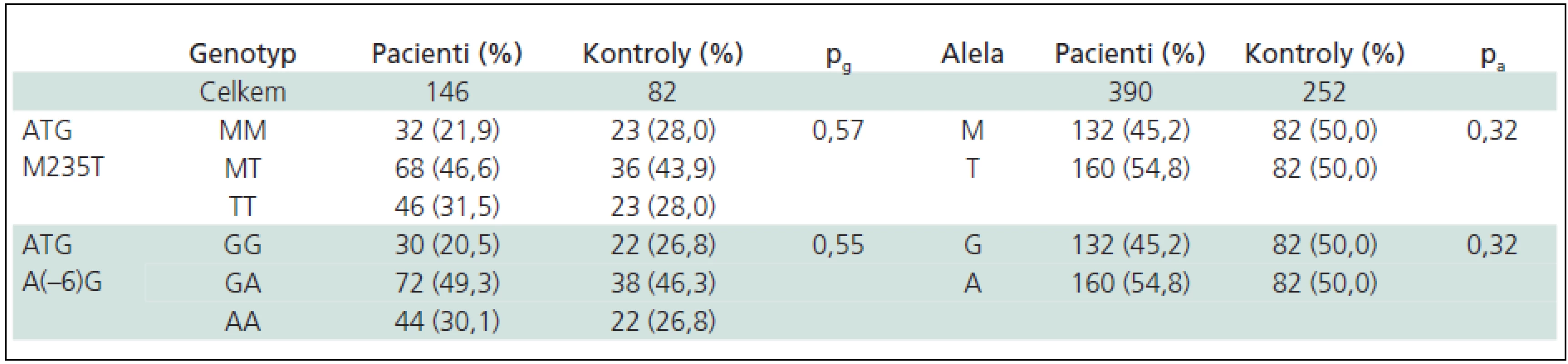
Při rozdělení souboru dle pohlaví byly nalezeny významné rozdíly v distribuci genotypů mezi muži, avšak skupina mužských pacientů s RS nesplňovala podmínky H-W rovnováhy (tab. 5 a 6). V obou skupinách (pacientů a kontrol) jsme nenalezli žádné TTGG a AAMM dvojnásobné homozygoty.
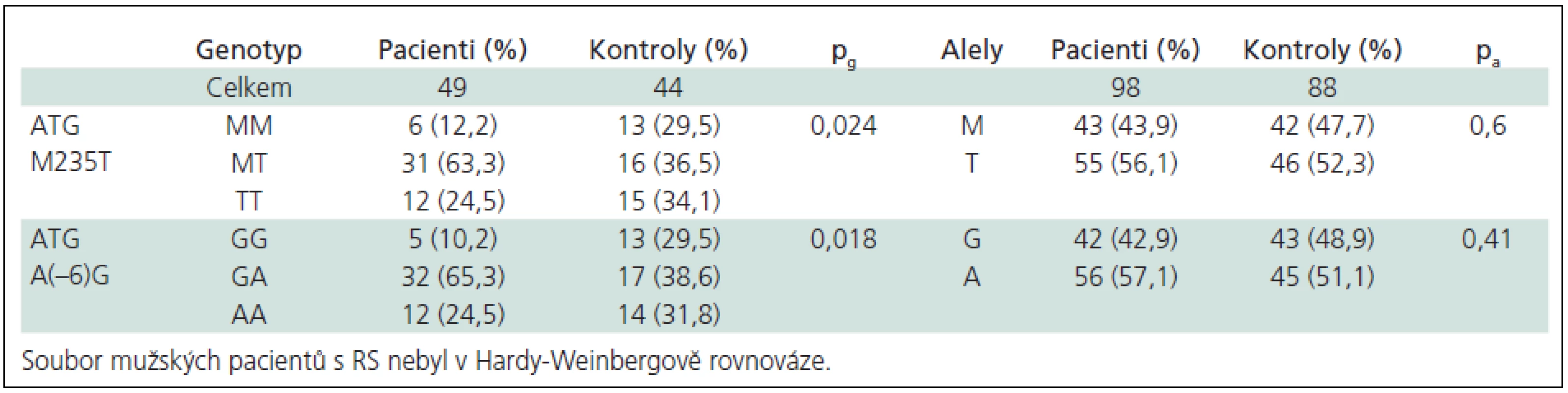
Polymorfizmy a forma RS (studie case-case)
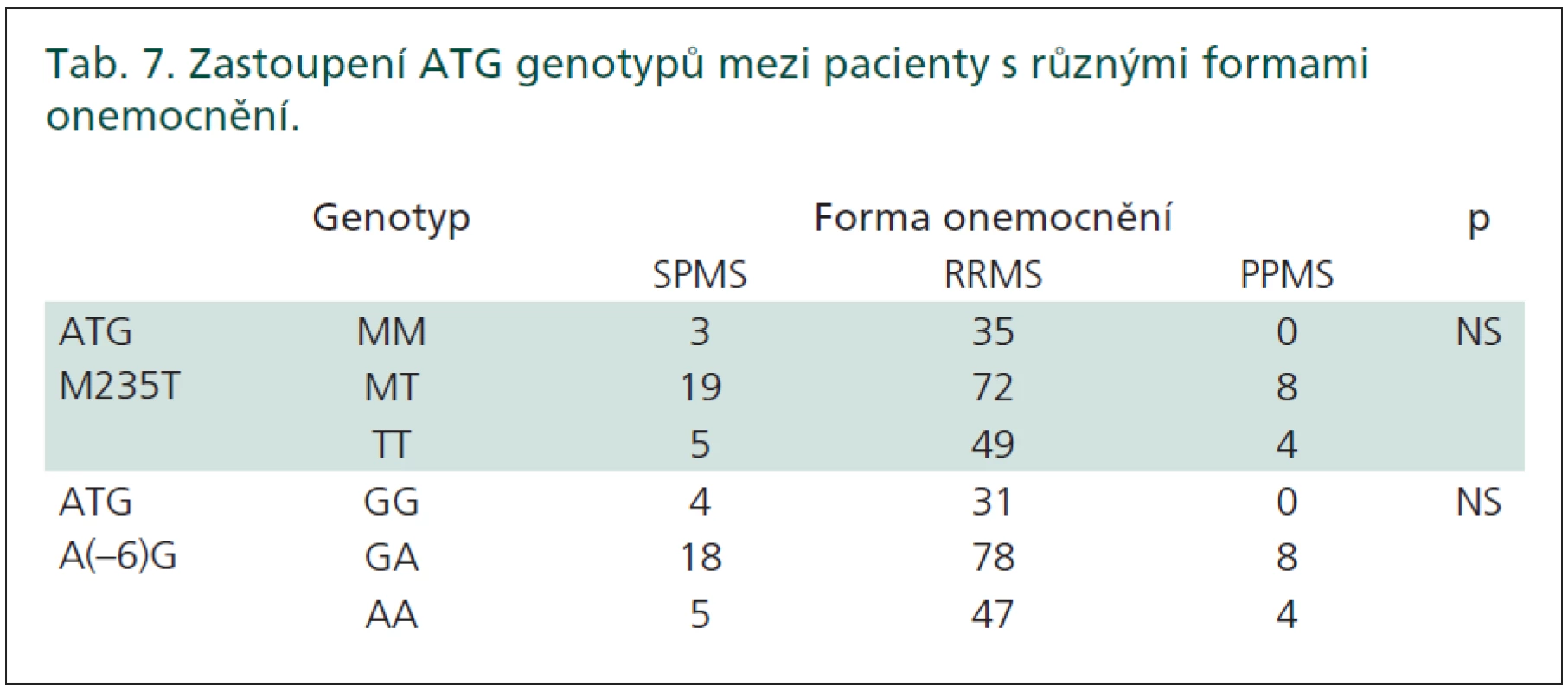
Zastoupení jednotlivých genotypů v souboru pacientů v závislosti na formě onemocnění je znázorněno v tab. 7. Nenalezli jsme statisticky významné rozdíly v distribuci genotypů mezi pacienty s rozdílnými formami onemocnění (RR, PP, SP).
Diskuze
Tkáňový renin-angiotenzinový systém tvoří rozsáhlou síť s pleotropickým efektem působícím na několika úrovních po celém organizmu. V některých orgánech pracuje tento lokální systém nezávisle na „klasickém cirkulujícím RAS“, např. u nadledvin a mozku [7]. V CNS angiotenzin II podporuje apoptózu a pravděpodobně i regeneraci po poranění. Nejen AT II, ale i AT III, IV a AT 1–7 jsou zapojeny do procesů, jakými jsou učení a paměť [7]. Klíčová role je dnes přičítána aktivaci celého RAS také u autoimunitních procesů, jakými je i roztroušená skleróza.
Dosavadní publikované poznatky k této problematice zahrnují několik typů studií, ať již na zvířecích modelech s EAE či přímo u pacientů s RS. První se zabývají průkazem aktivace a změněné exprese jednotlivých proteinů v buňkách imunitního systému, další zkoumají změněné hladiny těchto proteinů v mozkomíšním moku a poslední popisují expresi proteinů RAS přímo v mozkové tkáni postižené chronickým zánětlivým procesem (viz výše). Ve svém výsledku však tyto studie dávají pouze kusou představu o velmi složitém a vzájemně úzce kooperujícím působení jednotlivých proteinů RAS v průběhu chronického zánětlivého procesu CNS. Genetickým aspektem dané problematiky se před námi zabývala pouze jediná studie, kde byl pro ACE I/D polymorfizmus prokázán zvýšený výskyt alely D a genotypu DD u mužských pacientů s RS, jež je spojen s konečnými vyššími hladinami ACE [24]. Tato studie vznikla na základě poznatků o zvýšených sérových hladinách ACE u RS pacientů, kdy aktivita ACE korelovala s celkovým objemem plak na MR [25].
Naše skupina je první, jež zkoumala vztah mezi ATG polymorfizmy a RS. V obou našich skupinách (pacientů i kontrol) se nevyskytovali žádní dvojnásobní homozygoti GGTT a AAMM. To se shoduje s předchozími studiemi, kde byla nalezena vazebná nerovnováha mezi těmito dvěma polymorfizmy [17]. Směr vazby byl stejný – T je v kombinaci s A a alela M v kombinaci s G. Nepodařilo se nám však prokázat, že by zkoumané polymorfizmy asociovaly s vnímavostí k RS. V námi studovaném souboru se dvojnásobní homozygoti MMGG vyskytovali častěji v kontrolní skupině než u pacientů s RS. Z devíti možných kombinací představuje právě tato varianta tu, která je spojena s nejnižší konečnou plazmatickou hladinou ATG. Po přepočtu pravděpodobností Holmovým testem však nezůstala statistická signifikance pod 5% hladinou. Důvodem by mohly být nedostatečné počty pacientů v našich souborech. S použitím programu Statistica 8.0 jsme zjistili, že při zachování stávajícího rozložení genotypů a alel v daných souborech by mohly být statisticky signifikantní výsledky získány, pokud by byly oba soubory rozšířeny na minimálně 269 pacientů a stejný počet kontrol. Další možností, jak prokázat, zda existuje asociace mezi vnímavostí k RS a polymorfizmy proteinů RAS (nejen samotného ATG), je studium haplotypů (obdobně jako např. v práci Choi et al) [26]. Přínosné by mohlo být především spojení s polymorfizmem A1166C AT1R, který nebyl doposud v souvislosti s RS zkoumán.
V průběhu zánětu dochází působením interleukinu-1 a TNF alfa, jež jsou produkovány makrofágy, k aktivaci ATG transkripce. Tyto cytokiny ovlivňují vazbu dvou skupin transkripčních faktorů, které se vážou na jedno regulační místo ATG promotoru – proteiny vázající zesilovač transkripce CCAAT a především nukleární faktor kappa B [27]. Aktivace RAS, cestou přes produkci AT II jako hlavního efektoru tohoto systému, má za následek pozitivní zpětnou vazbu a následnou stimulaci ATG syntézy [28]. Nabízí se zde tedy ještě další otázka, zda ke změnám v rámci RAS nedochází pouze cestou sekundární aktivace RAS za již změněných podmínek chronického zánětu a zkoumané polymorfizmy zde nejsou asociovány s vnímavostí k dané chorobě, ale ovlivňují pouze míru postižení a průběh RS.
Druhým cílem naší studie tedy bylo prokázat, zda existuje vztah mezi ATG polymorfizmy a rozdílnými formami onemocnění. Přestože byly zjištěny rozdílné hladiny ATG v CSF u pacientů s rozdílnými formami onemocnění [12], ani tady naše studie nepotvrdila přímou souvislost s ATG polymorfizmy. Zde je však neúspěch podmíněn malými počty pacientů s PPRS a SPRS v námi studovaném souboru.
Pozitivním aspektem naší práce je stratifikace souboru (pohlaví, věk, RS formy), která velmi dobře koresponduje s rozložením onemocnění v populaci. Česká republika patří mezi země s vysokou prevalencí RS, ale zároveň také vysokou genetickou homogenitou. Právě náročnost na správnou stratifikaci souboru a správný výběr kandidátních genů je velkou nevýhodou asociačních studií s kandidátními geny s využitím SNPs (Single Nucleotide Polymorfizmů) [29]. Hlavní problémy však vyplývají z nutnosti zajištění dostatečně velkých souborů pro dosažení statisticky signifikantních výsledků, což se ukázalo i u naší studie. Přesto si však tyto relativně „malé“ studie vydobyly svoje stálé místo a mohou tvořit předstupeň pro větší, finančně i technicky náročnější výzkumy.
Závěr
Roztroušená skleróza představuje multifaktoriální onemocnění, vznikající na podkladě kombinace více genetických faktorů. Předpokládá se, že různé genetické pozadí může existovat pro různé formy onemocnění, může ovlivňovat rychlost progrese a odpovídá za odlišné schopnosti pacientů reagovat na určitou specifickou léčbu (respondenti a non-respondenti). Z tohoto pohledu tak studium jednotlivých genových variant může nejen sloužit k určení vyšší vnímavosti k dané chorobě, ale i přispět k výběru určitých skupin pacientů vhodných pro určitou specifickou léčbu.
MUDr. Magdaléna Hladíková
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: magdap@centrum.cz
Přijato k recenzi: 9. 5. 2011
Přijato do tisku: 11. 7. 2011
Studie byla podpořena VZ MŠMT ČR č. MSM0021622404 (Vnitřní organizace a neurobiologické mechanismy funkčních systémů CNS).
Zdroje
1. Miller DH, Barkhof F, Berry I, Kappos L, Scotti G, Thompson AJ. Magnetic resonance imaging in monitoring the treatment of multiple sclerosis: concerted action guidelines. J Neurol Neurosurg Psychiatry 1991; 54(8): 683–688.
2. Thorpe JW, Kidd D, Moseley IF, Kenndall BE, Thompson AJ, MacManus DG et al. Serial gadolinium-enhanced MRI of the brain and spinal cord in early relapsing-remitting multiple sclerosis. Neurology 1996; 46(2): 373–378.
3. Das UN. Is angiotensin-II an endogenous pro-inflammatory molecule? Med Sci Monit 2005; 11(5): 155–162.
4. Suzuki Y, Ruiz-Ortega M, Lorenzo O, Ruperez M, Esteban V, Egido J. Inflammation and angiotensin II. Int J Biochem Cell Biol 2003; 35(6): 881–900.
5. Wick G, Knoflach M, Xu Q. Autoimmune and inflammatory mechanisms in atherosclerosis. Annu Rev Immunol 2004; 22: 361–403.
6. Feldmann M, Steinman L. Design of effective immunotherapy for human autoimmunity. Nature 2005; 435(7042): 612–619.
7. Fyhrquist F, Saijonmaa O. Renin-angiotensin system revisited. J Intern Med 2008; 264(3): 224–236.
8. Zhuo J, Moeller I, Jenkins T, Chai SY, Allen AM, Ohishi M et al. Mapping tissue angiotensin-converting enzyme and angiotensin AT1, AT2 and AT4 receptors. J Hypertens 1998; 16(12): 2027–2037.
9. Stegbauer J, Lee DH, Seubert S, Ellrichmann G, Manzel A, Kvakan H et al. Role of the renin-angiotensin system in autoimmune inflammation of the central nervous system. Proc Natl Acad Sci U S A 2009; 106(35): 14942–14947.
10. Platten M, Youssef S, Hur EM, Ho PP, Han MH, Lanz TV et al. Blocking angiotensin-converting enzyme induces potent regulatory T cells and modulates TH1- and TH17-mediated autoimmunity. Proc Natl Acad Sci U S A 2009; 106(35): 14948–14953.
11. Constantinescu CS, Ventura E, Hilliard B, Rostami A. Effects of the angiotensin converting enzyme inhibitor captopril on experimental autoimmune encephalomyelitis. Immunopharmacol Immunotoxicol 1995; 17(3): 471–491.
12. Ottervald J, Franzén B, Nilsson K, Andersson LI, Khademi M, Eriksson B et al. Multiple sclerosis: Identification and clinical evaluation of novel CSF biomarkers. J Proteomics 2010; 73(6): 1117–1132.
13. Hammack BN, Fung KY, Hunsucker SW, Duncan MW, Burgoon MP, Owens GP et al. Proteomic analysis of multiple sclerosis cerebrospinal fluid. Mult Scler 2004; 10(3): 245–260.
14. Stoop MP, Dekker LJ, Titulaer MK, Lamers RJ, Burgers PC, Sillevis Smitt PA et al. Quantitative Matrix-Assisted Laser Desorption Ionization-Fourier Transform Ion Cyclotron Resonance (MALDIFT-ICR) Peptide Profiling and Identification of Multiple-Sclerosis-Related Proteins. J Proteome Res 2009; 8(3): 1404–1414.
15. Igić R, Behnia R. Properties and distribution of angiotensin I converting enzyme. Curr Pharm Des 2003; 9(9): 697–706.
16. Imboden H, Harding JW, Hilgenfeldt U, Celio MR, Felix D. Localization of angiotensinogen in multiple cell types of rat brain. Brain Res 1987; 410(1): 74–77.
17. Inoue I, Nakajima T, Williams CS, Quackenbush J, Puryear R, Powers M et al. A nucleotide substitution in the promoter of human angiotensinogen is associated with essential hypertension and affects basal transcription in vitro. J Clin Invest 1997; 99(7): 1786–1797.
18. Rotimi C, Cooper R, Ogunbiyi O, Morrison L, Ladipo M, Tewksbury D et al. Hypertension, serum angiotensinogen, and molecular variants of the angiotensinogen gene among Nigerians. Circulation 1997 20; 95(10): 2348–2350.
19. Jeunemaitre X, Soubrier F, Kotelevtsev YV, Lifton RP, Williams CS, Charru A et al. Molecular basis of human hypertension: role of angiotensinogen. Cell 1992; 71(1): 169–180.
20. Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the „McDonald Criteria“. Ann Neurol 2005; 58(6): 840–846.
21. Sambrook J., Maniatis T, Fritsch EF. Molecular Cloning: a Laboratory Manual. New York: Cold Spring Harbor Laboratory Press 1989.
22. Russ AP, Maerz W, Ruzicka V, Stein U, Gross W. Rapid detection of the hypertension-associated Met235-->Thr allele of the human angiotensinogen gene. Hum Mol Genet 1993; 2(5): 609–610.
23. Hegele RA, Harris SB, Hanley AJ, Sun F, Connelly PW, Zinman B. –6A promoter variant of angiotensinogen and blood pressure variation in Canadian Oji-Cree. J Hum Genet 1998; 43(1): 37–41.
24. Lovrečić L, Ristić S, Starcević-Cizmarević N, Jazbec SS, Sepcić J, Kapović M et al. Angiotensin-converting enzyme I/D gene polymorphism and risk of multiple sclerosis. Acta Neurol Scand 2006; 114(6): 374–377.
25. Constantinescu CS, Goodman DB, Grossman RI, Mannon LJ and Cohen JA. Serum angiotensin-converting enzyme in multiple sclerosis. Arch Neurol 1997; 54(8): 1012–1015.
26. Choi YS, Kwon H, Kim JH, Shin JE, Choi Y, Yoon TK. Haplotype-based association of ACE I/D, AT1R 1166A>C, and AGT M235T polymorphisms in renin-angiotensin-aldosterone system genes in Korean women with idiopathic recurrent spontaneous abortions. Eur J Obstet Gynecol Reprod Biol 2011; 158(2): 225–228.
27. Yanai K, Saito T, Hirota K, Kobayashi H, Murakami K, Fukamizu A. Molecular variation of the human angiotensinogen core promoter element located between the TATA box and transcription initiation site affects its transcriptional activity. J Biol Chem 1997; 272(48): 30558–30562.
28. Brasier AR, Li J. Mechanisms for inducible control of angiotensinogen gene transcription. Hypertension 1996; 27(3): 465–475.
29. Hoffjan S, Akkad DA. The genetics of multiple sclerosis: an update 2010. Mol Cell Probes 2010; 24(5): 237–243.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 1
Nejčtenější v tomto čísle
- Vertebroplastika – možnost léčby strukturálně narušených obratlů
- Karpální tunel a neurochirurg – zkušenosti po 2 200 operacích
- Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
- Klinický standard pro farmakoterapii neuropatické bolesti