Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
Patient Benefit from Cerebrovascular Reserve Capacity Assessment using Brain SPECT and Hypercapnia
Aim:
To determine whether symptomatic patients after revascularization brain surgery with reduced cerebrovascular reserve capacity (CVRC) established by brain SPECT and hypercapnia improved in terms of clinical findings and to assess any differences in the incidence of recurrence of stroke or TIA in the patient group with pathological CVRC results treated conservatively or surgically.
Material and Methods:
CVRC using brain SPECT with hypercapnia test was performed in 64 patients. Patients were divided into 3 groups. The first consisted of 31 patients with normal CVRC, the second of 14 patients with pathological CVRC who were treated conservatively, and the third of 19 patients with pathological CVRC who underwent surgical revascularization of the brain.
Results:
Neurological findings improved in 8 of the 19 patients (42%) in Group 3. Stroke and TIA recurrence after surgery was assessed in terms of secondary prevention. One patient had intracerebral haemorrhage after surgery, another 18 patients had no stroke or TIA after surgery. In the group of non-surgically treated patients there was one patient with ipsilateral stroke, one with ipsilateral TIA, and two patients died of fatal stroke. If we compare disease-free survival (DSF) in the two groups of patients with and without surgery, then a statistically difference emerges at a level of p = 0.15.
Conclusion:
CVRC examination is able to help with the selection of patients with occlusive cerebrovascular disease for neurosurgical bypass surgery.
Key words:
cerebrovascular reserve capacity – brain SPECT – hypercapnia
Autoři:
P. Širůček 1; O. Kraft 1; T. Hrbáč 2; V. Kosek 3
Působiště autorů:
Fakultní nemocnice Ostrava
Klinika nukleární medicíny
1; Fakultní nemocnice Ostrava
Neurochirurgická klinika
2; Fakultní nemocnice Ostrava
Oddělení ekonomiky a financí
3
Vyšlo v časopise:
Cesk Slov Neurol N 2011; 74/107(3): 299-311
Kategorie:
Původní práce
Souhrn
Cíl:
Cílem práce bylo stanovit, zda u symptomatických pacientů po revaskularizační operaci mozku se sníženou CVRC stanovenou pomocí SPECT mozku a hyperkapnie došlo ke zlepšení klinického nálezu, a posoudit rozdíl ve výskytu recidiv CMP či TIA u skupiny pacientů s patologickým výsledkem CVRC léčených konzervativně a chirurgicky.
Soubor a metoda:
Cerebrovaskulární rezervní kapacitu (CVRC) pomocí SPECT mozku s hyperkapnickým testem jsme vyšetřovali u 64 pacientů. Soubor pacientů byl rozdělen do tří skupin. První skupinu představovalo 31 pacientů s normální CVRC, druhou skupinu 14 pacientů s patologickým nálezem CVRC, kteří byli léčeni konzervativně, a třetí skupinou bylo 19 pacientů s patologickým nálezem na CVRC, kteří podstoupili chirurgickou revaskularizaci mozku.
Výsledky:
U osmi z 19 operovaných pacientů (42 %) došlo ke zlepšení neurologického nálezu. V rámci sekundární prevence byla hodnocena recidiva CMP a TIA. Jeden pacient měl intracerebrální pooperační krvácení, ostatních 18 operovaných pacientů nemělo žádnou CMP či TIA. U skupiny pacientů léčených medikamentózně se u jednoho pacienta vyskytla ipsilaterální CMP, u jednoho ipsilaterální TIA, dva pacienti z důvodu fatální CMP exitovali. Jestliže porovnáme parametr Disease Free Survival v těchto dvou skupinách operovaných a neoperovaných pacientů, pak se na hladině významnosti p = 0,15 statisticky liší.
Závěr:
Vyšetření CVRC pomocí SPECT mozku a hyperkapnie je jednoduchá metoda, která účinně pomáhá při výběru pacientů s okluzivním cerebrovaskulárním onemocněním k neurochirurgickému bypassovému zákroku.
Klíčová slova:
cerebrovaskulární rezervní kapacita – SPECT mozku – hyperkapnie
Úvod
Dnešní diagnostika nejen umožňuje morfologické zobrazení mozku a jeho cévního systému, ale je i schopna podat informace o průtokových parametrech v klidu a zátěži. Za funkční parametry považujeme zjištění mozkového krevního průtoku (CBF) a vyšetření cerebrovaskulární rezervní kapacity (CVRC). Princip stanovení CVRC je jednoduchý a vychází z poznatku, že v hypoperfundované oblasti mozku jsou cévy dilatovány tak, aby byl zajištěn maximální přítok krve. Při dalším podnětu k dilataci, kterým je při zátěžovém vyšetření nejčastěji inhalace CO2 či podání acetazolamidu, je v postižené oblasti mozku schopnost reagovat na takovýto podnět omezena a v hypoperfundované oblasti dojde k relativnímu snížení krevního průtoku.
CVRC lze stanovit pomocí několika technik. Nejjednodušší je transkraniální dopplerometrie (TCD), dále je to SPECT mozku, perfuzní CT, méně dostupná je pozitronová emisní tomografie a dynamická magnetická rezonance s využitím Blood Oxygen Level Dependent efektu [1–6].
Vyšetření CVRC se skládá ze dvou vyšetření – klidového a zátěžového. Zátěž může představovat i.v. aplikace acetazolamidu či hyperkapnie.
Hyperkapnii lze dosáhnout pomocí inhalace směsi vzduchu a CO2. Pacientem vdechovaný vzduch je obohacován o CO2 přiváděný z tlakové láhve do inspirační části aparatury. Kapnometrem na výdechové části je sledována hodnota tzv. end-tidal CO2, tj. obsah oxidu uhličitého na konci exspiria (EtCO2). Vyšetřovaná osoba nejprve dýchá čistý vzduch, čímž jsou získány hodnoty klidového EtCO2. Během vyšetření je množství CO2 regulováno tak, aby hodnota EtCO2 stoupla o 2 kPa. Vhodné je dosažení hodnoty 7–7,5 kPa EtCO2 [7,8].
Další možností vazodilatace je aplikace acetazolamidu, který blokuje karboanhydrázu [9–11]. Ta katalyzuje přeměnu H2O a CO2 na H2CO3 na membráně erytrocytů. Acetazolamid způsobuje zvýšení koncentrace CO2, a tím vazodilataci mozkových arteriol. 1 g acetazolamidu aplikujeme jednorázově intravenózně. Nástup účinku je rychlý, maximum je mezi 15.–20. minutou. Hlavní nevýhodou acetazolamidu je absence antidota v případě nežádoucích účinků, jimiž mohou být bolesti hlavy, závratě a parestezie.
Po dosažení hyperkapnie inhalací CO2 či po aplikaci acetazolamidu je prováděno sonografické vyšetření, aplikováno radiofarmakum při SPECT vyšetření či podána kontrastní látka při perfuzním CT. Výsledky vyšetření v zátěži jsou porovnávány s nálezem klidových vyšetření. TCD sleduje změny rychlosti proudění v mozkových arteriálních kmenech. Zde k vazodilataci nedochází, ale každá změna v distální části mozkového řečiště se tady odrazí ve změně průtokových rychlostí.
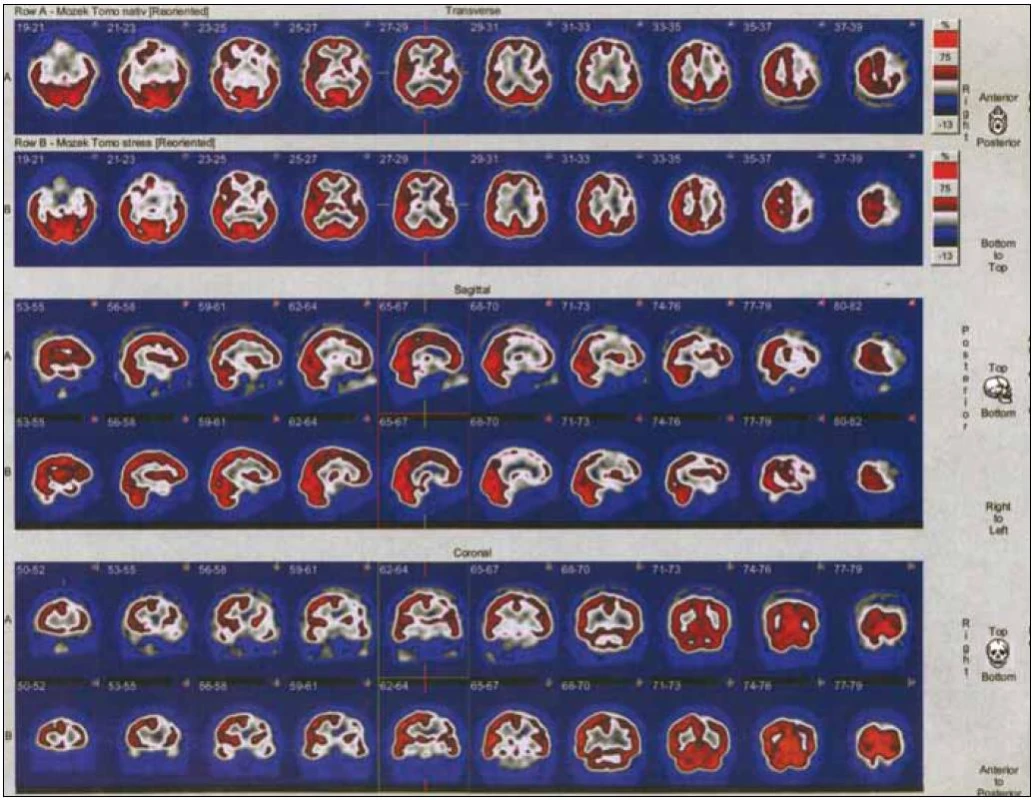
SPECT mozku je často využívaná metoda. Výsledkem tohoto vyšetření je trojrozměrný obraz rozložení radiofarmaka. Ten vzniká počítačovým zpracováním série dvourozměrných obrazů, které se vytvářejí při rotaci detektoru okolo hlavy pacienta. Úroveň mozkové akumulace je úměrná hodnotě regionálního krevního průtoku. Nejrozšířenějším indikátorem mozkové perfuze je 99mTc-ECD (etyl-cysteinát-dimer neboli bicisát) či 99mTc-HMPAO (hexa-metyl-propylen--amino-oxim). Pro porovnání klidové a zátěžové perfuze je třeba provést dvě vyšetření nejvhodněji s 24hodinovým odstupem, kdy již došlo k přeměně či vyloučení významné části radiofarmaka (obr. 1–3) [7].


Perfuzní CT mozku je v poslední době další využívaná metoda [7,8]. K získání dvou vyšetření – klidového a po zátěži – je třeba 24hodinového intervalu potřebného k vyloučení kontrastní látky. Nevýhodou je to, že mozek je vyšetřován na starších přístrojích s menším počtem detektorů pouze ve dvou vrstvách. Na moderních přístrojích s 64 a více detektory lze při jednom vyšetření již provést perfuzní vyšetření celého mozku. Obecná nevýhoda CT perfuzního vyšetření je větší radiační zátěž. U nemocných s těžkým postižením krčních a mozkových tepen je to však irelevantní. Při možnosti vyšetřit pouze dvě vrstvy lze perfuzním CT cílit na střed ischemického ložiska podle předchozího SPECT mozku [6].
PET (pozitronová emisní tomografie) mozku lze podobně využít jako SPECT či perfuzní CT. Nevýhodou je vyšší cena vyšetření a menší dostupnost PET pracovišť v naší republice ve srovnání s CT pracovišti či klasickými odděleními nukleární medicíny.
Terapeutické možnosti u pacientů se sníženou CVRC
Konzervativní terapie zahrnuje antiagregační terapii, úpravu antihypertenzní medikace (snížení dávky), event. podávaní statinů a omezení či eliminaci rizikových faktorů. V případech stenózy kontralaterální arteria carotis interna nebo stejnostranné arteria carotis externa je možno zvážit provedení karotické endartektomie nebo perkutánní transluminální angioplastiky a její stenting [7].
U pacientů se sníženou či výrazně sníženou cerebrovaskulární rezervní kapacitou s okluzí arteria carotis interna bez fixovaného rozsáhlého neurologického deficitu je možno zvážit indikaci k extra-intrakraniální anastomóze s našitím a. temporalis superficialis na a. cerebri media. U pacientů, kteří nemají možnost tuto operaci podstoupit např. z důvodu hypoplazie tepen používaných běžně k anastomózám, je možné provést výkon typu EDAMS (encephalo-duro-arterio-myo-synangiosis). Obě neurochirurgické metody lze označit za experimentální, jelikož jejich užití není podloženo výsledky velké randomizované studie.
Extra-intrakraniální anastomóza
EC-IC anastomóza byla poprvé provedena v roce 1967 současně Yasargilem a Donaghym. Největší rozmach zaznamenala ve druhé polovině 70. a začátkem 80. let 20. století. Jednoduchost operace a malý počet závažných komplikací vedly k jejímu výraznému rozšíření. Indikace v té době byly volné. Operováni byli téměř všichni nemocní s trombózou karotidy. Neoperovali se pouze nemocní s velkým neurologickým deficitem.
Sedmdesátá léta 20. století byla obdobím, kdy byla lépe poznána patofyziologie iktů, zejména byl popsán embolický původ TIA. Výsledky EC-IC anastomózy byly zpochybňovány a nadužívání této metody dospělo k inicializaci mezinárodní studie vedené H. Barnettem [7,8,12].
Studie neprokázala účinek výkonu v prevenci iktu, proto se na dlouhou dobu od tohoto typu operace upustilo. Do této studie však byli zařazeni všichni pacienti s okluzí ACI bez ohledu na hemodynamické poměry. Význam hemodynamických poměrů v patofyziologii iktu nebyl do té doby rozpoznán a vyšetřování cerebrovaskulární rezervní kapacity nebylo známo. Až v roce 1994 Schmiedek et al publikovali svou práci, která obhajuje indikace EC-IC bypassu u přísně selektovaných pacientů. Jako indikační kritéria uvádějí symptomatickou okluzi vnitřní karotidy, dostatečně průchodnou kontralaterální ACI, absenci velkého ischemického ložiska na CT či MR mozku a zejména vyčerpanou CVRC. Po této publikaci se EC-IC bypass opět postupně rozšiřoval do té míry, že je u selektovaných pacientů považován za indikovaný [13].
Materiál a metodika
Cerebrovaskulární rezervní kapacitu pomocí SPECT mozku s hyperkapnickým testem jsme vyšetřovali u 64 pacientů, z toho bylo 21 žen (33 %) a 43 mužů (67 %). Průměrný věk vyšetřovaných mužů i žen byl 59,6 let. Věkové rozmezí bylo od 31 do 76 let. Soubor pacientů byl rozdělen do tří skupin. První skupinu představovalo 31 pacientů s normální CVRC, druhou skupinu 14 pacientů s patologickým nálezem CVRC, kteří byli léčeni konzervativně, a třetí skupinou bylo 19 pacientů s patologickým nálezem na CVRC, kteří podstoupili chirurgickou revaskularizaci mozku.
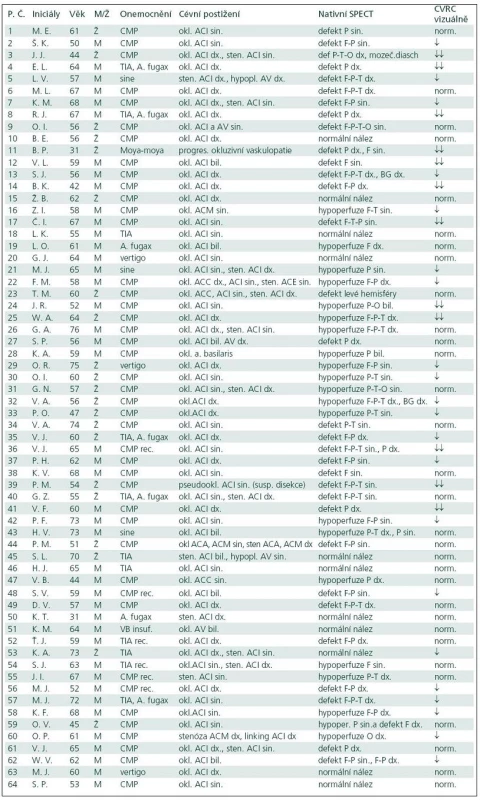
Klinická symptomatologie pacientů indikovaných k vyšetření cerebrovaskulární rezervní kapacity byla rozmanitá. Nejvíce vyšetřených pacientů mělo v anamnéze cévní mozkovou příhodu (44 pacientů), v menším zastoupení pak byli nemocní s proběhlou tranzitorní ischemickou atakou (šest pacientů), event. kombinovanou s přechodnou slepotou (pět pacientů). Ostatní projevy či diagnózy byly zastoupeny v menší míře, tři pacienti byli dokonce bez klinické symptomatologie související s ischemickým postižením mozku a nález stenózy či okluze ACI byl náhodný (tab. 1).

Pacienti indikovaní k vyšetření cerebrovaskulární rezervní kapacity měli rozmanité cévní postižení zjištěné sonograficky a potvrzené angiograficky. Rovnoměrně byla zastoupena pravostranná a levostranná okluze vnitřní karotidy kombinovaná s jinou stenózou, v malém počtu byly zastoupeny oboustranné okluze ACI či intracerebrální okluze. Menší skupinu představovali pacienti s heterogenním cévním postižením, která již nebyla podrobněji dělena.
Indikací k vyšetření cerebrovaskulární rezervní kapacity pomocí SPECT mozku s hyperkapnickým testem byl uzávěr arteria carotis interna, případně okluze arteria vertebralis či basilaris, výjimečně závažná stenóza arteria carotis interna většinou spojená s další cévní abnormalitou, např. hypoplazií arteria vertebralis. Okluze arteria carotis interna byla diagnostikována primárně většinou sonograficky a potvrzena digitální subtrakční angiografií. V našem souboru pacientů byli v malém počtu odesláni k vyšetření CVRC i pacienti s výraznou stenózou arteria carotis interna, u nichž by endartektomie byla nemožná pro příliš vysoko umístěnou stenózu.
Kontraindikace ke scintigrafickému vyšetření je těhotenství a kojení. Ani jedna z těchto kontraindikací se netýkala pacientek v našem souboru, pouze jediná žena byla ve fertilním věku.
U všech indikovaných pacientů bylo provedeno vyšetření SPECT mozku pomocí dvoudetektorové scintilační kamery E.CAM fy Siemens s konvergentními kolimátory typu fan beam. Po vymočení byl pacient uložen na lehátko do tiché a zatemněné místnosti a byla mu zavedena i.v. kanyla. Byl poučen, aby nemluvil, nevstával, nečetl a zavřel oči. Aplikace radiofarmaka byla provedena po 10–15 min. Následná akvizice byla uskutečněna po aplikaci 99mTc-bicisátu (preparát NEUROLITE® firmy Bristol-Mayers Squibb, Sermoneta, Itálie) za 30–60 min v 64 krocích pro jeden detektor, jeden krok trval 20 s. Byla použita záznamová matice 128 × 128 a akviziční mód step and shoot při zoomu 1,23. Vyšetření bylo uskutečněno za klidových podmínek a následně po zátěži. Zátěž byla realizována inhalací vzduchu obohaceného o CO2 z tlakové láhve. Při vzestupu parciálního tlaku CO2 o 2 kPa ve vydechovaném vzduchu bylo pacientovi i.v. aplikováno radiofarmakum a následně byl proveden SPECT mozku. Obě vyšetření byla vyhodnocena pomocí filtrované zpětné projekce za použití filtru Butterworth (Cuttoff 0,5; Order 5) a porovnána. Hodnocení CVRC bylo provedeno po rekonstrukci řezů z klidové a zátěžové studie v identických rovinách a porovnání vzájemně sounáležejících řezů.
Při hodnocení SPECT mozku používáme pojmy hypoperfuze a defekt. Hypoperfuzi jsme si definovali jako snížení akumulace radiofarmaka o 25–70 % ve srovnání s normálem, defekt pak jako výrazné snížení radiofarmaka o více než 70 % maxima – normálu.
Referenční oblastí byl většinou mozeček, pokud zde nedošlo ke snížení akumulace radioindikátoru, např. z důvodu zkřížené mozečkové diaschýzy. Na našem pracovišti používáme čtyřstupňovou černo-modro-bílo-červenou barevnou kontinuální škálu s firemním označením „Stars“, přičemž černá barva odpovídá nepřítomnosti radiofarmaka, červená pak maximální koncentraci.
Počítačový software E.SOFT firmy Siemens nám umožňoval pokud možno co nejpřesněji rekonstruovat obě studie v identických rovinách.
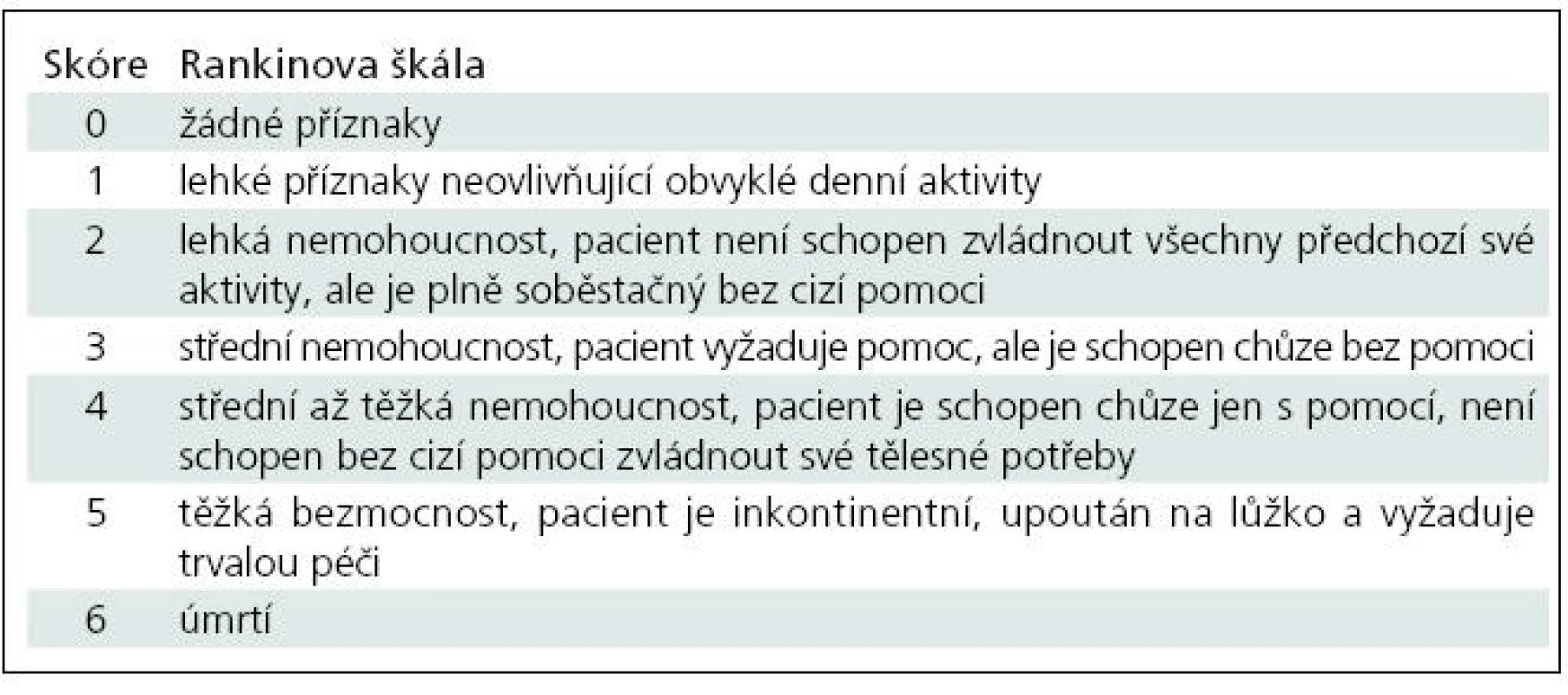
Při rekonstrukci bylo postupováno tak, aby se izokontury mozku pacienta vyšetřeného v klidu a v zátěži co nejvíce překrývaly. Použité vizuální hodnocení bylo rozděleno do třístupňové škály: cerebrovaskulární rezervní kapacita (CVRC) byla normální při neměnném nálezu v zátěži a klidu, při zhoršení nálezu v zátěži byla CVRC hodnocena jako snížená či výrazně snížená. To, zda pacient již má CVRC sníženou či výrazně sníženou, je stanoveno na základě hodnocení poruchy perfuze, která je dána rozsahem a hloubkou. Sníženou CVRC se rozumí stav, kdy rozdíl ploch či hloubky poruchy perfuze mezi zátěžovým a klidovým vyšetřením je mezi 5–10 %. Výrazně snížená CVRC je při rozdílu větším než 10 %. Rozdíl mezi zátěžovým a klidovým vyšetřením by měl být patrný ve všech třech rovinách.
Výsledky
Výsledky klidového SPECT mozku byly velmi rozmanité. Úplné defekty perfuze převažovaly nad nálezem hypoperfuze, v jednom případě byla kombinace hypoperfuze a defektu, menší část pacientů měla normální nález.
Normální CVRC byla u 31 pacientů (48 %), snížená se vyskytla u 21 pacientů (33 %) a výrazně sníženou jsme pozorovali u zbývajících 12 pacientů (19 %) (tab. 2).
Statisticky jsme porovnali pomocí chí--kvadrát testu anamnestické onemocnění a výsledky cerebrovaskulární rezervní kapacity. Závislost těchto dvou parametrů prokázána nebyla (p = 0,3159). Mezi výsledkem klidového SPECT mozku a výsledkem CVRC však závislost pomocí identického chí-kvadrát testu potvrzena byla (p = 0,0013).
Mozková revaskularizace
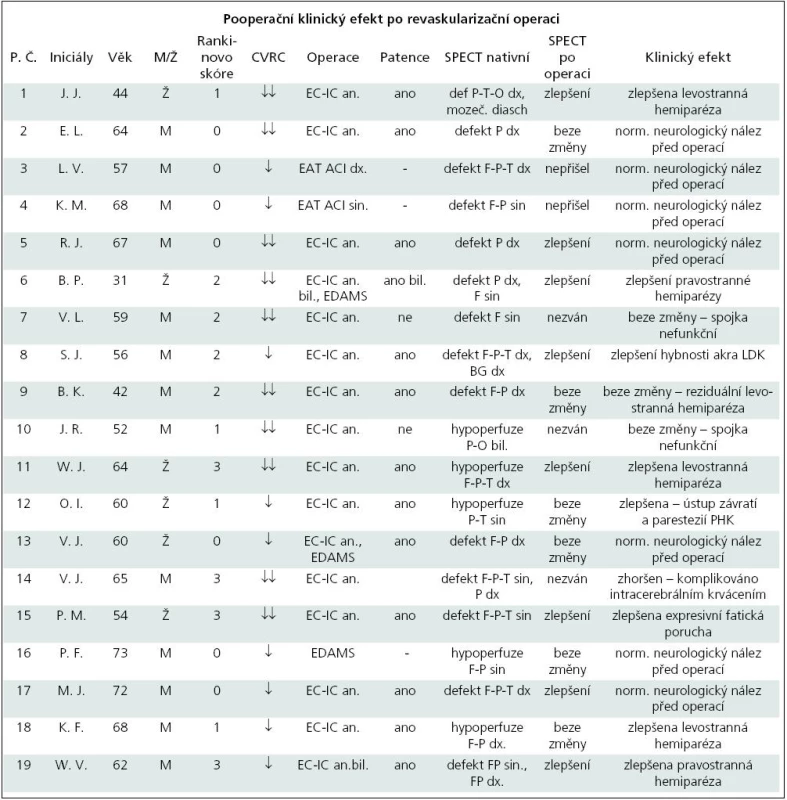
Celkem bylo operováno 19 pacientů, z toho šest žen a 13 mužů. Muži i ženy měli věkový průměr 58,6 let. Žádný z těchto pacientů neměl těžký fixovaný neurologický deficit, tj. všichni měli skóre v Rankinově škále rovno či menší než 3 (tab. 3). Samostatný extra-intrakraniální bypass s našitím arteria temporalis superficialis na arteria cerebri media byl proveden u většiny operovaných pacientů – u 14 (74 %), u jednoho pacienta byl použit neurochirurgický zákrok typu EDAMS (encefalo-duro-arterio-myo-synangiosis), u dvou pacientů byl zákrok kombinovaný výše uvedenými způsoby a u dvou pacientů byla provedena endartektomie arteria carotis interna.
Cévní anastomóza byla dominantně našívána na infrasylvijskou větev střední mozkové tepny. Pokud ta byla z nějakého důvodu nevhodná, byla použita suprasylvijská větev. V rámci perioperační medikace byl aplikován lokálně heparin do připravovaného cévního pahýlu. U většiny operovaných pacientů byl prováděn lalokový kožní řez, u posledních dvou pacientů byl použit přímý kožní řez. U každého pacienta byla pooperačně ověřována průchodnost anastomózy dopplerometricky.
Každé operační řešení skýtá riziko pooperačních komplikací. V našem souboru 19 operovaných pacientů došlo celkem ke čtyřem komplikacím. V jednom případě se jednalo o závažnou komplikaci intracerebrálního krvácení u pacienta s výrazně sníženou CVRC. Na klidovém SPECT mozku byl popsán rozsáhlý nález defektu fronto-parieto-temporálně vlevo a parietálně vpravo. Tento pacient zůstal po operaci kvadruplegikem. U dvou pacientů došlo k okluzi anastomózy, která byla zjištěna sonograficky a potvrzena digitální subtrakční angiografií na panangiografii. V jednom případě došlo k okrajové nekróze v okolí kožní incize.
Z pozvaných 16 pacientů se ke kontrolnímu SPECT mozku dostavilo celkem 14 pacientů. Dva pacienti nereagovali na výzvu. Tři pacienty jsme nezvali – dva měli spojku neprůchodnou, jeden prodělal intracerebrální krvácení. Při vizuálním hodnocení u osmi pacientů došlo ke zlepšení, šest pacientů mělo nález beze změny.
U osmi z 19 operovaných pacientů nastalo zlepšení neurologického nálezu. Ve většině případů (6×) šlo o zlepšení hemiparézy, u jednoho pacienta se zlepšilo vertigo a parestezie horní končetiny, u jednoho pacienta se zlepšila expresivní fatická porucha. Sedm pacientů bylo po operaci beze změny. Tito pacienti měli předoperačně normální neurologický nález a operace byla provedena v rámci sekundární prevence. U třech pacientů zůstává identický patologický nález, z toho u dvou pacientů není spojka funkční. U jednoho pacienta došlo ke zhoršení klinického stavu z důvodu pooperační komplikace – intracerebrálního krvácení.
V tab. 5 jsou porovnána data 19 pacientů, kteří podstoupili revaskularizační zákrok. Všem pacientům bylo před operací provedeno vyšetření cerebrovaskulární rezervní kapacity. Podle vizuálního hodnocení mělo 10 pacientů CVRC výrazně sníženou, devět pacientů sníženou.
Z tab. 4 bylo provedeno pomocí chí-kvadrát testu statistické porovnání klinického zlepšení po revaskularizačním mozkovém zákroku a zlepšení patrném na pooperačním SPECT mozku. Vzhledem k vypočtené hodnotě p = 0,1026 z oboustranného Fisherova faktoriálového testu můžeme konstatovat, že klinické zlepšení nekoreluje s výsledkem pooperačního SPECT mozku.

Další otázka, která by měla být zodpovězena, je to, zda sedm pacientů se zlepšeným SPECT mozku mělo na klidovém SPECT mozku spíše defekty či nálezy hypoperfuze. Šest pacientů mělo na klidovém předoperačním SPECT mozku defekty, jeden pacient hypoperfuzi, avšak rozsáhlejší. V rámci sekundární prevence byla hodnocena recidiva CMP a TIA po operaci. Jeden pacient měl pooperačně intracerebrální krvácení. Všech ostatních 18 operovaných pacientů nemělo žádnou cévní mozkovou příhodu v rámci sledovaných 54 ± 19 měsíců.
Rozdíl mezi skupinou pacientů s patologickým výsledkem CVRC léčených konzervativně a chirurgicky
V této kapitole jsou porovnány dvě skupiny pacientů s patologickým výsledkem cerebrovaskulární rezervní kapacity. První skupině 19 pacientů byla navržena chirurgická revaskularizační terapie mozku, kterou akceptovali a podstoupili. Druhá skupina 14 pacientů měla patologickou CVRC, ale byla dále léčena konzervativně. Rozdělení do těchto dvou skupin bylo provedeno na základě rozhodnutí pacienta podstoupit či odmítnout chirurgický zákrok.
U první skupiny pacientů se v průběhu sledovaného období, které činilo 54 ± 19 měsíců (medián 60, min. 1, max. 76 měsíců) po operaci, nevyskytla žádná mozková příhoda. U druhé skupiny pacientů, jež byli léčeni pouze medikamentózně, se u jednoho pacienta vyskytla ipsilaterální cévní mozková příhoda, u jednoho ipsilaterální tranzitorní ischemická ataka, dva pacienti z důvodu fatální CMP exitovali. Sledované období druhé skupiny bylo 58 ± 20 měsíců (medián 59, min. 18, max. 82 měsíců) od zjištění patologické CVRC. Doba sledování v měsících u skupiny pacientů s patologickou CVRC léčených konzervativně a u skupiny léčených chirurgicky byla statisticky porovnána.
K testu hypotézy, že mezi dobou sledování obou skupin není posun, lze užít Mannův-Whitneyův test. Tímto testem byla zjištěna hladina významnosti p = 0,51; tzn. hypotéza se na hladině významnosti 0,05 nezamítá, a tudíž nebyl prokázán statisticky významný rozdíl v době sledování v obou skupinách pacientů.
Při určování pravděpodobnosti nevýskytu CMP/TIA v čase u operovaných a neoperovaných pacientů se setkáváme s cenzorovanými pacienty, tj. pacienty, kteří byli po určité době z nějakých důvodů vyřazeni ze sledování. Pro odhad nevýskytu CMP/TIA byla použita Kaplanova--Meierova analýza Disease-Free Survival (DSF), která přihlíží k cenzorování. Pro operované pacienty lze odhad nevýskytu CMP/TIA zobrazit tmavě zelenou, pro neoperované světle zelenou křivkou (graf 1).

Jestliže porovnáváme doby přežití bez přítomnosti CMP či TIA dvou skupin pacientů operovaných a neoperovaných, pak na hladině významnosti 0,15 se hypotéza rovnosti zamítá. Pokud bychom nebrali v úvahu operační komplikaci s intracerebrálním krvácením u jednoho pacienta, pak se hypotéza rovnosti zamítá na hladině významnosti 0,057. Z toho plyne, že Disease-Free Survival se v těchto skupinách pacientů operovaných a neoperovaných, pokud bychom nebrali v úvahu jednu závažnou pooperační komplikaci, statisticky liší.
Dále bylo hodnoceno u pacientů s patologickým výsledkem CVRC, jestli je na konci sledovaného období rozdíl ve zlepšení klinického stavu operovaných a neoperovaných.
Vzhledem k výskytu malých četností byl použit k výpočtu této statistiky oboustranný Fisherův faktoriálový test. Jeho p je 0,0104; což znamená, že zlepšení klinického stavu u symptomatických pacientů s patologickým výsledkem CVRC závisí na provedení revaskularizační operace mozku.
Rizikové faktory cévních mozkových příhod a jejich vztah k anamnestickému onemocnění, SPECT mozku a CVRC
Z hlediska prevence je důležitá skupina ovlivnitelných rizikových faktorů. Z těchto rizikových faktorů jsou nejpodstatnější arteriální hypertenze, kouření, diabetes mellitus, hyperilipidemie, fyzická inaktivita a další [8,14]. Ve skupině vyšetřených 64 pacientů byl vypočten z výšky a váhy Body Mass Index a pacienti rozděleni do dvou skupin. První skupinu tvořilo 15 normosteniků (23 %) s BMI < 24,9. Ve druhé skupině bylo 49 pacientů s nadváhou a obezitou (32 vyšetřených – 50 % mělo BMI 25–29,9; 17 vyšetřených – 27 % BMI > 30. Z celkových 64 pacientů kouřilo 36 (56 %), 49 má stanovenou diagnózu hyperlipoproteinemie (77 %), 54 má hypertenzi (84 %) a 17 pacientů trpí cukrovkou (27 %).
V tab. 6 je uvedeno věkové rozpětí, rizikové faktory a jejich procentuální zastoupení v jednotlivých skupinách.
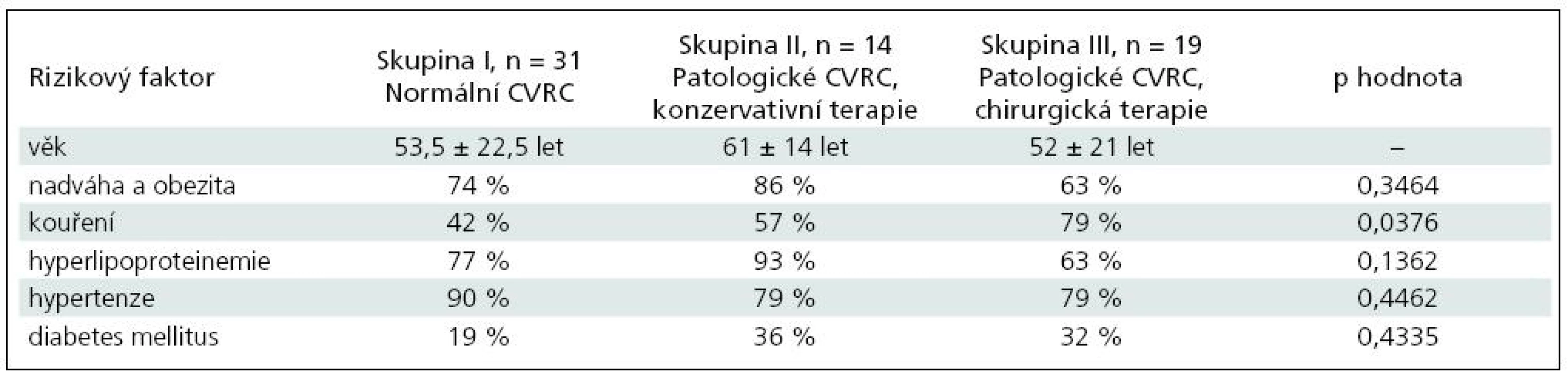
Statisticky byly porovnány rizikové faktory v jednotlivých skupinách pomocí chí-kvadrát testu a hodnota p je uvedena v posledním sloupci. Z tabulky je patrné, že pouze statisticky významný je rozdíl v kouření mezi skupinami I, II a III (p = 0,0376). Ostatní rizikové faktory se statisticky v jednotlivých skupinách neliší.
V tab. 7 jsou uvedeny vypočítané hodnoty významnosti p pro chí-kvadrát test nezávislosti z 18 kontingenčních tabulek zkoumající hypotézu nezávislosti mezi anamnestickým onemocněním, výsledkem klidového SPECT mozku a výsledkem cerebrovaskulární rezervní kapacity s pohlavím, nadváhou a obezitou, kouřením, hyperlipoproteinemií, hypertenzí a cukrovkou.
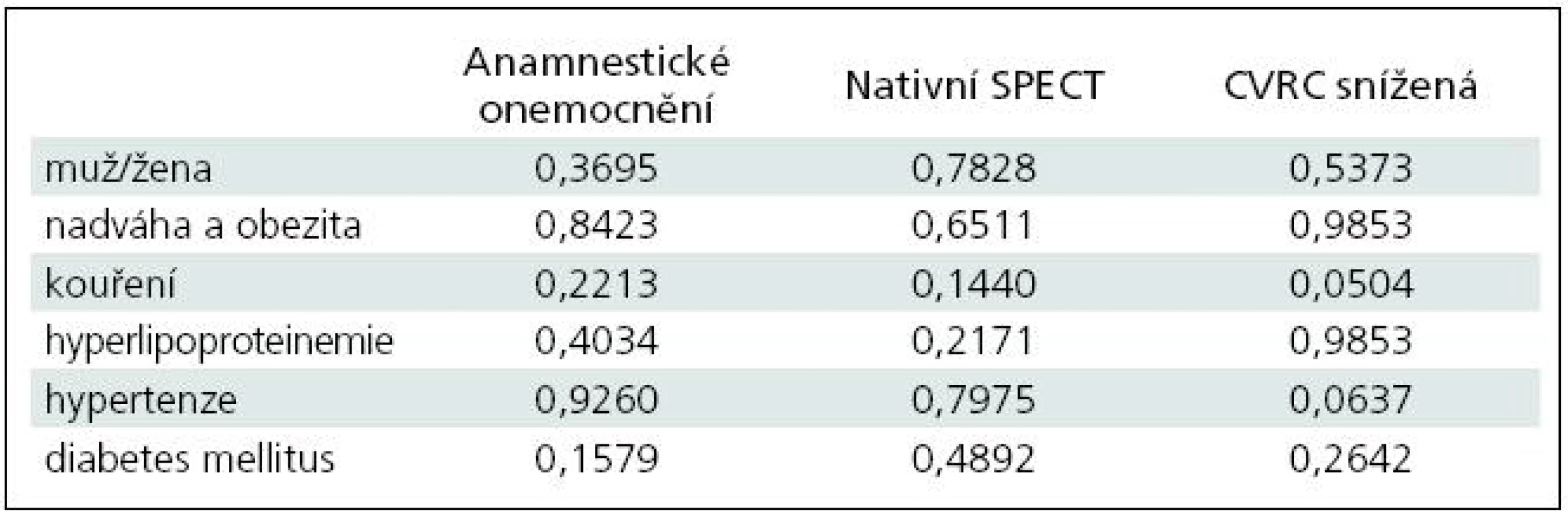
Z výsledků plyne, že na hladině významnosti 0,05 nelze zamítnout nezávislost téměř pro celou tabulku. Výjimku tvoří vztah mezi výsledkem CVRC a kouřením (p = 0,0504). Při statistickém srovnání přítomnosti hypertenze a výsledku CVRC se hypotéza nezávislosti na hladině 0,05 nezamítá, jelikož je p > 0,05; avšak se k této hodnotě velmi blíží (p = 0,064). Proto lze očekávat závislost, byť volnější mezi patologickým výsledkem CVRC a hypertenzí.
Diskuze
Onemocnění, která předcházela vyšetření cerebrovaskulární rezervní kapacity, byla v souboru pacientů uváděných v praktické části práce rozmanitá. Nejvíce vyšetřených mělo v anamnéze cévní mozkovou příhodu (44 pacientů), v menším zastoupení pak byli nemocní s proběhlou tranzitorní ischemickou atakou (šest pacientů), event. kombinovanou s přechodnou slepotou (pět pacientů). Ostatní projevy či diagnózy byly zastoupeny v menší míře, tři pacienti byli dokonce zatím bez klinické symptomatologie.
Pacienti indikovaní k vyšetření cerebrovaskulární rezervní kapacity měli různorodé cévní postižení zjištěné sonograficky a potvrzené angiograficky. Rovnoměrně byla zastoupena pravo- či levostranná okluze vnitřní karotidy kombinovaná s jinou stenózou, v malém počtu byly přítomny oboustranné okluze ACI či intracerebrální okluze. Menší skupinu představovali pacienti s heterogenním cévním postižením, která již nebyla podrobněji dělena.
Ve výsledcích klidového SPECT mozku převažovaly defekty perfuze nad nálezem hypoperfuze, v jednom případě byla kombinace hypoperfuze a defektu, menší část pacientů měla normální nález.
V této práci byla použita k zátěžovému testu směs vzduchu a oxidu uhličitého. Jinou možností je použití acetazolamidu. Porovnání těchto dvou možností zátěže provedli ve své práci Ringelstein et al. Acetazolamid působí jako reverzibilní inhibitor karboanhydrázy a způsobuje extracelulární acidózu mozkové tkáně. Efekt acetazolamidu nastupuje se zpožděním ve srovnání s inhalací CO2, tj. asi po 15–20 min. Vazoaktivní efekt daný inhalací CO2 a intravenózním podáním 1 g acetazolamidu zhodnotili Ringelstein et al jako statisticky velmi podobný s korelačním koeficientem p = 0,0001 při posuzování celkové CO2 reaktivity i při hyperventilaci. Uvádějí, že hlavní výhodou aplikace acetazolamidu je nezávislost výsledku na spolupráci pacienta [11].
Při vizuálním hodnocení byla CVRC normální u téměř poloviny pacientů (48 %). Patologický nález CVRC měla zbývající polovina. Konkrétně snížená CVRC se týkala 21 pacientů (33 %), výrazně snížená byla u 12 pacientů (19 %).
Jedním z podstatných výstupů této práce je průkaz zlepšení klinického stavu symptomatických pacientů, kteří podstoupili revaskularizační mozkový zákrok na základě snížené CVRC, což je jedním z cílů práce. U osmi z 19 operovaných pacientů, tj. ve 42 %, došlo ke zlepšení neurologického nálezu. Ve většině případů (6×) šlo o zlepšení hemiparézy, u jednoho pacienta se zlepšilo vertigo a parestezie horní končetiny, u jednoho pacienta se zlepšila expresivní fatická porucha. Sedm pacientů bylo po operaci beze změny. Tito pacienti měli předoperačně normální neurologický nález a operace byla provedena v rámci sekundární prevence. U třech pacientů zůstává identický patologický nález, z toho u dvou pacientů není spojka funkční. U jednoho pacienta se zhoršil klinický stav z důvodu intracerebrálního krvácení.
V statistických testech při použití chí--kvadrátu nebyla prokázána závislost mezi cévním postižením a výsledkem klidového SPECT mozku (p = 0,9533); anamnestickým onemocněním a zjištěným výsledkem cerebrovaskulární rezervní kapacity (p = 0,3159) či cévním postižením a výsledkem CVRC (p = 0,5586).
Naopak závislost byla prokázána mezi výsledkem klidového SPECT mozku a výsledkem CVRC (p = 0,0013).
Celkem bylo operováno 19 pacientů, z toho šest žen a 13 mužů. Průměrný věk mužů i žen byl identický – 58,6 let. Samostatný extra-intrakraniální bypass s našitím arteria temporalis superficialis na arteria cerebri media byl proveden u většiny operovaných pacientů – 14 (74 %), u jednoho pacienta byl vykonán neurochirurgický zákrok typu EDAMS (encefalo-duro-arterio-myo-synangiosis), u dvou pacientů byl zákrok kombinovaný výše uvedenými způsoby a u dvou pacientů byla provedena endartektomie arteria carotis interna. Průchodnost EC-IC bypassu byla 86 %.
Dalším cílem práce bylo posoudit rozdíl ve výskytu recidiv CMP či TIA u skupiny pacientů s patologickým výsledkem CVRC léčených konzervativně a chirurgicky. Interval sledování u 19 operovaných pacientů v rámci sekundární prevence byl 54 ± 19 měsíců (medián 60, min. 1, max. 76 měsíců). Jeden pacient měl pooperačně intracerebrální krvácení s následnou kvadruparézou, dalších 18 pacientů v průběhu sledovaného období nemělo CMP či TIA.
Skupina pacientů s patologickým výsledkem CVRC léčená konzervativně byla sledována 58 ± 20 měsíců (medián 59, min. 18, max. 82 měsíců) od zjištění patologického výsledku CVRC. U jednoho pacienta se vyskytla ipsilaterální cévní mozková příhoda, u jednoho ipsilaterální tranzitorní ischemická ataka, dva pacienti z důvodu fatální CMP exitovali.
Při statistickém porovnání nevýskytu CMP/TIA u dvou skupin pacientů s patologickým výsledkem CVRC léčených chirurgicky a konzervativně byl použit Mantelův-Haenszelův test přežití. Jestliže porovnáváme nevýskyt CMP/TIA, pak na hladině 0,15 se hypotéza rovnosti zamítá (p = 0,15). Pokud bychom nebrali v úvahu operační komplikaci s intracerebrálním krvácením u jednoho pacienta, pak se hypotéza rovnosti zamítá na hladině významnosti 0,057. Z toho plyne, že Disease-Free Survival se v těchto skupinách pacientů operovaných a neoperovaných statisticky liší.
V této souvislosti je vhodné podotknout, jak uvádějí ve své práci „Symptomatic carotid artery. A reappraisal of hemodynamic factors“ Klijn et al, že riziko CMP u pacientů se symptomatickou karotickou okluzí a porušenou CVRC je okolo 10–14 % ve srovnání s 4–6 % u osob se zachovanou CVRC. Tato práce vychází z 20 sledovacích studií, ve kterých bylo použito ke zjištění CVRC pozitronové emisní tomografie, SPECT, transkraniální dopplerovské sonografie nebo SPECT s xenonem [4].
Kuroda et al [9] ve skupině 32 pacientů s okluzí vnitřní karotidy hodnotili rCBF a CVRC pomocí SPECT s 133Xe s acetazolamidovým testem. Zvažovali užitečnost detekce redukované CVRC a dlouhodobou prognózu. První skupina pacientů s normální rCBF a normální CVRC byla léčena medikamentózně bez rekurence ischemické mozkové příhody. Druhá a třetí skupina pacientů souhlasících s chirurgickým zákrokem podstoupila dvojitou anastomózu arteria temporalis superficialis a střední mozkové tepny. Všichni pacienti druhé skupiny s normální rCBF a redukovanou CVRC a pacienti třetí skupiny s redukovanou rCBF a CVRC, kteří podstoupili chirurgický zákrok, neměli v budoucnosti další ischemickou mozkovou příhodu, došlo u nich k normalizaci CVRC. Dlouhodobá úprava rCBF byla pozorována pouze u tří ze sedmi pacientů třetí skupiny. Mozková hemodynamika zůstala beze změny u čtvrté skupiny pacientů s redukovanou rCBF a normální CVRC. V průběhu sledování kompletní CMP se vyskytla u všech pacientů druhé a třetí skupiny, kteří nesouhlasili s operačním zákrokem a byli léčeni pouze medikamentózně. Tento výsledek ukazuje na užitečnost acetazolamidového testu v hodnocení CVRC a predikci dlouhodobého přežití u pacientů s okluzí ACI.
Retrospektivní studie shledávají těsnou korelaci mezi poškozenou CVRC a incidencí hemodynamické CMP. Kleiser et al [15] tento vztah potvrzují ve studii prospektivní. Transkraniální dopplerovskou sonografií vyšetřil s pomocí CO2 testu 85 pacientů s uzavřenou vnitřní karotidou. Všichni pacienti byli sledování v následujících 38 ± 15 měsících. Ve skupině s normální CVRC se u čtyř pacientů ze 48 (tj. v 8 %) rozvinuly ispilaterální tranzientní symptomy, nedošlo však k rozvoji CMP. V případech se sníženou či vyčerpanou CVRC 12 pacientů ze 37 (32 %) utrpělo stejnostrannou příhodu (čtyři TIA, osm CMP). Svou práci uzavírá tvrzením, že transkraniální dopplerovská sonografie je vhodná metoda k hodnocení rizika mozkové příhody u pacientů s okluzí vnitřní karotidy.
Uvedené výsledky ukazují, že vyšetření CVRC pomocí SPECT mozku a hyperkapnie je významný přínos pro pacienty s okluzivním cerebrálním postižením. Správný výběr pacientů k revaskularizačnímu mozkovému zákroku vede ke zlepšení klinického stavu u významné části pacientů, kteří v době před operačním výkonem vykazovali neurologickou symptomatologii, a hlavně snižuje množství rekurencí ischemických mozkových příhod u pacientů s předoperačně patologickou CVRC.
Vztah rizikových faktorů ischemických mozkových příhod k anamnestickému onemocnění, SPECT mozku a CVRC bylo dalším bodem našeho zájmu. Hodnoty byly statisticky zpracovány pomocí chí--kvadrát testu a zkoumaly hypotézu nezávislosti mezi pohlavím, nadváhou a obezitou, kouřením, hyperlipoproteinemií, hypertenzí, cukrovkou a anamnestickým onemocněním, výsledkem klidového SPECT mozku, výsledkem cerebrovaskulární rezervní kapacity. Z výsledků plyne, že na hladině významnosti 0,05 nelze zamítnout nezávislost pro téměř všechny testy. Výjimku tvoří prokázaná závislost mezi výsledkem CVRC a kouřením (p = 0,05) a volnější závislost mezi výsledkem CVRC a hypertenzí (p = 0,064).
Z pozvaných 15 pacientů se ke kontrolnímu SPECT mozku dostavilo celkem 14 pacientů. Dva pacienti nereagovali na výzvu. Tři pacienty jsme nezvali – dva měli spojku neprůchodnou, jeden prodělal intracerebrální krvácení. Při vizuálním hodnocení u osmi pacientů došlo k mírnému zlepšení, šest pacientů mělo nález beze změny. Při použití chí-kvadrát testu však nebyla prokázána závislost mezi klinickým pooperačním efektem a výsledkem pooperačního SPECT mozku (p = 0,1026). Vhodnější je provedení zátěžového pooperačního testu a zhodnocení, zda došlo k úpravě CVRC.
Ve srovnání s jinými pracovišti České republiky jsou shromážděná data podobná. Na Neurochirurgické klinice pražské Nemocnici Na Homolce za posledních šest let odoperovali celkem 24 pacientů, průchodnost bypassu byla 100 %. U 12 pacientů, tj. v 50 %, registrovali zlepšení klinického stavu [16]. V Hradci Králové za posledních šest let odoperovali celkem 20 pacientů, průchodnost bypassu byla taktéž 100 %. Jejich pooperační komplikace zahrnovaly jedno úmrtí na infarkt myokardu a krvácení do bazálních ganglií [17]. V Českých Budějovicích v minulých osmi letech odoperovali celkem 75 pacientů, z toho 57 pacientů bylo symptomatických. V klinickém obraze převažovala TIA či CMP s malým reziduálním deficitem či amaurosis fugax. V jednom případě došlo k pooperačnímu uzávěru bypassu. Celkem u 50 % došlo ke zlepšení neurologického nálezu [18]. Podobně jako na našem pracovišti v rámci předoperačního vyšetření procházeli pacienti řadou vyšetření včetně stanovení CVRC metodami TCD, perfuzního CT či MR, zátěžovým SPECT mozku.
V Ústí nad Labem v letech 2005–2006 bylo provedeno 18 EC-IC bypassů. Základní metoda vyšetření CVRC bylo dopplerometrické vyšetření střední mozkové arterie. Vazomotorickou zátěží byla směs 7,5 % CO2 a 92,5 % O2. Korelující vyšetřovací metoda bylo perfuzní CT. Perioperační a významná mortalita byla nulová. Průchodnost bypassů potvrzená digitální subtrakční angiografií činila 100 %, pouze v jednom případě došlo ke spontánní asymptomatické obliteraci bypassu [19].
Od roku 2003, kdy se započalo s revaskularizačními mozkovými zákroky ve FN Ostrava, množství operačních výkonů klesá z důvodu větší prooperovanosti spádové oblasti, uvážlivější indikace a snaze minimalizovat komplikace. K revaskularizačním operacím nejsou vhodní pacienti s těžkým a fixovaným neurologickým deficitem a rozsáhlým ischemickým postižením patrným na CT či MR.
Závěr
CVRC jsme vyšetřili celkem u 64 pacientů. Základem posouzení CVRC bylo vizuální srovnání 99mTc-ECD SPECT řezů mozkem za klidových podmínek a při hyperkapnii. Patologicky změněnou CVRC vykazovala více než polovina vyšetřených, z toho u 21 pacientů (33 % z celkového počtu vyšetřených osob) byla CVRC hodnocena jako „snížená“ a u 12 pacientů (19 %) jako „výrazně snížená“. Neurochirurgický bypassový zákrok byl na základě indikační rozvahy vycházející i z posouzení CVRC proveden u 19 pacientů. Pooperačně došlo ke zlepšení neurologického nálezu u osmi z 11 pacientů, kteří předoperačně vykazovali klinické projevy okluzivního cerebrálního postižení. Sedm pacientů mělo normální předoperační neurologický nález a operace u nich měla význam sekundárně preventivní.
Kritériem pro hodnocení uvedeného sekundárně preventivního efektu neurochirurgického bypassového zákroku provedeného na základě komplexní rozvahy vycházející i z posouzení CVRC byl výskyt recidiv CMP či TIA za 54 ± 19 měsíců po operaci. Osmnáct operovaných a poté dostatečně dlouho sledovaných pacientů nemělo v uvedeném období žádnou cévní mozkovou příhodu.
Skupina 14 pacientů s patologickým výsledkem CVRC léčená konzervativně byla sledována 58 ± 20 měsíců od zjištění patologického výsledku CVRC. U jednoho pacienta se vyskytla ipsilaterální cévní mozková příhoda, u jednoho ipsilaterální tranzitorní ischemická ataka, dva pacienti z důvodu CMP zemřeli.
Při statistickém porovnání nevýskytu CMP/TIA u dvou skupin pacientů s patologickým výsledkem CVRC léčených chirurgicky a konzervativně byl použit Mantelův-Haenszelův test přežití, z jehož výsledku plyne, že nevýskyt CMP/TIA se statisticky liší na hladině významnosti 0,15. Pokud bychom nebrali v úvahu operační komplikaci s intracerebrálním krvácením u jednoho pacienta, pak se liší na hladině významnosti 0,057.
Na základě klinického sledování pacientů jsme zjistili, že revaskularizační operace provedená na základě průkazu redukce CVRC vede u významného počtu pacientů ke zlepšení jejich klinického stavu, a má tedy kurativní efekt.
Uvedené výsledky ukazují, že vyšetření CVRC pomocí SPECT mozku a hyperkapnie je významný přínos pro pacienty s okluzivním cerebrálním postižením. Optimalizace výběru pacientů k operačnímu výkonu vede ke zlepšení klinického stavu u významné části pacientů, kteří v době před operačním výkonem vykazovali neurologickou symptomatologii, a obecně minimalizuje výskyt recidiv ischemických mozkových příhod u pacientů s předoperačně sníženou či výrazně sníženou CVRC.
Vyšetření CVRC pomocí SPECT mozku a hyperkapnie je jednoduchá metoda, která účinně pomáhá při výběru pacientů s okluzivním cerebrovaskulárním onemocněním k neurochirurgickému bypassovému zákroku.
MUDr.
Pavel Širůček
Klinika
nukleární medicíny
Fakultní
nemocnice Ostrava
17.
listopadu 1790
708
52 Ostrava-Poruba
e-mail:
pavel.sirucek@fnspo.cz
Přijato
k recenzi: 22. 9. 2010
Přijato
do tisku: 22. 12. 2010
Zdroje
1. Engelhardt M, Pfadenhauer K, Zentner J, Grimmer S, Wachenfeld-Wahl C, Heidenreich P et al. Impaired cerebral autoregulations in asymptomatic patients with carotid artery stenosis: comparison of acetazolamide-SPECT and transcranial CO2 dopplersonography. Zentralbl Chir 2004; 129(3): 178–182.
2. Choksi V, Hughes M, Selwa L, Hoeffner E. Transient neurologic deficit after acetazolamid challenge for computed tomography perfusion imaging. J Comput Assist Tomogr 2005; 29(2): 278–280.
3. Imaizumi T, Hayashi K, Saito K, Osawa M, Fukuyama Y. Long term outcomes of pediatric moyamoya disease monitored to adulthood. Pediatr Neurol 1998; 18(4): 321–325.
4. Klijn CJ, Kappelle LJ, Tulleken CA, van Gijn J. Symptomatic carotid artery occlusion. A reappraisal of hemodynamic factors. Stroke 1997; 28(10):1857–1860
5. Yamada I, Murata Y, Umehara I, Suzuki S, Matsushima Y. SPECT and MRI evaluations of the posterior circulation in moyamoya disease. J Nucl Med 1996; 37(10): 1613–1617.
6. Sameš M, Zolal A, Radovnický T, Vachata P, Bartoš R, Derner M. Použití metod magnetické rezonance pro posouzení cerebrovaskulární rezervní kapacity, Cesk Slov Neurol N 2009; 72/105(4): 323–330.
7. Beneš V. Ischémie mozku: chirurgická a endovaskulární terapie. 1st ed. Praha: Galén 2003.
8. Sameš M. Neurochirurgie: učebnice pro lékařské fakulty a postgraduální studium příbuzných oborů. Praha: Maxdorf 2005.
9. Kuroda S, Kamivama H, Abe H, Houkin K, Isobe M,Misumori K. Acetazolamide test in detecting reduced cerebral perfusion reserve and predicting long--term prognosis in patients with internal carotid artery occlusion. Neurosurgery 1993; 32(6): 912–918.
10. Mohapl M, Svobodová J, Beneš V. Vyšetřování cerebrovaskulární rezervní kapacity. Cesk Slov Neurol N 2004; 67/100(1): 12–15.
11. Ringelstein EB, Van Eyck S, Mertens I. Evaluation of cerebral vasomotor reactivity by various vasodilating stimuli: comparison of CO2 to acetazolamide. J Cereb Blood Flow Metab 1992; 12 (1): 162–168.
12. Krahulík D, Vaverka M, Hrabálek L, Hezig R, Kocher M, Houdek M. Extra-intrakraniální anastomóza: algoritmus vyšetření, technika operace a soubor pacientů za posledních 5 let. Cesk Slov Neurol N 2008; 71/104 (Suppl): 69.
13. Sameš M, Radovnický T, Zolal A, Nováková M, Derner M, Vachata P et al, Změny na perfuzní počítačové tomografii po konvenčním extra-intrakraniálním bypassu. Cesk Slov Neurol N 2010; 73/106(3): 267–273.
14. Nevšímalová S, Růžička E, Tichý J. Neurologie. 1st ed. Praha: Galén 2002.
15. Kleiser B, Widder B. Course of carotid artery occlusions with impaired cerebrovascular reactivity. Stroke 1992; 23(2): 171–174.
16. Šroubek J, Adamková Š, Kovář M. EC/IC anastomóza a chronická hypoperfuze CNS při okluzi vnitřní krkavice. Cesk Slov Neurol N 2008; 71/104 (Suppl): 68.
17. Kanta M, Náhlovský J, Habalová V, Hobza V, Řehák S,Adamkov J. Naše zkušenosti s nízkoprůtokovými EC-IC anastomózami. Cesk Slov Neurol N 2008; 71/104 (Suppl): 69.
18. Fiedler J, Přibáň V, Chlouba V, Schenk I, Škoda O. Konvenční mozkový bypass v indikaci chronického uzávěru vnitřní karotidy: naše zkušenosti u 57 pacientů. Cesk Slov Neurol N 2008; 71/104 (Suppl): 69–70.
19. Sameš M, Bartoš R, Vachata P, Zolal A, Cihlář F, Derner M et al. Hodnocení cerebrovaskulární rezervní kapacity po EC-IC bypassu pomocí TCD. Cesk Slov Neurol N 2009; 72/105(4): 359–363.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2011 Číslo 3
Nejčtenější v tomto čísle
- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření