Po užití metod magnetické rezonance pro poso uzení cerebrovaskulární rezervní kapacity
The Use of Magnetic Resonance for Assessing Cerebrovascular Reserve Capacity
The evalu ati on of cerebrovascular reserve capacity (CVRC) is the basic preconditi on required for EC‑IC bypass indicati on in pati ents with occlusive internal carotid dise ase. In additi on to the alre ady well described and established methods (PET, TCD, perfusi on CT and XeCT), in the last ye ars, a new interest in evalu ati on with the use of MRI methods has emerged. The MRI provides informati on on perfusi on in the whole volume of the brain and it does not expose pati ents to i onizing radi ati on. More over, with the use of some techniques, the examinati on can be performed witho ut the use of exogeno us contrast agent. In this revi ew, we summarize the possibiliti es of CVRC examinati on with the use of magnetic resonance methods, namely the dynamic susceptibility contrast, arteri al spin labeling and BOLD effect. The work presents the advantages and the disadvantages for e ach of these methods, provides the overvi ew of the currently available literary so urces and on their basis, the possible findings are summarized and the interpretati on is proposed.
Key words:
magnetic resonance imaging – perfusion – cerebrovascular reserve capacity – carotid artery occlusion – EC-IC bypass
Autoři:
M. Sameš 1; A. Zolal 1; T. Radovnický 1; P. Vachata 1; R. Bartoš 1; M. Derner 2
Působiště autorů:
Neurochirurgická klinika, UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z., 2Radiodiagnostické oddělení, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
1
Vyšlo v časopise:
Cesk Slov Neurol N 2009; 72/105(4): 323-330
Kategorie:
Přehledný referát
Souhrn
Vyšetření cerebrovaskulární rezervní kapacity (CVRC) je základním předpokladem indikace EC‑IC bypassu u paci entů s okluzivní nemocí vnitřních karotid. Kromě již dobře popsaných a zavedených metod (PET, TCD, perfuzní CT a XeCT) se v posledních letech dostává do popředí zájmu také vyšetření pomocí magnetické rezonance (MR), tedy vyšetření poskytující informace o perfuzi v celém objemu mozkové tkáně a zároveň nevystavující paci enta radi ační zátěži, za po užití určitých metod proveditelné dokonce bez aplikace exogenní kontrastní látky. V tomto přehledném referátu shrnujeme možnosti vyšetření CVRC pomocí metod MR, tedy vyšetření pomocí metod dynamic susceptibility contrast, arteri al spin labeling a pomocí metody založené na hodnocení tzv. BOLD (Blo od Oxygen Level Dependent) efektu. Pro každo u metodu práce předkládá její výhody a nevýhody, přináší přehled dostupných literárních údajů a na jejich základě shrnuje možné nálezy a navrhuje jejich interpretaci.
Klíčová slova:
magnetická rezonance – perfuze – cerebrovaskulární rezervní kapacita – okluze karotidy – EC-IC bypass
Úvod
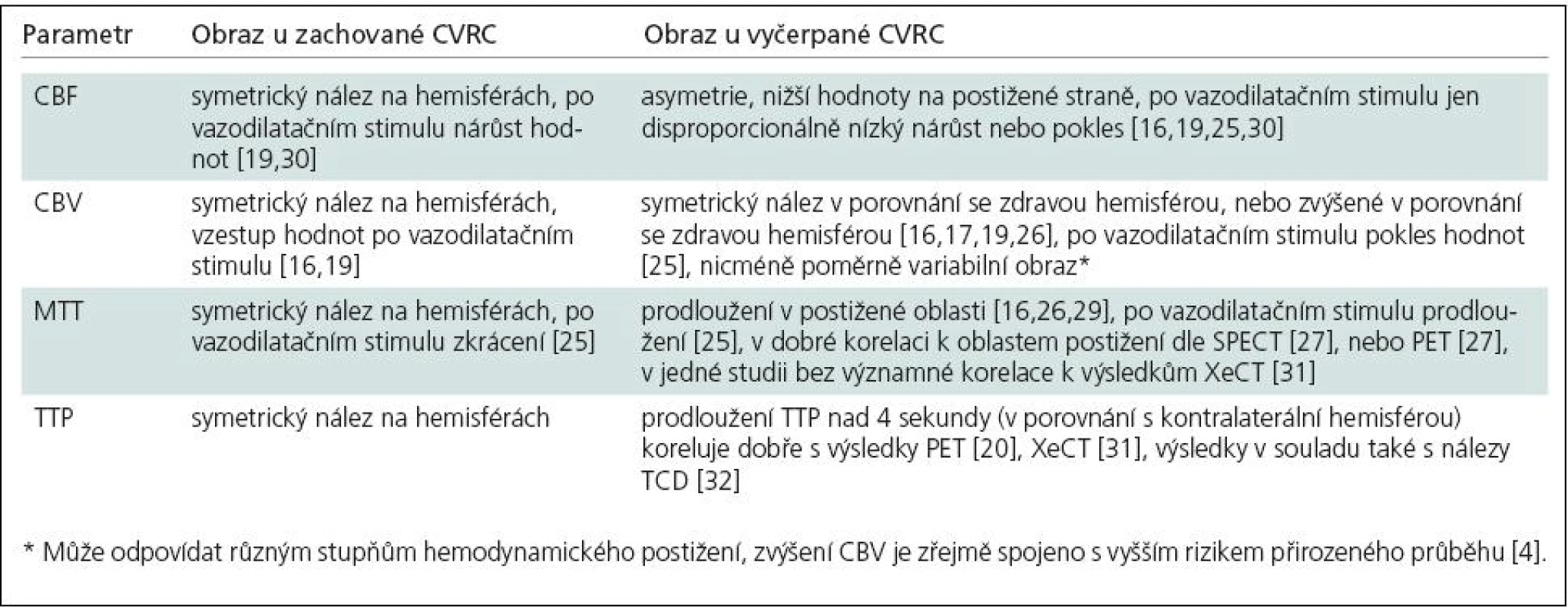
Vyšetření cerebrovaskulární rezervní kapacity (CVRC, Cerebrovascular Reserve Capacity) u pacientů postižených okluzí vnitřní karotidy je základním předpokladem indikace EC‑IC bypassu. Podle dostupných literárních údajů je riziko přirozeného průběhu u pacientů se symptomatickou okluzí karotidy (společné nebo vnitřní) s hemodynamickým selháním II. stupně [1] definovaným zvýšením extrakční frakce kyslíku (OEF, Oxygen Extraction Fraction) v postižené mozkové tkáni poměrně vysoké. Výskyt jakéhokoli iktu byl dle Grubba et al [2] u sledovaných pacientů s hemodynamickým selháním II. stupně (n = 39) 13,2 % během prvního roku a 29,2 % během dvou let sledování, pro ipsilaterální iktus byl pak zjištěn výskyt 10,6 % během prvního roku a 26,5 % během dvou let. Tato studie také prokázala signifikantně vyšší riziko u pacientů se zvýšenou OEF v postižené mozkové tkáni v porovnání se skupinou s normální OEF. Další studie, zabývající se detekcí poruchy CVRC pomocí TCD [3], potvrdila vysoké riziko (32 % během průměrných 38 měsíců sledování) i u pacientů s vyčerpáním CVRC zjištěným touto metodou.
Novější studie naznačují, že dalším parametrem poukazujícím na vysoké riziko iktu je zvýšení objemu krve v mozkové tkáni (CBV, Cerebral Blood Volume) [4]. Zvýšení CBV může dle autorů zmiňované studie odrážet krajní trvalou vazodilataci v postižené tkáni jako výraz vyčerpání autoregulační vazodilatační schopnosti. Pacienti se zvýšenou OEF a normálním CBV byli dle tohoto zdroje vystaveni nižšímu riziku iktu než pacienti se zvýšenou OEF i CBV. Vyplývající hypotézou je tedy možnost, že zachování normálního objemu krve ve tkáni odráží ještě nevyčerpanou autoregulační kapacitu. Autoři také shrnují a potvrzují závěry starších studií [5], které popisují mírný vzestup OEF ještě během stupně Ihemodynamického selhání v závislosti na mírném poklesu krevního průtoku (CBF, Cerebral Blood Flow).
U pacientů s asymptomatickou okluzí karotidy je riziko iktu pravděpodobně značně nižší, zároveň je u této populace pacientů i nižší výskyt zvýšení OEF [6]. Nižší výskyt závažného hemodynamického postižení tedy podmiňuje jak primární asymptomatičnost, tak benigní průběh. Jiná, starší studie [7] ovšem popisuje poměrně vysoký výskyt iktů u asymptomatické okluze karotidy. Skutečné riziko přirozeného průběhu je tedy u asymptomatické okluze karotidy poměrně nejasné, což je dáno zejména faktem, že prevalence asymptomatické okluze karotidy je neznámá.
Hemodynamické selhání II. stupně s projevy reflexní vazodilatační reakce jsou tudíž významným prognostickým faktorem předpovídajícím riziko vaskulární příhody, nezávisle na použité vyšetřovací metodě [2,8,9]. U pacientů, u kterých dostupné metody prokázaly hemodynamické postižení mozkové cirkulace, tedy volíme jako přímou revaskularizační metodu provedení EC‑IC bypassu [10], pokud nejsou indikovány metody nepřímé. Jako nepřímou metodu revaskularizace volíme při hemodynamicky významné stenóze kontralaterální vnitřní karotidy její endarterektomii nebo angioplastiku. Při prokázané kolateralizaci z povodí vnější karotidy nebo vertebrální arterie jsou pak v případě jejich stenózy indikovány zákroky na těchto tepnách [11].
EC‑IC bypass jako přímá revaskularizační procedura je některými nadále považován za kontroverzní v důsledku různých interpretací výsledků studie EC/IC Bypass Trial [12]. Kritickým momentem při posuzování výsledků této studie je fakt, že v době jejího provedení nebyly k dispozici metody, které by v populaci pacientů s okluzí vnitřní karotidy identifikovaly podskupinu s hemodynamickým deficitem. Probíhající studie Carotid Occlusion Surgery Study [13], při které je k posouzení CVRC použita metoda PET s přímým stanovením OEF, by měla na otázku indikace EC/IC bypassu odpovědět.
V současné době existuje množství technik umožňujících posouzení CVRC u pacientů s okluzí vnitřní karotidy. Vždy zde jde o nepřímé určení nedostatečnosti perfuze – sledovány jsou hemodynamické parametry (průtok oblastí, objem krve přítomné ve tkáni, čas průtoku), nikoli dostatečnost zásobení tkání kyslíkem. Jedinou výjimkou je metoda 15O2 PET, umožňující stanovení OEF v zobrazené tkáni. Mezi základní vyšetřovací metody patří transkraniální duplexní sonografie, dále je možné použít metody nukleární medicíny (PET, SPECT) a metody CT (XeCT, perfuzní CT včetně zátěžových fází). Jako velmi slibné pro použití v budoucnosti se jeví metody magnetické rezonance (MR), tedy vyšetření bez vystavení pacienta ionizujícímu záření, umožňující navíc vyšetření mozku v celém rozsahu s individuálním posouzením perfuzních parametrů jednotlivých tkáňových okrsků. Běžně používaná je metoda dynamického kontrastu susceptibility (v tomto kontextu je míněna ztráta MR signálu, způsobená pasáží bolusu paramagnetické kontrastní látky sledovanou tkání), založená na použití exogenního kontrastního materiálu podaného do krevního řečiště. Dalšími popisovanými metodami používanými pro vyšetření CVRC jsou techniky Arterial Spin Labeling (ASL) a techniky založené na BOLD efektu, využívající ke zjištění hemodynamických parametrů endogenních zejména intravaskulárních kontrastů.
Jednotlivé MR metody, u nichž bylo relevantně dokumentováno použití pro vyšetření CVRC u chronických okluzí magistrálních tepen předního povodí, shrnuje tab. 1.
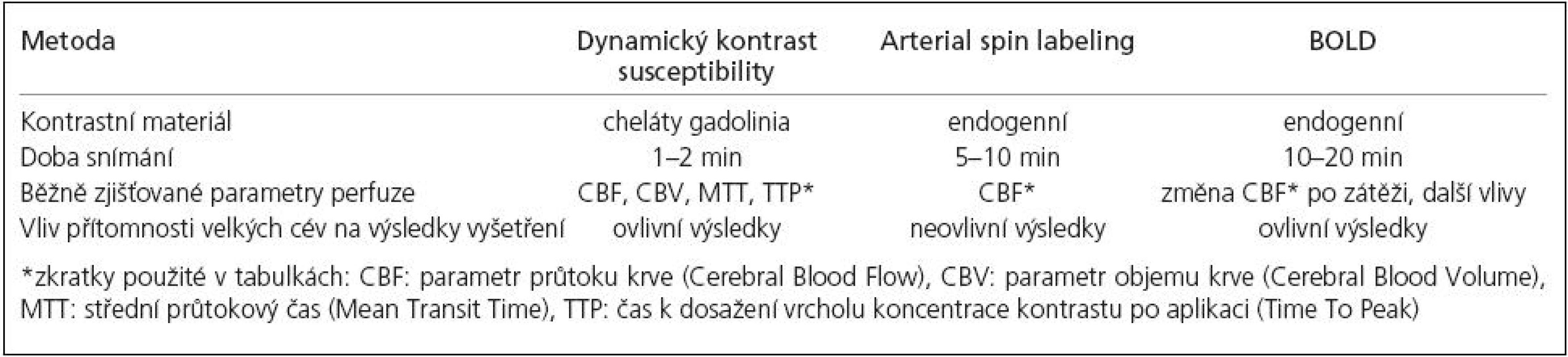
Dynamic Susceptibility Contrast
Metoda posouzení perfuze mozku pomocí dynamického kontrastu susceptibility (DSC) je založena na měření snížení T2 nebo T2* při spin‑echo, resp. gradient-echo sekvenci během prvního průtoku endovaskulárně podaného bolusu kontrastní látky kapilárním řečištěm [14]. Používanou kontrastní látkou jsou běžné cheláty gadolinia. Předpokladem dynamického zobrazení je dostatečné časové rozlišení použité sekvence. Pomocí komerčně dostupného softwaru dodávaného často již výrobcem MR přístroje je možné zjištění různých parametrů na základě vývoje hodnot čas-intenzita a tyto parametry mohou být zobrazeny v jednotlivých voxelech daného skenu pomocí barevné škály. Vyšetření bylo v některých publikacích použito i pro kvantitativní hodnocení perfuze, nicméně studie zkoumající vztah takto získaných údajů k parametrům obdrženým pomocí PET sice potvrdila lineární korelaci těchto dvou metod v rámci vyšetření u jednotlivých pacientů, při porovnání výsledků pacientů mezi sebou ale výsledky kvantitativního určení CBF nekorelovaly [15]. Tato diskrepance je dána mnoha faktory, které ovlivňují pasáž bolusu kontrastní látky cévním řečištěm – ať už jde o množství a rychlost podání kontrastní látky nebo o individuální hemodynamické parametry u daného vyšetřovaného subjektu. Jako semikvantitativní údaj může ale sloužit porovnání dvou ROI (Region Of Interest, oblast zájmu), kdy je jedno ROI umístěno v hemisféře na straně uzavřené karotidy, druhé pak na straně druhé a parametry zjištěné v daných ROI se vzájemně porovnávají. Tab. 2 shrnuje dostupnou literaturu popisující použití DSC-MR k posouzení CVRC.
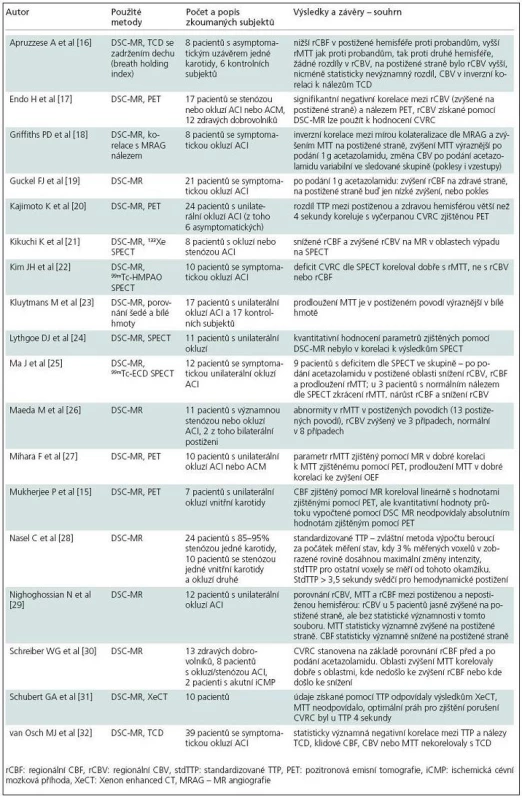
Jak je patrno ze souhrnů výsledků a interpretací dostupné literatury, pro posouzení CVRC jsou v praxi často používány různé parametry, rovněž metodika vyšetření se liší co do použití hemodynamické zátěže ať už ve formě vyvolání hyperkapnie, nebo podání acetazolamidu. Studie porovnávající DSC-MR s jinými metodami potvrzují poměrně dobře spolehlivost metody při pečlivé volbě postupu a hodnocených parametrů. V dobré korelaci k parametru OEF zjišťovanému pomocí PET se dle výše uvedených studií zdají být zejména parametry CBF, MTT (Mean Transit Time) a TTP (Time To Peak); výsledky použití CBV pro určení CVRC se ve zde shrnutých publikacích liší. Studie publikovaná v nedávné době [31] však nenašla dobrou korelaci mezi MTT a CVRC detekovanou pomocí XeCT, popisuje nicméně dobrou korelaci k parametru TTP, s porušením CVRC v oblastech zvýšení relativního TTP nad 4 s. Podobné použití parametru TTP používá i Nasel [28], který hemodynamické postižení popisuje u prodloužení TTP nad 3,5 s od okamžiku, kdy 3 % z voxelů v dané rovině dosáhla špičkové hodnoty intenzity. Jinou metodou použitou v další výše uvedené studii [20] je odečtení TTP zdravé hemisféry od postižené – zde oblasti s relativním prodloužením TTP nad 4 s korelovaly s oblastmi zvýšené OEF dle PET.
Vzhledem k malému počtu pacientů popisovaných ve výše uvedených publikacích a k rozdílům v hodnocených parametrech i metodice jejich porovnání nelze z dostupné literatury vyvodit zcela jednoznačné závěry a téma vyžaduje podrobnější zpracování a porovnání s dalšími vyšetřovacími metodami. Se zřetelem k výše uvedeným faktům – závislosti výsledků na mnoha hemodynamických i technických vlivech a neprokázané korelaci kvantitativních výsledků s kvantitativními výsledky metod PET – je vhodnější semikvantitativní hodnocení získaných hodnot, tedy porovnání se zdravou oblastí u vyšetřovaného pacienta, spíše než kvantitativní hodnocení porovnáním výsledků s tabulkou normálních fyziologických hodnot. Dostupné poznatky jsou shrnuty v tab. 3.
Arterial Spin Labeling
Tato poměrně nová metoda spočívá na magnetickém značení protonové masy přitékající v tepnách do mozkové tkáně. Ve značící rovině proximálně od vyšetřovaného okrsku tkáně se protékající voda magneticky označí, ve vlastní tkáni je pak detekovatelná malá změna MR signálu, obecně v řádu cca 1 % ze základní hodnoty zjištěné kontrolním skenem v dané rovině bez značení. Snímky vyšetřované tkáně získané při značení a bez značení vodních molekul přitékajících do tkáně se pak digitálně subtrahují, z výsledných obrazů je poté možné usuzovat na objem přitékající vody [33,34]. Existují různé techniky značení a detekce značených molekul (pulzní, kontinuální), jejich popis však není pro naše účely přínosný. Výhodou metody je možnost detekce mozkového průtoku v celém objemu mozku nebo ve vybraných povodích a použití endogenního kontrastního materiálu. Jedinými kontraindikacemi vyšetření jsou obecné kontraindikace MR. Nevýhodou zůstávají doposud malé zkušenosti s metodou. Z principu metody vyplývá parametr zjistitelný touto metodou – regionální průtok krve mozkovou tkání, CBF – oblasti s vyčerpanou CVRC by tedy měly vykazovat obleněnou nebo žádnou reakci na vazodilatační stimul. Metoda Arterial Spin Labeling (ASL) má podle dostupných zpráv poměrně dobrou opakovatelnost [35], pomocí různých matematických modelů je z výsledků možné dovozovat i kvantitativní hodnoty krevního průtoku šedou hmotou, u bílé hmoty jsou však hodnoty zjištěné touto metodou podhodnoceny [34].
Zprávy o použití této metody k vyšetření CVRC u chronických uzávěrů karotid jsou vzácné, metoda ASL byla přesto použita jako referenční metoda k zjištění reaktivity CBF na vazodilatační stimul i v článcích popisujících metody založené na BOLD efektu popsané v další sekci. Zajímavou možností je samozřejmě i popisované vyšetření perfuze jednotlivých povodí selektivním značením krve protékající jednotlivými arteriemi v porovnání s anatomickým nálezem [36]. Tato možnost nezávislého vyšetření jednotlivých povodí a schopnost kvantifikovat CBF a jeho změny budou v budoucnosti jistě předmětem dalšího výzkumu, a v kombinaci s dalšími metodami se proto ASL jeví jako informačně velmi výnosná metoda. Přehled relevantní literatury je uveden v tab. 4.

Techniky založené na BOLD efektu
Techniky založené na změně kontrastu vyšetřované tkáně v závislosti na oxygenaci krve (BOLD, Blood Oxygen Level Dependent) [40] se nejčastěji používají k vyšetření regionálních změn perfuze způsobených lokální aktivací mozkové tkáně při vyšetření funkční magnetickou rezonancí (fMR). Z hlediska vyšetření vlastní perfuze jako takové je tato technika literárně popsána v menším rozsahu. Některé články zabývající se tímto tématem popisují změny hemodynamické odpovědi u pacientů se stenózou magistrálních tepen přední cirkulace při klasickém vyšetřovacím paradigmatu fMR [41,42]. Většina autorů popisujících použití BOLD efektu ke stanovení CVRC ale využívá globálních změn perfuze po vazodilatačním stimulu při elevaci pCO2 nebo po podání acetazolamidu v porovnání s klidovým stavem. Rozpaky při interpretaci získaných dat jsou dány zejména faktem, že fyziologickým podkladem pozorovaných změn nejenom jsou změny krevního průtoku (CBF), ale v neznámé míře dochází k ovlivnění výsledků dalšími faktory, včetně parciálního tlaku kyslíku v krvi, hematokritu a objemu krve ve vyšetřované tkáni [40]. Dalším sporným momentem je vztah reaktivity na vazodilatační stimul ke klinickému průběhu a možný rozdíl mezi fyziologickou odpovědí na dva nejčastěji používané druhy stimulů [43]. Souhrn relevantní literatury je uveden v tab. 5.
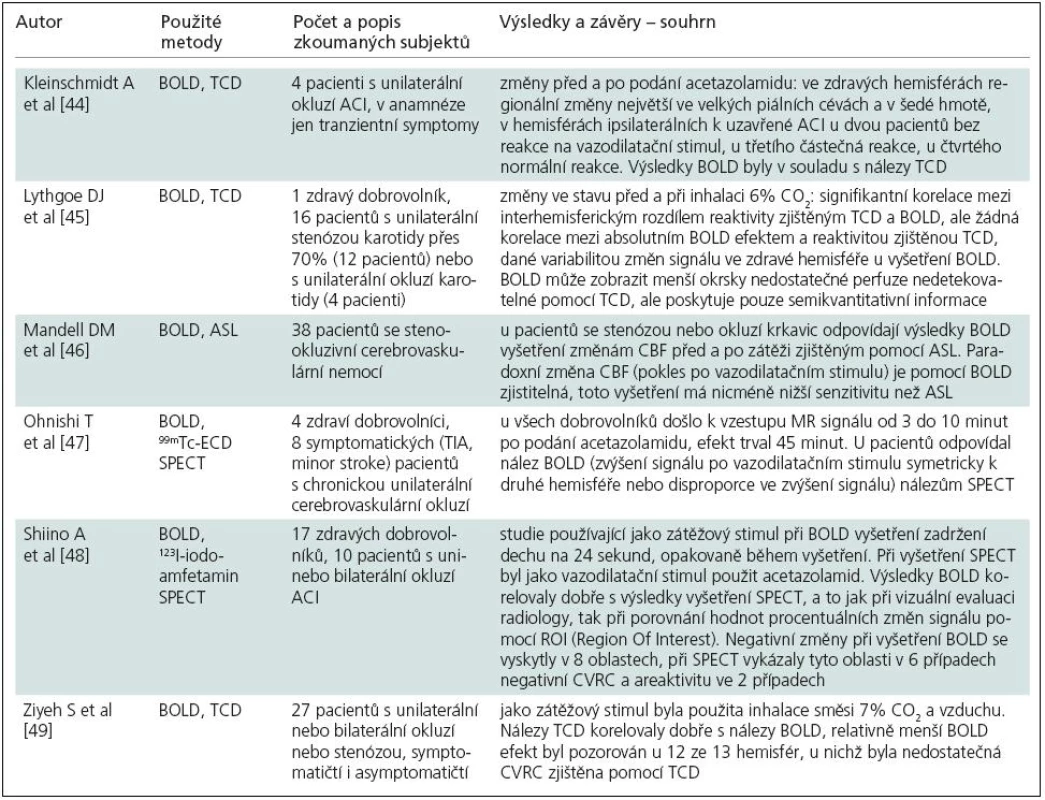
Veškerá dostupná literatura se shoduje na tom, že změny T2* kontrastu při zátěžovém vyšetření hrubě odpovídají změnám CBF, ovšem nikoli lineárně [48]. Jsou do jisté, zatím neurčené míry ovlivněny dalšími faktory – CBV, hematokritem i anatomií mikrovaskulárního řečiště. V hustotě mikrovaskulárního řečiště je zřejmě možné hledat také důvod významného rozdílu velikosti BOLD efektu mezi bílou a šedou hmotou popisovaného ve všech výše zmíněných článcích i ve studiích popisujících fyziologický stav u zdravých dobrovolníků [50]. BOLD efekt je také mnohem výraznější v blízkosti povrchu mozkové kůry a v subarachnoidálním prostoru, což je způsobeno změnami oxygenace krve v kortikálních žilách [51].
Pozornost je třeba věnovat také fyziologickému významu výskytu tzv. paradoxních změn – tedy regionálnímu poklesu T2* signálu po vazodilatačním stimulu. V recentním článku autorů Mandell et al [46] odpovídaly paradoxní změny T2* signálu po zátěži poměrně dobře paradoxním změnám CBF zjištěným pomocí ASL. Shiino et al nalezli paradoxní změny T2* signálu v osmi případech, výsledky byly s referenčním vyšetřením (v tomto případě SPECT) rovněž srovnatelné. Tyto paradoxní změny T2* signálu tedy mohou odpovídat výskytu tzv. steal fenoménu, jenž podle některých zdrojů koreluje se zvýšenou extrakcí kyslíku [52] a může znamenat zvýšené riziko iktu [53]. Přesnou informaci, zda regionální paradoxní změny T2* intenzity pozorované při BOLD vyšetření korelují s regionální elevací OEF, by ovšem přinesla pouze studie porovnávající přímo tyto dvě metody. Existují nicméně nové studie popisující složitější metody zpracování dat získaných použitím BOLD efektu, pomocí kterých je teoreticky možno zjistit extrakční frakci kyslíku přímo [54,55]. Metoda popsaná autory Kavecem et al v roce 2004 [56] kombinující použití BOLD efektu a DSC-MR pro výpočet OEF nebyla dobře přijata (pouze tři citace v databázi Scopus, z toho jeden článek kritizující použitou metodologii [57]).
Závěr
Z výše uvedených literárních údajů lze shrnout, že magnetická rezonance představuje neinvazivní, radiační zátěži nevystavující modalitu vyšetření CVRC, která je již dnes dostatečně literárně popsána, a může tedy být použita v korelaci s dalšími metodami i pro rutinní vyšetřování nemocných s okluzí vnitřní karotidy před eventuální indikací EC‑IC bypassu. Slibnou se do budoucna jeví zejména možnost exaktního vyšetření změn krevního průtoku mozkovým řečištěm pomocí ASL, detekce patologického steal efektu v rozsahu celého objemu mozkové tkáně a eventuálně i recentně popsané možnosti zjištění OEF v zobrazené tkáni.
Podpořeno grantem IGA MZČR NR 8849-4/2006
doc. MUDr. Martin Sameš, CSc.
Neurochirurgická klinika
Masarykova nemocnice
Sociální péče 12A
401 13 Ústí nad Labem-Bukov
e-mail: martin.sames@mnul.cz
Zdroje
1. Powers WJ, Press GA, Grubb RL jr, Gado M, Raichle ME. The effect of hemodynamically significant carotid artery dise ase on the hemodynamic status of the cerebral circulati on. Ann Intern Med 1987; 106(1): 27– 34.
2. Grubb RL jr, Derdeyn CP, Fritsch SM, Carpenter DA, Yundt KD, Videen TO et al. Importance of hemodynamic factors in the prognosis of symptomatic carotid occlusi on. JAMA 1998; 280(12): 1055– 1060.
3. Kleiser B, Widder B. Co urse of carotid artery occlusi ons with impaired cerebrovascular re activity. Stroke 1992; 23(2): 171– 174.
4. Derdeyn CP, Videen TO, Yundt KD, Fritsch SM, Carpenter DA, Grubb RL et al. Vari ability of cerebral blo od volume and oxygen extracti on: stages of cerebral haemodynamic impairment revisited. Brain 2002; 125(3): 595– 607.
5. Schumann P, To uzani O, Yo ung AR, Morello R, Baron JC, MacKenzi e ET. Evalu ati on of the rati o of cerebral blo od flow to cerebral blo od volume as an index of local cerebral perfusi on pressure. Brain 1998; 121(7): 1369– 1379.
6. Powers WJ, Derdeyn CP, Fritsch SM, Carpenter DA, Yundt KD, Videen TO et al. Benign prognosis of never- symptomatic carotid occlusi on. Ne urology 2000; 54(4): 878– 882.
7. Hennerici M, Hülsbömer HB, Ra utenberg W, Hefter H.Spontane o us history of asymptomatic internal carotid occlusi on. Stroke 1986; 17(4): 718– 722.
8. Verni eri F, Pasqu aletti P, Passarelli F, Rossini PM, Silvestrini M. Outcome of carotid artery occlusi on is predicted by cerebrovascular re activity. Stroke 1999; 30(3): 593– 598.
9. Ogasawara K, Ogawa A, Yoshimoto T. Cerebrovascular re activity to acetazolamide and o utcome in pati ents with symptomatic internal carotid or middle cerebral artery occlusi on: a xenon‑133 single‑photon emissi on computed tomography study. Stroke 2002; 33(7): 1857– 1862.
10. Schmi edek P, Pi epgras A, Leinsinger G, Kirsch CM, Einhüpl K. Improvement of cerebrovascular reserve capacity by EC‑IC arteri al bypass surgery in pati ents with ICA occlusi on and hemodynamic cerebral ischemi a. J Ne urosurg 1994; 81(2): 236– 244.
11. Derdeyn CP, Grubb RL jr, Powers WJ. Indicati ons for cerebral revascularizati on for pati ents with atherosclerotic carotid occlusi on. Skull Base 2005; 15(1): 7– 14.
12. Failure of extracrani al- intracrani al arteri al bypass to reduce the risk of ischemic stroke. Results of an internati onal randomized tri al. The EC/ IC Bypass Study Gro up. N Engl J Med 1985; 313(19): 1191– 1200.
13. Grubb RL jr, Powers WJ, Derdeyn CP, Adams HP jr,Clarke WR. The Carotid Occlusi on Surgery Study. Ne urosurg Focus 2003; 14(3): e9.
14. Rosen BR, Bellive a u JW, Veve a JM, Brady TJ. Perfusi on imaging with NMR contrast agents. Magn Reson Med 1990; 14(2): 249– 265.
15. Mukherjee P, Kang HC, Videen TO, McKinstry RC, Powers WJ, Derdeyn CP. Me asurement of cerebral blo od flow in chronic carotid occlusive dise ase: comparison of dynamic susceptibility contrast perfusi on MR imaging with positron emissi on tomography. AJNR Am J Ne uroradi ol 2003; 24(5): 862– 871.
16. Apruzzese A, Silvestrini M, Floris R, Verni eri F, Bozzao A, Hagberg G et al. Cerebral hemodynamics in asymptomatic pati ents with internal carotid artery occlusi on: a dynamic susceptibility contrast MR and transcrani al Doppler study. AJNR Am J Ne uroradi ol 2001; 22(6): 1062– 1067.
17. Endo H, Ino ue T, Ogasawara K, Fukuda T, Kanbara Y,Ogawa A. Qu antitative assessment of cerebral hemodynamics using perfusi on- weighted MRI in pati ents with major cerebral artery occlusive dise ase: comparison with positron emissi on tomography. Stroke 2006; 37(2): 388– 392.
18. Griffiths PD, Gaines P, Cleveland T, Be ard J, Venables G, Wilkinson ID. Assessment of cerebral haemodynamics and vascular reserve in pati ents with symptomatic carotid artery occlusi on: an integrated MR method. Ne uroradi ology 2005; 47(3): 175– 182.
19. Gückel FJ, Brix G, Schmi edek P, Pi epgras Z, Becker G,Köpke J et al. Cerebrovascular reserve capacity in pati ents with occlusive cerebrovascular dise ase: assessment with dynamic susceptibility contrast- enhanced MR imaging and the acetazolamide stimulati on test. Radi ology 1996; 201(2): 405– 412.
20. Kajimoto K, Moriwaki H, Yamada N, Hayashida K, Kobayashi J, Miyashita K et al. Cerebral hemodynamic evalu ati on using perfusi on- weighted magnetic resonance imaging: comparison with positron emissi on tomography values in chronic occlusive carotid dise ase. Stroke 2003; 34(7): 1662– 1666.
21. Kikuchi K, Murase K, Miki H, Kikuchi T, Sugawara Y,Mochizuki T et al. Me asurement of cerebral hemodynamics with perfusi on- weighted MR imaging: comparison with pre‑ and post‑acetazolamide 133Xe- SPECT in occlusive carotid dise ase. AJNR Am J Ne uroradi ol 2001; 22(2): 248– 254.
22. Kim JH, Lee SJ, Shin T, Kang KH, Cho i PY, Gong JC et al. Correlative assessment of hemodynamic parameters obtained with T2*- weighted perfusi on MR imaging and SPECT in symptomatic carotid artery occlusi on. AJNR Am J Ne uroradi ol 2000; 21(8): 1450– 1456.
23. Kluytmans M, van der Grond J, Folkers PJ, Mali WP, Vi ergever MA. Differenti ati on of gray matter and white matter perfusi on in pati ents with unilateral internal carotid artery occlusi on. J Magn Reson Imaging 1998; 8(4): 767– 774.
24. Lythgoe DJ, Ostergaard L, Willi am SC, Clucki e A, Buxton- Thomas M, Simmons A et al. Qu antitative perfusi on imaging in carotid artery stenosis using dynamic susceptibility contrast- enhanced magnetic resonance imaging. Magn Reson Imaging 2000; 18(1): 1– 11.
25. Ma J, Mehrkens JH, Holtmannspoetter M, Linke R,Schmid- Elsaesser R, Steiger HJ et al. Perfusi on MRI before and after acetazolamide administrati on for assessment of cerebrovascular reserve capacity in pati ents with symptomatic internal carotid artery (ICA) occlusi on: comparison with 99mTc- ECD SPECT. Ne uroradi ology 2007; 49(4): 317– 326.
26. Maeda M, Yuh WT, Ueda T, Maley JE, Crosby DL, Zhu MW et al. Severe occlusive carotid artery dise ase: hemodynamic assessment by MR perfusi on imaging in symptomatic pati ents. AJNR Am J Ne uroradi ol 1999; 20(1): 43– 51.
27. Mihara F, Kuwabara Y, Tanaka A, Yoshi ura T, Sasaki M, Yoshida T et al. Reli ability of me an transit time obtained using perfusi on- weighted MR imaging; comparison with positron emissi on tomography. Magn Reson Imaging 2003; 21(1): 33– 39.
28. Nasel C, Azizi A, Wilfort A, Mallek R, Schindler E. Me asurement of time- to- pe ak parameter by use of a new standardizati on method in pati ents with stenotic or occlusive dise ase of the carotid artery. AJNR Am J Ne uroradi ol 2001; 22(6): 1056– 1061.
29. Nighoghossi an N, Berthezene Y, Philippon B, Adeleine P, Froment JC, Tro uillas P. Hemodynamic parameter assessment with dynamic susceptibility contrast magnetic resonance imaging in unilateral symptomatic internal carotid artery occlusi on. Stroke 1996; 27(3): 474– 479.
30. Schreiber WG, Gückel F, Stritzke P, Schmi edek P, Schwartz A, Brix G. Cerebral blo od flow and cerebrovascular reserve capacity: estimati on by dynamic magnetic resonance imaging. J Cereb Blo od Flow Metab 1998; 18(10): 1143– 1156.
31. Schubert GA, Weinmann C, Seiz M, Gerigk L, Weiss C,Horn P et al. Cerebrovascular insuffici ency as the criteri on for revascularizati on procedures in selected pati ents: a correlati on study of xenon contrast‑enhanced CT and PWI. Ne urosurg Rev 2009; 32(1): 29– 35.
32. van Osch MJ, Rutgers DR, Vonken EP, van Huffelen AC, Klijn CJ, Bakker CJ et al. Qu antitative cerebral perfusi on MRI and CO2 re activity me asurements in pati ents with symptomatic internal carotid artery occlusi on. Ne uro image 2002; 17(1): 469– 478.
33. Golay X, Hendrikse J, Lim TC. Perfusi on imaging using arteri al spin labeling. Top Magn Reson Imaging 2004; 15(1): 10– 27.
34. Wintermark M, Sesay M, Barbi er E, Borbely K, Dillon WP, Eastwo od JD et al. Comparative overvi ew of brain perfusi on imaging techniques. Stroke 2005; 36(9): e83– e99.
35. Parkes LM, Rashid W, Chard DT, Tofts PS. Normal cerebral perfusi on me asurements using arteri al spin labeling: Reproducibility, stability, and age and gender effects. Magn Reson Med 2004; 51(4): 736– 743.
36. Golay X, Hendrikse J, Van Der Grond J. Applicati on of regi onal perfusi on imaging to extra- intracrani al bypass surgery and severe stenoses. J Ne uroradi ol 2005; 32(5): 321– 324.
37. Detre JA, Samuels OB, Alsop DC, Gonzalez- At JB, Kasner SE, Raps EC. Noninvasive magnetic resonance imaging evalu ati on of cerebral blo od flow with acetazolamide challenge in pati ents with cerebrovascular stenosis. J Magn Reson Imaging 1999; 10(5): 870– 875.
38. Hendrikse J, van Osch MJ, Rutgers DR, Bakker CJ,Kappelle LJ, Golay X et al. Internal carotid artery occlu-si on assessed at pulsed arteri al spin‑labeling perfusi on MR imaging at multiple delay times. Radi ology 2004; 233(3): 899– 904.
39. Yoneda K, Harada M, Morita N, Nishitani H, Uno M,Matsuda T. Comparison of FAIR technique with different inversi on times and post contrast dynamic perfusi on MRI in chronic occlusive cerebrovascular dise ase. Magn Reson Imaging 2003; 21(7): 701– 705.
40. Ogawa S, Lee TM, Kay AR, Tank DW. Brain magnetic resonance imaging with contrast dependent on blo od oxygenati on. Proc Natl Acad Sci U S A 1990; 87(24): 9868– 9872.
41. Roc AC, Wang J, Ances BM, Li ebeskind DS, Kasner SE, Detre JA. Altered hemodynamics and regi onal cerebral blo od flow in pati ents with hemodynamically significant stenoses. Stroke 2006; 37(2): 382– 387.
42. Herzig R, Hlustik P, Skolo udik D, Sanak D, Vlachova I,Herman M et al. Assessment of the cerebral vasomotor re activity in internal carotid artery occlusi on using a transcrani al Doppler sonography and functi onal MRI. J Ne uro imaging 2008; 18(1): 38– 45.
43. Kazumata K, Tanaka N, Ishikawa T, Kuroda S, Ho ukin K, Mitsumori K. Dissoci ati on of vasore activity to acetazolamide and hypercapni a. Comparative study in pati ents with chronic occlusive major cerebral artery dise ase. Stroke 1996; 27(11): 2052– 2058.
44. Kleinschmidt A, Steinmetz H, Sitzer M, Merboldt KD, Frahm J. Magnetic resonance imaging of regi onal cerebral blo od oxygenati on changes under acetazolamide in carotid occlusive dise ase. Stroke 1995; 26(1): 106– 110.
45. Lythgoe DJ, Willi ams SC, Cullinane M, Markus HS. Mapping of cerebrovascular re activity using BOLD magnetic resonance imaging. Magn Reson Imaging 1999; 17(4): 495– 502.
46. Mandell DM, Han JS, Po ublanc J, Crawley AP, Stainsby JA, Fisher JA et al. Mapping cerebrovascular re activity using blo od oxygen level- dependent MRI in Pati ents with arteri al steno‑occlusive dise ase: comparison with arteri al spin labeling MRI. Stroke 2008; 39(7): 2021– 2028.
47. Ohnishi T, Nakano S, Yano T, Hoshi H, Jinno uchi S,Nagamachi S et al. Susceptibility- weighted MR for evalu ati on of vasodilatory capacity with acetazolamide challenge. AJNR Am J Ne uroradi ol 1996; 17(4): 631– 637.
48. Shiino A, Morita Y, Tsuji A, Maeda K, Ito R, Furukawa A et al. Estimati on of cerebral perfusi on reserve by blo od oxygenati on level- dependent imaging: comparison with single‑photon emissi on computed tomography. J Cereb Blo od Flow Metab 2003; 23(1): 121– 135.
49. Ziyeh S, Rick J, Reinhard M, Hetzel A, Mader I, Speck O. Blo od oxygen level- dependent MRI of cerebral CO2 re activity in severe carotid stenosis and occlusi on. Stroke 2005; 36(4): 751– 756.
50. van der Zande FH, Hofman PA, Backes WH. Mapping hypercapni a‑induced cerebrovascular re activity using BOLD MRI. Ne uroradi ology 2005; 47(2): 114– 120.
51. Hedera P, Lai S, Lewin JS, Haacke EM, Wu D, Lerner AJ et al. Assessment of cerebral blo od flow reserve using functi onal magnetic resonance imaging. J Magn Reson Imaging 1996; 6(5): 718– 725.
52. Nari ai T, Suzuki R, Hirakawa K, Maehara T, Ishii K, Senda M. Vascular reserve in chronic cerebral ischemi a me asured by the acetazolamide challenge test: comparison with positron emissi on tomography. AJNR Am J Ne uroradi ol 1995; 16(3): 563– 570.
53. Widder B, Kleiser B, Krapf H. Co urse of cerebrovascular re activity in pati ents with carotid artery occlusi ons. Stroke 1994; 25(10): 1963– 1967.
54. He X, Yablonskiy DA. Qu antitative BOLD: mapping of human cerebral de oxygenated blo od volume and oxygen extracti on fracti on: defa ult state. Magn Reson Med 2007; 57(1): 115– 126.
55. He X, Zhu M, Yablonskiy DA. Validati on of oxygen extracti on fracti on me asurement by qBOLD technique. Magn Reson Med 2008; 60(4): 882– 888.
56. Kavec M, Useni us JP, Tuunanen PI, Rissanen A, Ka uppinen RA. Assessment of cerebral hemodynamics and oxygen extracti on using dynamic susceptibility contrast and spin echo blo od oxygenati on level- dependent magnetic resonance imaging: applicati ons to carotid stenosis pati ents. Ne uro image 2004; 22(1): 258– 267.
57. Anderson CM, Ka ufman MJ, Lowen SB, Rohan M, Renshaw PF, Teicher MH. Brain T2 relaxati on times correlate with regi onal cerebral blo od volume. MAGMA 2005; 18(1): 3– 6.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2009 Číslo 4
Nejčtenější v tomto čísle
- Nádory tretej mozgovej komory
- Získaná neuromyotonie s nevelkými centrálními příznaky s průkazem protilátek proti napěťově řízeným kaliovým kanálům – kazuistika
- Botulotoxin v léčbě spasticity
- Paroxysmální kinezigenní dyskineze: případ mladé ženy s alternující hemidystoni í – kazuistika
