Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí
Intracranial angioplasty and stent implantation in atherosclerotic lesions
Purpose:
Authors report periprocedural and short term results of intracranial stenoses treatment using angioplasty and stent implantation.
Methods:
In the period from 8/2002 to 4/2007 (56 months) altogether 53 patients were treated in our department. Group consists of 12 women and 41 men (mean age 63 years), 48 lesions were symptomatic, 5 were asymptomatic. 56 procedures were performed with 53 stents implantations. 46 stenoses (84 %, n = 55) were located in anterior circulation. 9 stenoses were in posterior circulation (16 %). All procedures were done from femoral approach. Patients were put on clopidogrel (Plavix, Sanofi Pharma, Bristol-Meyer) and acetylsalicylic acid (Anopyrin, Zentiva, CZ) 3 days before the procedure. Bolus of heparin (Heparin Natrium, Zentiva, CZ) was given in the beginning of procedure. Combination of Plavix and Anopyrin was used for 1 month after the procedure and Anopyrin long-life. Balloon – expandable stents were used in 41 lesions (77 %, n = 53), self-expandable stents were used in 12 lesions (23 %, n = 53).
Results:
Primary technical success was achieved in 48 patients (91 %, n = 53), secondary technical success rate was 96 %. There were 9 periprocedural complications (16 %, n = 56), two minor, without sequelae, seven major leading to change of treatment and prolonged hospital stay. One procedure related dead occurred.
Conclusion:
Angioplasty with stent implantation was indicated in symptomatic patients with stenosis greater than 50 %. Our periprocedure results show, that stent implantation is technically feasible in most cases. The periprocedure results and complications rate in our group are comparable with those of other published studies.
Key words:
stroke – cerebral arteries – stent – intracranial atherosclerosis
Autoři:
F. Charvát 1; J. Mašková 1; J. Lacman 1; V. Beneš 2
Působiště autorů:
Radiologické oddělení, ÚVN Praha
1; Neurochirurgická klinika, 1. LF UK a VFN, Praha
2
Vyšlo v časopise:
Cesk Slov Neurol N 2008; 71/104(2): 190-196
Kategorie:
Krátké sdělení
Souhrn
Cíl:
Seznámit s periprocedurálními a krátkodobými výsledky léčby symptomatických aterosklerotických stenóz intrakraniálních tepen pomocí perkutánní angioplastiky a zavedení cévního stentu.
Soubor a metodika:
V intervalu od 8/2002 do 4/2007 (56 měsíců) bylo na našem pracovišti léčeno 53 nemocných s aterosklerotickými stenózami intrakraniálních tepen. Soubor zahrnuje 12 žen a 41 mužů, u kterých bylo provedeno 56 výkonů se zavedením 53 stentů. Průměrný věk byl 63 let. 48 lézí bylo symptomatických, 5 asymptomatických. 46 stenóz (84 %, n= 55) bylo lokalizovaných v přední cirkulaci. 9 stenóz (16 %, n= 55) bylo lokalizovaných v zadní cirkulaci. Výkony jsme provedli v lokální anestezii přístupem ze stehenní tepny. Během výkonu byl nemocným podán bolus 5 000 j. heparinu (Heparin Natrium, Zentiva, CZ), v elektivních případech byli nemocní premedikováni klopidogrelem (Plavix, Sanofi Pharma, Bristol-Meyer) a acetylsalicylovou kyselinou (Anopyrin, Zentiva, CZ) po dobu 3 dnů. Po výkonu byla podávána duální antiagregační terapie po dobu 1 měsíce, Anopyrin je podáván trvale. Ve 41 případech (77 %, n = 53) byly implantovány balon-expandibilní stenty, v 12 případech (23 %, n = 53) stenty samoexpandibilní.
Výsledky:
Primárně úspěšných bylo 48 výkonů (91 %, n = 53, sekundární technický úspěch byl 96 %, n = 53). Během výkonů se vyskytlo 9 komplikací (16 %), jednou došlo k úmrtí nemocného v souvislosti s výkonem.
Závěr:
Angioplastika se zavedením stentu byla indikována u symptomatických nemocných se stenózou ve více než 50 %. Naše periprocedurální výsledky ukazují, že zavedení stentu je technicky schůdné ve většině případů. Periprocedurální výsledky našich výkonů a komplikace jsou srovnatelné s výsledky uváděnými v literatuře.
Klíčová slova:
ischemická mozková cévní příhoda – mozkové tepny – stent – intrakraniální ateroskleróza
Úvod
Intrakraniální aterosklerotické stenózy jsou příčinou 5–10 % ischemických cévních mozkových příhod [1,2]. Konzervativní léčba spočívá v antiagregační a antikoagulační terapii a v redukci rizikových faktorů. Alternativní metody léčby jsou dosud kontroverzní. Extrakraniálně- intrakraniální bypass, který je metodou chirurgickou, se ukázal neefektivní u nemocných s intrakraniální stenózou, roční riziko ischemické cévní mozkové příhody (iCMP) po chirurgické léčbě zůstává 8–10 % [3,4], tedy obdobné jako u nemocných, kteří jsou léčeni pouze medikamentózně. WASID studie prokázala roční riziko iCMP v povodí stenózy 7,8 %, resp. 10,7 % [2,3,5]. Nemocní, kteří jsou symptomatičtí i přes medikamentózní léčbu, mají špatnou prognózu s rizikem iCMP nad 50 % během 2 let [1]. Endovaskulární léčba aterosklerotických intrakraniálních stenóz pomocí angioplastiky a zavedení cévního stentu je metodou volby léčby těchto lézí. Je užívána od 80. let minulého století, ale její začátky byly provázeny vysokým procentem periprocedurálních komplikací a úmrtí. S rozvojem moderních technologií, především flexibilnějšího instrumentária včetně balonexpandibilních a samoexpandibilních stentů se výsledky zlepšují, ale stále se jedná o metodu provázenou vážnými komplikacemi, takže přínos léčby je někdy zpochybňován [6].
Tato léčba je většinou dokumentována na menších souborech nemocných, léčených jak pouhou angioplastikou, tak s použitím různých druhů stentů, převážně z jednotlivých center [1,3,6–17].
Uvádíme naše zkušenosti s intrakraniálními angioplastikami a zavedením stentu u aterosklerotických lézí s periprocedurálními a časnými postprocedurálními výsledky.
Soubor a metodika
Nemocní
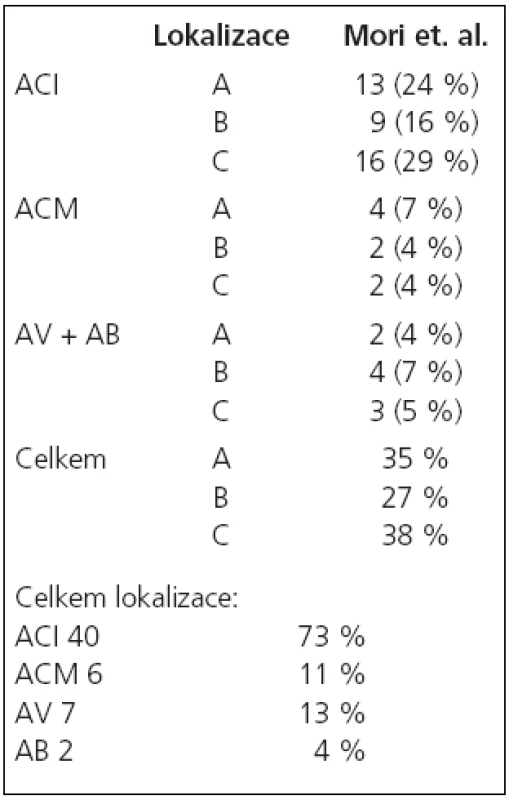
V období od 8/2002 do 4/2007 jsme na našem pracovišti provedli angioplastiku se zavedením stentu pro více než 50% stenózu v intrakraniálním tepenném řečišti u 53 nemocných. U těchto nemocných bylo provedeno celkem 56 výkonů se zavedením 54 stentů. Z nemocných bylo 12 žen a 41 mužů ve věkovém rozmezí 36–83 let, průměrný věk 63 let. U žen bylo věkové rozmezí 48–82 let, průměrně 58 let, a u mužů 36–83 let, průměrně 60 let. K léčbě byli indikováni pacienti se symptomatickou stenózou v 48 případech (91 %), 5krát byla stenóza asymptomatická (9 %), z toho jednou se jednalo o asymptomatickou restenózu po předchozí úspěšné angioplastice a u ostatních nemocných byla stenóza lokalizovaná na straně zásobující obě hemisféry při druhostranném uzávěru karotické tepny v extrakraniálním úseku.U 1 nemocného byly v tomtéž sezení léčeny oboustranné stenózy a u 1 nemocného tandemové léze na intrakraniálním povodí a. carotis interna (ACI) a a. cerebri media (ACM). U 12 nemocných byla zároveň ošetřena tandemová extrakraniální stenóza mateřské tepny. 46 stenóz (84 %, n = 55) bylo lokalizováno v přední cirkulaci, z toho 6 (11 %, n = 55) na ACM a 40 (73 %, n = 55) na ACI. 9 stenóz (16 %, n = 55) bylo lokalizovaných v zadní cirkulaci, 2 na a. bazilaris (4 %, n = 55) a 7 v intrakraniálním úseku a. vertebralis (13 %, n = 55). Klasifikace lézí [18,19] je uvedena v tab. 1. a 2.

Všichni nemocní podepsali informovaný souhlas s výkonem, který byl indikován na základě interdisciplinárního rozhodnutí. Před výkony byli nemocní premedikováni klopidogrelem (Plavix, Sanofi Pharma, Bristol-Meyer), 75 mg/den po dobu 3 dnů a acytylsalicylovou kyselinou (Anopyrin, Zentiva, CZ) 100 mg/den. Nemocní bez této premedikace byli saturováni bolusem Plavixu (3krát 75 mg) v den výkonu. Během výkonu bylo všem nemocným podáno v bolusu 5 000 j. heparinu (Heparin Natrium, Zentiva, CZ). Po výkonu po dobu 30 dnů jim byla podávána duální antiagregační terapie Plavix 75 mg/den s Anopyrinem 100 mg/den. Anopyrin byl po výkonu podáván již trvale.
Intervenční výkon
Všechny výkony byly provedeny v místním znecitlivění. Během výkonů bylo nemocným monitorováno EKG, saturace kyslíkem a krevní tlak. Přístupem ze společné stehenní tepny byl zaveden 6F vodicí katétr Envoy (Cordis Corp. Miami, FL, USA) do mateřské tepny a byla provedena digitální subtrakční angiografie (DSA), v posledním roce doplněná o třídimenzionální (3D) angiografii s přesnou kalibrací stupně stenózy a průměru mateřské tepny. Rekonstrukce 3D angiografie zároveň umožnila vyloučit, zda v místě stenózy nejsou přítomny cirkulární kalcifikace, u kterých je třeba vyvarovat se předilatace vzhledem k zvýšenému riziku ruptury kalcifikované tepny. Výkony byly provedeny na přístroji firmy GE, Innova 3100 (GE Medical Systems).
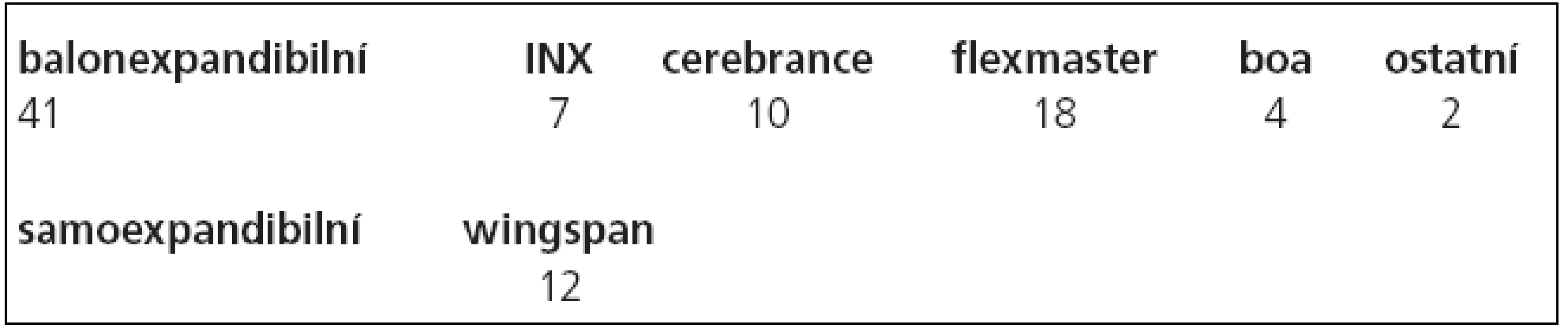
Po provedení angiografického vyšetření byl přes stenózu zaveden mikrokatétr (Excelsior SL10, Boston Scientific, Fremont, CA USA) po mikrovodiči (Transend 10, Boston Scientific Target, Fremont, CA, USA). Tento mikrovodič byl vyměněn za tuhý výměnný vodič (Choice PT, BS Scimed, MN, USA), po kterém byla provedena předdilatace balonkem a následně zaveden stent. Ve 41 (77 %, n = 53) případech byly implantovány balonexpandibilní (koronární) stenty, v 12 případech (22 %, n = 53) stenty samoexpandibilní. Zastoupení jednotlivých stentů je uvedeno v tab. 3.
Technický úspěch
Primární technický úspěch byl definován jako úspěšné dosažení léze s implantací stentu a reziduální stenózou méně než 50 % v 1. sezení. Sekundární technický úspěch byl dosažen tehdy, kdy se podařilo zavést stent až v 2. sezení, po předchozí balonkové angioplastice.
Klinický úspěch
Periprocedurální a časný postprocedurální klinický stav jsme hodnotili v 5stupňové škále, kde stupeň I – neurologicky zlepšený (bez opakování tranzitorní ataky nebo jiných ischemických příznaků), stupeň II – beze změny klinického stavu a bez neurologických komplikací, stupeň III – přechodné neurologické komplikace, stupeň IV – permanentní neurologický deficit a stupeň V – smrt spojená s výkonem [10].
Komplikace
Periprocedurální a časné postprocedurální komplikace byly klasifikovány v souladu s platnými standardy Society of Interventional Radiology – SIR standards of practice committee classification of complications by outcome [20] na:
- nezávažné komplikace:
- A: nevyžadující léčbu, bez konsekvencí
- B: nominální léčba, bez konsekvencí, zahrnuje i případy prodloužení hospitalizace o 24 h pro observaci
- závažné komplikace:
- C: vyžadující léčbu, prodloužení hospitalizaci do 48 h
- D: vyžadující zásadní léčbu, neplánované rozšíření úrovně péče, prolongovanou hospitalizaci nad 48 h
- E: s trvalými následky
- F: mající za následek úmrtí nemocného
Výsledky
Technický úspěch
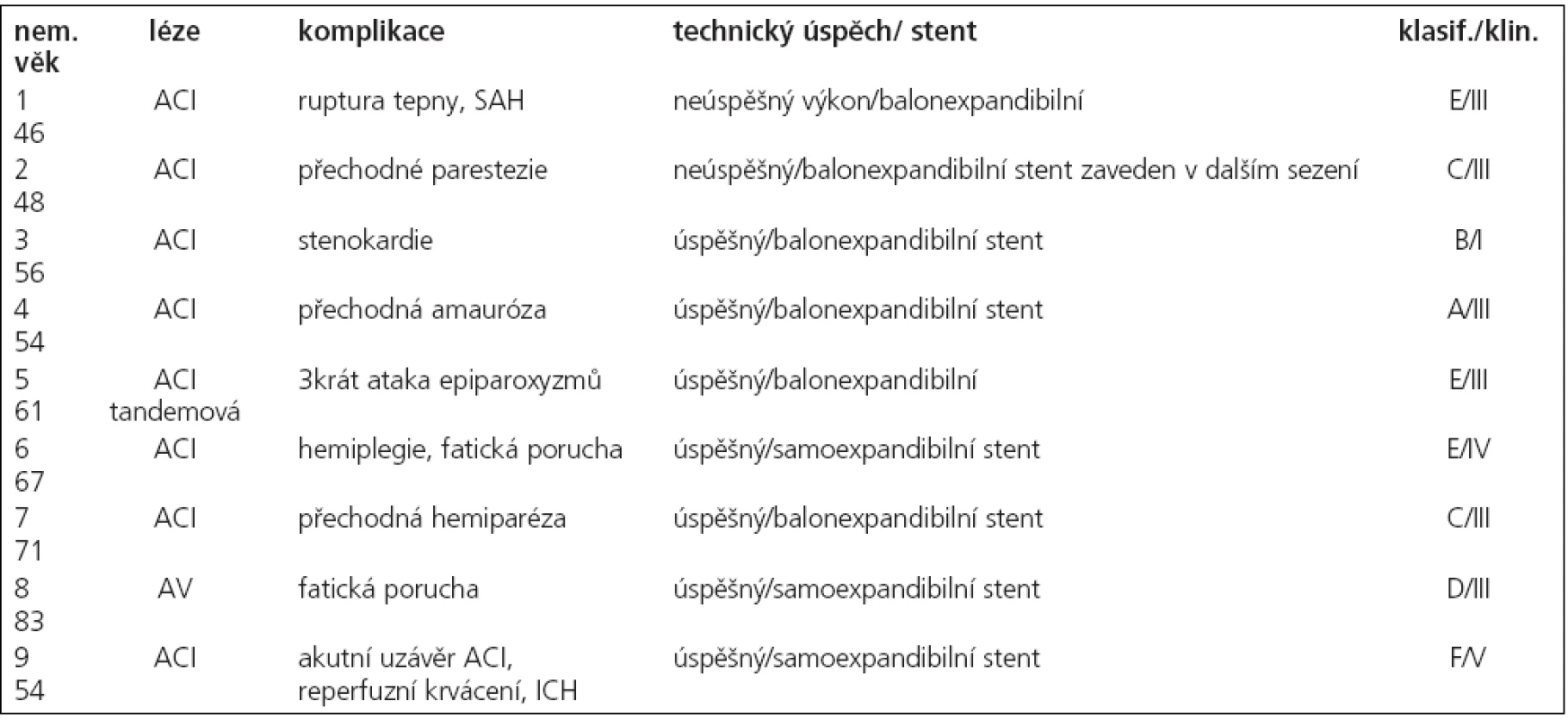
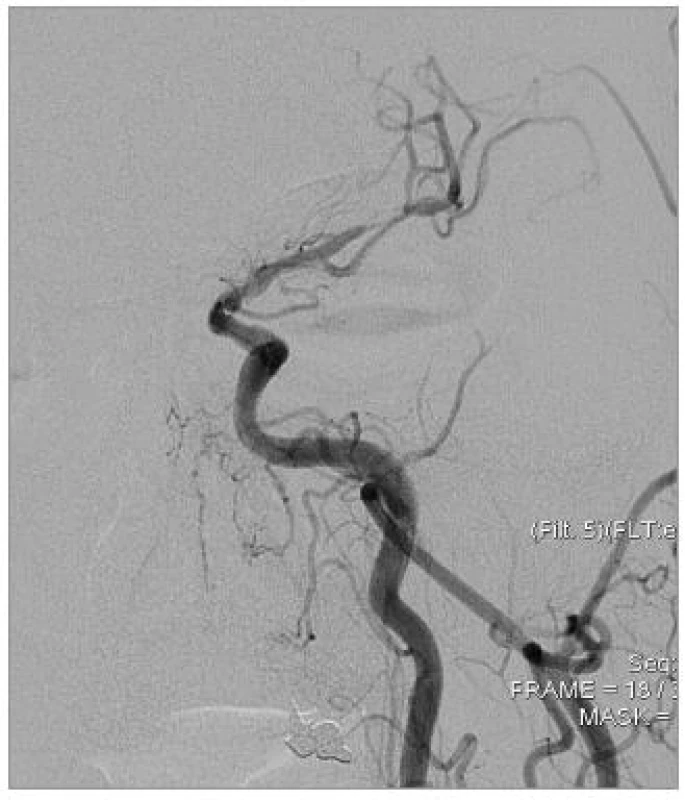
Primární technický úspěch, při kterém bylo dosaženo léze a úspěšně implantován stent v 1. sezení s reziduální stenózou méně než 50 %, jsme dosáhli u 48 nemocných (91 %, n = 53). U všech nemocných jsme při neúspěšném pokusu o zavedení stentu provedli angioplastiku a o implantaci stentu jsme se pokusili u 3 z nich ve 2. sezení. U těchto 3 byl 2. výkon úspěšný, sekundární technický úspěch byl tedy 96 % (n = 53). Jednalo se o 4 nemocné se stenózou ACI v úseku C4 a 1 nemocného se stenózou ACM v úseku M1. U 2 nemocných, u kterých nebyl výkon opakován, byla jednou ponechána tepna bez stentu, ošetřena pouze angioplastikou, u 2. z nich byl výkon komplikován disekcí tepny a krvácením, pro které byl výkon ukončen. Při propuštění byl neurologický stav nemocného nezměněný.
Klinický úspěch
K hodnocení klinického úspěchu jsme použili škálu stupňů I–V, kde I je neurologické zlepšení, tj. bez dalších ischemických příhod nebo tranzitorních atak, II je neurologický stav nezměněný, III jsou přechodné neurologické komplikace, IV neurologický deficit nově vzniklý a permanentní a V je úmrtí v souvislosti s výkonem. Klinický stav nemocných po výkonu a při ukončení hospitalizace u našich nemocných je uveden v tab. 4.

Komplikace
V souvislosti s výkonem došlo ke komplikacím u 9 nemocných, které lze klasifikovat v souladu s platnými standardy Society of Interventional Radiology do tříd A–F. Jednotlivé komplikace uvádíme v tab. 5, současně s klasifikací klinického stavu po výkonu. Z tabulky vyplývá, že u 2 nemocných se jednalo o lehké komplikace neovlivňující léčbu ani délku hospitalizace, u 1 z nich došlo ke zlepšení klinického stavu po výkonu, u 2. byly neurologické komplikace přechodné. U 7 nemocných byly komplikace klasifikovány jako závažné, s prodloužením doby hospitalizace a změnou léčebných postupů, u 4 z nich byly neurologické komplikace přechodné, u 2 měla komplikace za následek permanentní neurologický deficit a u 1 nemocného došlo k úmrtí s souvislosti s výkonem. U tohoto nemocného došlo během výkonu k akutnímu uzávěru ACI, řešenému mechanickým rozrušením trombu a podáním eptifibatidu (Integrillin, Glaxo Smith Kline, USA) v bolusu a i.v. infuzi. Neurologický stav se upravil, ve výkonu bylo pokračováno, po zavedení stentu však došlo k hypertenznímu zakrvácení do mozkové tkáně s rozsáhlým intracerebrálním hematomem v povodí ACM vlevo, které mělo za následek smrt.
Diskuse
Epidemiologie a rizikové faktory
Příčiny intrakraniální aterosklerózy nebyly dosud dostatečně podrobně zkoumány, na rozdíl od její extrakraniální lokalizace, většinou jsou však postiženi jedinci s celkovou aterosklerózou. Vyskytuje se ve formě ektatické i stenotické. Rizikovými faktory jsou inzulin-dependentní diabetes, hypercholesterolemie, kouření, hypertenze a černá, hispánská nebo asijská rasová příslušnost [11,21,22].
Patofyziologie a dynamika intrakraniálních stenóz
Intrakraniální sklerotické léze jsou dynamické, mohou progredovat i regredovat nebo zůstávat stabilní po mnoho let, přitom jejich vývoj je těžko predikovatelný. Zvýšené riziko progrese stenózy je u rizikových skupin [21,22] a u skupin, kde se klinicky projeví iCMP než u nemocných s tranzitorní ischemickou atakou (TIA) [23]. V literatuře se uvádí, že intrakraniální aterosklerotické postižení je příčinou 8–12 % iCMP [21]. Příčinou cévní mozkové příhody je buď nedostatečný přísun okysličené krve stenotickou tepnou, trombóza tepny v místě zúžení, tromboembolie nebo uzávěr odstupu perforujících tepének přerůstajícím plátem [21]. Dalším významným nálezem je nález mikroembolizací při transkraniálním dopplerovském (TCD) vyšetření. To je signálem přítomnosti nestabilního plátu a tito nemocní by měli být indikováni k léčbě zaměřené v 1. době na stabilizaci plátu a teprve v 2. době k endovaskulárnímu řešení stenózy [21].
Prognóza
Prognóza nemocných po iCMP spojené s intrakraniální stenózou závisí na lokalizaci stenózy a pokročilosti onemocnění. Incidence iCMP u nemocných se stenózou intrakraniálních tepen i při medikamentózní léčbě je 10–24 % [11]. Nemocní s intrakraniální stenózou, kteří byli sledováni 3,9 roku, měli TIA nebo iCMP v 27,3 % [10].
Diagnostika
Nemocní s iCMP jsou kromě klinického vyšetření indikováni k vyšetření dopplerovským ultrazvukem k vyloučení stenózy v extrakraniálním úseku mozkových tepen, dále je dnes již rutinně prováděna počítačová tomografie (CT), event. CT perfuzní vyšetření a CT angiografie, které spolehlivě detekují lokalizaci stenózy. Další možnou vyšetřovací metodou je TCD.
Prahová systolická rychlost pro ACM je pro muže 103 cm/s, ženy 110 cm/s, pro bazilární tepnu pro muže i ženy 65 cm/s a pro intrakraniální úsek vertebrální tepny pro muže 59 cm/s a ženy 62 cm/s. Je-li příčinou ischemie stenóza v intrakraniálním úseku mozkových tepen, měla by být u nemocného zahájena maximální medikamentózní léčba [21].
Medikamentózní léčba
Spočívá v kontrole rizikových faktorů a podávání antiagregační terapie. Obvykle spočívá v podávání Anopyrinu (více než 81 mg/den). Účinnější podávání Warfarinu ve srovnání s Anopyrinem prokázala WASID studie, která však byla předčasně zastavena pro signifikantně vyšší výskyt krvácivých komplikací ve warfarinizované skupině [5,2]. Je-li medikamentózní léčba neúčinná, tj. dojde-li u nemocného k další ischemické příhodě, je indikována endovaskulární léčba.
Endovaskulární léčba
Přes veliký pokrok v materiálech k neurointervenčním výkonům zůstává endovaskulární léčba intrakraniálních stenóz rizikovým výkonem. Je tedy indikována u stenóz nad 50 %, symptomatických, refrakterních k medikamentózní léčbě. Nutný je multidisciplinární přístup, protože technicky úspěšná revaskularizace je pouze 1. krokem ke klinickému úspěchu léčby [24]. Angiografická klasifikace lézí do typů A, B a C podle jejich morfologie ukázala, že čím je léze komplexnější, tím horší je okamžitý i dlouhodobý výsledek výkonu. Při užití balonkové angioplastiky bez zavedení stentu byla úspěšnost u typu A, reprezentovaného stenózou do 5 mm, koncentrickou, neokluzivní, v rovném úseku tepny 92 %, zatímco u typu C, kde je stenóza nad 10 mm dlouhá, v extrémně vinutém úseku tepny nebo u tepny s velmi vinutým proximálním úsekem, byla úspěšnost pouze 33 % se 100 % restenóz v 12měsíčním sledování [18,19]. U našich nemocných byla 5krát stenóza asymptomatická, z toho jednou se jednalo o asymptomatickou restenózu po předchozí úspěšné angioplastice, ke které došlo i přes adekvátní antiagregační terapii, a u ostatních nemocných byla stenóza lokalizovaná na straně zásobující obě hemisféry při druhostranném uzávěru karotické tepny v extrakraniálním úseku, i u těchto nemocných byla medikamentózní léčba bez efektu.
Použití angioplastiky a zavedení stentu u okluze intrakraniálních tepen
Při akutním uzávěru mozkových tepen se v endovaskulární léčbě stále častěji uplatňuje farmakomechanická desobliterace s použitím mechanické trombektomie se zavedením samoexpandibilního stentu a podáním GP IIb/III inhibitorů (eptifibatid 180 ug/kg v intravenózním bolusu, nebo abciximab 0,25 mg/kg v intravenózním bolusu, následovaným intravenózní kontinuální infuzí). V publikované sérii 18 nemocných, léčených touto kombinací, byl stent úspěšně zaveden ve všech případech, angiograficky dobrého výsledku bylo dosaženo v 79 % a ke klinickému zlepšení došlo u 61 % nemocných [25]. Endovaskulární rekanalizace symptomatických chronických uzávěrů se rutinně neprovádí, tito nemocní jsou indikováni k chirurgické léčbě. Kombinace chirurgického a endovaskulárního přístupu u aterosklerotického uzávěru byla popsána pouze v kazuistice [26].
Obecné principy intervence
3 dny před výkonem je v elektivních případech podána duální antiagregační terapie klopidogrelem (Plavix, 75 mg/den) a acetylsalicylovou kyselinou (Anopyrin 100 mg/den). Výkony jsou většinou prováděny z třísla, v místním znecitlivění nebo v celkové anestezii v závislosti na zvyklostech pracoviště. Na začátku výkonu je podáván heparin v bolusu buď podle váhy nemocného tak, aby ACT byl 250–300 s nebo, jako podáváme na našem pracovišti, 5000 j. v bolusu intravenózně. K průchodu lézí je vhodné použít mikrokatétr s jemným mikrovodičem a teprve po výměně za tužší vodič, který umožňuje větší podporu, zavést balonek k předdilataci a poté implantovat stent. Předdilatace je prováděna velmi pomalu, rychlostí zhruba 1 atm za 30 s, pro vysokou tendenci k disekci, tlak k inflaci by neměl překročit 7 atm [21,9]. Samotná angioplastika bez implantace stentu je možná tam, kde je extrémně vinutá přístupová cesta a zavedení stentu je technicky neschůdné. Výsledky samotné angioplastiky, hodnocené v retrospektivní studii u 120 nemocných, ukazují benefit této léčby u nemocných refrakterních k medikamentózní terapii, kdy během ročního sledování došlo k 3,2 % ischemických příhod v léčené oblasti [7].
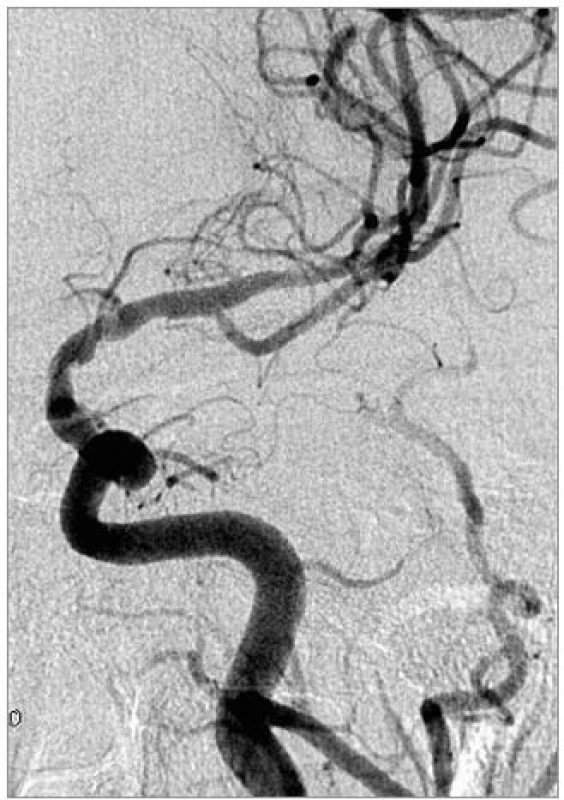
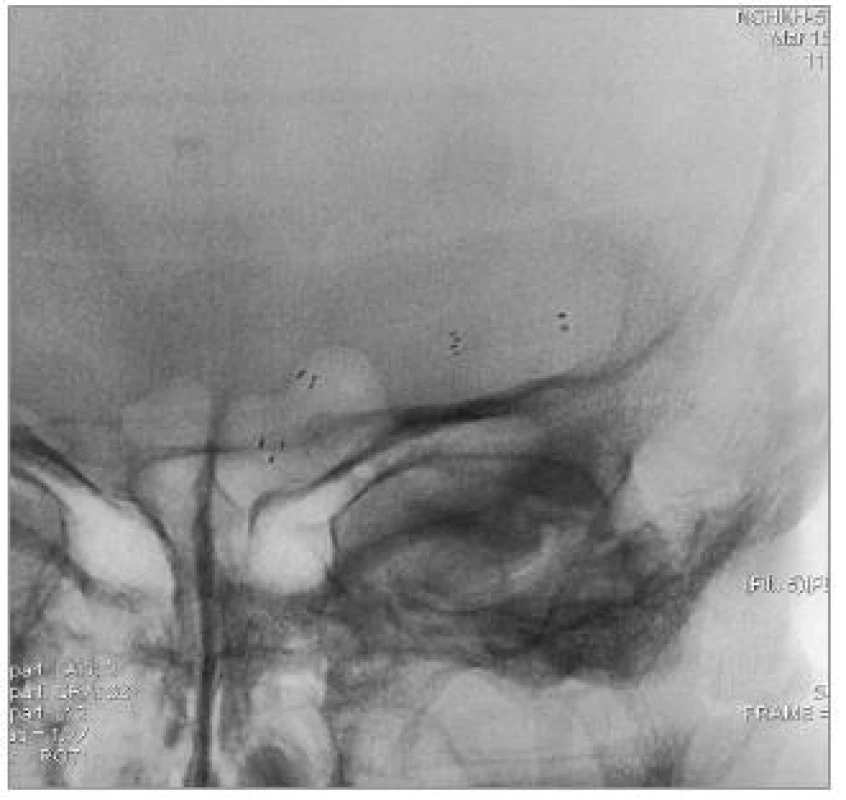
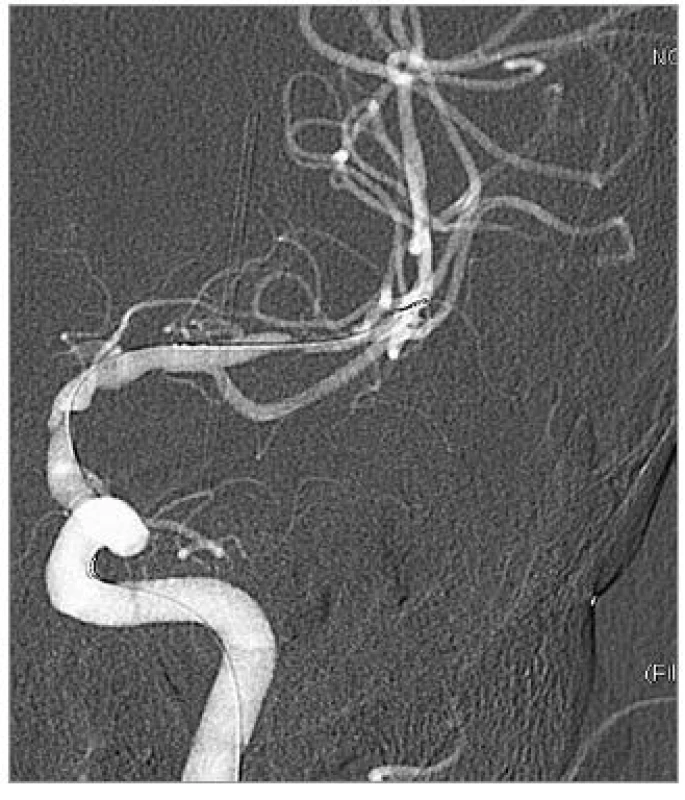
Přesné změření průměru tepny, kalibrace stenózy a volba vhodného stentu jsou velmi důležité pro zvýšené riziko ruptury intrakraniálních tepen. Použít lze program ke kalibraci stenózy při 3D angiografii, tak jak to umožňují nové typy přístrojů, nebo užití výpočtu [27]:
procento stenózy = [(1 - (Dstenoza/Dtepna )] × 100
Použití balonexpandibilních stentů, většinou koronárních, které jsou rigidní, zůstává metodou volby u rovného úseku mozkových tepen se snadným přístupem. Čím dál více se uplatňuje použití samoexpandibilního stentu. Wingspan (Boston Scientific, Fremont, CA, USA) je v současné době jediným dostupným samoexpandibilním stentem určeným k léčbě stenóz intrakraniálních tepen. Stent je nitinolový, samoexpandibilní, memotermický, velmi flexibilní. Je k dispozici v průměru od 2,5 do 4,5 mm v délkách 9, 15 a 20 mm [28]. Obdobné nitinolové stenty se využívají i při remodelační technice léčby mozkových aneuryzmat [29].
Hodnocení periprocedurálních výsledků multicentrické studie u 78 nemocných s užitím tohoto stentu ukázalo 98,8% technický úspěch, 6,1 % závažných periprocedurálních komplikací, které ve 4 případech vedly k úmrtí nemocného do 30 dnů od výkonu [30]. Ve skupině 43 nemocných léčených zavedením tohoto stentu bylo zaznamenáno 9,3 % ipsilaterálních iCMP v ročním sledování [28].
Komplikace
Mezi nejčastější komplikace patří ischemická příhoda s vytvořením čerstvého trombu, která může být řešena podáním trombolytik nebo antiagregancií, dále intrakraniální krvácení způsobené reperfuzí chronicky ischemické oblasti nebo perforací či rupturou tepny během výkonu. V zatím jediné prospektivní multicentrické studii SSYLVIA 4 z 61 nemocných utrpěli ischemickou cévní příhodu periprocedurálně, žádný nemocný nezemřel ve 30 dnech od výkonu. To představuje 30denní morbiditu a mortalitu 6,6 % [11]. Roční incidence iCMP v této studii byl 13,2 % [11].
Sledování nemocných
V souvislosti s remodelingem a neointimální hyperplazií dochází k restenózám v místě zavedeného stentu.Vhodnou metodou ke sledování se jeví CT angiografie, která u multidetektorových přístrojů není zatížená přítomností artefaktů a je schopná detekovat i dosud klinicky němé restenózy [21]. Další vhodnou metodou je použití TCD [1,22]. Procento restenóz závisí na typu léze, u komplexních lézí typu C se uvádí až 100 % restenóz v 1 roce po balonkové angioplastice bez použití stentu [18,21]. Určitým příslibem ve snižování počtu restenóz je možnost použití stentů potažených léky. V literatuře uváděné výsledky prací se stenty potaženými sirolimem a paklitaxelem udávají 6 % restenóz při užití v intrakraniálních tepnách při 4měsíčním sledování [13], větší zkušenosti s jejich užitím však v této lokalizaci dosud chybějí.
Srovnání našich výsledků, limitace naší práce
Při porovnání klinických výsledků dosažených u našich nemocných jsou výsledky srovnatelné s výsledky uváděnými v literatuře. U 64 % nemocných jsme dosáhli klinického zlepšení, u 17 % zůstal neurologický stav nezměněný, u 13 % se stabilizoval po přechodném neurologickém zhoršení, u 4 % došlo k ireverzibilnímu zhoršení klinického stavu a ve 2 % k úmrtí v souvislosti s výkonem. To koreluje s 62 % klinicky zlepšených nemocných, 26 % stabilních, 6 % klinicky zhoršených a 6 % úmrtí v souvislosti s výkonem, uvedenými v práci Lylyka et al [10]. Technické výsledky naší práce jsou také srovnatelné, v literatuře se pohybují v rozmezí 95–98,8 % [11,12,19,28,30]. Chybí nám dlouhodobé klinické výsledky a zhodnocení procenta restenóz ve vztahu ke klasifikaci lézí, pravidelné CT AG kontroly jsou prováděny až v posledních 2 letech, předchozí pacienti byli indikování k angiografické kontrole pouze v případě, že byli symptomatičtí. Naše práce je také zatížena nevýhodami retrospektivního zhodnocení.
Závěr
Indikace k jakékoliv léčbě závisí vždy na bilanci mezi riziky léčby a riziky onemocnění, je-li neléčené. Špatná prognóza nemocných se symptomatickými aterosklerotickými stenózami mozkových tepen, refrakterními k medikamentózní léčbě otevřela další prostor endovaskulární terapii. Riziko iCMP a úmrtí je u těchto nemocných při užití endovaskulární léčby výrazně nižší než při medikamentózní terapii, přesto je stále zatížená 10–20% morbiditou a mortalitou i u minimálně symptomatických nemocných a je ještě rizikovější u jedinců neurologicky nestabilních, u kterých periprocedurální mortalita dosahuje až 17 %. Zásadní je proto individuální přístup s multidisciplinárním zvážením této léčby tak, abychom byli schopni dosáhnout co nejlepších výsledků.
Intrakraniální angioplastika a zavedení cévního stentu je tématem vysoce aktuálním. Endovaskulární léčba se jeví účinnou technikou , ale další výzkum, vč. dlouhodobého sledování, je nutností. Proto bylo naše pracoviště zařazeno do mezinárodního registru, jehož úkolem je zhodnotit a porovnat výsledky léčby na evropských pracovištích. První práce zhodnocující periprocedurální výsledky z našeho pracoviště ukazuje, že jsou v korelaci s výsledky uváděnými v literatuře.
Seznam použitých zkratek
- ICA – arteria carotis interna
- ACM – arteria cerebri media
- EC-IC – external carotid-internal carotid
- TCD – transkraniální dopplerovské vyšetření
- DSA – digitální subtrakční angiografie
- iCMP – ischemická cévní mozková příhoda
- TIA – tranzitorní ischemická ataka
- CT – počítačová tomografie
prim. plk. MUDr. František Charvát, Ph.D.
Radiologické oddělení
Ústřední vojenská nemocnice
U vojenské nemocnice 1200
169 02 Praha 6-Střešovice
frantisek.charvat@uvn.cz
Přijato k recenzi: 20. 7. 2007
Přijato do tisku: 18. 12. 2007
Zdroje
1. de Rochemont Rdu M, Turowski B, Buchkremer M, Sitzer M, Zanella FE, Berkefeld J. Reccurent symptomatic high – grade intracranial stenoses: safety and efficacy of undersized stents- initial experience. Radiology 2004; 231: 45–49.
2. Benesch CG, Chimowitz MI. Best treatment for intracranial arterial stenosis? 50 years of uncertainty. The WASID investigators. Neurology 2000; 55: 465–466.
3. Marks MP, Marcellus M, Norbash AM, Steinberg GK, Tong D, Albers GW. Outcome of angioplasty for atherosclerotic intracranial stenosis. Stroke 1999; 30: 1065–1069.
4. The EC/IC Bypass Study Group. Failure of extracranial-intracranial arterial bypass to reduce the risk of ischemic stroke. Results of an international randomized trial. N Engl J Med 1985; 313: 1191–1200.
5. Chimowitz MI, Lynn MJ, Howlett-Smith H, Stern BJ, Hertzberg VS, Frankel MR et al. Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis. N Engl J Med 2005; 352:1305–1316.
6. Takis C, Kwan ES, Pessin MS, Jacobs DH, Caplan LR. Intracranial angioplasty: experience and complications. AJNR Am J Neuroradiol 1997; 18: 1661–1668.
7. Marks MP, Wojak JC, Al-Ali F, Jayaraman M, Marcellus ML, Connors JJ et al. Angioplasty for symptomatic intracranial stenosis: clinical outcome. Stroke 2006; 37: 1016–1020.
8. Wojak JC, Dunlap DC, Hargrave KR, DeAlvare LA, Culbertson HS, Connors JJ. 3rd. Intracranial angioplasty and stenting: long-term results from a single centre. AJNR Am J Neuroradiol 2006; 27: 1882–1892.
9. Morris PP, Martin EM, Regan J, Braden G. Intracranial deployment of coronary stents for symptomatic atherosclerotic disease. AJNR Am J Neuroradiol 1999; 20: 1688–1694.
10. Lylyk P, Cohen JE, Cerrato R, Ferrario A, Miranda C. Angioplasty and stent placement in intracranial atherosclerotic stenoses and dissections. AJNR Am J Neuroradiol 2002; 23: 430–436.
11. The SSYLVIA study investigators. Stenting of symptomatic atherosclerotic lesions in the vertebral in intracranial arteries (SSYLVIA): study results. Stroke 2004; 35: 1388–1392.
12. Jiang WJ, Wang YJ, Du B, Wang SX, Wang GH, Jin M et al. Stenting of symptomatic M1 stenosis of modele cerebral artery: an initial experience of 40 patients. Stroke 2004; 35: 1375–1380.
13. Gupta R, Al-Ali F, Thomas AJ, Horowitz MB, Barrow T, Vora NA et al. Safety, feasibility and short term follow up of drug- eluting stent placement in the intracranial an extracranial circulation. Stroke 2006; 37: 2564–2566.
14. Nahser HS, Henkes H, Weber W, Berg-Dammer E, Yousry TA, Kühne D. Intracranial vertebrobasilar stenosis: angioplasty and follow-up. AJNR Am J Neuroradiol 2000; 21: 1293–1301.
15. Phatouros CC, Lefler JE, Higashida RT, Meyers PM, Malek AM, Dowd CF et al. Primary stenting for high-grade basilar artery stenosis. AJNR Am J Neuroradiol 2000; 21: 1744–1749.
16. Lee TH, Kim DH, Lee BH, Kim HJ, Choi CH, Park KP et al. Preliminary results of endovascular stent-assisted angioplasty for symptomatic middle cerebral artery stenosis. AJNR Am J Neuroradiol 2005; 26: 166–174.
17. Alazzaz A, Thornton J, Aletich V, Debrun GM, Ausman JI, Charbel F. Intracranial percutaneous transluminal angioplasty for arteriosclerotic stenosis. Arch Neurol 2000; 57: 1625–1630.
18. Mori T, Fukuoka M, Kazita K, Mori K. Follow-up after intracranial percutaneous transluminal cerebral balloon angioplasty. AJNR Am J Neuroradiol 1998; 19: 1525–1533.
19. Mori T, Kazita K, Chokyu K, Mima T, Mori K. Short-term arteriographic and clinical outcome after cerebral angioplasty and stenting for intracranial vertebrobasilar and carotid atherosclerotic occlusive disease. AJNR Am J Neuroradiol 2000; 21: 249–254.
20. Rajan DK, Patel NH, Valji K, Cardella JF, Bakal C, Brown D et al. Quality improvement guidelines for percutaneous management of acute limb ischemia. J Vasc Interv Radiol 2005; 16: 585–595.
21. Schumacher HC, Khaw AV, Meyers PM, Gupta R, Higashida RT. Intracranial angioplasty and stent placement for cerebral atherosclerosis. J Vasc Interv Radiol 2004; 15: S123–S132.
22. Akins PT, Pilgram TK, Gross DT, Moran CJ. Natural history of stenosis from intracranial atherosclerosis by serial angiography. Stroke 1998; 29: 433–438.
23. Marini C, Totaro R, Carolei A. Long-term prognosis of cerebral ischemia in young adults. National Research Council Study Group on Stroke in the Young. Stroke 1999; 30: 2320–2325.
24. Ecker RD, Levy EI, Sauvageau E, Hanel RA, Hopkins LN. Current concepts in the management of intracranial atherosclerotic disease. Neurosurgery 2006; 59(5 Suppl 3): 210–218.
25. Levy EI, Mehta R, Gupta R, Hanel RA, Chamczuk AJ, Fiorella D, et al. Self-expanding stents for recanalization of acute cerebrovascular occlusion. AJNR Am J Neuroradiol 2007; 28: 816–822.
26. Benes V, Netuka D, Charvat F, Mohapl M. Recanalization of long-lasting middle cerebral artery occlusion by a combination of surgical and interventional approaches: technical case report. Neurosurgery 2005; 57(4 Suppl): E401.
27. Samuels OB, Joseph GJ, Lynn MJ, Smith HA, Chimowitz MI. A standardized method for measuring intracranial arterial stenosis. AJNR Am J Neuroradiol 2000; 21: 643–646.
28. Bose A, Hartmann M, Henkes H, Liu HM, Teng MM, Szikora I et al. A novel, self-expanding, nitinol stent in medically refractory intracranial atherosclerotic stenoses: the Wingspan study. Stroke 2007; 38: 1531–1537.
29. Charvát F, Mašková J, Beneš V, Kramář F. Použití intrakraniálních stentů v endovaskulární léčbě mozkových aneuryzmat. Cesk Slov Neurol N 2006; 69/102(3): 211–216.
30. Fiorella D, Levy EI, Turk AS, Albuquerque FC, Niemann DB, Aagaard-Kienitz B et al. US multicenter experience with the wingspan stent system for the treatment of intracranial atheromatous disease: periprocedural results. Stroke 2007; 38: 881–887.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2008 Číslo 2
Nejčtenější v tomto čísle
- Roztroušená skleróza
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
- Syndrom Smithové-Magenisové: kazuistika