Overenie psychometrických vlastností slovenskej verzie Mattisovej škály demencie u zdravej populácie a pacientov s Parkinsonovou chorobou – pilotná štúdia
Verification of the psychometric properties of the Slovak version of the Dementia Rating Scale-2 in a healthy population and in patients with Parkinson‘s disease – a pilot study
Aim: Aims of this study were to verify the psychometric characteristics of the Slovak version of the Mattis Dementia Rating Scale-2 (DRS-2), examine its diagnostic accuracy in the population of patients with Parkinson‘s disease (PD), and establish a preliminary cut-off score for the diagnosis of mild cognitive impairment (MCI). Sample and methods: The clinical population consisted of 30 patients with PD with an average duration of the disease of 5.53 ± 3.92 years. Eleven patients were diagnosed with MCI. The control group of healthy people without neurological disease consisted of 43 participants who were age and education matched. All participants were administered the Slovak version of the DRS-2 measuring attention, memory, initiation/ perseveration, construction skills and conceptualization. A comprehensive neuropsychological battery was used to assess convergent validity. Results: Correlations of DRS-2 scores with a screening tools and analogous tests of the neuropsychological battery indicate good convergent validity of the tool (with the exception of the construction subtest). We found the strongest relationships for the initiation/perseveration and memory subtests. Furthermore, we objectified a good discriminative power in patients with PD without cognitive deficits and patients with MCI with the determination of an optimal cut-off score of 134 points (sensitivity 81.80% and specificity 89.50%). Conclusion: The Slovak version of the DRS-2 is an instrument with satisfactory psychometric properties and can potentially be used to test cognition in the healthy population and patients with Parkinson‘s disease.
Keywords:
Cognition – Psychometrics – Parkinson‘s disease – Dementia Rating Scale-2
Authors:
V. Boleková 1,2; P. Brandoburová 1,3,4; M. Hajdúk 3,5,6; I. Straka 1; P. Valkovič 1,7; Z. Košutzká 1*
Authors‘ workplace:
II. neurologická klinika LF UK a UNB, Bratislava, SR
1; Ústav klinickej psychológie, Fakulta psychológie, Paneurópska vysoká škola, Bratislava, SR
2; Katedra psychológie, Filozofická fakulta UK, Bratislava, SR
3; Centrum MEMORY n. o., Bratislava, SR
4; Psychiatrická klinika LF UK a UNB, Bratislava, SR
5; Centrum výskumu psychických porúch UK, Bratislava, SR
6; Ústav normálnej a patologickej fyziológie, Centrum experimentálnej medicíny Slovenskej akadémie vied, Bratislava, SR
7
Published in:
Cesk Slov Neurol N 2023; 86(3): 185-192
Category:
Original Paper
doi:
https://doi.org/10.48095/cccsnn2023185
Overview
Cieľ: Cieľom tejto práce bolo overenie psychometrických charakteristík slovenskej verzie Mattisovej škály demencie (Dementia Rating Scale-2; DRS-2), preskúmanie jej diagnostickej presnosti v populácii pacientov s Parkinsonovou chorobou (PCh) a stanovenie predbežného hraničného skóre pre diagnostiku miernej kognitívnej poruchy (mild cognitive impairment; MCI). Súbor a metodika: Klinická populácia bola zložená z 30 pacientov s PCh, s priemernou dĺžkou trvania ochorenia 5,53 ± 3,92 rokov. U 11 pacientov bola diagnostikovaná MCI. Kontrolnú skupinu zdravých ľudí bez neurologického ochorenia tvorilo 43 vekovo a vzdelanostne príbuzných participantov. Všetkým participantom bola administrovaná slovenská verzia DRS-2 merajúca pozornosť, pamäť, iniciáciu/ perseveráciu, konštrukčné schopnosti a konceptualizáciu. Na posúdenie konvergentnej validity bola využitá komplexná neuropsychologická batéria. Výsledky: Korelácie skóre DRS-2 so skríningovými nástrojmi a analogickými testami neuropsychologickej batérie poukazujú na dobrú konvergentnú validitu nástroja (s výnimkou subtestu konštrukcia). Najsilnejšie vzťahy sme zistili pre subtesty iniciácia/ perseverácia a pamäť. Objektivizovali sme dobrú diskriminačnú silu pri pacientoch s PCh bez kognitívneho deficitu a pacientoch s MCI so stanovením optimálneho cut-off skóre 134 bodov (senzitivita 81,80 % a špecificita 89,50 %). Záver: Slovenská verzia Mattisovej škály demencie je nástrojom s vyhovujúcimi psychometrickými vlastnosťami a možno ju potenciálne použiť na testovanie kognície u zdravej populácie a pacientov s Parkinsonovou chorobou.
Klíčová slova:
Parkinsonova choroba – kognícia – Mattisova škála demencie – psychometrika
Úvod
Mattisova škála demencie (Dementia Rating Scale-2; DRS-2) [1] bola vyvinutá ako skríningový nástroj určený na vyhodnotenie globálnej úrovne kognitívnych funkcií. Nástroj poskytuje dôležité informácie jednak o globálnom kognitívnom výkone, ako aj o úrovniach fungovania v nasledujúcich doménach: pozornosť, pamäť, iniciácia/ perseverácia, konštrukčné schopnosti a konceptualizácia. Svojou konštrukciou je špecificky navrhnutá na posúdenie nízkeho kognitívneho výkonu a je dostatočne senzitívna aj k odlíšeniu stredne závažných až závažných kognitívnych deficitov [1,2]. Klinickú užitočnosť nástroja ilustruje fakt, že bol zaradený ako súčasť odporúčaní pre diagnostiku kognitívnych porúch na úrovni I (Level 1) medzinárodnej Movement Disorder Society Task Force kritérií u pacientov s Parkinsonovou chorobou (PCh) [3,4]. Pri PCh môžu byť prítomné kognitívne poruchy už u novodiagnostikovaných pacientov a s progresiou ochorenia sa ich výskyt a závažnosť zvyšuje. V prípade pacientov s miernou kognitívnou poruchou (mild cognitive impairment; MCI) pri PCh (PCh-MCI) je prevalencia v prierezových štúdiách približne 40 % [5]. Môže sa jednať o kognitívne poruchy vyskytujúce sa v jednej alebo viacerých kognitívnych doménach. V úvodných štádiách podľa teórie duálneho syndrómu dominuje frontálno-dysexekutívny syndróm a v neskorších štádiách sa zvyčajne pridávajú poruchy pamäti a vizuo-priestorovej orientácie [6].
V neskorších štádiách PCh môžu byť pacienti indikovaní na pokročilé metódy liečby vrátane hlbokej mozgovej stimulácie (deep brain stimulation; DBS). Jedným z kľúčových selekčných kritérií vhodnosti pacienta na implantáciu DBS je absencia závažnejších kognitívnych porúch, resp. dementného syndrómu. Použitie škály DRS-2 je zlatým štandardom v indikačnom procese skríningu kognície, kedy sa využíva vyhovujúca senzitivita a špecificita pre diskrimináciu pacientov s ľahkým kognitívnym deficitom a demenciou [7], ako aj jej vhodnosť pre monitorovanie progresie ochorenia v čase [4]. Ďalšou výhodou DRS-2 pri hodnotení kognitívnych schopností pacientov s PCh je najmä dostupnosť validizačných štúdií naznačujúcich veľmi dobré psychometrické vlastnosti [8–10].
V zahraničí je škála DRS-2 často používaná v rámci empirického výskumu aj v klinickej praxi [11]. K dispozícii sú české normy [8], avšak slovenské normy a adaptácia nástroja doteraz nebola dostupná. Psychometricky orientované štúdie preukázali diagnostickú užitočnosť metódy a priniesli empirické poznatky o reliabilite a validite DRS-2 [2,9,12–14]. Test-retestová reliabilita s odstupom jedného týždňa bola r = 0,97 pre celkové skóre, čo indikuje výbornú spoľahlivosť testu [1]. Vnútorná konzistencia zisťovaná metódou split-half bola pre celkové skóre tiež dobrá (r = 0,90) a koeficienty vnútornej konzistencie sa pohybovali v rozmedzí a = 0,75–0,95, s výnimkou škály konštrukcie, ktorá vykazovala nízku vnútornú konzistenciu. Korelácie medzi jednotlivými subtestami sú silné, s výnimkou škál pozornosť a iniciácia/ perseverácia [14].
Výkon pacientov v DRS-2 koreluje s komplexnými neuropsychologickými testami, čo naznačuje dobrú súbežnú validitu. Na úrovni subtestov boli zistené vzťahy skóre pozornosti s výkonom v opakovaní čísel, iniciácie/ perseverácie s mierou perseverácií vo Wisconsinskom teste triedenia kariet, konceptualizácie so subtestom Podobnosti vo Wechslerovom teste inteligencie pre dospelých (WAIS-R) a tiež pamäti s oddialeným vybavením príbehu z Wechsler Memory Scale (WMS) [9]. Korelácie jednotlivých subtestov s obdobnými skúškami z Wechslerových testov zistili aj Marson et al [2]. V tomto výskume bol tiež konštatovaný silný vzťah medzi výkonom v teste verbálnej fluencie a úrovňou iniciácie/ perseverácie.
U pacientov s PCh sa cut-off skóre pre odlíšenie pacientov s MCI pri PCh (PCh-MCI) od pacientov bez kognitívnych porúch pohybuje okolo 139 bodov v americkej (senzitivita 77,00 %, špecificita 65,00 %) [15], holandskej (senzitivita 68,00 % a špecificita 79,00 %) [16], ako aj v českých štúdiách (senzitivita 78,00 %, špecificita 76,00 %, resp. senzitivita 82,00 %, špecificita 56,00 %) [8,17]. V porovnaní so zdravými kontrolami pacienti s PCh-MCI dosiahli signifikantne nižšie celkové skóre, ako aj nižšie skóre v subteste iniciácia/ perseverácia [18]. Llebaria et al udávajú cut-off skóre 123 bodov (senzitivita 92,65 % a špecificita 91,40 %) pre diskrimináciu pacientov s PCh s demenciou (PCh-D) a pacientov bez kognitívneho deficitu. V rámci subškál získali participanti s PCh-D podstatne nižšie skóre v subtestoch iniciácia/ perseverácia, konceptualizácia a pamäť [19].
Zistenia o vzťahu výkonu v DRS-2 so sociodemografickými premennými nie sú jednoznačné. V zdravej populácii dosahujú lepší výkon mladší participanti s vyšším vzdelaním [20–23]. U pacientov s PCh bol zistený len slabý vzťah s vekom, závažnosťou motorických príznakov a štádiom ochorenia [13]. Vo výskume pacientov s PCh-MCI, s nešpecifikovanou kognitívnou poruchou a s demenciou pri PCh bol zistený zanedbateľný alebo veľmi slabý vzťah so vzdelaním, vekom a pohlavím pacientov [8,24]. Podľa záverov holandskej štúdie pacientov s PCh indikovaných na DBS koreluje vek so skóre v DRS-2, vzdelanie a pohlavie však mieru výkonu diferencujú len veľmi slabo [16].
V slovenskom jazyku a populácii aktuálne absentujú normatívne dáta pre detekciu kognitívneho deficitu u pacientov s PCh s využitím skríningových kognitívnych nástrojov. Cieľom nášho výskumu bolo overiť základné psychometrické charakteristiky slovenskej verzie škály, preskúmať diagnostickú presnosť škály DRS-2 v populácii pacientov s PCh a určiť predbežné hraničné skóre pre diagnostiku MCI.
Metódy
Výskumný súbor
Výskumu sa zúčastnilo 30 pacientov s PCh vo veku 39–78 rokov (priemer = 61,93; smerodajná odchýlka [SD] = 10,16), s priemernou dĺžkou trvania ochorenia 5,53 rokov (SD = 3,92) a v štádiu ochorenia 1–3 podľa Hoehnovej a Yahra (HY) (medián = 2,00) [25]. Diagnóza PCh bola stanovená na základe klinických diagnostických kritérií Movement Disorder Society [26]. Priemerné skóre v motorickej časti MDS-Unified Parkinson‘s Disease Rating Scale (MDS-UPDRS) (časť III) bolo 31,45 (SD = 9,07) [27]. Klinickú skupinu tvorilo 12 žien a 18 mužov. Všetci pacienti boli vyšetrení ráno, v stave najlepšej motorickej a nemotorickej kompenzácie po užití dopamínergickej medikácie s priemernou levodopovou ekvivalentnou dennou dávkou (LEDD) 1 234,91 mg (SD = 596,48) [28]. Najlepší stav bol verifikovaný neurológom a subjektívnym zhodnotením samotného pacienta. U 11 pacientov bolo diagnostikované oslabenie kognitívnych funkcií v zmysle MCI na úrovni 1 podľa kritérií Movement Disorder Society; t.j. na základe skríningu kognitívneho deficitu prostredníctvom škály celkovej kognitívnej výkonnosti (tab. 1).
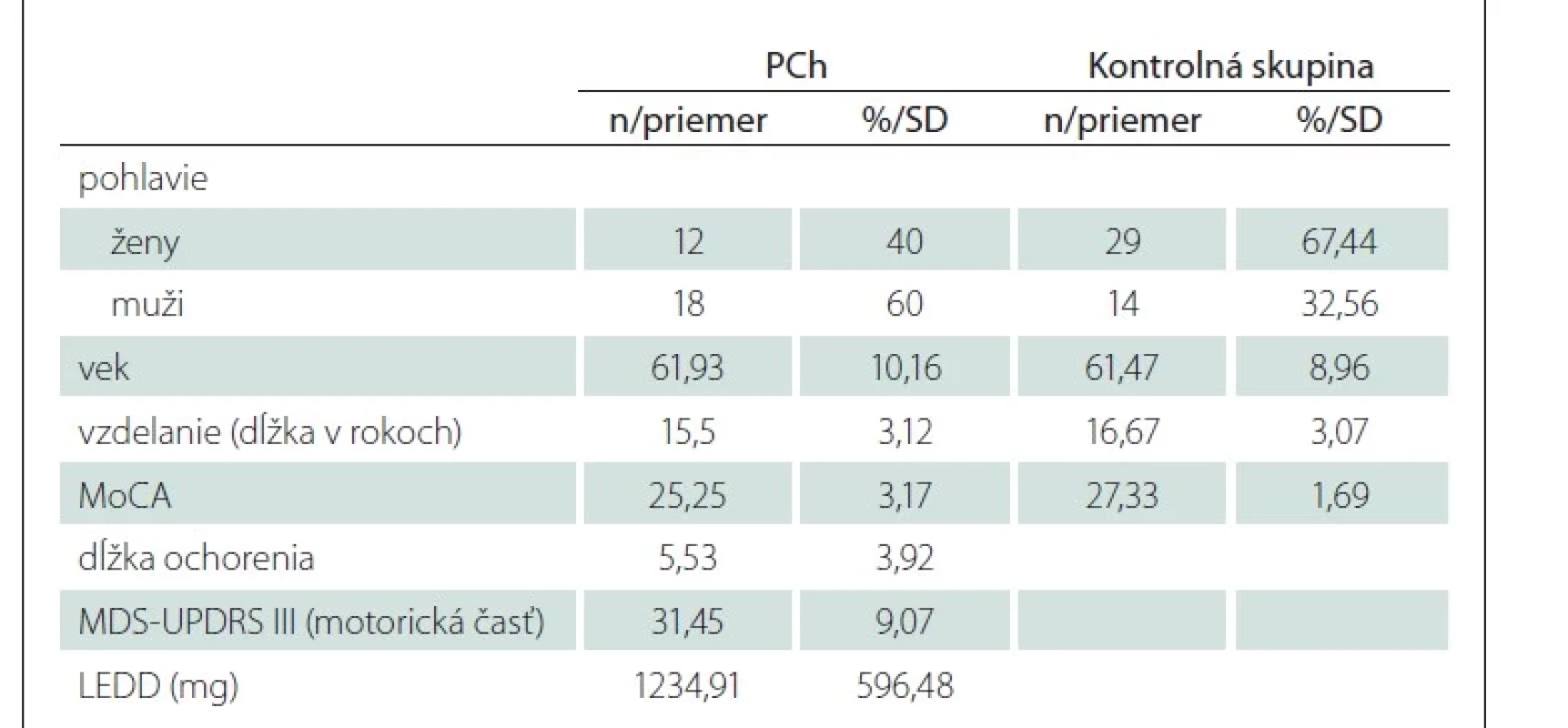
Kontrolnú skupinu zdravých ľudí bez neurologického ochorenia tvorilo 43 participantov (z toho 29 žien) vo veku 38–76 rokov. Priemerný vek bol 61,47 roka (SD = 8,96). Exklúznym kritériom výberu participantov do referenčnej skupiny bola prítomnosť oslabenia kognitívnych funkcií zistená skríningovým testom MoCA (cut-off skóre = 25). Skupiny boli vyvážené z hľadiska veku (U = 615,00; p = 0,74; d = 0,08) a tiež z hľadiska počtu rokov vzdelávania (U = 482,00; p = 0,07; d = 0,44).
Všetci pacienti aj zdraví participanti boli bez prítomnosti závažnej depresie, ktorá bola kvantifikovaná na základe Beckovho dotazníka depresie BDI-II (BDI-II) a klinického rozhovoru s neurológom.
Metódy zberu dát
DRS-2
DRS-2 [1] pozostáva z 5 subtestov, ktoré hodnotia výkon v nasledovných doménach: pozornosť (číselný rozsah, motorické odpovede na jednoduché príkazy, vizuálne rozpoznávanie, čítanie zoznamu slov a vizuálne priraďovanie obrazcov), pamäť (vybavenie zoznamu slov, dvoch jednoduchých viet a geometrických obrazcov, orientácia v čase, v priestore a v udalostiach), iniciácia/ perseverácia (generovanie slov v rôznych sémantických kategóriách, opakovanie podobných foném, vykonávanie striedavých pohybov, obkresľovanie geometrických útvarov), konštrukcia (rekonštrukcia vizuálnych obrazcov) a konceptualizácia (identifikácia rozdielov a podobností medzi jednoduchými geometrickými útvarmi, identifikácia podobností medzi pármi objektov, induktívne usudzovanie, určovanie nečlenov sémantických kategórií, generovanie jednoduchej vety pomocou zadaných slov). Vo väčšine štúdií sa však pracuje s celkovým skóre, ktorého teoretické rozpätie nadobúda hodnoty 0–144 bodov [14]. Súčasťou metódy je 32 podnetových kariet. Administrácia škály je odporúčaná pre ľudí vo veku 56–105 rokov. Dĺžka administrácie sa pohybuje v rozmedzí 20–45 min v závislosti od úrovne kognitívneho fungovania pacienta.
Neuropsychologická batéria
Participantom bola administrovaná komplexná batéria NEUROPSY, ktorá bola nedávno štandardizovaná a overená na slovenskej populácii [29]. V príspevku sú pre- zentované výsledky spracovania dát získaných metódami, ktoré merajú výkon v rovnakých doménach kognície ako DRS-2. Ukazovateľom úrovne pozornosti bolo skóre v testoch Symboly a Opakovanie čísel a tiež celkový čas v Testoch cesty (TMT) a v Stroopo- vom teste (subtest slová-farby). V testoch pamäti bol hodnotený rozsah bezprostrednej a oddialenej reprodukcie v Rey-Osterriethovom teste komplexnej figúry (ROCFT; vizuálna pamäť) a v Pamäťovom teste učenia AVLT (epizodická pamäť). Miera schopností iniciácie verbálnej produkcie sa hodnotila prostredníctvom testu fonematickej (K,P,S) a sémantickej fluencie (zelenina, zvieratá). Pre posúdenie konštrukčných schopností sme použili ROCFT. V batérii boli tiež zahrnuté skríningové testy kognitívnych funkcií – Montrealský skríning kognitívnych schopností (MoCA), Mini Mental State Examination (MMSE) a Batéria frontálnych funkcií (FAB). Skóre z vybraných subtestov bolo indikátorom pamäti, abstraktného myslenia a konceptualizácie.
Metódy analýzy dát
Konvergentná validita, ako aj vzťah so sociodemografickými charakteristikami a klinickými ukazovateľmi boli hodnotené prostredníctvom Spearmanovho koeficientu. Štatistickú významnosť a silu vzťahu medzi kategorizovanými premennými sme zisťovali prostredníctvom chí-kvadrát testu a koeficientu Cramerovo V. Reliabilita metódy bola odhadovaná prostredníctvom koeficientov Cronbachova alfa (a) a McDonaldova omega (w). Štatistickú významnosť rozdielov medzi klinickou a referenčnou skupinou, ako je medzi skupinami PCh a PCh-MCI sme analyzovali prostredníctvom Mann Whitney U testu. Ukazovateľom vecnej významnosti bol koeficient Cohenovo d s korekciou pre neparametrické testy (so zohľadnením U hodnoty a veľkosti porovnávaných skupín). Senzitivita a špecificita škály bola zisťovaná prostredníctvom analýz ROC (receiver operating characteristic).
Etické aspekty výskumu
Participanti sa výskumu zúčastnili dobrovoľne po podpísaní informovaného súhlasu, prostredníctvom ktorého boli poučení o priebehu výskumu a všetkých náležitostiach, ktoré účasť vo výskumnom projekte prinášala. Škála DRS-2 bola preložená a administrovaná so súhlasom vydavateľa (Psychological Assessment Resources, Inc.), Lutz, FL, USA. Preklad bol adaptovaný v súlade s postupom vyžadovaným spoločnosťou PAR Inc, ako aj odporúčaniami pre medzikulturálnu adaptáciu [30,31].
Výsledky
Celkové skóre v DRS-2 sa u pacientov s PCh pohybovalo v rozpätí 107–144 bodov (medián = 136,50; medzikvartilové rozpätie [IQR] = 130,00–140,25). Skóre vo všetkých subtestoch, najmä v dimenziách iniciácia/ perseverácia a konštrukcia, bolo záporne zošikmené. Koeficient šikmosti sa pohyboval v rozpätí od Skw = –0,79 (pozornosť) do Skw = –3,50 (konštrukcia). V subteste konštrukcia zároveň konštatujeme výrazný efekt stropu.
Vzťah skóre DRS-2, sociodemografických a klinických údajov
V klinickej skupine súviselo celkové skóre v škále DRS-2 s vekom (rs = –0,72; p = 0,01), ale nie s dĺžkou vzdelania v rokoch (rs = –0,07; p = 0,71). Vzťah dĺžky ochorenia s celkovým skóre bol pomerne slabý (rs = –0,27; p = 0,15), so subtestom konceptualizácia bol zistený stredne silný vzťah (rs = –0,38; p = 0,04). Miera závažnosti motorických symptómov zisťovaná prostredníctvom MDS-UPDRS III koreluje, aj keď štatisticky nevýznamne, len so skóre v pamäťovom subteste (rs = –0,32; p = 0,09). Hodnoty korelačných koeficientov tiež poukazujú na slabé záporné a štatisticky nevýznamné vzťahy medzi HY skóre a počtom bodov v celej škále (rs = –0,26; p = 0,16), ako aj v subtestoch iniciácia/ perseverácia (rs = –0,25; p = 0,18) a konceptualizácia (rs = –0,20; p = 0,29).
Psychometrické charakteristiky škály DRS-2
Súbežnú validitu sme overovali prostredníctvom korelačných analýz skóre v DRS-2 s vybranými neuropsychologickými testami. Hodnoty korelačných koeficientov uvádzame v tab. 2. Celkové skóre v DRS-2 u pacientov s PCh stredne silno až silno koreluje so skríningovými skúškami kognitívnych funkcií – MoCA testom (rs = 0,51; p = 0,01), MMSE (rs = 0,45; p = 0,02) a FAB (rs = 0,77; p < 0,001). Výkon v subteste, ktorý hodnotí pozornosť, koreluje stredne silno so skóre v tretej časti Stroopovho testu a s časom v Testoch cesty, ako aj s celkovým skóre v teste Symboly. Dostatočnú súbežnú evidenciu sme získali pre subtesty iniciácia/ perseverácia a pamäť. S rastúcim skóre v subteste iniciácia/ perseverácia stúpa počet vymenovaných slov v teste fonematickej fluencie a tiež počet vymenovaných druhov zvierat a zeleniny. Výkon v pamäťovej skúške DRS-2 koreluje stredne silno až silno s pamäťovým subtestom v MoCA teste (rs = 0,53; p = 0,01), s bezprostredným a s oddialeným vybavením podnetového materiálu v ROCFT (rs = 0,55; p = 0,01 a rs = 0,42; p = 0,11), ako aj slov v teste AVLT (rs = 0,49; p = 0,01 pre retenčný pokus A6 bezprostredne po interferenčnom pokuse a rs = 0,50; p = 0,01 pre vybavovanie po 30 min). Zanedbateľný vzťah sme však zistili medzi skóre v subteste konštrukcia a skóre v obkresľovaní ROCFT (rs = 0,05; p = 0,79). Skóre subtestu konceptualizácie len slabo koreluje s obdobným subtestom v teste MoCA (rs = 0,23; p = 0,17) a stredne silno so subtestom vo FAB (rs = 0,43; p = 0,02).
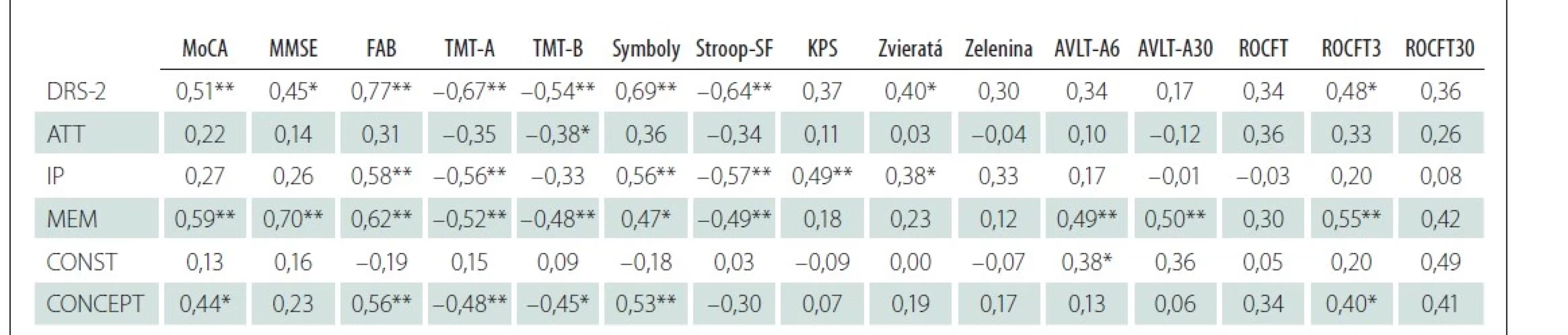
AVLT A6/A30 – Test pamäťového učenia (oddialené vybavovanie/po 30 min); ATT – pozornosť; CONCEPT – konceptualizácia; CONST – konštrukcia;
DRS-2 – Dementia Rating Scale-2; FAB – Batéria frontálnych funkcií; IP – iniciácia/perseverácia; KPS – test fonematickej fluencie; MEM – pamäť;
MMSE – Mini Mental State Examination; MoCA – Montrealský skríning kognitívnych funkcií; n – počet; ROCFT/3/30 – Test komplexnej figúry (kópia,
oddialené vybavenie po 3/30 min); Stroop-SF – Stroopov test; TMT – Test cesty
Vzhľadom na nízke teoretické rozpätie bodov v jednotlivých úlohách a nízku variabilitu skóre sme do analýzy reliability zaradili subskóre v jednotlivých dimenziách testu. Koeficienty reliability u participantov s PCh nadobúdali hodnoty a = 0,52 a w = 0,67. Skóre v subteste konštrukcia záporne korelovalo so zvyškom položiek zaradených do analýzy (r = –0,13). Hodnoty korelačných koeficientov medzi subtestami v skupine pacientov s PCh uvádzame v tab. 3.
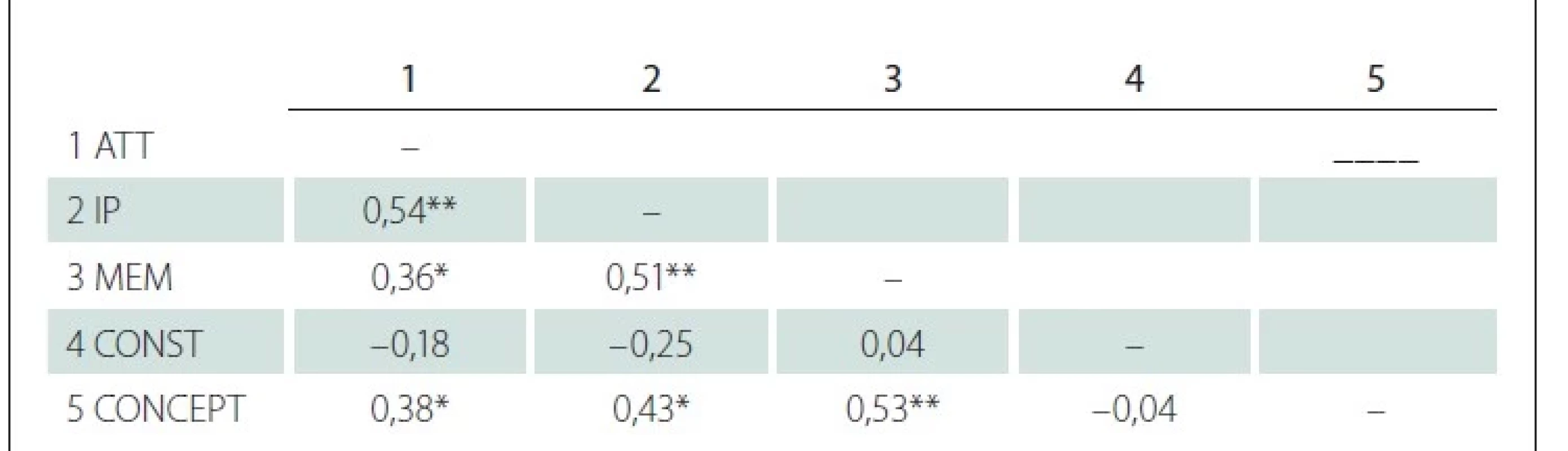
ATT – pozornosť; CONCEPT – konceptualizácia; CONST – konštrukcia; DRS-2 – Dementia Rating
Scale-2; IP – iniciácia/perseverácia; MEM – pamäť; n – počet
Senzitivita a špecificita škály DRS-2
U pacientov s PCh v porovnaní s referenčnou skupinou bol zistený horší výkon vo viacerých kognitívnych doménach (tab. 4). Veľké rozdiely boli identifikované v celkovom skóre (U = 320,00; p < 0,001; d = 0,92), ako aj v subtestoch iniciácia/ perseverácia (U = 325,00; p < 0,001; d = 0,90) a konceptualizácia (U = 324,50; p < 0,001; d = 0,93). Rozdiel vo výkone v pamäťovom subteste bol z hľadiska vecnej signifikancie stredne veľký (U = 431,00; p = 0,01; d = 0,59). Optimálne cut-off skóre pre odlíšenie pacientov s PCh od zdravých kontrol bolo 138 bodov (AUC = 74,60 %; 95 % CI [62,00–87,20]; senzitivita 70,00 % a špecificita 73,80 %).
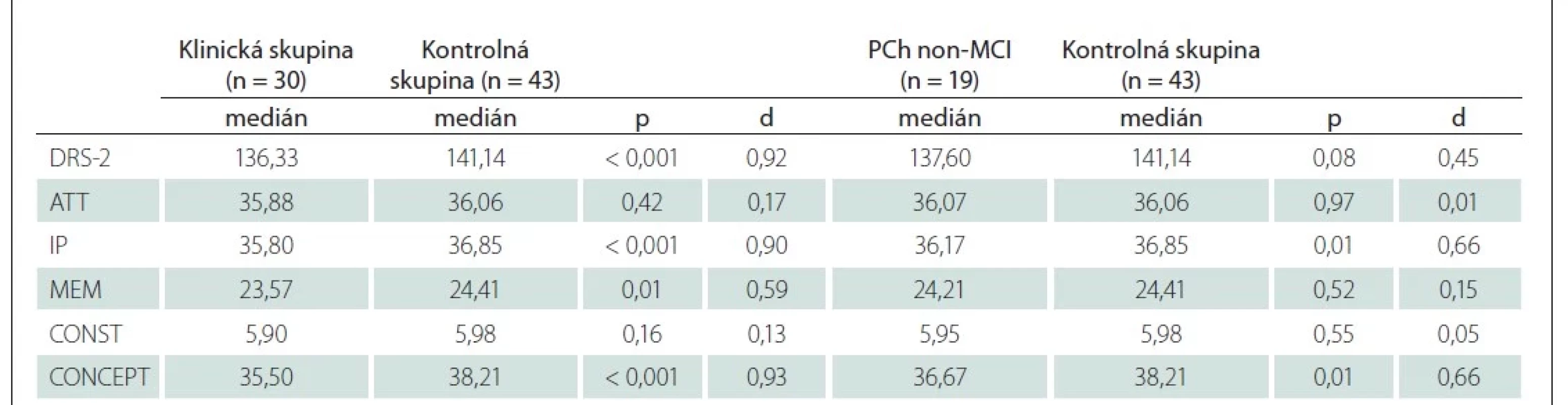
Na základe stanoveného kritéria (skóre v teste MoCA ≤ 25 bodov) sme u 11 pacientov konštatovali MCI na úrovni 1 [32]. U pacientov s PCh-MCI sme v porovnaní s pacientmi s PCh bez kognitívneho deficitu zistili horší výkon v pamäťovom subteste (U = 26,50; p < 0,001; d = 1,50), ďalej v subtestoch konceptualizácia (U = 46,00; p = 0,01; d = 1,04) a iniciácia/ perseverácia (U = 63,00; p = 0,08; d = 0,69). Rozdiel v celkovom skóre DRS-2 predstavuje 10,6 bodu a z hľadiska vecnej závažnosti ho možno považovať za veľký (U = 30,50; p = 0,01; d = 1,43). Výsledky komparačnej analýzy uvádzame v tab. 5. Rozdiel medzi pacientami s PCh bez kognitívneho oslabenia a zdravými kontrolami nebol významný (U = 288,00; p = 0,08; d = 0,45). Výsledky analýzy rozdielov v skóre v jednotlivých subtestoch prezentujeme v tab. 4.
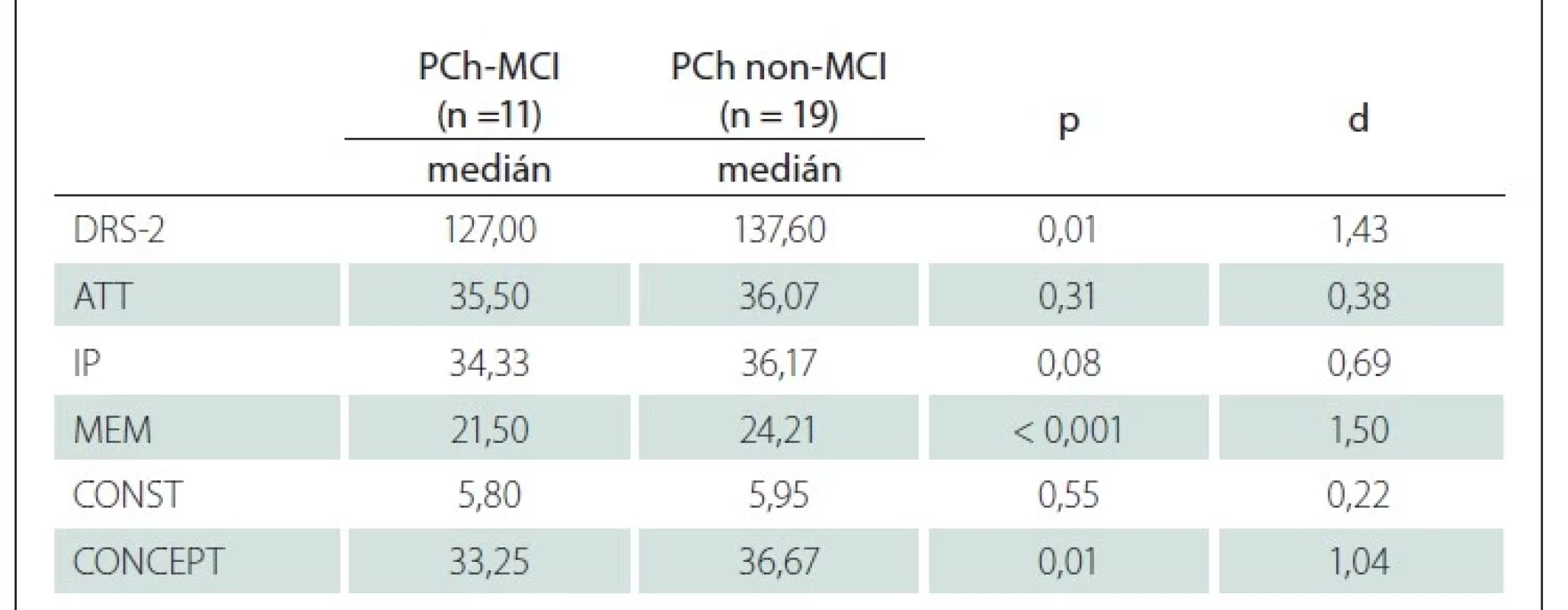
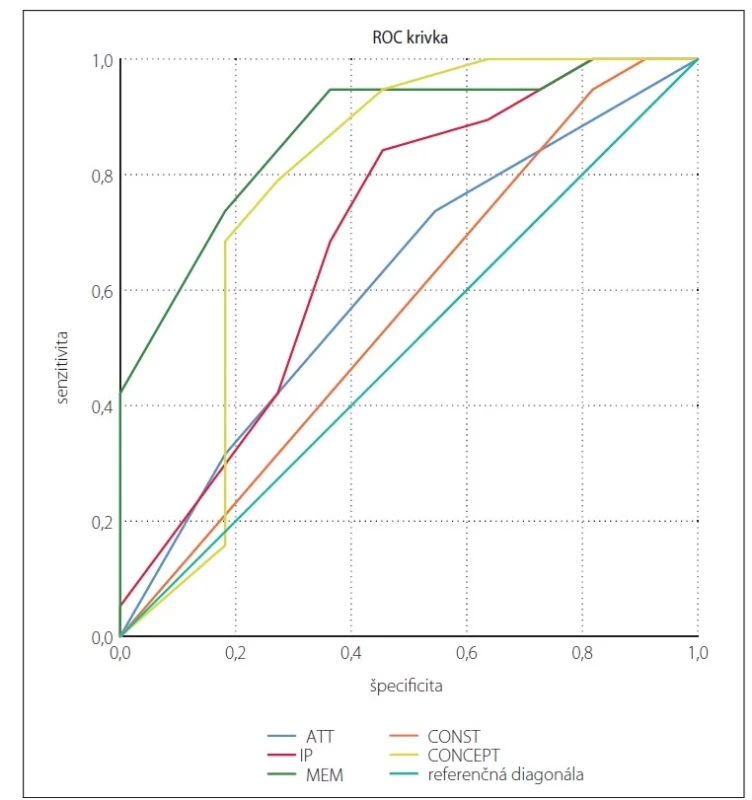
Pre odlíšenie pacientov s PCh bez kognitívneho deficitu a pacientov s MCI sme stanovili cut-off skóre 134 bodov (AUC = 85,40 %; 95 % CI [69,90–100,00]; senzitivita 81,80 % a špecificita 89,50 %). Najlepšiu diskriminačnú schopnosť majú subtesty pamäť a konceptualizácia (tab. 6, obr. 1).
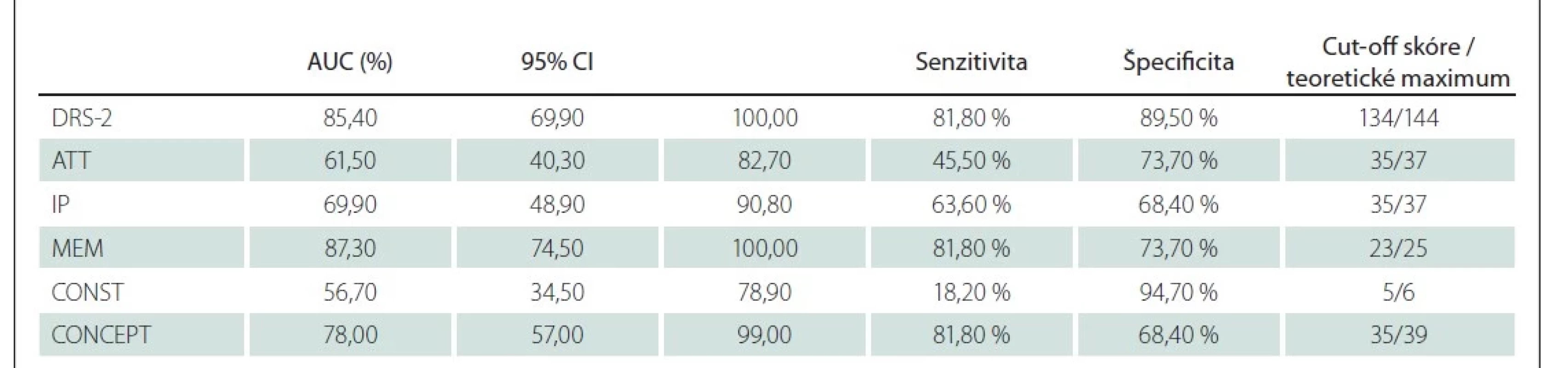
ATT – pozornosť; CONST – konštrukcia; CONCEPT – konceptualizácia; DRS-2 – Dementia Rating
Scale-2; IP – iniciácia/perseverácia; MCI – mierna kognitívna porucha; MEM – pamäť;
PCh – Parkinsonova choroba; ROC – receiver operating characteristic
Fig. 1. ROC curves for particular DRS-2 subtests – PD vs. PD-MCI. The most discrimination
power was shown for memory and conceptualization subtests.
ATT – attention; CONST – construction; CONCEPT – conceptualization; DRS-2 – Dementia Rating
Scale-2; IP – initiation/perseveration; MCI – mild cognitive impairment; MEM – memory;
PD – Parkinson‘s disease; ROC – receiver operating characteristic
Na základe zisteného cut-off skóre v DRS-2 sme rozdelili pacientov s PCh do skupín bez kognitívneho oslabenia a s prítomnou MCI. Následne sme porovnali distribúciu participantov v týchto kategóriách podľa MoCA a DRS-2. Prostredníctvom obidvoch nástrojov bola MCI zhodne identifikovaná u 30 % pacientov (n = 9). Dvaja participanti získali nižšie ako hraničné skóre v teste MoCA, avšak nie v DRS-2. Rovnako u dvoch pacientov skóre v DRS-2 naznačuje MCI, ktoré nebolo v súlade s výkonom v teste MoCA. Výkon v pásme normy sme na základe skóre v obidvoch metódach zistili u 56,70 % pacientov (n = 17). Vzťah medzi výkonmi v obdivoch testoch bol silný (X2 [1, n = 30] = 15,25; p < 0,001; V = 0,71).
Diskusia
Našou štúdiou sme zhodnotili vybrané psychometrické vlastnosti slovenskej verzie DRS-2 na klinickej vzorke pacientov s PCh bez demencie a na vzorke vekovo a vzdelanostne spárovanej referenčnej skupiny. Celkové skóre DRS-2 negatívne korelovalo s vekom, čo je v súlade s viacerými publikovanými štúdiami [20,33]. Obdobné zistenia boli publikované aj v porovnaní s inými skríningovými kognitívnymi nástrojmi, preto aj v prípade DRS-2 je odporúčané používať cut-off skóre s ohľadom na vekové skupiny [21], to ale vzhľadom k veľkosti našej vzorky nebolo možné overiť. V rámci ďalších vzťahových analýz sme nezistili vzťah skóre v DRS-2 s dĺžkou vzdelania. Tieto zistenia sú v súlade so závermi americkej štúdie pacientov s PCh s oslabením kognície [24]. Korešpondujú tiež s výsledkami výskumu pacientov s PCh indikovaných na DBS, v ktorom úroveň vzdelania nebola signifikantným prediktorom výkonu v DRS-2. [16]. Tento výsledok však mohol byť ovplyvnený relatívne malou variabilitou dĺžky vzdelania v našej vzorke, jednalo sa skôr o pacientov s vyšším vzdelaním.
Výsledky analýzy reliability poukazujú na nízke hodnoty koeficientov vnútornej konzistencie. Ich hodnota však môže byť skreslená nízkym počtom položiek zaradených do analýzy (vzhľadom na nízke teoretické rozpätie položiek boli do analýzy zaradené subskóre v jednotlivých dimenziách testu). Nižšia reliabilita môže byť tiež dôsledkom merania v pomerne homogénnej skupine participantov. Za problematickú považujeme zápornú koreláciu skóre v dimenzii konštrukcia s počtom bodov vo zvyšných častiach testu. V subteste sme zároveň zistili efekt stropu a veľmi nízku variabilitu dát, ktorá poukazuje na nízku chybovosť pacientov s PCh pri obkresľovaní pomerne jednoduchých geometrických útvarov. Test vykazoval nízku vnútornú konzistenciu aj v pilotnom overovaní metódy autorom škály [1].
Podporným faktom pre budúce používanie DRS-2 v slovenskom jazyku je zistenie štatisticky významných korelácií celkového skóre s ostatnými použitými skríningovými metódami (MoCA, MMSE a FAB), čo potvrdzuje dobrú konvergentnú validitu. Naopak v štúdii realizovanej Kaszásom et al [13] korelovalo celkové skóre DRS-2 so skríningovými nástrojmi kognitívneho výkonu (MMSE, FAB) u pacientov s PCh len veľmi slabo (r = 0,01–0,11). Jednoznačnou výhodou DRS-2 oproti týmto metódam je vyšetrenie viacerých kognitívnych domén a širšie rozpätie jednotlivých položiek. Spomedzi piatich subtestov škály DRS-2, vynímajúc doménu konštrukcia, sme potvrdili štatisticky významný vzťah s analogickými testami obsiahnutými v komplexnej neuropsychologickej batérii. Najsilnejšie vzťahy sme zistili pre subtesty iniciácia/ perseverácia a pamäť. Obdobné výsledky boli zistené aj v iných štúdiách, čo viedlo k skráteným verziám nástroja pozostávajúcich zo subtestov pamäť, iniciácia/ perseverácia a konceptualizácia [19].
Na základe ROC analýzy sme objektivizovali dobrú diskriminačnú silu pri pacientoch s PCh bez kognitívneho deficitu a PCh-MCI so stanovením optimálneho cut-off skóre 134 bodov, senzitivitou 81,80 % a špecificitou 89,50 %. Toto hraničné skóre je relatívne nižšie oproti publikovaným zahraničným štúdiám [8,15,16]. Vysvetlením môže byť fakt, že PCh-MCI pacienti boli do skupiny zaradení len na základe skríningového vyšetrenia (úroveň I MDS Task Force kritérií) a pacientska vzorka bola relatívne malá. Do súboru zároveň neboli zahrnutí pacienti s demenciou, u ktorých bola zistená vyššia diagnostická presnosť nástroja [19].
Prezentované predbežné výsledky je potrebné interpretovať v kontexte viacerých limitácií. Veľkosť vzorky spôsobila, že sme nemali dostatočne veľkú silu štatistických testov. Bolo to zrejmé najmä z hodnôt korelačných koeficientov, ktoré poukazovali na stredne silné vzťahy, ktoré však neboli štatisticky významné. Považujeme ale za potrebné dodať, že tieto vzťahy boli v očakávaných smeroch, čo prináša dôležité informácie o validite slovenskej verzie DRS-2. Aj napriek administrácii pomerne rozsiahlej neuropsychologickej batérie nebol výkon v každej oblasti kognície (pozornosť a pracovná pamäť, exekutívne funkcie, jazyk a reč, pamäť, vizuopriestorové funkcie) posúdený minimálne dvomi metódami. Stanovenie MCI prostredníctvom komplexnej batérie, t.j. na úrovni 2 podľa kritérií Movement Disorder Society [32], by prinieslo presnejšie a spoľahlivejšie výsledky. Overovanie psychometrických vlastností škály bolo zároveň realizované len u pacientov bez oslabenia kognitívnych funkcií a u pacientov s miernou kognitívnou poruchou. Výsledky tak nemožno zovšeobecňovať na pacientov s demenciou a pre určenie hraničného skóre pre odlíšenie závažnosti deficitu (MCI vs. demencia) je potrebný ďalší výskum.
Záver
Výsledky našej pilotnej štúdie ukazujú, že Mattisova škála demencie je nástrojom s vyhovujúcimi psychometrickými vlastnosťami, ktorú možno potenciálne použiť na kognitívne testovanie zdravej populácie a pacientov s PCh v slovenskom jazyku. V ďalšom výskume je však nutné získať väčšiu a klinicky heterogénnu vzorku, na ktorej bude ďalej možné overiť viaceré psychometrické vlastnosti, ako napr. faktorovú štruktúru nástroja. Za dôležité tiež považujeme zrealizovať ďalšie odhady reliability, a to prostredníctvom metódy test-retest a zhody viacerých posudzovateľov.
Etické apekty
Práca bola vykonaná v zhode s Helsinskou deklaráciou z roku 1975 a jej revíziami v rokoch 2004 a 2008. Výskum bol schválený Etickou komisiou UNB v Bratislave dna 18. 3. 2018 (kód štúdie: KOGEX). Škála DRS-2 bola preložená a administrovaná so súhlasom vydavateľa (Psychological Assessment Resources, Inc.).
Podpora
Výskum bol realizovaný s podporou crowdfundingovej kampane „Aby veda nebola bieda“ prostredníctvom platformy StartLab. Výskum nebol podporený žiadnou farmaceutickou firmou.
Konflikt záujmov
Autori nemajú finančné, ani iné záväzky, ktoré by mohli viesť ku konfliktom záujmov. Výskum nebol podporený žiadnou farmaceutickou firmou.
MUDr. Zuzana Košutzká, PhD.
II. neurologická klinika
LF UK a UN Bratislava
Limbová 5
833 05 Bratislava
Slovensko
e-mail: zuzanakosutzka@gmail.com
Přijato k recenzi: 9. 10. 2022
Přijato do tisku: 4. 5. 2023
Sources
1. Jurica PJ, Leitten CL, Mattis S. Dementia Rating Scale-2. Psychological Assessments Recources 2001.
2. Marson DC, Dymek MP, Duke LW et al. Subscale validity of the Mattis Dementia Rating Scale. Arch Clin Neuropsychol 1997; 12(3): 269–275.
3. Chou KL, Amick MM, Brandt J et al. A recommended scale for cognitive screening in clinical trials of Parkinson‘s disease. Mov Disord 2010; 25(15): 2501–2507. doi: 10.1002/ mds.23362.
4. Skorvanek M, Goldman JG, Jahanshahi M et al. Global scales for cognitive screening in Parkinson‘s disease: critique and recommendations. Mov Disord 2018; 33(2): 208–218. doi: 10.1002/ mds.27233.
5. Baiano C, Barone P, Trojano L et al. Prevalence and clinical aspects of mild cognitive impairment in Parkinson‘s disease: a meta-analysis. Mov Disord 2020; 35(1): 45–54. doi: 10.1002/ mds.27902.
6. Kehagia AA, Barker RA, Robbins TW. Neuropsychological and clinical heterogeneity of cognitive impairment and dementia in patients with Parkinson‘s disease. Lancet Neurol 2010; 9(12): 1200–1213. doi: 10.1016/ S1474-4422(10)70212-X.
7. Deuschl G, Schade-Brittinger C, Krack P et al. A randomized trial of deep-brain stimulation for Parkinson‘s disease. N Engl J Med 2006; 355(9): 896–908. doi: 10.1056/ NEJMoa060281.
8. Bezdicek O, Michalec J, Nikolai T et al. Clinical validity of the Mattis Dementia Rating Scale in differentiating mild cognitive impairment in Parkinson‘s disease and normative data. Dement Geriatr Cogn Disord 2015; 39 (5–6): 303–311. doi: 10.1159/ 000375365.
9. Brown GG, Rahill AA, Gorell JM et al. Validity of the Dementia Rating Scale in assessing cognitive function in Parkinson‘s disease. J Geriatr Psychiatry Neurol 1999; 12(4): 180–188. doi: 10.1177/ 089198879901200 403.
10. Villeneuve S, Rodrigues-Brazète J, Joncas S et al. Validity of the Mattis Dementia Rating Scale to detect mild cognitive impairment in Parkinson‘s disease and REM sleep behavior disorder. Dement Geriatr Cogn Disord 2011; 31(3): 210–217. doi: 10.1159/ 000326212.
11. Schmidt KS, Mattis PJ, Adams J et al. Alternate-form reliability of the Dementia Rating Scale-2. Arch Clin Neuropsychol 2005; 20(4): 435–441. doi: 10.1016/ j.acn. 2004.09.011.
12. Boycheva E, Contador I, Fernández-Calvo B et al. Spanish version of the Mattis Dementia Rating Scale-2 for early detection of Alzheimer‘s disease and mild cognitive impairment. Int J Geriatr Psychiatry 2018; 33(6): 832–840. doi: 10.1002/ gps.4707.
13. Kaszás B, Kovács N, Balás I et al. Sensitivity and specificity of Addenbrooke‘s Cognitive Examination, Mattis Dementia Rating Scale, Frontal Assessment Battery and Mini Mental State Examination for diagnosing dementia in Parkinson‘s disease. Parkinsonism Relat Disord 2012; 18(5): 553–556. doi: 10.1016/ j.parkreldis.2012.02. 010.
14. Lyness SA, Hernandez I, Chui HC et al. Performance of Spanish speakers on the Mattis dementia rating scale (MDRS). Arch Clin Neuropsychol 2006; 21(8): 827–836. doi: 10.1016/ j.acn.2006.09.003.
15. Pirogovsky E, Schiehser DM, Litvan I et al. The utility of the Mattis Dementia Rating Scale in Parkinson‘s disease mild cognitive impairment. Parkinsonism Relat Disord 2014; 20(6): 627–631. doi: 10.1016/ j.parkreldis.2014.03. 010.
16. Koevoets EW, Schmand B, Geurtsen GJ. Accuracy of two cognitive screening tools to detect mild cognitive impairment in Parkinson‘s disease. Mov Disord Clin Pract 2018; 5(3): 259–264. doi: 10.1002/ mdc3.12597.
17. Mazancova AF, Růžička E, Jech R et al. Test the best: classification accuracies of four cognitive rating scales for Parkinson‘s disease mild cognitive impairment. Arch Clin Neuropsychol 2020; acaa039. doi: 10.1093/ arclin/ acaa039.
18. Matteau E, Dupré N, Simard M. Detection of mild cognitive impairment in idiopathic Parkinson‘s disease with the Mattis Dementia Rating Scale. Alzheimers Dement 2008; 4(4): 267.
19. Llebaria G, Pagonabarraga J, Kulisevsky J et al. Cut-off score of the Mattis Dementia Rating Scale for screening dementia in Parkinson‘s disease. Mov Disord 2008; 23(11): 1546–1550. doi: 10.1002/ mds.22173.
20. Lavoie M, Callahan B, Belleville S et al. Normative data for the Dementia Rating Scale-2 in the French-Quebec population. Clin Neuropsychol 2013; 27(7): 1150–1166. doi: 10.1080/ 13854046.2013.825010.
21. Pedraza O, Lucas JA, Smith GE et al. Robust and expanded norms for the Dementia Rating Scale. Arch Clin Neuropsychol 2010; 25(5): 347–358. doi: 10.1093/ arclin/ acq030.
22. Rilling LM, Lucas JA, Ivnik RJ et al. Mayo‘s Older African American Normative Studies: norms for the Mattis Dementia Rating Scale. Clin Neuropsychol 2005; 19(2): 229–242. doi: 10.1080/ 13854040590945 328.
23. Strutt AM, Ayanegui IG, Scott BM et al. Influence of socio-demographic characteristics on DRS-2 performance in Spanish-speaking older adults. Arch Clin Neuropsychol 2012; 27(5): 545–556. doi: 10.1093/ arclin/ acs 049.
24. Pontone GM, Palanci J, Williams JR et al. Screening for DSM-IV-TR cognitive disorder NOS in Parkinson‘s disease using the Mattis Dementia Rating Scale. Int J Geriatr Psychiatry 2013; 28(4): 364–371. doi: 10.1002/ gps.3833.
25. Goetz CG, Poewe W, Rascol O et al. Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations. Mov Disord 2004; 19(9): 1020–1028. doi: 10.1002/ mds.20213.
26. Postuma RB, Berg D, Stern M et al. MDS clinical diagnostic criteria for Parkinson‘s disease. Mov Disord 2015; 30(12): 1591–1601. doi: 10.1002/ mds.26424.
27. Goetz CG, Tilley BC, Shaftman SR et al. Movement Disorder Society-sponsored revision of the Unified Parkinson‘s Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Mov Disord 2008; 23(15): 2129–2170. doi: 10.1002/ mds.22 340.
28. Tomlinson CL, Stowe R, Patel S et al. Systematic review of levodopa dose equivalency reporting in Parkinson‘s disease. Mov Disord 2010; 25(15): 2649–2653. doi: 10.1002/ mds.23429.
29. Hajdúk M, Brandoburová P, Pribišová K et al. NEUROPSY: Štandardizácia neuropsychologickej testovej batérie na dospelej slovenskej populácii. Bratislava: Univerzita Komenského v Bratislave 2021.
30. Beaton DE, Bombardier C, Guillemin F et al. Guidelines for the process of cross-cultural adaptation of self--report measures. Spine 2000; 25(24): 3186–3191. doi: 10.1097/ 00007632-200012150-00014.
31. Franzen S, Papma JM, van den Berg E et al. Cross- -cultural neuropsychological assessment in the European Union: a Delphi expert study. Arch Clin Neuropsychol 2021; 36(5): 815–830. doi: 10.1093/ arclin/ acaa 083.
32. Litvan I, Goldman JG, Tröster AI et al. Diagnostic criteria for mild cognitive impairment in Parkinson‘s disease: Movement Disorder Society Task Force guidelines. Mov Disord 2012; 27(3): 349–356. doi: 10.1002/ mds.24 893.
33. Chan AS, Choi MK, Salmon DP. The effects of age, education, and gender on the Mattis Dementia Rating Scale performance of elderly Chinese and American individuals. J Gerontol B Psychol Sci Soc Sci 2001; 56(6): P356–363. doi: 10.1093/ geronb/ 56.6.p356.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2023 Issue 3
Most read in this issue
- Verification of the psychometric properties of the Slovak version of the Dementia Rating Scale-2 in a healthy population and in patients with Parkinson‘s disease – a pilot study
- Analysis of a patient group with head and facial injuries in scooter accidents treated at the Central Military Hospital in Prague from 2010 to 2022
- Total locked-in syndrome in a severe course of acute polyradiculoneuritis
- Benefits and pitfalls of carotid stents with dual-layer design – a systematic review
