Patologické nálezy na zobrazení pomocí magnetické rezonance u onemocnění asociovaného s pozitivními protilátkami proti myelinovému oligodendrocytárnímu glykoproteinu
Pathological magnetic resonance imaging findings in myelin oligodendrocyte glycoprotein antibody-associated disease
Myelin oligodendrocyte glycoprotein antibody-associated disease is a recently identified autoimmune demyelinating disease that occurs both in adults and children. Clinical symptoms of this disease may overlap with MS or neuromyelitis optica spectrum disorders clinical presentation. In addition to the presence of serum autoantibodies, MRI findings in the brain and spinal cord are important for the diagnosis of the disease. Articles have been published describing pathological findings on MRI in an attempt to define the typical pattern of involvement for this disease and to distinguish it from other demyelinating diseases. Some patients were diagnosed under other medical conditions in the past. We would like to share our experience with MRI diagnosis of this disease and present the findings of a cohort of seven patients.
Keywords:
MRI – Brain – Multiple sclerosis – Spinal cord – neuromyelitis optica – myelin oligodendrocyte glycoprotein
Authors:
M. Vaněčková 1; P. Nytrová 2
Authors‘ workplace:
Oddělení MR, Radiodiagnostická klinika 1. LF UK a VFN v Praze
1; Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
2
Published in:
Cesk Slov Neurol N 2022; 85(4): 330-335
Category:
From Clinical Praxis
doi:
https://doi.org/10.48095/cccsnn2022330
Overview
Onemocnění asociované s protilátkami proti myelinovému oligodendrocytárnímu glykoproteinu je v nedávné době popsané autoimunitní demyelinizační onemocnění CNS, které se manifestuje jak v dospělosti, tak i u dětí. Klinické projevy této nemoci se mohou překrývat s RS či neuromyelitis optica a onemocněním jejího širšího spektra. Kromě průkazu autoprotilátek v séru je pro diagnostiku onemocnění důležitý nález na zobrazení MR mozku a míchy. Byly publikovány práce s popisy patologických nálezů při zobrazení pomocí MR, kde byla snaha o definici typického postižení pro tuto jednotku a odlišení od dalších demyelinizačních onemocnění. Někteří pacienti byli v minulosti vedeni pod jiným typem diagnózy. Chtěli bychom sdělit naše zkušenosti s diagnostikou pomocí MR u tohoto onemocnění a prezentovat nálezy souboru sedmi pacientů.
Klíčová slova:
roztroušená skleróza – MR – neuromyelitis optica – mícha – mozek – myelin oligodendrocytární glykoprotein
Úvod
Onemocnění asociované s protilátkami proti myelinovému oligodendrocytárnímu glykoproteinu (MOG-IgG) (myelin oligodendrocyte glycoprotein associated disease; MOGAD) je v nedávné době popsané autoimunitní onemocnění, které se projevuje demyelinizací CNS a vyskytuje se jak v dospělosti, tak i u dětí [1]. Medián manifestace onemocnění je ve třetí dekádě s mírnou převahou u žen [2,3]. Onemocnění se vyskytuje zřídka, dle holandské studie, v které bylo vyšetřeno 1 244 pacientů pro získaný demyelinizační syndrom, byla incidence MOGAD 0,16 případů na 100 000 obyvatel, s mírně vyšší séropozitivitou u dětí 0,31 vs. 0,13 u dospělých [4].
Onemocnění se může klinickým fenotypem překrývat s RS a s onemocněním ze spektra neuromyelitis optica (neuromyelitis optica spectrum disorders; NMOSD). Měli bychom tedy usilovat o správné diagnostické zařazení i vzhledem k odlišnostem v terapii těchto nemocí. V roce 2018 Jarius et al navrhli diagnostická kritéria (pod názvem MOG encefalomyelitida), jejichž součástí je i zobrazení pomocí MR [5,6]. Klinicky se onemocnění může prezentovat jako akutní diseminovaná encefalomyelitida (ADEM), která je nejčastějším projevem u dětí a mívá monofázický průběh [7]. U dospělých je manifestace podobná ADEM méně častá (udává se do 18 %) [7]. Nejčastěji se vyskytuje optická neuritida, která je popisována jako prvotní příznak u 44–60 % pacientů [7]. U mladých pacientů bývá unilaterální, u starších pacientů je typicky bilaterální a postihuje především přední segment [8]. Izolovaná transverzální myelitida se jako prvotní příznak vyskytuje přibližně u 20 % pacientů, v kombinaci s optickou neuritidou do 15 %. Další manifestací může být kmenová encefalitida, častěji bývá postižení crura cerebri či pontu [9]. Nejnověji popisovaným projevem je kortikální encefalitida klinicky provázená epileptickými paroxyzmy [10].
V současnosti přibývají práce, které popisují nálezy při zobrazení MR u tohoto onemocnění. Stejně jako tomu bylo před více než 20 lety u neuromyelitis optica (NMO), kdy se nejprve prezentovalo, že zobrazení mozku pomocí MR by mělo být negativní a klinické postižení je dáno postižením zrakových nervů nebo míchy. Později po objevu autoprotilátek proti akvaporinu-4 (AQ4-IgG) byl tento koncept přehodnocen a akceptovalo se i nespecifické drobnoložiskové postižení nesplňující v té době platná MR zobrazovací kritéria pro RS [11]. Postupně byly publikovány další práce, které u NMO popisovaly ložiska v lokalitách mimo optický nerv a míchu – např. v mozkovém kmeni (typicky area postrema a další), a zavedl se termín NMOSD [10]. V roce 2015 byla panelem odborníků navržena nová kritéria pro NMOSD, která již akceptují klinické příznaky i z oblastí mimo míchu a optický nerv, vč. nálezů na zobrazení MR [6]. V několika posledních letech byly publikovány první kohorty pacientů s MOGAD a jejich nálezy na MR zobrazení a bylo upozorněno na jeho jisté odlišnosti v porovnání s RS a NMOSD [10,12–16].
Soubor pacientů a metodika
Náš soubor čítal sedm pacientů (z toho čtyři ženy), kteří byli diagnostikováni v letech 2009–2021. U všech byla diagnóza potvrzena pozitivitou MOG-IgG v séru. Demografii pacientů uvádíme v tab. 1. Vyšetření pomocí MR bylo provedeno na různých typech přístrojů o síle 1,5 T a 3 T. Protokol vždy zahrnoval sekvenci potlačující signál tekutiny – fluid attenuated inversion recovery (FLAIR) – 2D či 3D a T2 vážený obraz pro vyšetření mozku, u dvou pacientů doplněný o 3D sekvenci s potlačením signálu tekutiny i bílé hmoty – double inversion recovery (DIR). Mícha byla vyšetřena v sagitálním T2 váženém obraze pro zobrazení míchy (bez potlačení tuku nebo technikou potlačující tuk – short-tau inversion recovery [STIR] nebo se saturací signálu tuku [Fat Sat]), v T1 váženém obraze. Kontrastní látka na bázi gadolinia byla podána ve dvou případech. Rozdílná kvalita snímků a parametry sekvencí byly dány retrospektivním hodnocením jednotlivých MR vyšetření v dlouhém časovém horizontu.
Výsledky
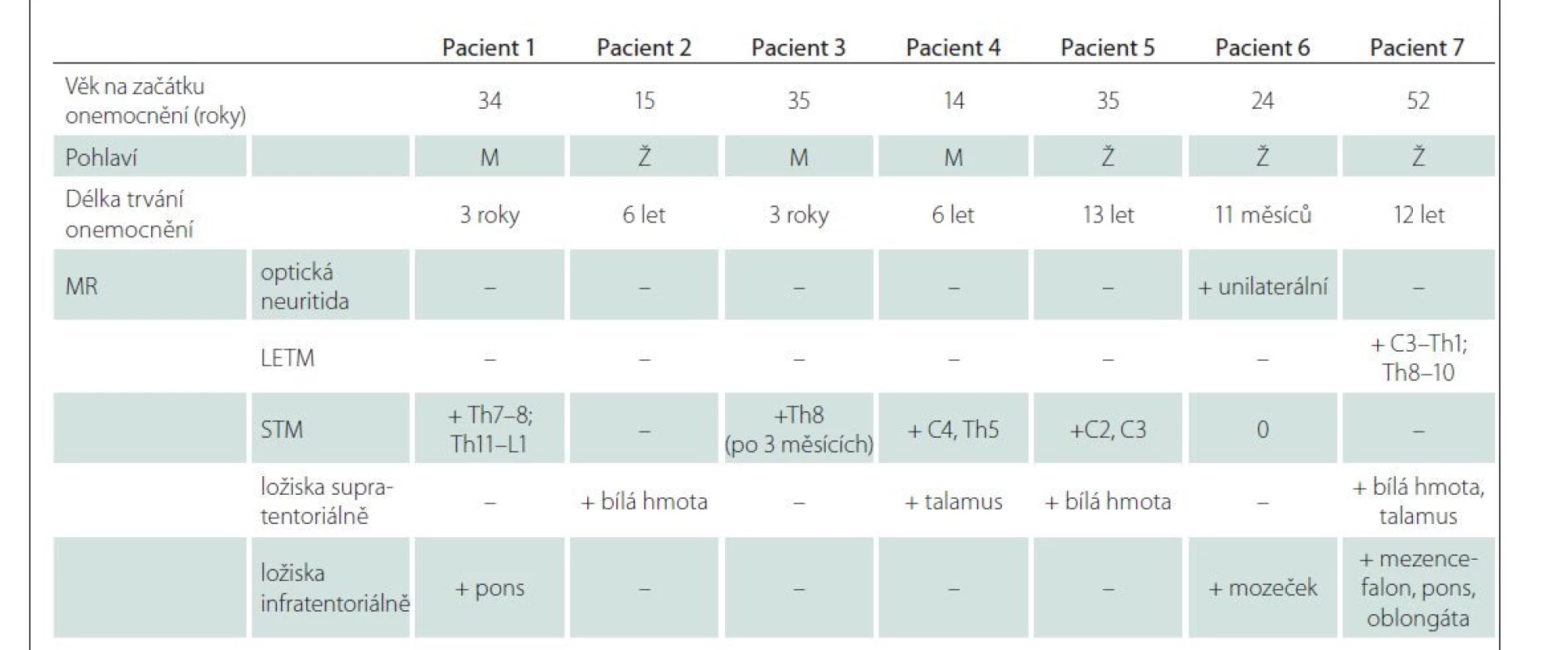
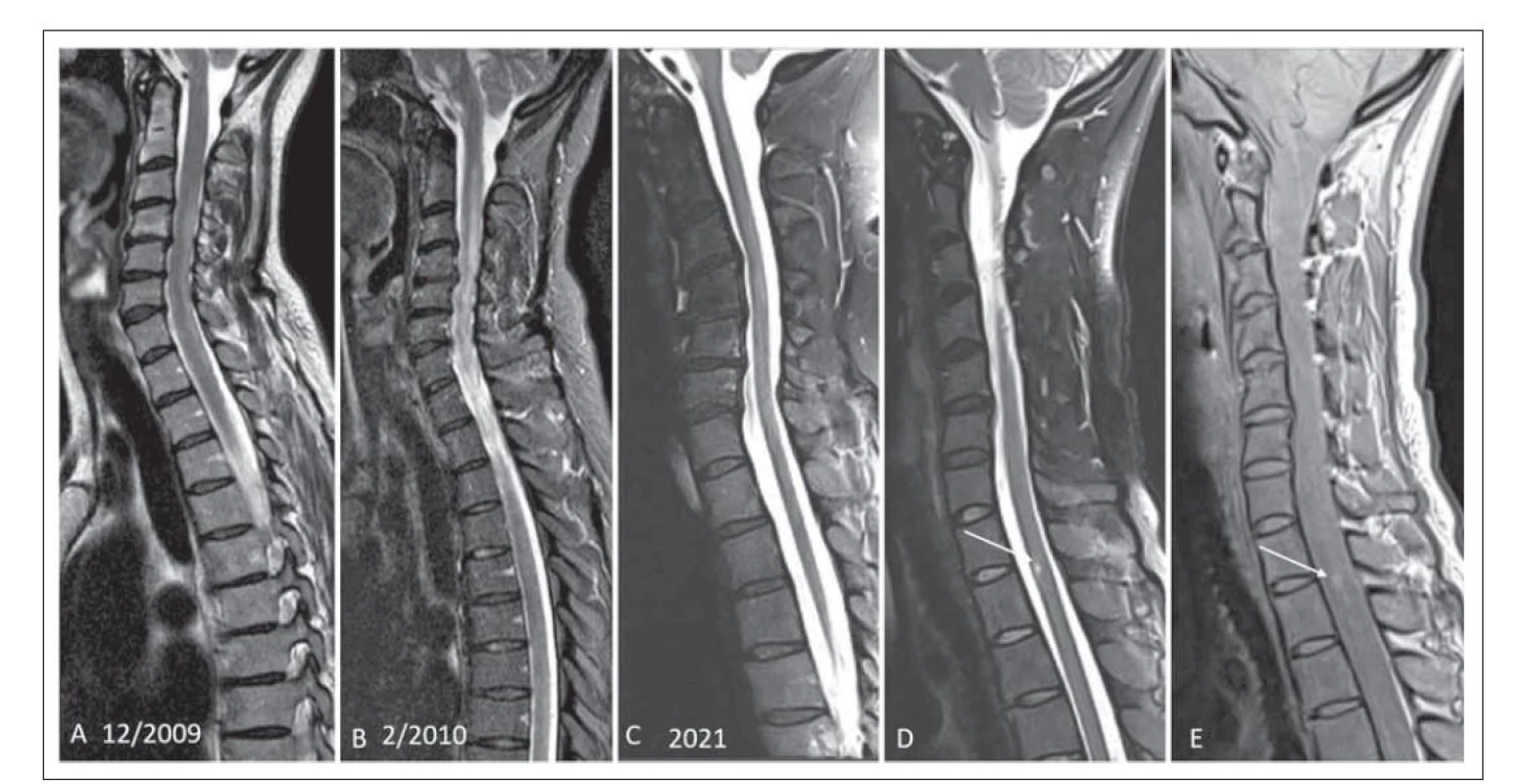
V šesti případech byla projevem myelitida. V jednom případě se jednalo o rozsáhlé ložisko splňující kritérium pro longitudinální extenzivní transverzální myelitidu (LETM) (obr. 1A, B). Ostatní myelitidy byly menšího rozsahu, definované jako krátké myelitidy (short transverse myelitis; STM) (obr. 2A–CE). U čtyř pacientů byla detekována dvě míšní ložiska. U jednoho pacienta bylo patrné ložisko v typické lokalizaci v oblasti pro MOGAD – v míšním konu (obr. 1A, B). Charakteristický tvar postižení připodobňovaný k písmenu H byl u jednoho pacienta (obr. 1D, E).
Fig. 1. (A) Typical hypersignal intramedullar lesion on T2-weighted image ranging from C3–Th1 fulfilling the criteria of longitudinal
extensive transverse myelitis. (B) Follow-up at 3 months shows enlargement of the lesion, from C2–Th2 on T2-weighted image short-tau
inversion recovery, spinal cord is enlarged. (C) Follow-up examination after 12 years shows diffuse changes and spinal cord atrophy
on T2-weighted image with fat saturation (Fat Sat), patient No. 7. (D) Intramedullar small lesion markedly hypersignal on T2-weighted
image at Th2 level (arrow) with a hypersignal correlate on a proton-density weighted image (E, arrow), patient No. 6.
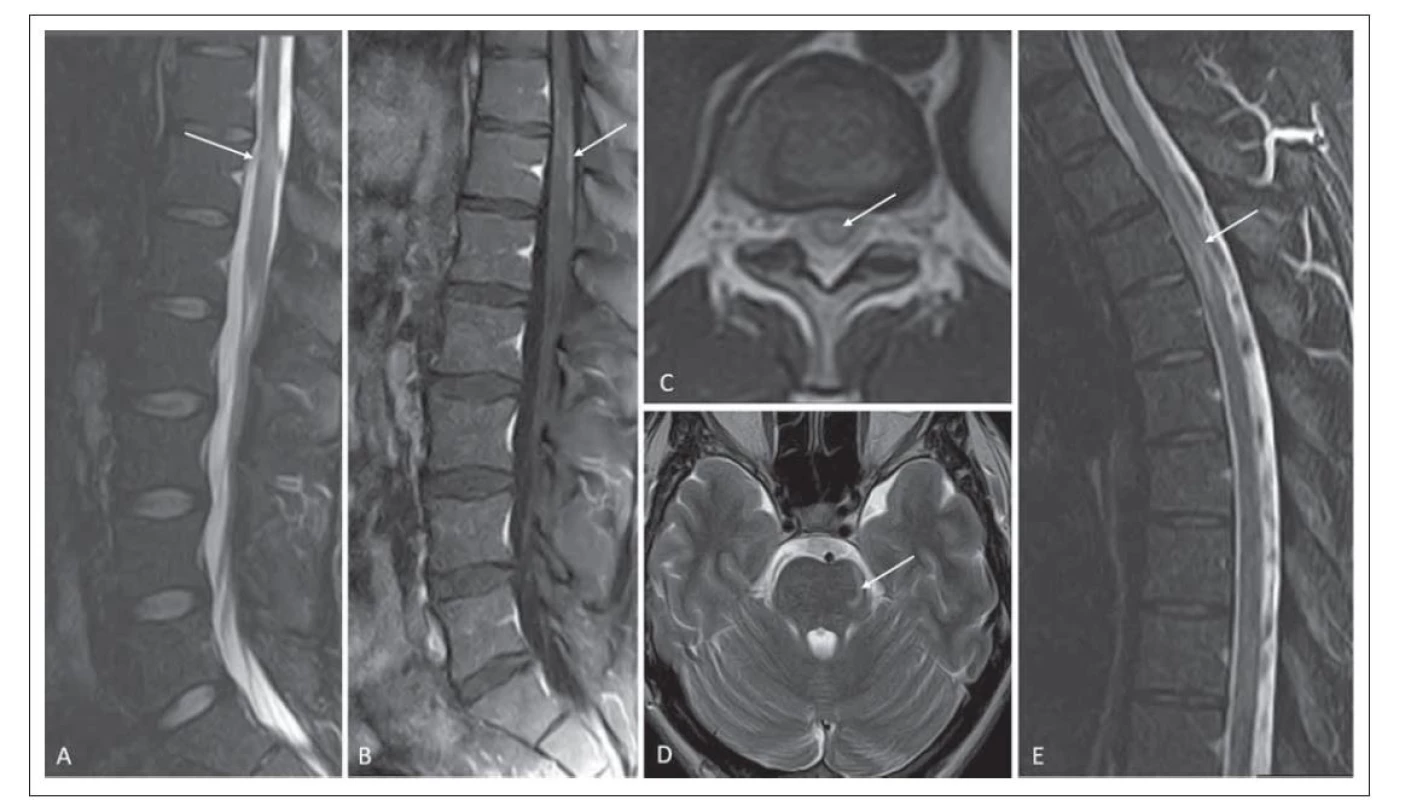
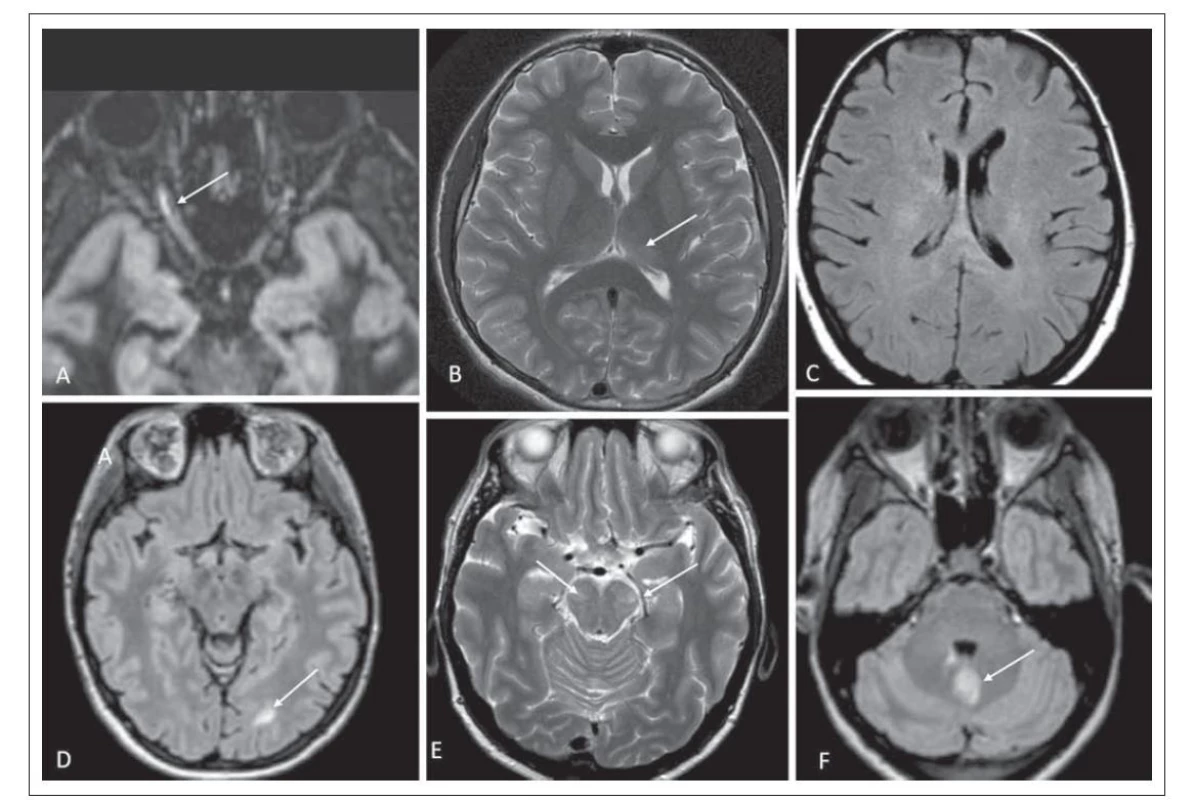
Optická neuritida byla patrná při zobrazení pomocí MR u jednoho pacienta (obr. 3A). Postižení mozkové tkáně se při zobrazení MR vyskytovalo u šesti pacientů, přičemž postižení mozkové tkáně hodnocené jako podobné ADEM se vyskytovalo u tří pacientů. U dvou bylo ložiskové postižení talamu, u jednoho z nich byla patrná i nepravidelná, neostře ohraničená ložiska v bílé hmotě, u dalšího pacienta větší ložisko v bílé hmotě zasahující subkortikálně (obr. 3B–D). Ložiska v oblasti mozkového kmene jsme zobrazili u třech pacientů, jednalo se o postižení pontu, crura cerebri bilaterálně (obr. 2D, 3E), postižení oblongáty ventrálně, u jednoho pacienta byla ložiska v mozečku (obr. 3F). Nálezy při zobrazení pomocí MR jsou shrnuty v tab. 1.
Fat Sat – potlačení tuku; MOGAD – onemocnění asociované s protilátkami proti myelinovému oligodendrocytárnímu glykoproteinu;
STIR – short-tau inversion recovery
Fig. 2. (A) Patient No. 1 with MOGAD with a typical MRI pattern. Caudal segment involvement of spinal cord extending into the conus,
hypersignal lesion on T2-weighted STIR image (arrow). (B) The enhanced leptomeninges are seen after contrast agent administration on
a T1-weighted fat saturation image (arrow). (C) The lesion affects more than 50% of the area and is centrally located (arrow). (D) A striated
hypersignal lesion is seen in the pontine region on a T2-weighted image (arrow). (E) In addition to the intramedullar lesion in the caudal
compartment, the patient had a short transverse myelitis lesion at the Th7-8 level, T2-weighted image with fat supression STIR (arrow).
Fat Sat – fat saturation; MOGAD – the myelin oligodendrocyte glycoprotein antibody-associated disease; STIR – short-tau inversion recovery
FLAIR – fluid attenuated inversion recovery
Fig. 3. MRI findings in the brain tissue and in the area of the nervus opticus. (A) Hypersignal lesion in the anterior segment of the right
optic nerve corresponding to optic neuritis on 3D double inversion recovery; patient No. 6 (arrow). (B) A mildly hypersignal lesion
in the left thalamus on a T2-weighted image; patient No. 4 (arrow). (C) Irregular signal increase in the white matter – character of
a “fluffy” lesion in FLAIR; patient No. 7. (D) Hypersignal lesion occipitally in the left extending subcortically on 3D FLAIR; patient No. 2
(arrow). (E) Large lesions of increased signal on T2-weighted image in the cerebral peduncles; patient No. 7 (arrows). (F) Two lesions in
the cerebellum on 3D FLAIR (small one beside the fourth ventricle and a second larger one, arrow); patient No. 6.
FLAIR – fluid attenuated inversion recovery
Diskuze
V našem souboru jsme detekovali myelitidu v šesti případech, pouze jednou však ve formě typické LETM, ostatní byly menšího rozsahu jako tzv. STM. V práci Jariuse et al se LETM vyskytovala častěji (u 72 % pacientů) než STM (u 41 % pacientů) [14]. U jednoho pacienta souboru byla STM v kaudálním úseku hrudní míchy, ložisko dosahovalo až ke konu. Lokalizace v oblasti míšního konu je typická pro MOGAD na rozdíl od RS, u které je dominantně postižen krční úsek. Pro NMOSD je typické postižení krční a horní hrudní míchy. Výskyt myelitidy v oblasti míšního konu se v literatuře udává okolo 40 % [12]. Lokalizace ložisek byla v našem souboru stejně častá v krčním a hrudním úseku. V publikovaných pracích není shoda preferenční lokalizace, u německé kohorty bylo postižení krčního úseku v 82 %, u holandské kohorty naopak, nejčastější bylo postižení hrudního úseku [12,13]. U našich čtyř pacientů byla detekována dvě míšní ložiska. Ložiska se vyskytovala jak centrálně, tak zasahovala i dorzálně, ale na rozdíl od ložisek u RS zabírala větší rozsah míchy. Pro MOGAD je typická lokalizace postižení v blízkosti centrálního kanálku, postihuje především šedou hmotu, ložisko může být výrazně hypersignální v T2 váženém obraze, někdy je popisováno jako „pseudodilatace centrálního kanálku“. Ložisko pak může mít na axiálních řezech tvar písmene H, tento příznak jsme detekovali u jednoho pacienta (obr. 1D, E) [8,16].
U jednoho pacienta se ložisko chovalo expanzivně a rozšiřovalo míchu, pacient byl na MR opakovaně vyšetřován, na kontrole po 3 měsících bylo patrné zvětšení rozsahu ložiska (obr. 1A, B). Na kontrole po 3 letech byly patrné pouze difuzní změny a atrofie míchy, která se v dalších letech akcentovala, poslední MR kontrola po 12 letech (obr. 1C). V literatuře je udáváno, že pro MOGAD je naopak typické rozšíření míchy při výskytu ložiskového postižení, které se při následných kontrolách redukuje až normalizuje [17]. V práci autorů Salama et al je uvedeno, že jedním ze znaků pomáhajících diferencovat NMOSD od MOGAD je právě nepřítomnost atrofie, která je typická pro NMOSD. Příznak lokální atrofie míchy po proběhlé myelitidě je součástí platných diagnostických kritérií pro NMOSD [6,12]. Dle našeho názoru by to mohlo být dáno delším trváním choroby u našeho pacienta (12leté sledování) a dále v tom může hrát roli vyšší věk pacienta (pacient číslo 7, 52 let) a terapeutické možnosti. Po podání kontrastní látky může u intramedulárních ložisek docházet k nepravidelnému sycení. U naší kohorty neměli pacienti první vyšetření s kontrastní látkou, u jednoho pacienta byl při opakovaném vyšetření po 14 dnech patrný nepravidelný okrajový enhancement (obr. 2B). Ten je udáván jako znak, který pomáhá odlišit ložiska u MOGAD či NMOSD od ložisek u RS, kde naopak bývá pravidelný a okrajový.
V našem souboru jsme optickou neuritidu zobrazili pomocí MR jen u jednoho pacienta, a to unilaterálně (obr. 3A). Takto nízký výskyt v našem souboru pro nás byl překvapením, protože optická neuritida je nejčastější klinická prezentace u MOGAD, její výskyt je udáván od 40–75 % [7,10,12]. Nejčastěji je postižen přední segment, naopak chiasma a optický trakt jsou postiženy (na rozdíl od NMOSD) zřídka [7,10,18]. Optický nerv bývá edematózně rozšířen, zvlněný, provázený edémem papily zrakového nervu. Až u 50 % je popisován enhancement pochvy zrakového nervu. To, že jsme na MR zobrazení optickou neuritidu nedetekovali častěji, může být dáno suboptimálním vyšetřovacím protokolem, dále i možným větším časovým odstupem od počáteční klinické prezentace, kdy měl pacient MR vyšetření až po pulsu methylprednisolonu, který vedl k normalizaci nálezu na MR. Jednostranný výskyt je udáván častěji u mladších pacientů, v našem souboru se jednalo o 24letou pacientku [7].
Postižení mozkové tkáně hodnocené jako podobné ADEM se vyskytovalo u tří pacientů, u dvou bylo ložiskové postižení talamu, u jednoho z nich byla patrná i nepravidelná, neostře ohraničená ložiska v bílé hmotě, u dalšího pacienta větší ložisko v bílé hmotě zasahující subkortikálně (obr. 3B–D). Postižení talamu je u MOGAD častější než u RS či NMOSD [19]. Ložiska v mozkové tkáni bývají rozsáhlejší, mohou mít nepravidelný tvar s nezřetelnými okraji v T2 váženém obraze a FLAIR, tzv. „fluffy“ ložiska (obr. 3C). Ložiska v bílé hmotě bývají především subkortikálně (obr. 3D). Pro ADEM podobnou prezentaci MOGAD se liší nálezy u dětských pacientů, kde je tento typ častější, od dospělých pacientů. U dětí je onemocnění často monofázické a dochází k normalizaci nálezu na MR zobrazení. Práce Ikedy et al, zabývající se nálezem u dětských pacientů MOGAD, ukázala, že ložiska v bílé hmotě mají odlišnou prezentaci v závislosti na věku – do 5 let bývají ložiska neostře ohraničená s tendencí zvětšovat se, nad 5 let byla ložiska dobře ohraničená [15]. Rozdílný charakter ložisek u dětských pacientů je vysvětlován postupnou myelinizací a změnou exprese MOG. U dětských pacientů nebyla popisována ložiska v corporis callosi a periventrikulárně, což pomáhá v rámci odlišení od RS [15]. Ložiska bývají také častěji asymptomatická. V porovnání s NMOSD je ložiskové postižení mozkové tkáně častější. Na rozdíl od NMOSD nebývají ložiska v typické lokalizaci pro toto onemocnění, které je spojováno s vyšší expresí AQP4 (jedná se o oblast subependymální, oblast hypotalamu, periakveduktální šeď) [15,16]. V diferenciální diagnostice s RS pomáhá tvar enhancementu, protože ten bývá nepravidelný, připodobňovaný k obláčkům – na rozdíl od prstenčitého u RS. Dále pomáhá diskriminovat MOGAD přítomnost leptomeningeálního enhancementu a ložiska v talamech [19].
Ložiska v oblasti mozkového kmene jsme detekovali u třech pacientů, jednalo se o postižení pontu, crura cerebri bilaterálně, postižení oblongáty ventrálně a u jednoho pacienta bylo ložiskové postižení mozečku. Ve dvou případech se jednalo o rozsáhlejší ložiska (obr. 3E a F). Právě rozsáhlejší ložiska v mozkovém kmeni jsou více typická pro MOGAD než pro NMOSD, častější je postižení mozkového kmene, pontu a mozečkových pedunkulů, pro NMOSD je typické postižení dorzální oblongáty v oblasti area postrema [7]. V nedávné době byla popsána asociace MOGAD s epileptickými záchvaty, u pacientů bylo nalezeno ložiskové postižení kůry, jednotka byla definována přítomností FLAIR-hyperintenzního ložiska s anti-MOG asociovanou encefalitidou se záchvaty, v anglosaské literatuře se zkracuje jako FLAMES (FLAIR-hyperintense lesions in anti-MOG-associated encephalitis with seizures) [20]. Další jednotkou byla encefalitida asociovaná s MOG-IgG se záchvaty s FLAIR variabilním unilaterálním enhancementem leptomening, v anglosaské literatuře se zkracuje jako FUEL (FLAIR-variable unilateral enhancement of the leptomeninges) [20].
Autoři Salama et al. se ve své práci snažili určit patologické znaky na MR zobrazení, které by měly klinické lékaře upozornit na možnost onemocnění MOGAD nebo NMOSD v diferenciální diagnostice a indikovat stanovení autoprotilátek MOG-IgG a AQP4-IgG. Pro MOGAD svědčil nález subkortikálních ložisek, ložisek zasahujících do kůry, naopak pro NMOSD postižení area postrema, periependymální, periakveduktální postižení a ložiska v hypotalamu. Na MR zobrazení míchy je pro NMOSD typická atrofie míchy po prodělané myelitidě. Naopak vymizení ložisek myelitidy je časté u MOGAD, vč. izolovaného postižení míšního konu provázené bilaterální optickou neuritidou [12]. Významným diferenciálně diagnostickým znakem je vývoj nálezu na MR zobrazení v čase, u MOGAD došlo ke zmenšení ložisek na dalších kontrolních vyšetřeních v 72 % případů, na rozdíl od RS a NMOSD, kde k tomuto došlo pouze v 17, resp. ve 14 % případů. Kompletní regrese intramedulárních ložisek byla u 79 % pacientů s MOGAD, ale u žádného pacienta s RS či NMOSD. U pacientů s MOGAD byla zajímavá normalizace nálezu v mozkové tkáni, kde vymizela ložiska lokalizovaná jak supra-, tak infratentoriálně, u NMOSD a RS jen infratentoriálně [17].
Závěr
V námi prezentovaném souboru se na MR zobrazení častěji vyskytoval méně specifický nález než takový, který by vedl k jasné suspekci na MOGAD. Je důležité znát typickou lokalizaci postižení, tvar ložisek a jejich vývoj v MR zobrazení. Jak ukazuje náš soubor, toto onemocnění může mít značně variabilní patologický nález na MR zobrazení a někdy je obtížně diferencovatelné od NMOSD a RS. Nález v námi prezentovaném souboru mohl být ovlivněn nasazenou léčbou a načasováním vyšetření, popřípadě delším intervalem mezi počátkem onemocnění a provedením MR v remisi. U pacientů s atypickou optickou neuritidou je vhodné doplnit cílené MR vyšetření na zrakový nerv. V neposlední řadě jsme chtěli upozornit na rozšiřující se spektrum MOGAD o nové jednotky encefalitid asociovaných s MOG-IgG (FLAMES a FUEL), u kterých klinicky dominují epileptické záchvaty.
Etické aspekty
Studie nepodléhá schválení etickou komisí, pacienti podepsali souhlas s diagnostickým a léčebným procesem.
Poděkování
Rádi bychom poděkovali kolegům z Radiologického a Neurologického oddělení Krajské nemocnice Liberec, Nemocnice Pardubického kraje a z Neurologické kliniky a radiodiagnostického oddělení Fakultní Thomayerovy nemocnice za MR vyšetření.
Grantová podpora
Práce byla podpořena Ministerstvem zdravotnictví ČR, výzkumným záměrem RVO 64165 a grantem NV 18-04-00168, a MŠMT ČR – Cooperatio (1. LF, Neuroscience).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
prof. MUDr. Manuela Vaněčková, Ph.D.
Radiodiagnostická klinika
1. LF UK a VFN v Praze
Kateřinská 30
128 08, Praha
e-mail: manuela.vaneckova@vfn.cz
Přijato k recenzi: 20. 3. 2022
Přijato do tisku: 4. 8. 2022
Sources
1. Marignier R, Hacohen Y, Cobo-Calvo A et al. Myelin-oligodendrocyte glycoprotein antibody-associated disease. Lancet Neurol 2021; 20 (9): 762–772. doi: 10.1016/S1474-4422 (21) 00218-0.
2. Wynford-Thomas R, Jacob A, Tomassini V. Neurological update: MOG antibody disease. J Neurol 2019; 266 (5): 1280–1286. doi: 10.1007/s00415-018-9122-2.
3. Deneve M, Biotti D, Patsoura S et al. MRI features of demyelinating disease associated with anti-MOG antibodies in adults, J Neuroradiol 2019; 46 (5): 312–318. doi: 10.1016/j.neurad.2019.06.001.
4. de Mol CL, Wong Y, van Pelt ED et al. The clinical spectrum and incidence of anti-MOG-associated acquired demyelinating syndromes in children and adults. Mult Scler 2020; 26 (7): 806–814. doi: 10.1177/1352458519845112.
5. Jarius S, Paul F, Aktas O et al. MOG encephalomyelitis: international recommendations on diagnosis and antibody testing. J Neuroinflammation 2018; 15 (1): 134. doi: 10.1186/s12974-018-1144-2.
6. Nytrová N. Historie neuromyelitis optica a onemocnění jejího širšího spektra, vývoj diagnostických kritérií. Cesk Slov Neurol N 2020; 83/116 (Suppl 1): 5–10. doi: 10.14735/amcsnn2020S5.
7. Ambrosius W, Michalak S, Kozubski W et al. Myelin oligodendrocyte glycoprotein antibody-associated disease: current insights into the disease pathophysiology, diagnosis and management. Int J Mol Sci 2020; 22 (1): 100. doi: 10.3390/ijms22010100.
8. Solomon JM, Paul F, Chien C et al. A window into the future? MRI for evaluation of neuromyelitis optica spectrum disorder throughout the disease course. Ther Adv Neurol Disord 2021; 14: 17562864211014389. doi: 10.1177/17562864211014389.
9. Libertinova J. Epidemiologie, klinický obraz a průběh onemocnění u neuromyelitis optica a onemocnění jejího širšího spektra. Cesk Slov Neurol N 2020; 83/116 (Suppl 1): 15–19. doi: 10.14735/amcsnn2020S15.
10. Jurynczyk M, Messina S, Woodhall MR et al. Clinical presentation and prognosis in MOG-antibody disease: a UK study. Brain 2017; 140 (12): 3128–3138. doi: 10.1093/brain/awx276.
11. Wingerchuk DM, Lennon VA, Pittock SJ et al. Revised diagnostic criteria for neuromyelitis optica. Neurology 2006; 66 (10): 1485–1489. doi: 10.1212/01.wnl.0000216139.44259.74.
12. Salama S, Khan M, Shanechi A et al. MRI differences between MOG antibody disease and AQP4 NMOSD. Mult Scler 2020; 26 (14): 1854–1865. doi: 10.1177/1352458 519893093.
13. Salama S, Khan M, Levy M et al. Radiological characteristics of myelin oligodendrocyte glycoprotein antibody disease. Mult Scler Relat Disord 2019; 29: 15–22. doi: 10.1016/j.msard.2019.01.021.
14. Jarius S, Ruprecht K, Kleiter I et al. MOG-IgG in NMO and related disorders: a multicenter study of 50 patients. Part 1: frequency, syndrome specificity, influence of disease aktivity, long-term course, association with AQP4-IgG and origin. J Neuroinflammation 2016; 13 (1): 279. doi: 10.1186/s12974-016-0717-1.
15. Ikeda A, Watanabe Y, Kaba H et al. MRI findings in pediatric neuromyelitis optica spectrum disorder with MOG antibody: Four cases and review of the literature. Brain Dev 2019; 41 (4): 367–372. doi: 10.1016/j.braindev.2018.10.011.
16. Vaněčková M. Nálezy na magnetické rezonanci u neuromyelitis optica a onemocnění jejího širšího spektra. Cesk Slov Neurol N 2020; 83/116 (Suppl 1): 20–30. doi: 10.14735/amcsnn2020S20.
17. Sechi E, Krecke KN, Messina SA et al. Comparison of MRI lesion evolution in different central nervous system demyelinating disorders. Neurology 2021; 97 (11): e1097–e1109. doi: 10.1212/WNL.0000000000012 467.
18. Dutra BG, Rocha AJ, Nunes RH et al. Neuromyelitis optica spectrum disorders: spectrum of MR imaging findings and their differential diagnosis. Radiographics 2018; 38 (1): 169–193. doi: 10.1148/rg.2018170 141.
19. Cobo-Calvo A, Ruiz A, Maillart E et al. Clinical spectrum and prognostic value of CNS MOG autoimunity in adults: the MOGADOR study. Neurology 2018; 90 (21): e1858–e1869. doi: 10.1212/WNL.0000000000005 560.
20. Budhram A, Mirian A, Le C et al. Unilateral cortical FLAIR-hyperintense lesions in anti-MOG-associated encephalitis with seizures (FLAMES): characterization of a distinct clinico-radiographic syndrome. J Neurol 2019; 266 (10): 2481–2487. doi: 10.1007/s00415-019-09440-8.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2022 Issue 4
Most read in this issue
- Validace dotazníku pro hodnocení dopadu cévní mozkové příhody – česká verze Stroke Impact Scale 3.0
- Telemedicínské vyšetření kognitivními testy ALBA, POBAV a ACE-III
- Patologické nálezy na zobrazení pomocí magnetické rezonance u onemocnění asociovaného s pozitivními protilátkami proti myelinovému oligodendrocytárnímu glykoproteinu
- Farmakogenetika dabigatranu a sekundární prevence ischemické cévní mozkové příhody
