Ovlivnění spasticity pomocí elektrické stimulace podle Jantsche – pilotní studie
Effects of electrical stimulation according to Jantsch on spasticity – a pilot study
Aim: The aim of the pilot study was to determine the effect of electrical stimulation according to Jantsch on spasticity and gait in patients with multiple sclerosis. Materials and methods: 15 patients (13 women and 2 men), aged 35 to 72 (51.2 ± 10.32) years, with spastic paraparesis of the lower limbs due to multiple sclerosis were involved in the study. Patients were randomly divided into two groups: 8 patients were included in the experimental group with electrostimulation according to Jantsch, while 7 were included in the control group who did not receive electrostimulation. Both groups received the identical rehabilitation program during hospitalization at the inpatient rehabilitation department, while the experimental group subjects received additional electrostimulation, which was applied once per day to both spastic lower limbs. The Gracies scale was used to quantify spasticity and the 10 Meter Walk and Timed Up and Go tests were used to evaluate gait. Results: The immediate effect of electrostimulation according to Jantsch on reducing spasticity of the triceps surae muscle group and facilitating the active movement of the tibialis anterior muscle was confirmed. A positive trend to reduce spasticity with repeated electrostimulation was found, but the intergroup difference was not significant. Neither group demonstrated a significant eff ect of rehabilitation on walking speed. Conclusion: Electrostimulation according to Jantsch significantly reduces spasticity of the triceps surae muscle group and increases the active range of foot dorsiflexion in patients with multiple sclerosis immediately after electrostimulation.
Keywords:
Multiple sclerosis – rehabilitation – muscle spasticity – electric stimulation
Authors:
M. Kövári; A. Tomášková; K. Slabý; J. Demeková; D. Lilling; A. Kobesová
Authors‘ workplace:
Klinika rehabilitace a tělovýchovného lékařství 2. LF UK a FN Motol, Praha
Published in:
Cesk Slov Neurol N 2022; 85(3): 239-244
Category:
Original Paper
doi:
https://doi.org/10.48095/cccsnn2022239
Overview
Cíl: Cílem pilotní studie bylo zjistit efekt elektrické stimulace dle Jantsche na spasticitu a chůzi u pacientů s RS. Soubor a metodika: Studie se zúčastnilo celkem 15 pacientů (13 žen a 2 muži) se spastickou paraparézou dolních končetin v důsledku RS ve věku od 35 do 72 (51,2 ± 10,32) let. Pacienti byli randomizovaně rozděleni do dvou skupin: 8 pacientů bylo zařazeno do skupiny experimentální s elektrostimulací dle Jantsche, 7 do skupiny kontrolní bez elektrostimulace. Obě skupiny měly během hospitalizace na lůžkovém rehabilitačním oddělení stejný rehabilitační program, u experimentální skupiny byla navíc jedenkrát denně aplikovaná elektrostimulace na obě spastické dolní končetiny. Pro vyšetření spasticity bylo použito hodnocení dle Graciese a pro hodnocení chůze 10 Meter Walk Test a Timed Up and Go Test. Výsledky: Byl potvrzen okamžitý efekt elektrostimulace dle Jantsche na snížení spasticity m. triceps surae a zvýšení aktivního pohybu m. tibialis anterior. Byl zjištěn pozitivní trend ke snížení spasticity při opakované elektrostimulaci, meziskupinový rozdíl ale nebyl signifikantní. Ani u jedné skupiny nebyl potvrzen signifikantní vliv rehabilitace na rychlost chůze. Závěr: Elektrostimulace dle Jantsche bezprostředně po stimulaci signifikantně snižuje spasticitu m. triceps surae a zvyšuje rozsah dorzální flexe nohy u pacientů s roztroušenou sklerózou.
Klíčová slova:
roztroušená skleróza – rehabilitace – spasticita – elektrická stimulace
Úvod
Spasticita je jedním z hlavních příznaků poruchy centrálního motoneuronu, který se často vyskytuje u CMP, RS, traumatického poškození mozku, dětské mozkové obrny a dalších neurologických onemocnění postihujících mozek nebo míchu. Spasticita je popisována jako odpor vznikající při rychlém, pasivním protažení svalu. Čím rychlejší nebo prudší protažení svalu je, tím je větší spastická odpověď. Při léčbě spasticity se využívá zejména farmakologická léčba. Velmi důležitou součástí léčby je také cílená rehabilitace, která zahrnuje fyzioterapii, ergoterapii, protetiku a další postupy. V rámci moderních neurorehabilitačních postupů lze využít také fyzikální terapii, do které se řadí elektrická stimulace (ES) [1].
V české literatuře je pojem „elektrická stimulace“ definován jako dráždění denervovaných svalů pomocí šikmých impulzů s pomalým náběhem intenzity a větší délkou impulzu [2]. V anglosaské literatuře je ES definována jako dráždění nepoškozeného periferního motoneuronu pomocí stimulace svalů či periferních nervů nízkofrekvenčními proudy [3] a v tomto smyslu je pojem ES definován i pro potřeby této práce.
V ČR je ES při léčbě spasticity indikována omezeně, ačkoli řada klinických studií dokumentuje pozitivní efekt různých typů elektroterapie na snížení spasticity, např. transkutánní elektrické nervové stimulace (TENS) [4–6], funkční elektrické stimulace (FES) [7,8] či neuromuskulární stimulace (NMES) [9–11]. Dostupné studie potvrzují pozitivní vliv ES (TENS, FES či NMES) jak na vlastní spasticitu (hodnocenou pomocí modifikované Ashworthovy nebo modifikované Tardieovy škály), tak i na příznaky spojené se spasticitou, jako jsou bolest, rychlost chůze, rozsah pohybu, svalová síla, sebeobsluha a nezávislost či kvalita života [12–16].
Mezi tzv. antispastickou ES patří elektroterapie spřaženými impulzy, mezi které se řadí i dvoukanálová ES dle Jantsche [2,17]. Při této ES rytmicky dochází ke střídavé stimulaci spastických svalů a s krátkým časovým odstupem ke stimulaci svalů paretických. Využívá se bipolární aplikace deskovými elektrodami na jednotlivé dvojice svalů, tzn. dva proudové okruhy (čtyři elektrody), kdy spastický sval je drážděn šikmým, resp. trojúhelníkovým impulzem, a paretický sval tetanizujícími skupinami impulzů [2,17]. V současné době mají tento typ ES k dispozici přístroje využívané běžně při aplikaci fyzikální terapie v rámci rehabilitace.
Cílem předkládané studie bylo zjistit, zda ES dle Jantsche snižuje spasticitu a zda má vliv na aktivní rozsah pohybu a na rychlost chůze u pacientů s RS.
Soubor a metodika
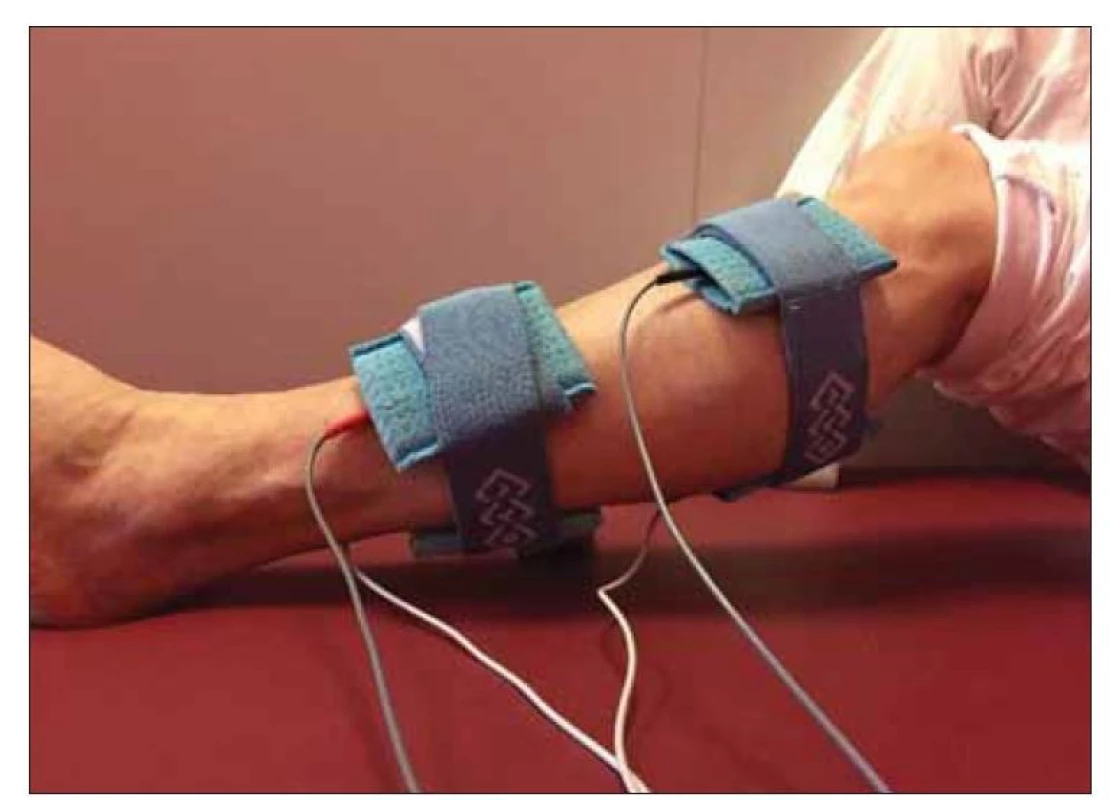
Studie se zúčastnilo 15 pacientů s RS hospitalizovaných na lůžkovém rehabilitačním oddělení. Pro zařazení pacientů do studie bylo nutné, aby byly splněny tyto podmínky: diagnostikovaná RS, přítomnost spasticity m. triceps surae bilat. (mm. gastrocnemii i m. soleus bilat.), zvládnutí chůzových testů, tj. 10 Meter Walk Test (10MWT) a Timed Up and Go Test (TUG), neporušené čití, nepřítomnost kožního onemocnění či poškození kožního krytu v oblasti aplikace ES a nepřítomnost kognitivního deficitu. Do souboru bylo zařazeno 13 žen a 2 muži ve věkovém rozmezí 35–72 (51,2 ± 10,32) let. Výrazně větší zastoupení žen ve sledovaném vzorku je zřejmě důsledkem toho, že dg. RS je častější u žen než u mužů [18,19]. Všichni pacienti byli schopni samostatné chůze bez opory. Pacienti byli randomizovaně rozděleni do dvou skupin (STIM a NOSTIM), kdy u obou skupin probíhala v rámci hospitalizace standardní rehabilitace ve stejném rozsahu a složení (fyzioterapie, ergoterapie, vodoléčba). U první skupiny nazvané STIM byla navíc přidána aplikace ES dle Jantsche. Stimulace byla aplikována na spastický m. triceps surae a jeho antagonistu, tj. m. tibialis anterior (jednotlivě na každou dolní končetinu [DK] (obr. 1), 1x denně kromě víkendu. U skupiny STIM (8 pacientů) i NOSTIM (7 pacientů) byly pro vyšetření spasticity použity prvky vyšetření pětistupňového konceptu vyšetření spastické parézy dle Jeana-Michela Graciese [20] vycházející z Tardieovy škály [21], zahrnující vyšetření pasivního rozsahu pohybu při rychlém protažení (parametr Xv3) a aktivního rozsahu pohybu (parametr XA) [20] a dále byla testována chůze pomocí 10MWT a TUG. U obou skupin probíhalo vyšetření první den před začátkem rehabilitace (s ES nebo bez ES), čtvrtý den po rehabilitaci a osmý den hospitalizace po ukončení rehabilitace. K ES byl využíván přístroj BTL 4625 Premium (BTL Medical Technologies, Praha, ČR), program E-5819 spastické stimulace Jantsch s přednastavenými parametry – režim CC, délka impulzů 1. kanálu 0,2 ms (T1), 2. kanálu 5 000 ms (T2), frekvence impulzů 0,16 Hz, pauza mezi T1 a T2 200 ms, uložení bipolárně pomocí středně velkých deskových elektrod na spastický m. triceps surae (T1) a jeho antagonisty, tzn. svalové bříško m. tibialis anterior (T2) (katoda proximálně, anoda distálně), intenzita nadprahově motorická v T1 i T2, doba aplikace 7 min, frekvence 1x denně (obr. 1). Všechna vyšetření prováděla jedna osoba a při hodnocení parametru Xv3 [20] byla použita stejná síla a rychlost. Po ES vždy bezprostředně následovala individuální fyzioterapie.
Fig. 1. Application of electrical stimulation according to Janstch – the leg is positioned
to a slight flexion in the knee joint for better visualization of electrode placement.
Pro potřeby statistické analýzy byly pro parametry Xv3 a XA hodnoceny výsledky všech končetin (tj. 16 končetin ve skupině STIM a 14 končetin ve skupině NOSTIM). Ke statistickému zpracování dat byl použit program Statistica 13.3 (TIBCO Software Inc., Palo Alto, CA, USA). Normálně distribuované veličiny jsou uvedeny jako průměr ± směrodatná odchylka (SD) a meziskupinový rozdíl byl hodnocen nepárovým t-testem, případně s Bonferroniho korekcí, nebo ANOVOU pro opakovaná měření s Fisherovým post-hoc testem. Neparametrické hodnoty jsou uvedeny jako medián (mezikvartilové rozpětí [interquartile range; IQR]) a hodnoceny pomocí Mann-Whitneyova testu. Normalita byla hodnocena graficky. Hladina statistické významnosti byla stanovena p < 0,05.
Výsledky
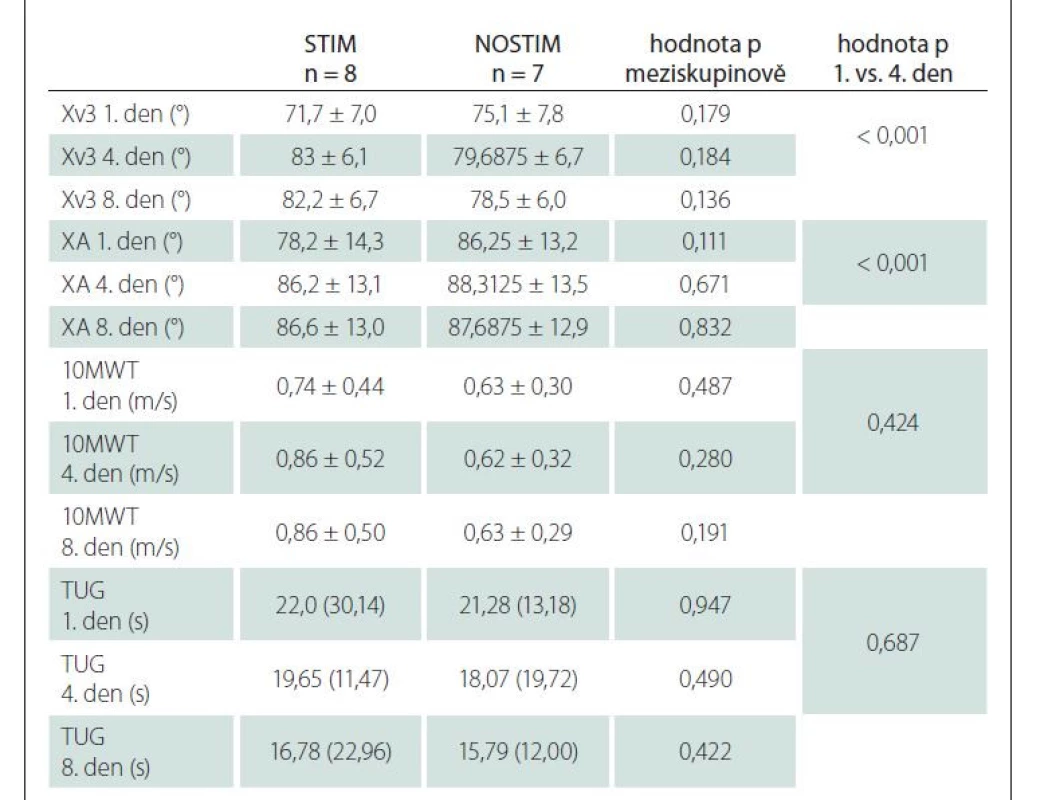
Popisná statistika, porovnání skupin a porovnání vstupního měření s měřením čtvrtý den a osmý den po rehabilitaci (resp. po rehabilitaci a stimulaci) jsou uvedeny souhrnně v tab. 1. U obou skupin došlo ke statisticky významnému nárůstu parametrů Xv3 i XA mezi vstupním měřením a čtvrtým dnem po rehabilitaci (se stimulací i bez). Výsledky 10MWT i TUG byly bez signifikantních změn v čase po celé sledované období. Ani v jednom z měřených parametrů nebyl zaznamenán statisticky signifikantní meziskupinový rozdíl. Parametr Xv3 nepřímo vykázal trend ke statisticky významnému meziskupinovému rozdílu mezi vstupním vyšetřením a vyšetřením čtvrtý den ve prospěch skupiny STIM (obr. 2). Ve skupině STIM byla zjištěna hodnota p = 0,00015, ve skupině NOSTIM p = 0,18239, nicméně bez signifikantního meziskupinového rozdílu.
K signifikantnímu zlepšení došlo ve skupině STIM po 4. intervenci v porovnání s výchozí
hodnotou.
NOSTIM – skupina bez elektrostimulace; SEM – směrodatná odchylka; STIM – skupina s elektrostimulací;
Xv3 – úhel pasivního rozsahu pohybu při rychlém protažení
Fig. 2. Development of the Xv3 parameter during the observed period of time in the
STIM and NOSTIM groups. Compared to the baseline significant improvement in the
STIM group after the 4th intervention was identified.
NOSTIM – group without electrostimulation; SEM – standard deviation; STIM – electrostimulation
group; Xv3 – passive range of motion angle at fast stretching

U skupiny STIM bylo navíc provedeno porovnání parametrů Xv3 a XA před první stimulací a ihned po první stimulaci. Úhel Xv3 před první stimulací měl průměrnou hodnotu 71,7 ± 7,0 bezprostředně po první stimulaci 77,9 ± 5,4 (p = 0,005). Úhel XA před první stimulací měl průměrnou hodnotu 78,2 ± 14,4 a bezprostředně po první stimulaci 85,9 ± 12,9 (p < 0,001).
Diskuze
Rehabilitace v kombinaci s farmakologickou léčbou hraje důležitou úlohu v terapii spasticity [22]. Mezi účinné postupy fyzioterapie, které zvyšují efekt aplikace botulotoxinu, patří používání ortéz [22,23] a prolongovaného statického strečinku [24] kombinovaného s následnými opakovanými rychlými pohyby antagonistů [25], aplikace postupů fyzioterapie založených na neurofyziologických principech, např. konceptu vynuceného používání (constraint-induced movement therapy; CIMT) [22,26] a ES [22,27]. Pro ovlivnění poruch chůze u spastické parézy můžeme použít různé druhy ES [28]. Aplikovat lze nízkofrekvenční proudy v podobě TENS, které mají signifikantní vliv na redukci spasticity, rychlost chůze a stabilitu [29], a to zejména při použití v kombinaci s aktivním cvičením [30]. V poslední době je populární využívání FES, s cílem ovlivnit peroneální parézu (tzv. drop foot) pomocí stimulace peroneálního nervu, ať už pacientů po CMP [31], s RS [32,33], nebo i u dalších poruch centrálního motoneuronu [34], a zvýšit pomocí FES efekt tradiční fyzioterapie [35]. K tomuto účelu slouží např. přístroj WalkAide, který ovlivňuje nejen vlastní spasticitu, ale hlavně funkci DK ve smyslu zlepšení stereotypu chůze, zvýšení rychlosti chůze a snížení energetického výdeje [36–38].
Výsledky naší studie poukazují na pozitivní efekt dalšího typu elektrostimulace, a to tzv. spřaženými impulzy dle Jantsche. Signifikantní zlepšení parametrů Xv3 a XA [20] bylo zjištěno bezprostředně po stimulaci i po opakované stimulaci 4 dny za sebou. Ke zlepšení parametrů spasticity došlo v rámci sledovaného období u obou skupin, tj. u skupiny stimulované i u skupiny bez stimulace. Ačkoli meziskupinový rozdíl nebyl signifikantní, parametr Xv3, který vypovídá o takzvaném „catch fenoménu“, tedy o úhlu, kdy „naskočí“ hypertonus, který zabrání dalšímu protažení a plynulosti pohybu, naznačuje trend zlepšení u stimulované skupiny (obr. 2). U obou skupin nebyl zjištěn signifikantní rozdíl mezi vstupním a výstupním vyšetřením, tj. po osmi terapiích nejen v parametrech spasticity, ale ani v parametrech hodnotících hybnost globálně, tj. v testech 10MWT a TUG. To přičítáme tomu, že mezi čtvrtou a pátou intervencí proběhl víkend, kdy u obou skupin proběhla rehabilitace pouze v omezeném rozsahu (u STIM bez ES) a celkový počet intervencí byl pouze 8. Pro signifikantní a přetrvávající efekt terapie, ať už se stimulací, nebo bez, je potřebné pravidelné opakování terapie alespoň po dobu 4 týdnů [39]. Výsledky pravděpodobně ovlivnil také velký vnitroskupinový rozdíl probandů v obou skupinách z hlediska stádia a formy RS, spasticity, mobility, kognice i dalších faktorů.
Ačkoli výsledky předložené studie pouze nepřímo naznačují, že ES dle Jantsche snižuje spasticitu m. triceps surae a zvyšuje aktivní rozsah dorzální flexe nohy, toto zjištění může být důležité pro klinickou praxi. Elektroterapie spřaženými impulzy je totiž rutinním programem dostupným ve většině moderních přístrojů pro aplikaci fyzikální terapie, které jsou k dispozici téměř na všech pracovištích rehabilitace. Už v publikaci Edela z roku 1975 [17] byla popsána elektroterapie tzv. spřaženými impulzy s cílem redukovat spasticitu, přesto se nám nepodařilo v rámci literární rešerše najít studii, která by účinky této elektroterapie zkoumala. Díky tomu nejspíše není tento typ ES v praxi příliš znám a využíván. Aplikace ES dle Jantsche je časově a technicky nenáročná, je indikována čistě za účelem antispastického účinku a lze využít přesně dané parametry, které jsou předprogramované v nabídce v běžně dostupných přístrojích v rehabilitačních zařízeních. Měnit lze čas aplikace či počet procedur podle časových možností pracoviště. Podle obecných doporučení [2] by měla být doba aplikace 3–7 min, frekvence 2–3× denně a počet procedur podle efektu terapie, v podstatě bez omezení. My jsme v rámci této studie stimulovali jednu DK po maximální doporučenou dobu 7 min v intenzitě nadprahově motorické. Z časových a kapacitních důvodů pracoviště byla volena aplikace pouze 1x denně celkem 8x na každou DK, což pravděpodobně nebyla dostatečná frekvence. Důležité ale je, že tato studie může být využita jako studie pilotní, neboť neměnnost parametrů vlastní stimulace (frekvence a doba impulzu, intenzita) umožňuje realizaci dalších, mezi sebou porovnatelných studií s větším počtem probandů, větší frekvencí a počtem stimulací po delší dobu.
V předložené studii byly parametry spasticity vyšetřeny vždy bezprostředně po aplikaci ES, lze tedy předpokládat, že byl zjištěn hlavně okamžitý efekt. To potvrzuje i porovnání výsledků před první ES a bezprostředně po ES, kdy bylo potvrzeno signifikantní zlepšení jak parametru Xv3, tak XA. Podstatou ES spřaženými impulzy je velmi krátká aktivace spastického svalu (0,2 ms) a následná delší aktivace oslabeného antagonisty (5 000 ms). Tím dochází k postfacilitační inhibici svalu spastického a ke stimulaci svalu oslabeného. Jedná se tedy o zlepšování koordinace mezi svalem spastickým (m. triceps surae v této studii) a jeho oslabeným antagonistou (m. tibialis anterior) a lze předpokládat, že při současné aplikaci fyzioterapeutických postupů na neurofyziologickém podkladě, popř. v kombinaci s dalšími indikovanými postupy, jako jsou aplikace botulotoxinu, progresivní strečink zkrácených svalů, robotická terapie s nácvikem funkčních pohybů atp. se může ES dle Jantsche uplatnit nejen na úrovni lokální, ale napomoci ke zlepšení pohybu na centrální úrovni řízení motoriky, což by mohlo zajistit dlouhodobější efekt. Pozitivní efekt kombinace běžněji užívaných typů ES (TENS, FES) s aplikací botulotoxinu, postupy fyzioterapie a neurorehabilitace oproti kontrolní skupině bez ES dokládají studie řady autorů [27,29–31,34,35]. Variabilita ve způsobu aplikace TENS a FES v kombinaci s dalšími terapeutickými postupy je ale značná a přesné parametry a způsoby aplikace TENS a FES zatím nejsou jednoznačně stanoveny [40]. Oproti tomu parametry ES dle Jantsche jsou v rámci přístrojů fyzikální terapie rigidně nastaveny. Ačkoli od samotné ES dle Jantsche zřejmě nelze očekávat ovlivnění spasticity v dlouhodobém horizontu, potvrzený okamžitý efekt, i když krátkodobý, může sloužit jako bezprostřední příprava pacienta na další rehabilitační postupy, které mohou v kombinaci s ES následně vykazovat významnější a trvalejší efekt. ES bezprostředně redukuje spasticitu, rehabilitace zaměřená na funkci paretických končetin pak může být lépe uplatněna. Při pravidelně opakované kombinované terapii může dojít k významnějšímu ovlivnění neuroplasticity a fixaci kvalitnějších pohybových vzorů [28,41], proto lze tento kombinovaný postup doporučit pro rutinní rehabilitační praxi.
Při rozhovoru s pacienty v den dimise jsme se ptali na subjektivní zkušenosti a pocity pacientů. Nikdo z pacientů se s ES dle Jantsche zatím nesetkal, a to ani chroničtí pacienti, kteří se se spasticitou léčí dlouhodobě. Pět z osmi pacientů ze skupiny STIM uvedlo pozitivní subjektivní změnu ve vnímání spasticity ve smyslu, že je méně obtěžovala, čtyři probandi po aplikaci subjektivně pociťovali zvětšení rozsahu pohybu v hlezenním kloubu a zlepšení chůze. Všichni probandi by stimulaci podstoupili znovu a šest z nich by chtělo stimulaci zařadit jako rutinní složku rehabilitace z dlouhodobého hlediska a doporučili by ji dalším pacientům.
Mezi limity této pilotní studie patří malý počet probandů v obou skupinách a jejich vysoká heterogenita z hlediska klinického obrazu, stupně spasticity i trvání a průběhu základního onemocnění RS. Dalšími limity jsou nízká frekvence a počet aplikací ES s víkendovým přerušením mezi 4. a 5. aplikací. Mezi diskutované parametry spasticity byly zařazeny pouze parametry Xv3 a XA. Neuvádíme výsledky parametru Xv1, který představuje pasivní pomalé protažení, tj. hodnotí přítomnost vazivové kontraktury. Cílem studie bylo zjistit, zda má ES vliv na snížení svalového hypertonu, a tedy na zlepšení aktivního pohybu v segmentu. Efekt limitovaného počtu ES na kontrakturu, resp. vazivovou složku jsme neočekávali. V dlouhodobém horizontu při pravidelných a četných aplikacích tohoto typu ES a v kombinaci s dalšími postupy rehabilitace a farmakoterapie lze ale hypoteticky očekávat i pozitivní vliv na morfologickou strukturu spastického svalu (i oslabeného antagonisty). Zajímavým cílem budoucí studie by též mohlo být zkoumání efektu kombinace stimulace WalkAide používané pacientem při chůzi a pravidelné aplikace ES dle Jantsche v rámci fyzioterapie. Součástí metodiky budoucích studií by mělo být též subjektivní hodnocení efektu rehabilitace zahrnující ES dle Jantsche pacientem, např. pomocí Goal Attainment Scaling [42], Numeric Rating Scale for Spasticity (NRS-S) [43] či Multiple Sclerosis Spasticity Scale-88 (MSSS) [43,44]. Tyto škály hodnotící subjektivní zkušenost pacienta nejsou v současné praxi příliš používány, měly by se ale stát součástí metodiky navazujících studií, protože subjektivní vnímání efektu terapie je důležitý parametr vypovídající o kvalitě poskytnuté péče. Dalším doporučením pro budoucí výzkum je zařazení pacientů se spastickou parézou v důsledku jiných diagnóz, jako jsou např. stav po CMP, kraniocerebrálním poranění či dětská mozková obrna. Větší počet sledovaných pacientů umožní spolehlivější hodnocení efektu terapie i případné porovnání efektu ES dle etiologie spastické parézy. Pokud bude budoucími studiemi potvrzen významný efekt, mohla by se ES dle Jantsche stát standardní součástí komplexní terapie v centrech spasticity.
Závěr
Elektrická stimulace dle Jantsche bezprostředně snižuje spasticitu m. triceps surae a zvyšuje aktivní rozsah pohybu dorzální flexe nohy u pacientů s RS a v kombinaci s dalšími postupy rehabilitace a farmakoterapie může zvyšovat terapeutický efekt. Pacienti hodnotili ES pozitivně. Pro potvrzení účinku tohoto typu ES je třeba provést kontrolní zaslepenou studii s větším počtem probandů, s častější frekvencí stimulace a větším počtem opakování, a to u pacientů s RS i s jinými příčinami spasticity jak na dolních, tak na horních končetinách. Pokud bude pozitivní efekt potvrzen, ES dle Jantsche by se mohla stát rutinní součástí rehabilitace u pacientů se spastickou parézou, neboť se jedná o program dostupný u většiny běžně používaných přístrojů fyzikální terapie, procedura je neinvazivní, časově i technicky nenáročná a pacienty pozitivně hodnocená.
Finanční podpora
Studie vznikla za podpory nadace Pohyb bez pomoci a programu Cooperatio: Sport Sciences – Biomedical & Rehabilitation Medicine .
Etické aspekty
Studie nepodléhá schválení etickou komisí, pacienti podepsali souhlas s diagnostickým a léčebným procesem.
Konflikt zájmů
Autoři deklarují , že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 11. 4. 2022
Přijato do tisku: 15. 6. 2022
prof. MUDr. Alena Kobesová, Ph.D.
Klinika rehabilitace
a tělovýchovného lékařství
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: alenamudr@me.com
Sources
1. Štětkářová I. Mechanizmy spasticity a její hodnocení. Cesk Slov Neurol N 2013; 76/ 109(3): 267–280.
2. Poděbradský J. Fyzikální terapie: manuál a algoritmy. Praha: Grada 2009.
3. Sheffler LR, Chae J. Neuromuscular electrical stimulation in neurorehabilitation. Muscle Nerve 2007; 35(5): 562–590. doi: 10.1002/ mus.20758.
4. Logosu D, Tagoe TA, Adjei P. Transcutaneous electrical nerve stimulation in the management of calf muscle spasticity in cerebral palsy: a pilot study. IBRO Neurosci Rep 2021; 11: 194–199. doi: 10.1016/ j.ibneur.2021.09. 006.
5. Cho H-Y, In TS, Cho KH et al. A single trial of transcutaneous electrical nerve stimulation (TENS) improves spasticity and balance in patients with chronic stroke. Tohoku J Exp Med 2013; 229(3): 187–193. doi: 10.1620/ tjem.229.187.
6. Park J, Seo D, Choi W et al. The effects of exercise with TENS on spasticity, balance, and gait in patients with chronic stroke: a randomized controlled trial. Med Sci Monit 2014; 20: 1890–1896. doi: 10.12659/ MSM.890926.
7. Moll I, Vles JS, Soudant DL et al. Functional electrical stimulation of the ankle dorsiflexors during walking in spastic cerebral palsy: a systematic review. Dev Med Child Neurol 2017; 59(12): 1230–1236. doi: 10.1111/ dmcn.13501.
8. Sabut S, Sikdar C, Kumar R et al. Functional electrical stimulation of dorsiflexor muscle: effects on dorsiflexor strength, plantarflexor spasticity, and motor recovery in stroke patients. NeuroRehabilitation 2011; 29(4): 393–400. doi: 10.3233/ NRE-2011-0717.
9. Stein C, Fritsch CG, Robinson C et al. Effects of electrical stimulation in spastic muscles after stroke: systematic review and meta-analysis of randomized controlled trials. Stroke 2015; 46(8): 2197–2205. doi: 10.1161/ STROKEAHA.115.009633.
10. Rose J, Cahill-Rowley K, Butler EE. Artifi cial walking technologies to improve gait in cerebral palsy: multichannel neuromuscular stimulation. Artif Organs 2017; 41(11): E233–E239. doi: 10.1111/ aor.13058.
11. Mooney JA, Rose J. A Scoping review of neuromuscular electrical stimulation to improve gait in cerebral palsy: the arc of progress and future strategies. Front Neurol 2019; 10: 887. doi: 10.3389/ fneur.2019.00887.
12. Tang Y, Wang L, He J et al. Optimal method of electrical stimulation for the treatment of upper limb dysfunction after stroke: a systematic review and bayesian network meta-analysis of randomized controlled trials. Neuropsychiatr Dis Treat 2021; 17: 2937–2954. doi: 10.2147/ NDT.S332967.
13. Moon J-H, Cho H-Y, Hahm S-C. Influence of electrotherapy with task-oriented training on spasticity, hand function, upper limb function, and activities of daily living in patients with subacute stroke: a double-blinded, randomized, controlled trial. Healthcare (Basel) 2021; 9(8): 987. doi: 10.3390/ healthcare9080987.
14. Sentandreu-Mañó T, Tomás JM, Ricardo Salom Terrádez J. A randomised clinical trial comparing 35 Hz versus 50 Hz frequency stimulation effects on hand motor recovery in older adults after stroke. Sci Rep 2021; 11(1): 9131. doi: 10.1038/ s41598-021-88607-8.
15. Picelli A, Tamburin S, Bonetti P et al. Botulinum toxin type A injection into the gastrocnemius muscle for spastic equinus in adults with stroke: a randomized controlled trial comparing manual needle placement, electrical stimulation and ultrasonography-guided injection techniques. Am J Phys Med Rehabil 2012; 91(11): 957–964. doi: 10.1097/ PHM.0b013e318269d7f3.
16. Musselman KE, Manns P, Dawe J et al. The feasibility of functional electrical stimulation to improve upper extremity function in a two-year-old child with perinatal stroke: a case report. Phys Occup Ther Pediatr 2018; 38(1): 97–112. doi: 10.1080/ 01942638.2016.1255291.
17. Edel H. Fibel der Elektrodia gnostik und Elektrotherapie. Dresden: Verlag 1975. [online]. Available from URL: https:/ / www.zvab.com/ Fibel-Elektrodiagnostik-Elektrotherapie- Herbert-Edel-Steinkopff / 30913831103/ bd.
18. Jobin C, Larochelle C, Parpal H et al. Gender issues in multiple sclerosis: an update. Womens Health (Lond) 2010; 6(6): 797–820. doi: 10.2217/ whe.10.69.
19. Markowitz CE. Multiple sclerosis update. Am J Manag Care 2013; 19: 294–300.
20. Gracies JM. Coefficients of impairment in deforming spastic paresis. Ann Phys Rehabil Med 2015; 58(3): 173–178. doi: 10.1016/ j.rehab.2015.04.004.
21. Azarnia S, Abdollahi I, Minoo M et al. The inter- and intra-rater reliability of Modified Tardieu Scale in assessing spasticity of knee extensors in patients with multiple sclerosis. J Bodyw Mov Ther 2021; 26: 515–518. doi: 10.1016/ j.jbmt.2020.09.004.
22. Mills PB, Finlayson H, Sudol M et al. Systematic review of adjunct therapies to improve outcomes following botulinum toxin injection for treatment of limb spasticity. Clin Rehabil 2016; 30(6): 537–548. doi: 10.1177/ 0269215515593783.
23. Farag J, Reebye R, Ganzert C et al. Does casting after botulinum toxin injection improve outcomes in adults with limb spasticity? A systematic review. J Rehabil Med 2020; 52(1): jrm00005. doi: 10.2340/ 16501977-2629.
24. Martín Lorenzo T, Rocon E, Martínez Caballero I et al. Prolonged stretching of the ankle plantarflexors elicits muscle-tendon adaptations relevant to ankle gait kinetics in children with spastic cerebral palsy. Med Hypotheses 2017; 109: 65–69. doi: 10.1016/ j.mehy.2017.09.025.
25. Gracies J-M, Francisco GE, Jech R et al. Guided self-rehabilitation contracts combined with abobotulinumtoxina in adults with spastic paresis. J Neurol Phys Ther 2021; 45(3): 203–213. doi: 10.1097/ NPT.0000000000000359.
26. Nasb M, Shah SZ, Chen H et al. Constraint-induced movement therapy combined with botulinum toxin for post-stroke spasticity: a systematic review and meta-analysis. Cureus 2021; 13(19): e17645. doi: 10.7759/ cureus.17645.
27. Picelli A, Filippetti M, Sandrini G et al. Electrical stimulation of injected muscles to boost botulinum toxin effect on spasticity: rationale, systematic review and state of the art. Toxins (Basel) 2021; 13(5): 303. doi: 10.3390/ toxins13050303.
28. Schuhfried O, Crevenna R, Fialka-Moser V et al. Noninvasive neuromuscular electrical stimulation in patients with central nervous system lesions: an educational review. J Rehabil Med 2012; 44(2): 99–105. doi: 10.2340/ 16501977-0941.
29. Lin S, Sun Q, Wang H et al. Influence of transcutaneous electrical nerve stimulation on spasticity, balance, and walking speed in stroke patients: a systematic review and meta-analysis. J Rehabil Med 2018; 50(1): 3–7. doi: 10.2340/ 16501977-2266.
30. Mills PB, Dossa F. Transcutaneous electrical nerve stimulation for management of limb spasticity: a systematic review. Am J Phys Med Rehabil 2016; 95(4): 309–318. doi: 10.1097/ PHM.0000000000000437.
31. Johnson CA, Burridge JH, Strike PW et al. The effect of combined use of botulinum toxin type A and functional electric stimulation in the treatment of spastic drop foot after stroke: a preliminary investigation. Arch Phys Med Rehabil 2004; 85(6): 902–909. doi: 10.1016/ j.apmr.2003.08.081.
32. Prokopiusova T, Pavlikova M, Markova M et al. Randomized comparison of functional electric stimulation in posturally corrected position and motor program activating therapy: treating foot drop in people with multiple sclerosis. Eur J Phys Rehabil Med 2020; 56(4): 394– 402. doi: 10.23736/ S1973-9087.20.06104-3.
33. Miller L, McFadyen A, Lord AC et al. Functional electrical stimulation for foot drop in multiple sclerosis: a systematic review and meta-analysis of the eff ect on gait speed. Arch Phys Med Rehabil 2017; 98(7): 1435–1452. doi: 10.1016/ j.apmr.2016.12.007.
34. Wilkenfeld AJ. Review of electrical stimulation, botulinum toxin, and their combination for spastic drop foot. J Rehabil Res Dev 2013; 50(3): 315–326. doi: 10.1682/ jrrd.2012.03.0044.
35. Novotná K, Jeníček J, Janatová M et al. Neurorehabilitace poruch chůze s využitím funkční elektrické stimulace – aktuální poznatky z randomizovaných klinických studií. Cesk Slov Neurol N 2019; 82/ 115(6): 621–626. doi: 10.14735/ amcsnn2019621.
36. El-Shamy SM, Abdelaal AA. WalkAide efficacy on gait and energy expenditure in children with hemiplegic cerebral palsy: a randomized controlled trial. Am J Phys Med Rehabil 2016; 95(9): 629–638. doi: 10.1097/ PHM.0000000000000514.
37. Everaert DG, Stein RB, Abrams GM et al. Effect of a foot-drop stimulator and ankle-foot orthosis on walking performance after stroke: a multicenter randomized controlled trial. Neurorehabil Neural Repair 2013; 27(7): 579–591. doi: 10.1177/ 1545968313481278.
38. Elsner VR, Trevizol L, de Leon I et al. Therapeutic effectiveness of a single exercise session combined with WalkAide functional electrical stimulation in poststroke patients: a crossover design study. Neural Regen Res 2021; 16(5): 805–812. doi: 10.4103/ 1673-5374.297078.
39. Rayegani SM, Babaee M, Raeissadat SA. Rehabilitation medicine management of spasticity. IntechOpen 2020. doi: 10.5772/ intechopen.93008.
40. Intiso D, Santamato A, Di Rienzo F. Effect of electrical stimulation as an adjunct to botulinum toxin type A in the treatment of adult spasticity: a systematic review. Disabil Rehabil 2017; 39(21): 2123–2133. doi: 10.1080/ 09638288.2016.1219398.
41. Bao S, Khan A, Song R et al. Rewiring the lesioned brain: electrical stimulation for post-stroke motor restoration. J Stroke 2020; 22(1): 47–63. doi: 10.5853/ jos. 2019.03027.
42. Říha M, Dvořáková P. Goal Attainment Scaling (GAS) – metoda hodnocení efektu terapie u pacientů s fokální spastickou parézou. Rehabil fyz Lék 2015; 22: 144–147.
43. Hugos CL, Cameron MH. Assessment and measurement of spasticity in MS: state of the evidence. Curr Neurol Neurosci Rep 2019; 19(10): 79. doi: 10.1007/ s11910-019- 0991-2.
44. Freeman J, Gorst T, Ofori J et al. Evaluation of the multiple sclerosis spasticity scale 88: a short report. Rehabil Process Outcome 2019; 8: 1179572718823510. doi: 10.1177/ 1179572718823510.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2022 Issue 3
Most read in this issue
- Neurologické příznaky asociované s onemocněním COVID-19 podle celostátního online průzkumu
- Ovlivnění spasticity pomocí elektrické stimulace podle Jantsche – pilotní studie
- Stanovisko Sekce pro diagnostiku a léčbu bolestí hlavy
- Intracerebrální krvácení při COVID-19
