Český národní registr Guillainova-Barrého syndromu
Czech National Guillain-Barré Syndrome Registry
Introduction:
The Guillain-Barré syndrome is an acute inflammatory autoimmune polyradiculo-neuropathy and belongs among rare neurologic diseases. Since poliomyelitis has been almost completely eliminated, it is currently the most frequent cause of acute flaccid paralysis worldwide. The registry was formed in the Czech Republic in 2012 and is an important source of prospectively recorded data.
Aim:
The goal of the registry is to follow up the clinical profile, treatment and 6-month prognosis of Guillain-Barré syndrome patients. Methods: The data are collected prospectively by persons delegated by neuromuscular centres in the Czech Republic. The clinical course is assessed on the basis of the GBS disability scale and muscle strength according to the Medical Research Council sum score for facial muscles and extremity muscles. Detailed clinical investigation is done on admission, before the treatment, immediately after the treatment, 1 month and 6 months after the end of the treatment.
Results:
We enrolled a total 272 cases of Guillain-Barré syndrome patients in the period from 1st January 2012 to 17th August 2016. We have complete data for 6 months in 137 of them. 52 were treated with intravenous human immunoglobulin and 85 with plasma exchange. A good clinical outcome after 6 months (ability to walk unassisted) was achieved in 85% of patients. Severe residual neurological deficit persisted after 6 months in 11% of patients. The remaining 6 patients died. We did not find any difference in the efficiency of immunoglobulin vs. plasma exchange in the whole group, in the subgroup of the severely disabled patients and according to sex.
Conclusion:
Medical care centralisation and adherence to the standard of care lead to a good clinical outcome in Guillain-Barré syndrome patients, which is comparable with relevant sources.
Key words:
Guillain-Barré syndrome – intravenous human immunoglobulin – plasma exchange
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
捷克国家格林-巴利综合征登记处介绍:
格林-巴利综合征是一种急性炎症性自身免疫多神经根性神经病变,属于罕见的神经系统疾病。 鉴于脊髓灰质炎几乎完全消除,它是全球性急性弛缓麻痹的最常见原因。 2012年,在捷克共和国成立了相关研究联盟,是前瞻性记录数据的重要来源。
目标:
该研究联盟主要采集格林-巴利综合征患者的临床表现、治疗以及6个月预后的相关数据。
方法:数据经由捷克共和国神经肌肉中心授权前瞻性研究人员收集。根据GBS残疾量表对临床症状进行评估,并根据医学研究委员会开发的面部肌肉和四肢肌肉综合评分对肌肉力量进行评估。 在患者入院时、治疗前、治疗完成当天、治疗结束后1个月以及6个月进行详细的临床调查。
结果:
在2012年1月1日至2016年8月17日期间,我们共招募了272例格林-巴利综合征患者,其中137位患者拥有6个月的完整数据,52例患者进行了静脉注射人免疫球蛋白,85例患者进行了血浆置换。 经过6个月治疗,85%的患者获得了良好的临床疗效(能够独立行走), 11%的患者仍有严重的残余性神经缺陷,其中还有6名患者死亡。在整个小组、重度残疾患者亚组以及性别分组亚组中,我们没有发现免疫球蛋白与血浆置换疗效存在任何差异。
结论:
与已有数据相比较,集中化医疗和坚持标准化护理将有助于格林-巴利综合征患者的取得良好的临床治疗效果。
关键词:
格林-巴利综合征 - 静脉内人免疫球蛋白 - 血浆置换
Authors:
M. Škorňa 1; J. Bednařík 1; J. Junkerová 2; J. Staněk 3; E. Ehler 4; R. Mazanec 5; J. Haberlová 6; P. Ridzoň 7; P. Otruba 8; J. Kuchyňka 9; L. Strmisková 9; T. Božovský 10; M. Forgáč 11; P. Vaško 12; E. Minks 13
; D. Kvasničková 1; M. Pátá 14; M. Suchý 14
Authors‘ workplace:
Neurologická klinika LF MU a FN Brno
1; Neurologická klinika LF OU a FN Ostrava
2; Oddělení dětské neurologie, FN Ostrava
3; Neurologická klinika FZS UP a Pardubické
krajské nemocnice, a. s.
4; Neurologická klinika
2. LF UK a FN Motol, Praha
5; Klinika dětské neurologie
2. LF UK a FN Motol, Praha
6; Neurologické oddělení, Thomayerova
nemocnice, Praha
7; Neurologická klinika LF UP a FN Olomouc
8; Neurologická klinika LF UK
a FN Hradec Králové
9; Neurologická klinika LF UK a FN Plzeň
10; Neurologická klinika 1. LF UK a VFN v Praze
11; Neurologická klinika 3. LF UK a FN Královské
Vinohrady, Praha
12; I. neurologická klinika
LF MU a FN u sv. Anny v Brně
13; Inaverz, o. p. s.
14
Published in:
Cesk Slov Neurol N 2017; 80/113(4): 418-427
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn2017418
Overview
Úvod:
Guillainův-Barrého syndrom je akutní zánětlivá autoimunitní polyradikuloneuropatie patřící mezi vzácnější neurologická onemocnění, nicméně po téměř úplné eradikaci poliomyelitidy je celosvětově nejčastější příčinou akutně vzniklé chabé paralýzy. Registr funguje od roku 2012 a poskytuje prospektivně zaznamenávaná data. Cíl: Cílem registru je sledování klinického profilu, léčby a šestiměsíční prognózy nemocných s Guillainovým-Barrého syndromem.
Metodika:
Data zadávají osoby pověřené neuromuskulárními centry. Klinický průběh je hodnocen na základě GBS disability scale a svalové síly pro obličejové svalstvo a svalstvo končetin. Vyšetření je provedeno při přijetí pacienta k hospitalizaci, před léčbou, ihned po léčbě, za 1 měsíc a za 6 měsíců od ukončení léčby.
Výsledky:
V registru bylo zaznamenáno celkem 272 případů, u 137 z nich jsou k dispozici kompletní data za 6 měsíců. Z těchto 137 pacientů bylo 52 léčeno intravenózním lidským imunoglobulinem a 85 výměnnou plazmaferézou. Dobrého výsledného klinického stavu po 6 měsících dosáhlo celkem 85 % pacientů. Reziduální těžký neurologický deficit přetrvával po 6 měsících u 11 % pacientů. Šest pacientů zemřelo. Nezaznamenali jsme rozdíl v účinnosti imunoglobulinu a plazmaferézy v celém souboru, v podskupině nejtěžších pacientů či ve vztahu k pohlaví.
Závěr:
Centralizace péče a dodržování standardů péče vedou k dobré prognóze nemocných s Guillainovým-Barrého syndromem srovnatelné s relevantními zdroji.
Klíčová slova:
Guillainův-Barrého syndrom – intravenózní lidský imunoglobulin – výměnná plazmaferéza
Úvod
Guillainův-Barrého syndrom (GBS) je akutní zánětlivá autoimunitní polyradikuloneuropatie, které 1– 4 týdny před vznikem neurologické symptomatiky předchází až u 2/ 3 pacientů známý faktor, nejčastěji infekce [1,2]. S průměrnou incidencí 1,8/ 100 000 obyvatel [1] patří mezi vzácnější neurologická onemocnění, nicméně po téměř úplné eradikaci poliomyelitidy je celosvětově nejčastější příčinou akutně vzniklé chabé paralýzy a představuje závažné onemocnění z oblasti neurointenzivní péče [3]. GBS není jedno onemocnění. Jedná se o heterogenní skupinu onemocnění lišících se vzájemně klinicky, patofyziologicky a elektrofyziologicky. Existuje řada klinických variant, jejich inkompletních forem a překryvných syndromů [2,4]. Nejčastější elektrofyziologickou formou v Evropě a Severní Americe (až 90 % případů) je demyelinizační varianta, axonální varianty vč. Millerova- Fisherova syndromu (MFS) jsou vzácnější [1,3]. GBS typicky postihuje periferní nervový systém, nicméně u malé části nemocných nacházíme klinické a paraklinické známky postižení centrálního nervového systému (CNS) [4]. Prognóza onemocnění je u velké části nemocných dobrá, přesto až 20 % pacientů zůstane po 6 měsících těžce postižených a kolem 5 % jich zemře na komplikace jako sepse, plicní embolie či srdeční zástava na podkladě těžké autonomní dysfunkce [1,3]. Moderní neurointenzivní péče a včasné zahájení specifické imunoterapie výměnnou plazmaferézou (VPF) a intravenózním lidským imunoglobulinem (IVIG) výrazně zlepšuje prognózu, urychluje úpravu neurologického deficitu a snižuje mortalitu [1– 3].
V roce 2010 byl v České republice skupinou odborníků vytvořen „Standard pro léčbu pacientů s autoimunitními nervosvalovými onemocněními intravenózním lidským imunoglobulinem a plazmaferézou“ s cílem sjednotit diagnostiku a léčbu relativně vzácných autoimunitních nervosvalových onemocnění, a to vč. GBS [5]. Na tento klinický standard navázal v roce 2012 vznik registru autoimunitních nervosvalových onemocnění AINSO, a právě GBS bylo prvním sledovaným onemocněním [6]. Registr poskytuje prospektivně sbíraná data epidemiologická, klinická, léčebná i ekonomická. Umožňuje hodnocení efektivity různých léčebných postupů v různých klinických situacích, srovnání na národní i mezinárodní úrovni, umožňuje sledovat, zda dochází k dodržování doporučení klinického standardu, a v neposlední řadě může být účinným nástrojem v diskuzi s plátci péče těchto nákladných, ale účinných léčebných postupů. Následující článek prezentuje data případů GBS z registru AINSO zadaných od počátku roku 2012 do 17. 8. 2016.
Metodika
Data jsou do registru AINSO zadávána prospektivně osobami pověřenými neuromuskulárními centry v České republice. Do registru přispělo za uvedené období celkem devět neuromuskulárních center a dalších pět pracovišť, která se diagnostikou a terapií GBS zabývají. Sběr dat byl anonymní a každý pacient podepsal před vstupem do registru informovaný souhlas. Zařazení pacienta do registru proběhlo v den přijetí k hospitalizaci na dané pracoviště a celková délka sledování činila 6 měsíců od ukončení specifické imunoterapie. Kromě zadání základních demografických dat (pohlaví, věk), komorbidit, odstupu prvních příznaků k přijetí k hospitalizaci a zvoleného terapeutického postupu (IVIG, VPF, ani IVIG ani VPF) vč. dávkování a komplikací léčby bylo provedeno detailní klinické vyšetření při přijetí pacienta k hospitalizaci, před léčbou, ihned po léčbě, za 1 měsíc a za 6 měsíců od ukončení léčby. Klinický průběh byl hodnocen na základě GBS disability scale a svalové síly. GBS disability scale je obecně používaná škála postižení u pacientů s GBS, která dosahuje hodnot od nuly (zdráv) do šesti (smrt) (tab. 1) [7]. Svalová síla byla hodnocena pomocí Medical Research Council (MRC) sum score pro obličejové svalstvo (zvlášť pro svaly inervované horní a dolní větví nervus facialis) a svalstvo končetin (tři svalové skupiny pro každou končetinu). MRC sum score je šestistupňová škála nabývající hodnot od nuly (žádný pohyb) do pěti (normální svalová síla) (tab. 2) [8]. Sledování bylo ukončeno po 6 měsících od poslední podané léčby nebo ihned v případě úmrtí a za situace, kdy specifická terapie nebyla vzhledem k lehkému klinickému průběhu indikována. Pokud bylo v průběhu sledování zjištěno, že se jedná o jiné onemocnění než GBS, pacient byl z registru a dalšího statistického zpracování vyřazen. Srovnání použitých léčebných metod (IVIG a VPF) bylo provedeno pomocí GBS disability scale a MRC sum score v různých časových odstupech po léčbě. Pacienti museli mít kompletní všechna hodnocení v průběhu sledování. Efekt obou léčebných modalit byl posouzen i pro další kohorty – IVIG muži vs. IVIG ženy, VPF muži vs. VPF ženy, pacienti s GBS disability scale ≥ 4 při započetí léčby, pacienti s hodnocením pouze po 1 měsíci. Zlepšení stavu bylo hodnoceno proporčním z-testem na hladině významnosti 0,05.


Výsledky
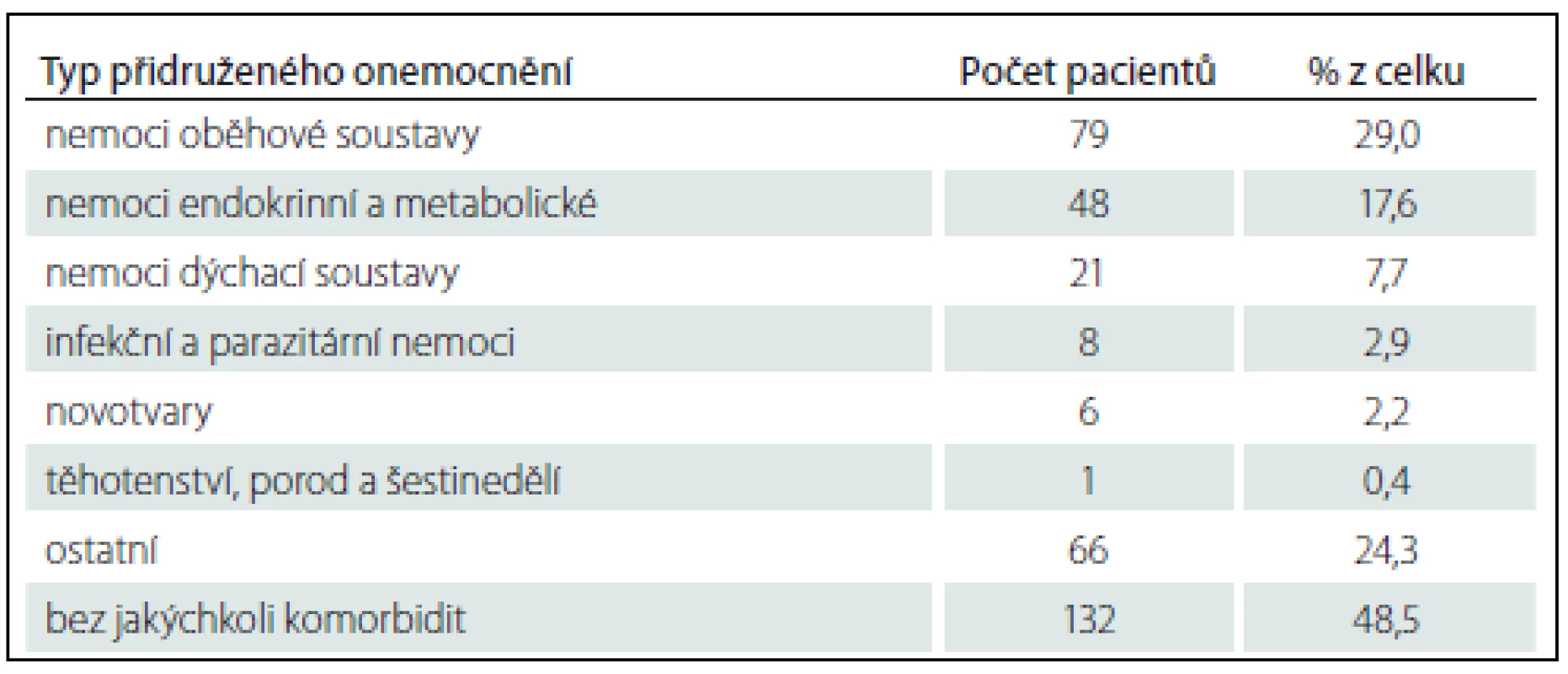
Od 1. 1. 2012 do 17. 8. 2016 bylo v registru zaznamenáno celkem 272 případů GBS, u 137 z nich máme kompletní data za 6 měsíců. Jejich charakteristiky jsou uvedeny v tab. 3. Muži mírně převažovali nad ženami (155 : 117 = 1,3 : 1). Z grafu 1 je zřejmé, že incidence narůstala s věkem a maxima dosáhla v sedmé dekádě. Většina případů (221; 81 %) byla primárně zachycena v nemocnici příslušného pracoviště, které se na tvorbě registru podílí. Patnáct z nich bylo léčeno či zachyceno na jiném oddělení než na neurologickém, téměř polovina (sedm) pak na infekčním oddělení. Nejčastější a významné komorbidity prezentuje tab. 4. Z těchto 272 případů bylo celkově šest vyřazeno pro nesprávnou diagnózu. U dvou z nich se jednalo o chronickou zánětlivou demyelinizační polyneuropatii s akutním začátkem (A-CIDP), u jednoho šlo o Wegenerovu granulomatózu, u dalšího o myeloradikulitidu (neautoimunitní) a u zbylých dvou nebyla diagnóza uvedena.
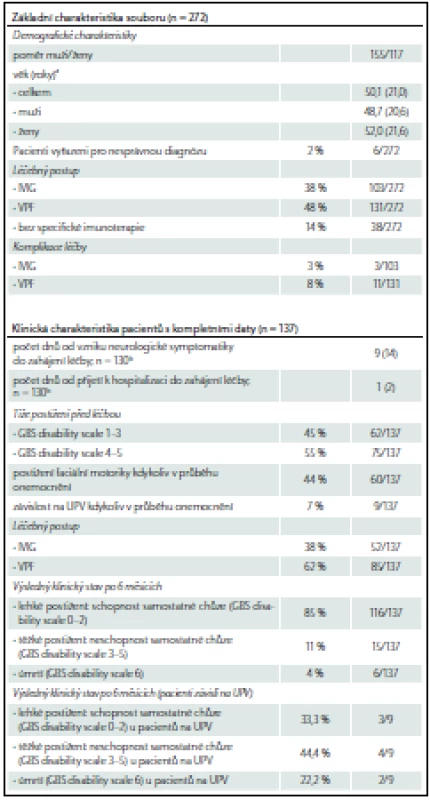

Nejčastějším léčebným postupem byla VPF (131 pacientů), léčbu IVIG podstoupilo 103 pacientů a 38 pacientů žádnou specifickou imunoterapii nevyžadovalo vzhledem k mírnému neurologickému deficitu.
Komplikace léčby se vyskytly u tří pacientů léčených IVIG a u 11 pacientů léčených VPF. V případě IVIG se u jednoho pacienta jednalo o flu-like příznaky (zimnice, třesavka) a hypertenzní reakci, u druhého byla popsána „zmatenost“, dezorientace, kardiopulmonální nestabilita a hyponatremie v souvislosti s podáváním IVIG a u třetího byla zaznamenána sinusová tachykardie. Žádná z těchto komplikací nebyla závažná a nevyžadovala ukončení léčby. U pacientů léčených VPF se objevily tyto komplikace: ve dvou případech se jednalo o nezávažnou alergickou reakci (u jednoho pacienta kašel a dušnost, u druhého exantém), která ustoupila po farmakologické terapii; u čtyř pacientů došlo během VPF k oběhové nestabilitě (kolísání tlaku krve, hypertenzi, hypotenzi, ortostatické hypotenzi, presynkopě a tachykardii); u dalších tří pacientů byly zaznamenány komplikace v oblasti vstupu do cévního řečiště (u jednoho z nich šlo o malfunkci přístupového portu kanyly, u dalšího o insuficienci periferního žilního přístupu s nutností opakovaného zavedení periferního žilního katétru a u posledního o problémy s centrálním venózním katétrem, které vyžadovaly předčasné ukončení výkonu); u jednoho pacienta došlo k perforaci arteria femoralis communis při kanylaci vena femoralis; a u posledního pacienta byla popsána ischemie v okcipitálním laloku jako suspektní PRES (Posterior Reversible Encephalopathy Syndrome); u jednoho z pacientů s oběhovými komplikacemi se navíc vyskytly bolesti zad a produktivní kašel v souvislosti s VPF.
Kompletní data za 6 měsíců jsou k dispozici u 137 pacientů, za 1 měsíc u 159 pacientů, u zbylých pacientů jsou data inkompletní nebo jejich sledování nebylo ještě ukončeno. Těchto 137 (resp. 159) pacientů bylo podrobeno detailnější analýze a byla vyhodnocena účinnost léčby, vyjádřen výsledný klinický stav po 6 měsících sledování, provedeno srovnání pacientů léčených IVIG a VPF a vyjádřen vliv pohlaví a tíže deficitu před započetím léčby na výsledný klinický stav u obou léčebných modalit.
Z těchto 137 pacientů mělo na počátku léčby 55 % GBS disability scale ≥ 4, po 1 měsíci klesl tento podíl na 15 % a po 6 měsících činil podíl tří nejzávažnějších stavů 9 %. Ke kompletní úpravě neurologického deficitu došlo po 6 měsících u 26 % pacientů (graf 2a). S tímto koreluje statisticky signifikantní zlepšení MRC sum score svalů končetin při srovnání na počátku léčby (medián MRC sum score 42) a po 6 měsících (medián MRC sum score 60; p < 0,001) (graf 2b). Porovnáním obou typů imunoterapie nebyl nalezen rozdíl mezi jejich účinností, výsledky vývoje GBS disability scale a MRC sum score jsou pro VPF (85 pacientů) a IVIG (52 pacientů) srovnatelné (graf 3a– d).



U pacientů s kompletními daty po 1 měsíci (159 pacientů; 60 pacientů bylo léčeno pomocí IVIG a 99 pomocí VPF) byla navíc vypočítána průměrná změna GBS disability scale po 1 měsíci oproti výchozímu stavu. Průměrná změna GBS disability scale činila pro VPF – 1,1 a pro IVIG – 1,2. Jejich průměrný rozdíl s 95% konfidenčním intervalem (CI) činil 0,07 (– 0,30; 0,44). O jeden nebo více stupňů v GBS disability scale se po 1 měsíci zlepšilo 75 pacientů léčených VPF (76 %) a 44 pacientů léčených IVIG (73 %). Risk ratio (RR) s 95% CI (IVIG vs. VPF) bylo 0,91 (0,53; 1,6). I z těchto analýz je patrné, že nebyl nalezen statisticky významný rozdíl v účinnosti IVIG a VPF.
Dobrého výsledného klinického stavu po 6 měsících (schopnosti samostatné chůze; tj. GBS disability scale 0– 2) dosáhlo celkem 85 % pacientů. Reziduální těžký neurologický deficit (neschopnost samostatné chůze) přetrvával po 6 měsících u 11 % pacientů. Zbylých šest pacientů (4 %) zemřelo.
Ve skupině pacientů s kompletními daty za 6 měsíců byla dále vyhodnocena lateralizace svalové slabosti. Z grafu 4 je patrné, že postižení svalů bylo stranově symetrické, průměrná svalová síla dle MRC sum score dolních končetin byla výrazně nižší než svalů horních končetin a distální svaly byly lehce více postiženy než svaly proximální. Časový vývoj svalové síly demonstruje, že k úpravě došlo nejdříve u svalů méně postižených, úprava svalové síly více postižených svalů trvala delší dobu.

Efekt imunoterapie byl dále vyhodnocen ve vztahu k pohlaví a v podskupině pacientů s GBS disability scale ≥ 4 na počátku léčby, tj. u pacientů, kteří byli odkázání na sedačku či postel nebo závislí na umělé plicní ventilaci (UPV).
Nebyl pozorován vliv pohlaví u jednotlivých léčebných modalit na výsledný klinický stav po šesti měsících. Podíl pacientů zcela zdravých (GBS disability scale 0) po 6 měsících činil u mužů léčených IVIG i VPF 29 % a u žen 21 %.
Podíl pacientů s GBS disability scale ≥ 4 na počátku léčby byl 55 % (75 pacientů). Po 6 měsících došlo ke kompletnímu uzdravení u 11 % pacientů (GBS disability scale 0) a podíl těchto tří nejzávažnějších stavů poklesl na 17 %, z nich šest zemřelo (graf 5a). Všechna zaznamenaná úmrtí z celého souboru 137 pacientů byla tedy ve skupině nejvíce postižených pacientů na počátku léčby. U MRC sum score došlo opět ke statisticky signifikantnímu zlepšení při srovnání na počátku léčby (medián MRC sum score 33) a po 6 měsících (medián MRC sum score 58; p < 0,001) (graf 5b). Ani v této podskupině nebyl zaznamenán rozdíl v účinnosti VPF (47 pacientů) a IVIG (28 pacientů). Podíl zcela uzdravených pacientů po 6 měsících léčených VPF (13 %) je srovnatelný s podílem pacientů léčených IVIG (7 %; p = 0,778) (graf 6a– d). Při srovnání pacientů s GBS disability scale 1– 3 s pacienty s GBS disability scale 4– 5 došlo bez ohledu na GBS disability scale při započetí léčby po 6 měsících ke zlepšení MRC sum score na srovnatelnou hladinu u obou podskupin (graf 7).




Diskuze
Tato publikace prezentuje pilotní data z národního registru GBS sbíraná po dobu necelých 5 let jeho fungování. Popisuje zejména účinnost obou léčebných modalit, vzájemně je srovnává a vyjadřuje výsledný klinický stav po šestiměsíčním sledování.
První léčebnou modalitou, která prokázala účinnost v léčbě GBS, byla VPF. Toto dokumentuje Cochranova metaanalýza šesti studií, které porovnávaly efekt VPF proti podpůrné léčbě. Efekt VPF byl statisticky významně lepší u řady proměnných (časnější dosažení schopnosti chůze s pomocí, časnější nástup úpravy motoriky, větší podíl pacientů schopných chůze s pomocí po 4 týdnech, zlepšení o jeden nebo více stupňů v GBS disability scale po 4 týdnech, dřívější schopnost chůze bez pomoci, nižší riziko nutnosti UPV, vyšší pravděpodobnost úpravy svalové síly do normy po 1 roce a menší pravděpodobnost těžkého reziduálního motorického deficitu) [9]. U dalších studií, které následně sledovaly účinnost IVIG, byla srovnávanou léčbou právě VPF. Tyto studie srovnávaly účinnost IVIG samotného nebo přidaného k VPF/ imunoabsorpci s účinností VPF či imunoabsorpce. Cochranova metaanalýza těchto studií prokázala srovnatelnou účinnost obou léčebných modalit, nebyl pozorován jasný efekt IVIG přidaného k VPF nebo imunoabsorpci [10]. Primárním „outcomem“ v metaanalýze studií srovnávajících efekt IVIG a VPF byla průměrná změna GBS disability scale po 4 týdnech [11– 15] a počet pacientů zlepšených alespoň o jeden bod v GBS disability scale po 4 týdnech [11– 16] V této metaanalýze byla průměrná změna GBS disability scale za 4 týdny po léčbě – 0,86 u pacientů léčených VPF a – 0,84 u pacientů léčených IVIG, průměrný rozdíl s 95% CI byl – 0,02 (– 0,25; 0,2). U 60 % pacientů léčených IVIG (177/ 293) a u 56 % pacientů léčených VPF (154/ 274) došlo po 4 týdnech ke zlepšení v GBS disability scale alespoň o jeden stupeň, mírně větší pravděpodobnost zlepšení byla zjištěna pro IVIG (RR 1,08), ale nebyl nalezen statisticky významný rozdíl (95% CI 0,94–1,23). V našem souboru pacientů analyzovaných po 1 měsíci od léčby jsme dospěli k podobným výsledkům. Ani my jsme nenalezli statisticky signifikantní rozdíl v efektu obou typů imunoterapie při hodnocení těchto proměnných.
Nezjistili jsme rozdílnou účinnost jednotlivých typů imunoterapie ve vztahu k pohlaví. Ani v podskupině nejvíce postižených pacientů na počátku léčby (GBS disability scale ≥ 4) nebyl pozorován rozdíl v účinnosti IVIG a VPF. Existují studie či analýzy podskupin s velmi malými počty pacientů, které favorizují IVIG nebo VPF, nicméně dle Cochranovy metaanalýzy nebyla jednoznačně identifikována podskupina, která by profitovala více z IVIG nebo VPF [10]. Jedna studie prokázala lepší efekt VPF u malé podskupiny ventilovaných pacientů [12], další zjistila, že u těžce postižených dětí léčených VPF byla doba trvání UPV lehce, ale statisticky signifikantně kratší, než u dětí léčených IVIG [16]. Naproti tomu jiná malá studie prokázala rychlejší úpravu klinického stavu u dětí léčených IVIG než dětí léčených VPF [17]. Stejně tak byl malými studiemi popsán lepší efekt IVIG u pacientů s pozitivními protilátkami proti gangliosidům GM1 [18– 20].
Většina námi zaznamenaných nežádoucích účinků léčby nebyla závažná a pouze u jednoho pacienta bylo nutno ukončit VPF předčasně. U pacientů léčených IVIG jsme komplikace zaznamenali u tří (3 %), u pacientů léčených VPF 11 (8 %). V metaanalýze čtyř studií bylo méně komplikací u pacientů léčených IVIG (23/ 196; 12 %) než u pacientů léčených VPF (29/ 192; 15 %), nicméně rozdíl nebyl statisticky významný (RR 0,84, 95% CI 0,54–1,3) [12,14– 16]. Riziko přerušení léčby bylo však významně nižší u pacientů léčených IVIG [10]. Jako léčba první volby je tak vzhledem k příznivějšímu bezpečnostnímu profilu obecně doporučován IVIG [2,3,21].
U jednoho našeho pacienta byl jako komplikace léčby VPF uveden PRES. Domníváme se, že PRES je většinou komplikací samotného GBS než vlastní léčby. Přesná incidence PRES u GBS není známá, nicméně je jeho výskyt u GBS udáván jako extrémně vzácný. V literatuře existují pouze kazuistická sdělení. Soubor 13 případů PRES asociovaného s GBS, který publikovali autoři Chen et al, představuje většinu doposud popsaných případů [22]. U dvou z nich byl průběh subklinický a diagnóza byla provedena na základě nálezu na magnetické rezonanci. Z tohoto vyplývá, že subklinická porucha cerebrovaskulární autoregulace může být častější, než je dokumentováno. Existuje několik hypotéz vzniku PRES u GBS: první je jako spouštěcí mechanizmus uváděna arteriální hypertenze při autonomní neuropatii; další uvádí roli cytokinů, jejichž hladina je u GBS v likvoru elevována; a jako poslední je PRES dáván do souvislosti s léčbou IVIG [23]. Z těchto 13 popsaných případů došlo u 12 z nich k rozvoji PRES ještě před podáním léčby, u zbylého pacienta vznikl PRES krátce po započetí léčby IVIG. Z výše uvedeného lze usoudit, že PRES je spíše komplikací GBS než samotné léčby, nicméně souvislost s podáním IVIG je jistě možná. Kazuistika autorů Nabi et al popisuje rozvoj PRES až po provedení VPF (stejně jako v případě našeho pacienta), nicméně autoři vznik PRES nedávají do souvislosti s VPF [23].
U dalšího pacienta léčeného IVIG byla uvedena jako komplikace léčby hyponatremie. U pacientů léčených IVIG může dojít k poklesu natremie. Nemusí se však jednat o pravou hyponatremii, ale může jít pouze o pseudohyponatremii, laboratorní chybu danou zvýšením koncentrace proteinů v séru po podání IVIG [24]. Pravá hyponatremie, způsobená nejčastěji syndromem inadekvátní sekrece antidiuretického hormonu (SIADH), bývá poměrně častým jevem u GBS. V prospektivní observační studii s 50 pacienty s GBS byl SIADH popsán u 48 % z nich a byl asociován s těžším průběhem GBS [25]. Myslet na možnost vzniku pseudohyponatremie u pacientů léčených IVIG je důležité, protože může zabránit potenciálně škodlivé restrikci tekutin a substituci hypertonickými roztoky natria, tedy opatřením, které představují léčbu SIADH. V našem registru není SIADH systematicky sledován, proto přesná data o jeho výskytu nemáme.
I přes relativně dobrou prognózu má značná část pacientů těžký reziduální neurologický deficit. Neschopnost samostatné chůze (GBS disability scale > 3) je po 6 měsících udávána až ve 20 % případů [2,21]. Zemře 3– 10 % pacientů [2,21,26]. V souboru 489 dospělých pacientů s GBS z Nizozemí (pacienti ze čtyř studií s končetinovou slabostí) bylo po 6 měsících schopno samostatné chůze 82 % [26]. V další práci z Indie, která zahrnovala 90 pacientů (2/ 3 axonální varianta GBS, pouze 13 pacientů podstoupilo specifickou imunoterapii – IVIG), byla šestiměsíční prognóza o něco horší. Samostatné chůze bylo schopno 72 % pacientů, neschopných samostatné chůze a mrtvých bylo 28 % pacientů [27]. V našem souboru bylo po 6 měsících schopno samostatné chůze 85 % pacientů, těžký reziduální neurologický deficit jsme zaznamenali u 11 % pacientů a zbylých šest pacientů (4 %) zemřelo.
Nutnost UPV je udávána u 25 % pacientů s GBS [2,21]. V průběhu 1 týdne od přijetí ji lze predikovat na základě klinických charakteristik zjištěných při přijetí pomocí skóre EGRIS (Erasmus GBS Respiratory Insufficiency Scale) [28]. Přesná data o prognóze těchto pacientů závislých na UPV jsou limitována, jak ukazuje přehledná práce Boisangera. Mortalita v sedmi analyzovaných studiích dosahovala 8,3– 20 % [29]. Ve čtyřech studiích byl výsledný stav vyjádřen pomocí GBS disability scale. Netto et al dokumentovali GBS disability scale 0– 3 při propuštění u 30,9 % pacientů [30]. Fletcher et al zjistili, že dobrého klinického výsledku (GBS disability scale 0– 2) dosáhlo po půl roce kolem 30 % pacientů, po roce 52 % a v období maximálního zlepšení 61 % [31]. Witsch et al definovali dobrý výsledný klinický stav jako GBS disability scale 0– 1 a dosáhlo na něj po 1 roce a delším časovém intervalu 53,8 % pacientů [32]. Köhrmann et al zjistili, že dobrý klinický výsledek (0– 2) byl přítomen po 1 roce u 63 % pacientů [33]. Obecně lze tedy říci, že prognóza těchto pacientů je horší. Srovnání našich dat s těmito výsledky je poměrně obtížné. Nejstarší publikovaná studie pochází sice z roku 2000, ale data jsou sbírána v širokém časovém intervalu (nejstarší data pochází z roku 1976), kdy nebyla dostupná současná terapie, a nemusí tedy reflektovat prognózu v současné době. Dalším problémem je heterogenita období, v níž je výsledný klinický stav stanoven. V našem souboru máme k dispozici šestiměsíční prognózu mechanicky ventilovaných pacientů. Ze 137 jich potřebovalo kdykoliv v průběhu onemocnění UPV pouze devět (7 %). Dva z nich zemřeli a dobrého klinického výsledku (GBS disability scale 0– 2) dosáhli tři pacienti (33,3 %).
Efekt imunoterapie je největší, pokud je zahájena do 2 týdnů od rozvoje motorického deficitu [2,3,21]. Proto je velmi důležité rychlé stanovení správné diagnózy, což většinou nečiní výraznější potíže, obzvláště u pacientů s klasickým průběhem. Diferenciální diagnostika je však poměrně široká, proto je nutné znát i atypický průběh onemocnění a stavy, které mohou GBS napodobovat [2,21,34]. V našem souboru byl medián vzniku neurologické symptomatiky do zahájení léčby 9 dnů (75. kvantil 14 dnů) a medián od přijetí k hospitalizaci k zahájení léčby 1 den (75. kvantil 2 dny). Z uvedeného vyplývá, že zahájení léčby bylo u většiny pacientů včasné (do 14 dnů) a diagnostika byla rychlá. Nesprávné označení jiného onemocnění za GBS však může významně oddálit zavedení účinné léčby (např. chirurgické léčby u kompresivních lézí nervového systému). V našem souboru byla nesprávná diagnóza iniciálně stanovena u šesti pacientů. U dvou nebyla finální diagnóza uvedena, u dvou se jednalo o A-CIDP, u jednoho pacienta šlo o Wegenerovu granulomatózu a u posledního byla finální diagnózou myeloradikulitida jiná než autoimunitní. Přibližně u 5 % pacientů s předpokládaným GBS jde ve skutečnosti o A-CIDP [35]. Rozeznat GBS od A-CIDP je v iniciální fázi velmi složité až nemožné i vzhledem k faktu, že téměř u 11 % pacientů s GBS můžeme pozorovat po iniciálním zlepšení nebo stabilizaci zhoršení neurologického deficitu, tzv. treatment-related clinical fluctuation (TRF). V klinickém obraze bývá u pacientů s GBS častější postižení hlavových nervů, svalová slabost má rychlejší nástup a je těžší, oproti tomu pacienti s A-CIPD většinou nepotřebují ventilační podporu, mají více vyjádřenou senzitivní symptomatiku vč. senzitivní ataxie, mají méně autonomních příznaků a vyšší proteinorachii [21,35]. Tyto klinické markery jsou však málo spolehlivé a až další průběh onemocnění ukáže, že jde o A-CIDP. Pro A-CIDP svědčí progrese symptomatiky po dobu více jak 8 týdnů a tři a více exacerbací/ TRF, které se navíc vyskytují později než u GBS [21,35]. TRF bývají u pacientů s GBS maximálně dvě a vyskytují se do 8 týdnů od začátku onemocnění [21] nebo od začátku léčby [26], dle různých zdrojů.
Nález nemocí oběhové soustavy jako nejčastějších komorbidit v našem souboru není překvapivý vzhledem k jejich velké prevalenci v obecné populaci, zvláště u starších lidí, u kterých je i incidence GBS vyšší. Zajímavou komorbiditou/ přidruženým stavem z hlediska terapie a patogeneze jsou nádorová onemocnění (šest pacientů) a těhotenství a puerperium (jeden pacient).
GBS bývá diagnostikován v průběhu těhotenství vzácně, nebyla zjištěna vyšší incidence oproti běžné populaci a těhotenství neovlivňuje přirozený průběh nemoci. Existují pouze sporá data o vyšším riziku relapsu onemocnění časně postpartálně. Imunoterapie je v těhotenství shodná, pouze u VPF je nutno mít na mysli specifická opatření. GBS není sám o sobě indikací k císařskému řezu [36].
V literatuře existuje řada zmínek o současném výskytu malignity a GBS. Příkladem je kazuistika GBS s atypickým průběhem a renálním karcinomem [37]. Nejčastěji bývá popisována v souvislosti s GBS hematologická malignita, z karcinomů pak karcinom plic. Není však jasné, zda jde pouze o koincidenci či paraneoplastický projev maligního onemocnění. Současný výskyt GBS a malignity je udáván kolem 2 % [37]. Toto dokumentuje i retrospektivní studie (435 pacientů s GBS), která zjistila současný výskyt malignity u devíti pacientů, což je více než dvojnásobná incidence oproti předpokladu v běžné populaci [38]. Z tohoto vyplývá, že alespoň u části pacientů se o paraneoplastickou manifestaci může jednat. V našem souboru 272 pacientů jsme zjistili současný výskyt malignity u šesti z nich (2,2 %). U dvou pacientů se jednalo o hematologickou malignitu (chronickou lymfatickou leukemii z B buněk a folikulární lymfom), u jednoho pacienta šlo o zhoubný novotvar prsu, u dalšího o zhoubný novotvar dělohy, dále o zhoubný novotvar ledviny a u posledního pacienta byl diagnostikován zhoubný novotvar kůže obličeje.
Hlavní výhodou dat získaných z registru je jejich prospektivní a standardizovaný charakter, což umožňuje srovnání kvality diagnostiky, efektu léčby a šestiměsíční prognózy na různých pracovištích i na celonárodní úrovni. Zároveň jsme si vědomi řady limitací naší práce a nedostatků dat získaných z registru. Z počtu zadaných případů GBS nelze usuzovat na incidenci onemocnění v České republice. Toto je dáno faktem, že ne všechna neurologická pracoviště, která se diagnostikou a léčbou GBS zabývají, na registru spolupracují a současně některá spolupracující pracoviště nezadávají všechny pacienty. Dalším nedostatkem je absence kompletních dat za 6 měsíců u některých pacientů, což znemožňuje zpracování širšího souboru pacientů. Řada dat není v registru systematicky sledována, proto četnost některých udaných jevů může být zkreslená. Příkladem jsou komplikace léčby, jejichž udaná četnost je zřetelně nižší než četnost udávaná v randomizovaných studiích. Hlavním cílem do budoucna by měla být snaha rozšířit počet spolupracujících pracovišť a zefektivnit zadávání dat u pracovišť stávajících.
Závěr
Efekt IVIG/ VPF a výsledný klinický stav po 6 měsících, zjištěný na základě našich dat registru, je srovnatelný se světově publikovanými daty.
I přes účinnost těchto léčebných postupů je nutno hledat další možnosti léčby vzhledem ke špatné prognóze určité části pacientů. V současné době probíhá studie u pacientů s GBS se špatnou prognózou (tito pacienti jsou identifikováni na základě „modified Erasmus GBS Outcome Score“ [39]), kde je sledován efekt druhé dávky IVIG podané krátce po první dávce – randomizovaná kontrolovaná studie SID-GBS (Nizozemí). Efekt jiné léčebné strategie se snaží nalézt další studie, v níž je sledován efekt eculizumabu, monoklonální protilátky, která se váže na C5 faktor komplementu a zabraňuje jeho štěpení, a tím tvorbu terminálního cytolytického komplexu [40– 42].
Registr pacientů s GBS představuje velmi významný prvek v péči o pacienty s GBS, neboť slouží k systematickému sledování efektu jednotlivých léčebných postupů za různých klinických situací a umožňuje jednak srovnání běžné klinické praxe s daty randomizovaných klinických studií, jednak srovnání na úrovni národní i mezinárodní, a je tedy i jakýmsi ukazatelem kvality péče.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Miroslav Škorňa
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: Skorna.miroslav2@fnbrno.cz
Přijato k recenzi: 8. 1. 2017
Přijato do tisku: 16. 3. 2017
Sources
1. Katirji B, Koontz D. Disorders of Peripheral Nerves. In: Daroff RB, Fenichel GM, Jankovic J, eds. Bradley’s Neurology in Clinical Practice. 6th ed. Philadelphia: Elsevier Saunders 2012:1955– 64.
2. Willison HJ, Jacobs BC, van Doorn PA. Guillain--Barré syndrome. Lancet 2016;388(10045):717– 27. doi: 10.1016/ S0140-6736(16)00339-1.
3. Yuki N, Hartung HP. Guillain-Barré syndrome. N Engl J Med 2012;366(24):2294– 304. doi: 10.1056/ NEJMra1114525.
4. Wakerley BR, Uncini A, Yuki N, et al. Guillain-Barré and Miller Fisher syndromes – new diagnostic classification. Nat Rev Neurol 2014;10(9):537– 44. doi: 10.1038/ nrneurol.2014.138.
5. Bednařík J, Voháňka S, Ehler E, et al. Standard pro léčbu pacientů s autoimunitními nervosvalovými onemocněními intravenózním lidským imunoglobulinem a plazmaferézou. Cesk Slov Neurol N 2010;73/ 106(5):579– 89.
6. Léčba AutoImunitních NervoSvalových Onemocnění. [cit. 2017 Čer 12]. Dostupné z URL: http:/ / ainso.cz/.
7. Hughes RA, Newsom-Davis JM, Perkin GD, et al. Controlled trial prednisolone in acute polyneuropathy. Lancet 1978;2(8093):750– 3.
8. Kleyweg RP, van der Meché FG, Schmitz PI. Interobserver agreement in the assessment of muscle strength and functional abilities in Guillain-Barré syndrome. Muscle Nerve 1991;14(11):1103– 9.
9. Raphaël JC, Chevret S, Hughes RA, et al. Plasma exchange for Guillain-Barré syndrome. Cochrane Database Syst Rev 2012;7:CD001798. doi: 10.1002/ 14651858.CD001798.pub2.
10. Hughes RA, Swan AV, van Doorn PA. Intravenous immunoglobulin for Guillain-Barré syndrome. Cochrane Database Syst Rev 2014;9:CD002063.
11. van der Meché FG, Schmitz PI. A randomized trial comparing intravenous immune globulin and plasma exchange in Guillain-Barré syndrome. Dutch Guillain--Barré Study Group. N Engl J Med 1992;326(17):1123– 9.
12. Plasma Exchange/ Sandoglobulin Guillain--Barré Syndrome Trial Group. Randomised trial of plasma exchange, intravenous immunoglobulin, and combined treatments in Guillain-Barré syndrome. Lancet 1997;349(9047):225– 30.
13. Bril V, Ilse WK, Pearce R, et al. Pilot trial of immunoglobulin versus plasma exchange in patients with Guillain-Barré syndrome. Neurology 1996;46(1):100– 3.
14. Diener HC, Haupt WF, Kloss TM, et al. A preliminary, randomized, multicenter study comparing intravenous immunoglobulin, plasma exchange, and immune adsorption in Guillain-Barré syndrome. Eur Neurol 2001;46(2):107– 9.
15. Nomura K, Hamaguchi K, Hosokawa T, et al. A randomized controlled trial comparing intravenous immunoglobulin and plasmapheresis in Guillain-Barré syndrome. Neurological Therapeutics 2001;18(1):69– 81.
16. El-Bayoumi MA, El-Refaey AM, Abdelkader AM, et al. Comparison of intravenous immunoglobulin and plasma exchange in treatment of mechanically ventilated children with Guillain Barré syndrome: a randomized study. Crit Care 2011;15(4):R164. doi: 10.1186/ cc10305.
17. Wang R, Feng A, Sun W, et al. Intravenous immunoglobulin therapy in children with Guillain-Barre syndrome. J Appl Clin Pediatrics 2001;16(4):223– 4.
18. Yuki N, Ang CW, Koga M, et al. Clinical features and response to treatment in Guillain-Barré syndrome associated with antibodies to GM1b ganglioside. Ann Neurol 2000;47(3):314– 21.
19. Kuwabara S, Mori M, Ogawara K, et al. Indicators of rapid clinical recovery in Guillain-Barré syndrome. J Neurol Neurosurg Psychiatry 2001;70(4):560– 2.
20. Jacobs BC, van Doorn PA, Schmitz PI, et al. Campylobacter jejuni infections and anti-GM1 antibodies in Guillain-Barré syndrome. Ann Neurol 1996;40(2):181– 7.
21. van Doorn PA. Diagnosis, treatment and prognosis of Guillain-Barré syndrome (GBS). Presse Med 2013;42(6 Pt 2):e193– 201. doi: 10.1016/ j.lpm.2013.02.328.
22. Chen A, Kim J, Henderson G, et al. Posterior reversible encephalopathy syndrome in Guillain-Barré syndrome. J Clin Neurosci 2015;22(5):914– 6. doi: 10.1016/ j.jocn.2014.11.004.
23. Nabi S, Rajput HM, Badshah M, et al. Posterior reversible encephalopathy syndrome (PRES) as a complication of Guillain-Barre‘ syndrome (GBS). BMJ Case Rep 2016; pii: bcr2016216757. doi: 10.1136/ bcr-2016-216757.
24. Lawn N, Wijdicks EF, Burritt MF. Intravenous immune globulin and pseudohyponatremia. N Engl J Med 1998;339(9):632.
25. Saifudheen K, Jose J, Gafoor VA, et al. Guillain-Barre syndrome and SIADH. Neurology 2011;76(8):701– 4. doi: 10.1212/ WNL.0b013e31820d8b40.
26. Fokke C, van den Berg B, Drenthen J, et al. Diagnosis of Guillain-Barré syndrome and validation of Brighton criteria. Brain 2014;137(1):33– 43. doi: 10.1093/ brain/ awt285.
27. Verma R, Chaudhari TS, Raut TP, et al. Clinico-electrophysiological profile and predictors of functional outcome in Guillain-Barre syndrome (GBS). J Neurol Sci 2013;335(1– 2):105– 11. doi: 10.1016/ j.jns.2013.09.002.
28. Walgaard C, Lingsma HF, Ruts L, et al. Prediction of respiratory insufficiency in Guillain-Barré syndrome. Ann Neurol 2010;67(6):781– 7. doi: 10.1002/ ana.21976.
29. de Boisanger L. Outcomes for patients with Guillain-Barré syndrome requiring mechanical ventilation: a literature review. Ir J Med Sci 2016;185(1):11– 5. doi: 10.1007/ s11845-015-1365-7.
30. Netto AB, Taly AB, Kulkarni GB, et al. Prognosis of patients with Guillain-Barré syndrome requiring mechanical ventilation. Neurol India 2011;59(5):707– 11. doi: 10.4103/ 0028-3886.86545.
31. Fletcher DD, Lawn ND, Wolter TD, et al. Long-term outcome in patients with Guillain-Barré syndrome requiring mechanical ventilation. Neurology 2000;54(12):2311– 5.
32. Witsch J, Galldiks N, Bender A, et al. Long-term outcome in patients with Guillain-Barré syndrome requiring mechanical ventilation. J Neurol 2013;260(5):1367– 74. doi: 10.1007/ s00415-012-6806-x.
33. Köhrmann M, Huttner HB, Nowe T, et al. Mechanical ventilation in Guillain-Barré syndrome: does age influence functional outcome? Eur Neurol 2009;61(6):358– 63. doi: 10.1159/ 000210548.
34. Levin KH. Variants and mimics of Guillain Barré Syndrome. Neurologist 2004;10(2):61– 74.
35. Anadani M, Katirji B. Acute-onset chronic inflammatory demyelinating polyneuropathy: an electrodiagnostic study. Muscle Nerve 2015;52(5):900– 5. doi: 10.1002/ mus.24667.
36. Pacheco LD, Saad AF, Hankins GD, et al. Guillain-Barré Syndrome in pregnancy. Obstet Gynecol 2016;128(5):1105– 10.
37. Večeřa L, Bednařík J. Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem. Cesk Slov Neurol N 2012;75/ 108(1):84– 7.
38. Vigliani MC, Magistrello M, Polo P, et al. Risk of cancer in patients with Guillain-Barré syndrome (GBS). A population-based study. J Neurol 2004;251(3):321– 6.
39. Walgaard C, Lingsma HF, Ruts L, et al. Early recognition of poor prognosis in Guillain-Barre syndrome. Neurology 2011;76(11):968– 75. doi: 10.1212/ WNL.0b013e3182104407.
40. Fitzpatrick AM, Mann CA, Barry S, et al. An open label clinical trial of complement inhibition in multifocal motor neuropathy. J Peripher Nerv Syst 2011;16(2):84– 91. doi: 10.1111/ j.1529-8027.2011.00328.x.
41. Halstead SK, Zitman FM, Humphreys PD, et al. Eculizumab prevents anti-ganglioside antibody-mediated neuropathy in a murine model. Brain 2008;131(5):1197– 208.
42. Yamaguchi N, Misawa S, Sato Y, et al. A Prospective, Multicenter, Randomized Phase II Study to Evaluate the Efficacy and Safety of Eculizumab in Patients with Guillain-Barré Syndrome (GBS): Protocol of Japanese Eculizumab Trial for GBS (JET-GBS). JMIR Res Protoc 2016;5(4):e210.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 4
Most read in this issue
- Český národní registr Guillainova-Barrého syndromu
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
