Okulárna myasténia gravis v Slovenskej republike
Ocular Myasthenia Gravis in Slovak Republic
Background:
Ocular symptoms are the most common initial symptoms of myasthenia gravis (MG) and they generalize rapidly in the majority of MG patients. In purely ocular MG (OMG), impairment of neuromuscular transmission remains limited to extraocular muscles even after three years from OMG onset.
Aim:
We performed retrospective longitudinal study in 946 MG patients with initial ocular symptoms (oMG) registered between 1978 and 2015 at the Slovak Centre for Neuromuscular Diseases. The aim of this study was to analyze clinical assessments, laboratory findings and prognostic factors in oMG.
Material and methods:
We analyzed data and findings in medical records of oMG patients including age at onset, sex, autoantibodies against acetylcholine receptors (AChRs) and muscle-specific kinase (MuSK), a type of clinical symptomatology. We evaluated the therapies used, clinical status at the last examination and prognosis in this initial clinical pattern.
Results:
Impairment of ocular muscles as the first MG sign occurred in 946 patients (M = 487, F = 459). oMG generalized in due course in 554 (58.6%) patients. We identified male gender (RR 1.23), age at onset of over 50 years (RR 1.23), association with other autoimmune diseases (RR 1.57), AChR - seropositivity (RR 2.09) and thymoma (RR 15.71) as the risk factors of oMG generalization. We identified female gender (RR 1.2), AChR - seronegativity (RR 1.58), oMG generalization (RR 1.63) and age at onset of below 50 years (RR 2.08) as predictive factors of unfavourable outcome (repeated exacerbations, unfavourable post-intervention status).
Conclusion:
To improve oMG prognosis, it is important to recognize the oMG patients with high risk of generalization and/or unfavourable outcome and to select appropriate therapy for these patients.
Key words:
myasthenia gravis – ocular myasthenia gravis – diagnosis – prognosis – generalization
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
斯洛伐克共和国眼科重症肌无力背景:
眼部症状通常是重症肌无力(MG)的最初表现,并且它们在大多数MG患者中发展的很迅速。在纯粹的眼部MG(OMG)中,即使在OMG发病三年后,仍然存在有限的存在损伤的神经肌肉传播到眼外肌。
目标:
我们对1978年至2015年间在斯洛伐克神经肌肉疾病中心登记的946名MG患者进行了追溯性纵向研究。本研究的目的是分析oMG中的临床评估,实验室检查结果和预后因素。
材料和方法:
我们分析了oMG患者的病历数据,包括发病年龄,性别,乙酰胆碱受体(AChR)和肌肉特异性激酶(MuSK)的一种临床症状学类型。我们评估了使用的治疗方法,最后一次检查时的临床状态和初步临床模式的预后。
结果:
946例MG患者均首次出现了眼肌损伤的征兆(男 = 487,女 = 459)。 oMG在554例(58.6%)患者中适时推广。我们确定男性性别(RR 1.23),50岁以上发病(RR 1.23),与其他自身免疫性疾病(RR 1.57),AChR-血清阳性(RR 2.09)和胸腺瘤(RR 15.71)的关系作为oMG的危险因素。我们确定女性性别(RR 1.2),AChR - 血清反应性(RR 1.58),oMG泛化(RR 1.63)和50岁以下发病(RR 2.08)作为不良后果的预测因素(重复加重,不良干预后状态)。
结论:
为了改善oMG预后,重要的是要识别具有广泛性风险和/或不利后果的oMG患者,并为这些患者选择合适的治疗方法。
关键词:
重症肌无力 - 重症肌无力 - 诊断 - 预后 - 泛化
Authors:
I. Martinka 1; F. Cibulčík 1; J. Bednařík 2; P. Špalek 1
Authors‘ workplace:
Centrum pre neuromuskulárne ochorenia, Neurologická klinika SZU a UN Bratislava
1; Neurologická klinika LF MU a FN Brno
2
Published in:
Cesk Slov Neurol N 2017; 80/113(2): 190-196
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn2017190
Overview
Úvod:
Okulárna symptomatika je najčastejším prvým prejavom myasténie gravis (MG), pri prirodzenom priebehu dochádza obvykle k rýchlej generalizácii. O čisto okulárnej MG (OMG) hovoríme, ak izolovaná okulárna symptomatika pretrváva aj po 3 rokoch od vzniku MG.
Cieľ:
Prezentujeme retrospektívnu longitudinálnu štúdiu súboru 946 pacientov s iniciálnou okulárnou symptomatikou MG (oMG) evidovaných v slovenskom Centre pre neuromuskulárne ochorenia v rokoch 1978– 2015. Cieľom práce bola analýza klinických údajov, laboratórnych nálezov a prognostických faktorov.
Materiál a metodika:
Metódou štúdia bol rozbor zdravotnej dokumentácie pacientov s oMG. Zisťovali sme vek pri vzniku oMG, pohlavie, titer autoprotilátok proti acetylcholínovým receptorom (AChR) a svalovo špecifickej kináze (MuSK). Hodnotili sme použité terapeutické postupy, klinický stav pri poslednej kontrole a prognózu.
Výsledky:
Okulárna symptomatika bola iniciálnym príznakom MG u 946 pacientov (M = 487, Ž = 459). oMG generalizovala u 554 (58,6 %) pacientov. Ako rizikové faktory generalizácie oMG sme identifikovali mužské pohlavie (RR 1,23), vek nad 50 rokov (RR 1,23), asociáciu s ďalším autoimunitným ochorením (RR 1,57), AChR séropozitívitu (RR 2,09), tymóm (RR 15,71). Prediktívnymi faktormi nepriaznivého priebehu (opakované exacerbácie MG, nepriaznivý postintervenčný status) sú ženské pohlavie (RR 1,2), AChR séronegativita (RR 1,58), generalizácia oMG (RR 1,63), vek pod 50 rokov (RR 2,08).
Záver:
Pre zlepšenie prognózy je dôležité včasné rozpoznanie pacientov s oMG s vyšším rizikom generalizácie a/ alebo nepriaznivého priebehu a indikácia správnej liečby týmto pacientom.
Kľúčové slová:
myasténia gravis – okulárna myasténia gravis – diagnostika – prognóza – generalizácia
Úvod
Myasténia gravis (MG) je autoimunitné ochorenie nervovo-svalového spojenia, ktoré sa prejavuje slabosťou postihnutých svalových skupín kolísavej intenzity. Pre MG je typické postihnutie okohybných svalov. Okulárne príznaky (diplopia, ptóza viečok) sú najčastejším iniciálnym prejavom MG u 40– 50 % pacientov, v priebehu MG sa manifestujú u väčšiny pacientov. Existuje niekoľko príčin častého postihnutia okohybných svalov u MG:
- Vyššia frekvencia nervovo-svalových spojení v okohybných svaloch (resp. menšie motorické jednotky).
- Nižšia denzita acetylcholínových postsynaptických receptorov v okohybnom svalstve, a tým nižšia funkčná rezerva neuromuskulárneho prenosu.
- Vznik klinických príznakov (diplopia) už pri ľahkej slabosti niektorého z okohybných svalov na základe vychýlenia optických osí [1].
U väčšiny pacientov s iniciálnou izolovanou okulárnou symptomatikou MG (oMG) dochádza pri prirodzenom priebehu (bez ovplyvnenia imunoterapiou) ku generalizácii MG. Porucha neuromuskulárneho prenosu sa môže manifestovať v ktoromkoľvek ďalšom priečne pruhovanom svale. oMG najčastejšie generalizuje v prvých 2 rokoch od vzniku, zriedkavejšie v 3. roku [1– 4]. O lokalizovanej okulárnej MG (OMG) hovoríme, ak ochorenie ostáva limitované na okohybné svaly aj po 3. roku od vzniku prvých príznakov MG [1,5– 8].
V našej práci prezentujeme retrospektívnu longitudinálnu štúdiu súboru 946 pacientov s oMG evidovaných v slovenskom Centre pre neuromuskulárne ochorenia (NMO) v rokoch 1978– 2015. Cieľom práce bola analýza klinických údajov, laboratórnych nálezov a identifikácia rizikových faktorov generalizácie a nepriaznivého priebehu oMG.
Súbor a metodika
V súbore 2 074 pacientov s MG registrovaných v našom Centre pre NMO v rokoch 1978– 2015 sme hodnotili skupinu 946 pacientov s oMG. Pacienti s MG sú na našom pracovisku systematicky dispenzarizovaní s celoslovenskou pôsobnosťou od roku 1978. Metódou štúdia bol retrospektívny rozbor údajov a nálezov zdravotnej dokumentácie Centra pre NMO Slovenskej republiky.
Na základe týchto diagnostických kritérií bola diagnostikovaná oMG:
- Klinické kritériá MG – anamnéza; základné neurologické vyšetrenie; statické a dynamické záťažové testy (Gorelickov príznak, Simpsonova skúška) [1,9,10].
- Elektrofyziologické vyšetrenia – SFEMG: predĺžený jitter, blokovanie.
- Pozitívny farmakologický reparačný test – hodnotenie a porovnanie klinického nálezu pred i.v. aplikáciou neostigmínu a po nej.
- Vyšetrenie protilátok proti acetylcholínovým receptorom (AChR) a svalovo špecifickej kináze (MuSK).
Sledovaný súbor sme rozdelili na tri skupiny:
- Skupina 1: oMG so sekundárnou generalizáciou (G-oMG): v úvode sa manifestovala izolovaná okulárna symptomatika, v ďalšom priebehu došlo ku generalizácii MG u všetkých pacientov počas prvých 3 rokov od vzniku MG.
- Skupina 2: Lokalizovaná OMG liečená imunoterapiou: od stanovenia diagnózy alebo v priebehu ochorenia bola pacientom ordinovaná imunoterapia (kortikosteroidy a/ alebo imunosupresíva) pre vyššie riziko generalizácie hodnotené empiricky, závažnú okulárnu symptomatiku alebo nedostatočný efekt inhibítorov acetylcholínesterázy (IAChE).
- Skupina 3: Lokalizovaná OMG neliečená imunoterapiou: pacientom bol ordinovaný len IAChE alebo z dôvodu spontánnej remisie žiadnu liečbu neužívali.
V jednotlivých skupinách pacientov s oMG sme zisťovali tieto údaje:/p>
- pohlavie,
- vek pri vzniku MG,
- klinický obraz a priebeh (generalizácia, spontánne remisie),
- titer protilátok proti AChR a MuSK,
- formy liečby MG (IAChE, kortikoterapia, imunosupresíva, tymektómia),
- klinický stav pacientov pri poslednej kontrole (MGFA postintervenčný status) [11],
- výskyt exacerbácií oMG, resp. myastenických kríz u G-oMG.
Pre porovnanie štatistickej významnosti pozorovaných javov v jednotlivých skupinách oMG sme použili adekvátne testy (Studentov t-test, chi kvadrát test, ANOVA analýza).
Zo získaných údajov sme identifikovali prediktory sekundárnej generalizácie a nepriaznivého priebehu oMG. Ako kritérium pre nepriaznivý priebeh oMG sme stanovili výskyt opakovaných exacerbácií (dve a viac) a/ alebo nepriaznivý klinický stav pri poslednej kontrole podľa MGFA postintervenčného statusu [11]. Exacerbáciu sme definovali ako zhoršenie klinického stavu pacienta v porovnaní s predchádzajúcou kontrolou (nová myastenická symptomatika alebo zvýšenie intenzity pôvodných myastenických príznakov) [11]. Ako nepriaznivý sme hodnotili status horší ako minimálna manifestácia [11].
Pri hodnotení rizikových faktorov generalizácie sme porovnávali výskyt sledovaných parametrov (vek, pohlavie, pozitivita/ negativita titra protilátok proti AChR v sére, asociované autoimunitné ochorenia, tymóm) u G-oMG (skupina 1) a v skupine lokalizovanej OMG bez imunoterapie (skupina 3). Pri hodnotení prediktorov nepriaznivého priebehu sme porovnávali výskyt vyššie uvedených parametrov v skupine pacientov s priaznivým a nepriaznivým priebehom oMG. Do týchto skupín boli pacienti zaradení na základe vyššie uvedených kritérií pre nepriaznivý priebeh, bez ohľadu na neskoršiu generalizáciu oMG. Následne sme vypočítali RR a jeho hladinu štatistickej významnosti pre sledované parametre.
Výsledky
Demografické, klinické a laboratórne charakteristiky
oMG sa v našom súbore 2 074 pacientov s MG vyskytla u 946 pacientov (45,6 %). K sekundárnej generalizácii oMG došlo u 554 pacientov (58,6 %). Skupinu 2 tvorí 240 pacientov (25,4 %), skupina 3 pozostáva zo 152 pacientov (16,0 %).
Priemerný vek a medián pri vzniku oMG v celom súbore aj pre jednotlivé skupiny a pohlavia je uvedený v tab. 1. Štatisticky signifikantne sa líši celkový priemerný vek pri vzniku oMG medzi jednotlivými skupinami, priemerný vek pri vzniku oMG u žien v porovnaní s mužmi v celom súbore aj v skupine 1 (tab. 1), priemerný vek pri vzniku oMG u mužov medzi skupinou 1 a 3, resp. 2 a 3 (p < 0,01) a u žien medzi skupinami 1 a 2, resp. 2 a 3 (p < 0,01).
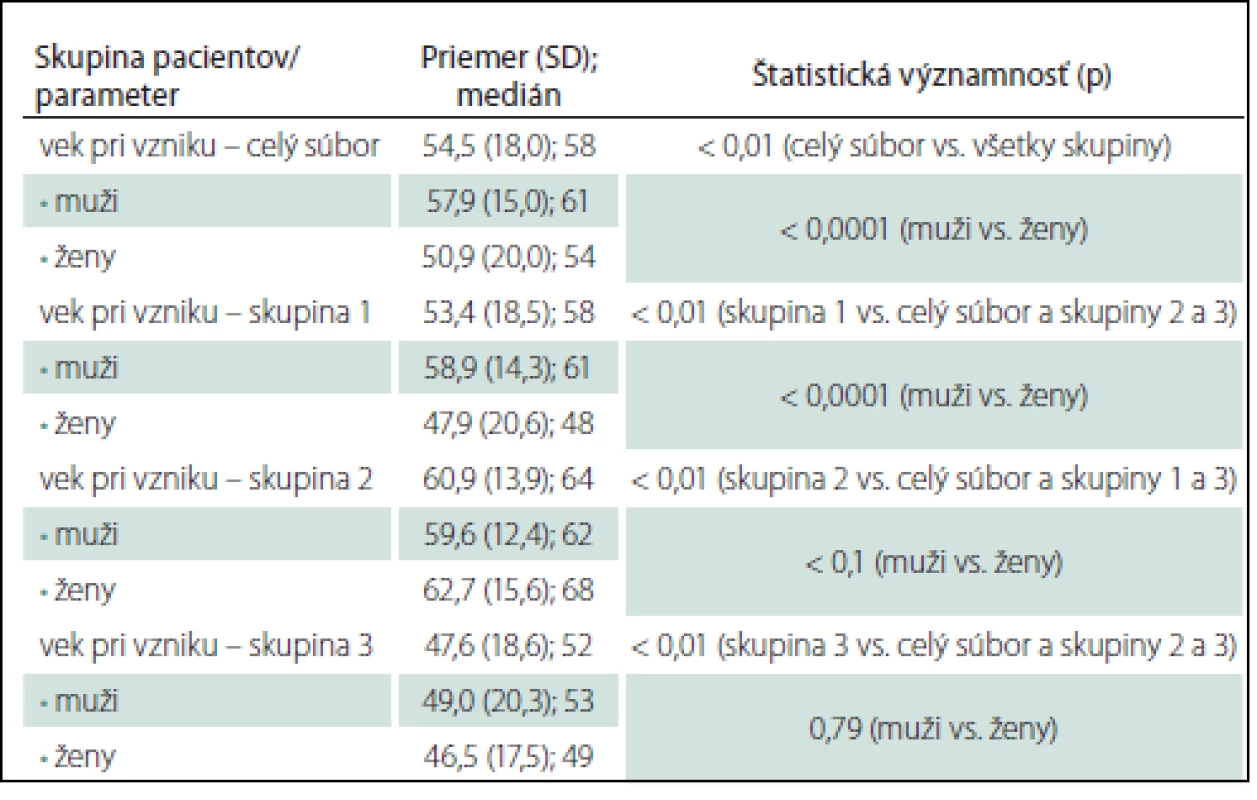
oMG môže vzniknúť v akomkoľvek veku (graf 1). U skupiny 3 je primomanifestácia oMG pred 50. rokom podstatne častejšia u 70 pacientov (46,1 %) v porovnaní so skupinou 1 u 187 pacientov (33,7 %) a najmä skupinou 2 u 39 pacientov (16,5 %) (p < 0,01 pre skupiny 1 a 3; p < 0,0001 pre skupiny 2 a 3).
V celom súbore sme oMG zaznamenali u 487 mužov (M) a 459 žien (Ž) (graf 1). V skupine 1 je zastúpenie pohlaví takmer rovnomerné (M = 280, Ž = 274), v skupine 2 prevažujú muži (M = 144, Ž = 96), v skupine 3 sme zaznamenali prevahu žien (M = 63, Ž = 89). Proporcionálne zastúpenie mužov a žien sa v jednotlivých skupinách líši (p < 0,01 pre skupiny 1 a 2, resp. 2 a 3; p < 0,05 pre skupiny 1 a 3).

Klinicky sa oMG v našom súbore manifestovala poklesom viečok u 241 pacientov (25,5 %), poruchou okulomotoriky s diplopiou u 74 pacientov (7,8 %), kombináciou poklesu viečok a poruchy okulomotoriky u 631 pacientov (66,7 %).
Titer protilátok proti AChR sme vyšetrili u 786 pacientov a titer protilátok proti MuSK u 126 pacientov s oMG. Pozitívny titer protilátok proti MuSK sme nezistili u žiadneho z vyšetrených pacientov. AChR séronegatívna forma sa signifikantne častejšie (p < 0,0001)vyskytuje v skupine 3 u 75 pacientov (49,3 %) v porovnaní so skupinami 1 a 2 u 66, resp. 30 pacientov (11,9 %, resp. 12,5 %).
U všetkých pacientov s AChR séropozitívnou oMG je indikované CT mediastina s kontrastnou látkou alebo MR mediastina na vylúčenie tymómu. Tymóm sme diagnostikovali u 39 pacientov, u 28 z nich oMG generalizovala.
Liečba
Liečba indikovaná v jednotlivých skupinách našich pacientov je uvedená v tab. 2.
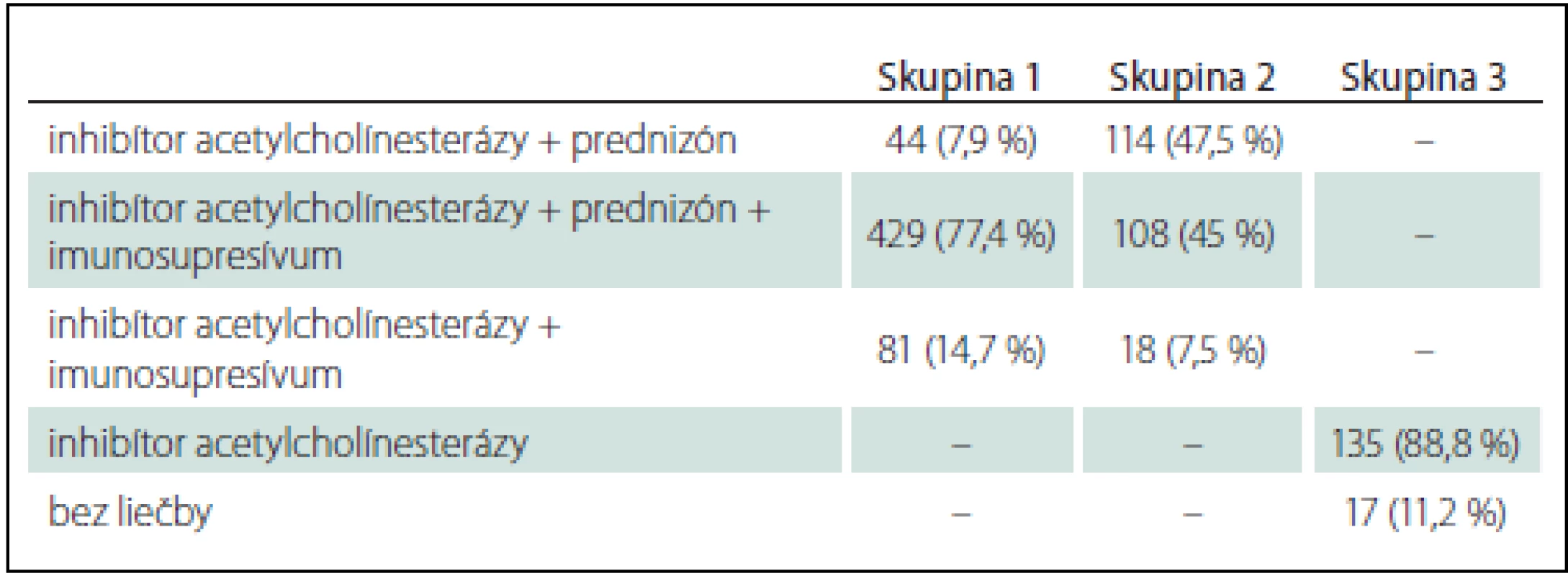
Tymektómiu sme u G-oMG ordinovali u 28 pacientov s tymómom a u ďalších 119 pacientov s AChR séropozitívnou MG so vznikom pred 50. rokom veku. U pacientov s lokalizovanou OMG podstúpilo tymektómiu 11 pacientov s diagnostikovaným tymómom, u ostatných 17 pacientov bola indikáciou k tymektómii AChR séropozitívna MG, vek pod 50 rokov a výrazná okulárna symptomatika.
Klinický priebeh a prognóza
Pri posudzovaní prognózy pacientov s oMG sme hodnotili klinický stav pri poslednej kontrole, priebeh, výskyt exacerbácií. Veľmi dobrý klinický stav (kompletná stabilná remisia; CSR, farmakologická remisia; PR, minimálna manifestácia; MM) sme zaznamenali u 346 pacientov (62,5 %) v skupine 1 a u 189 pacientov (78,8 %) v skupine 2, v skupine 3 u 117 pacientov (76,9 %) (tab. 3). V skupine 3 došlo u 17 pacientov k spontánnej remisii bez nutnosti liečby.
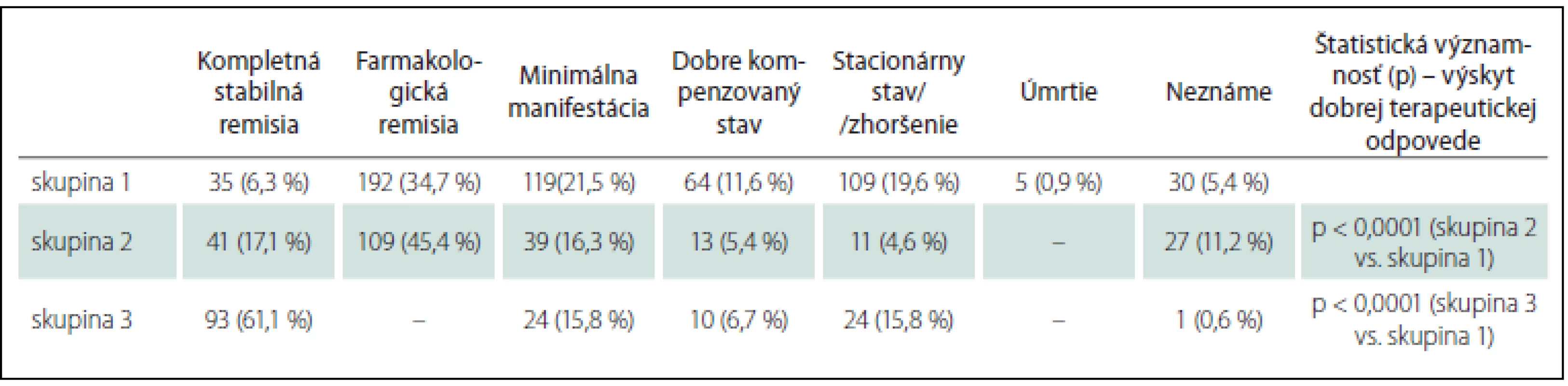
V skupine 1 sme zaznamenali exacerbáciu 600-krát u 241 pacientov (43,5 %), u 120 pacientov (21,7 %) sa exacerbácie MG vyskytli dvakrát a viac. U G-oMG sme päťkrát zaznamenali aj hroziacu myastenickú krízu, 41-krát rozvinutú myastenickú krízu s nutnosťou UPV, piati pacienti zomreli pred rokom 1996 v myastenickej kríze. U lokalizovanej OMG sme zaznamenali 49 exacerbácií v okohybnom svalstve u 37 pacientov (9,4 %). Výskyt exacerbácií aj podiel pacientov s opakovanými exacerbáciami je signifikantne častejší u G-oMG ako u lokalizovanej OMG (p < 0,0001).
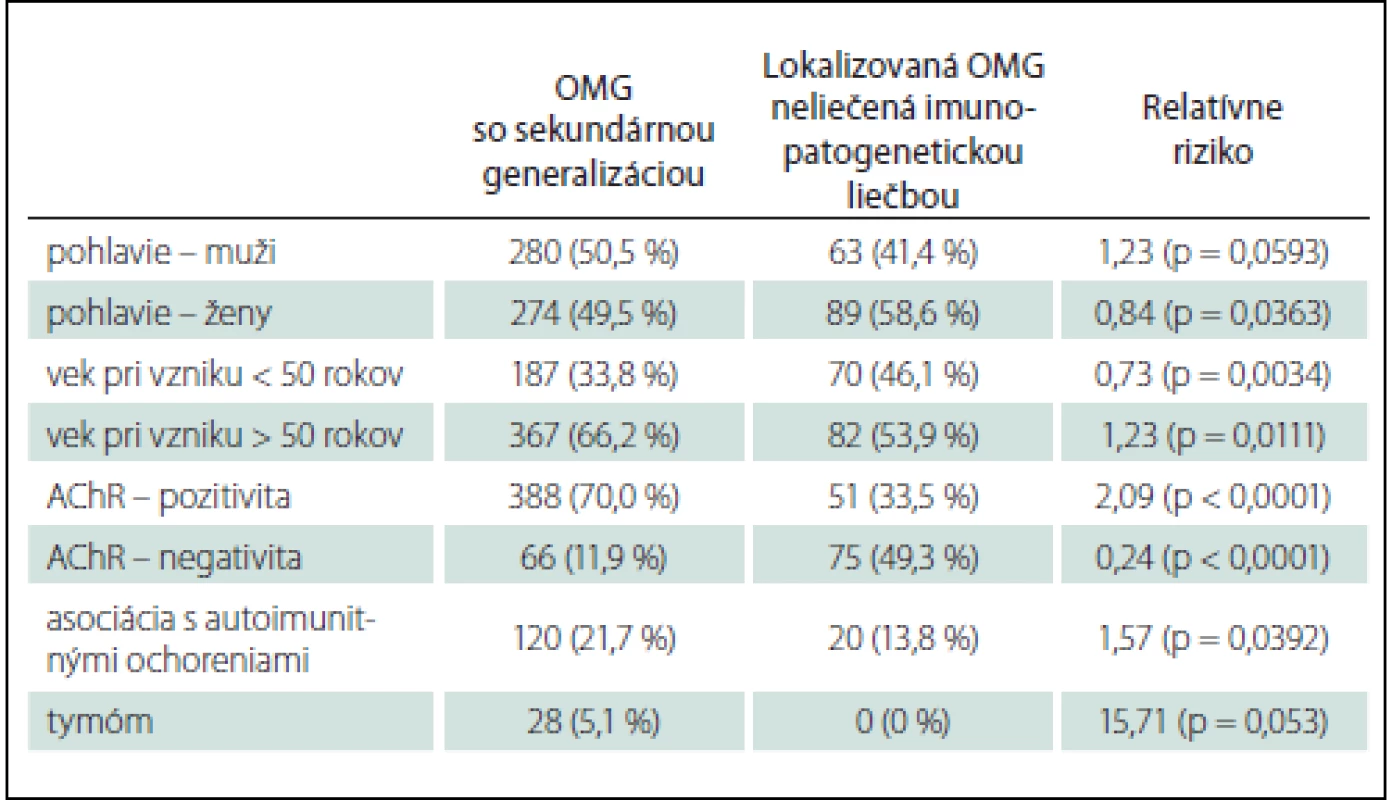
oMG generalizovala u 554 pacientov (58,6 %). Rizikovými faktormi pre generalizáciu oMG sú vek nad 50 rokov (RR 1,23), asociácia s ďalším autoimunitným ochorením (RR 1,57), AChR séropozitívita (RR 2,09) (tab. 4). Veľmi pravdepodobnými rizikovými faktormi generalizácie sú aj mužské pohlavie (RR 1,23) a tymóm (RR 15,71) (tab. 4). Asociácia týchto potenciálnych rizikových faktorov s generalizáciou oMG sa blížila štatistickej významnosti (tab. 4).
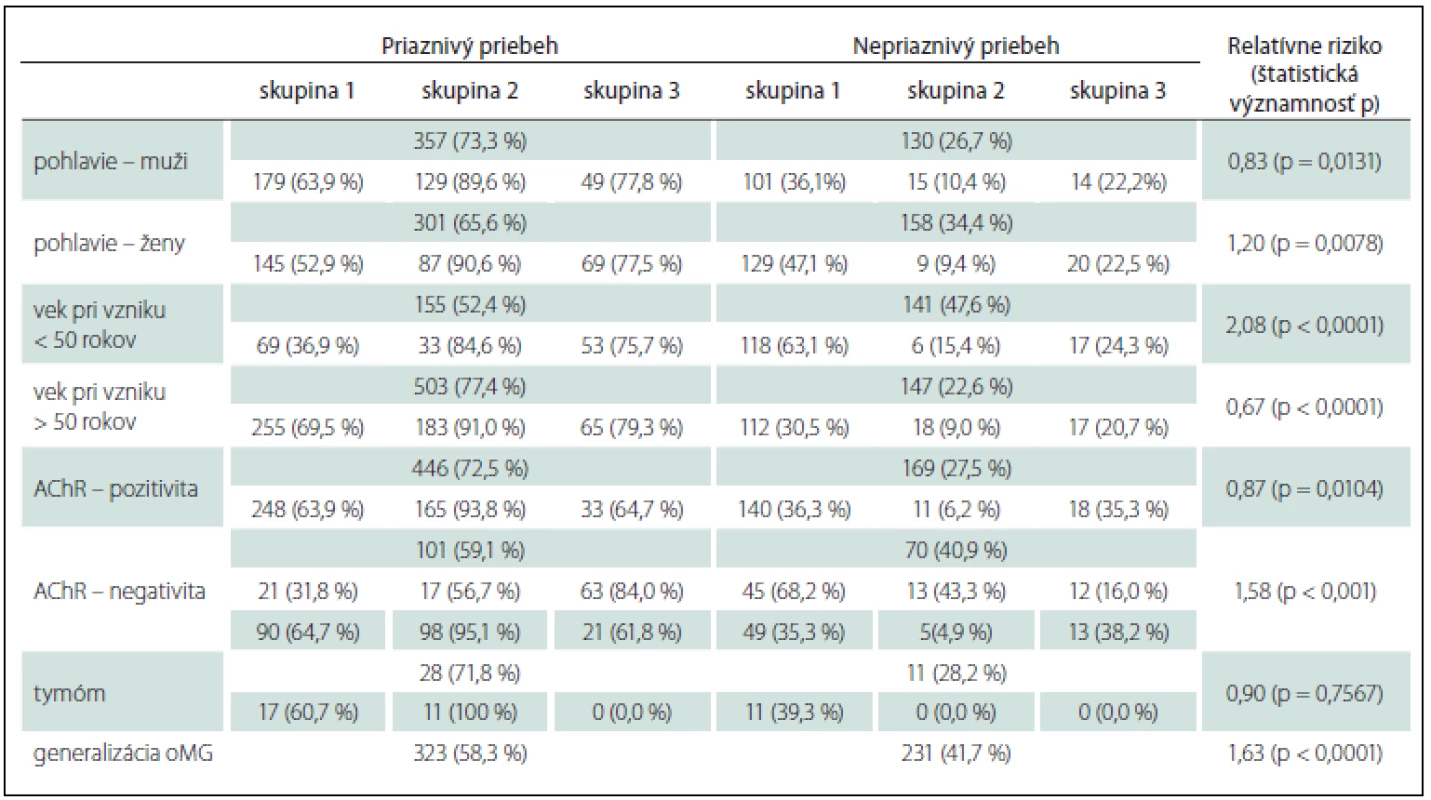
Priaznivý priebeh sme zaznamenali u 658 pacientov (69,6 %), nepriaznivý priebeh u 288 pacientov (30,4 %). Výskyt sledovaných parametrov v skupinách s priaznivým/ nepriaznivým priebehom a v podskupinách oMG je uvedený v tab. 5. Prediktormi nepriaznivejšieho priebehu oMG sú ženské pohlavie (RR 1,20), AChR – séronegativita (RR 1,58), generalizácia oMG (RR 1,63), vek pod 50 rokov (RR 2,08) (tab. 5).
Diskusia
Izolovaná okulárna symptomatika sa podľa literárnych údajov objavuje v úvode MG u 40– 50 % pacientov [1,9,10]. OMG sa vyskytuje u 15– 20 % všetkých pacientov s MG [9,10]. V našom súbore sme oMG zaznamenali u 946 z 2074 pacientov s MG (45,6 %) a lokalizovanú OMG sme zistili u 392 pacientov (18,9 %), čo je v zhode s literárnymi údajmi.
Podľa literárnych zdrojov sa lokalizovaná OMG častejšie vyskytuje u žien [8,12– 14], priemerný vek pri vzniku OMG sa pohybuje od 40 do 50 rokov [9,10,14]. V našom súbore sú v skupinách 1 a 2 častejšie zastúpení muži, v skupine 3 ženy (graf 1). Priemerný vek pri vzniku oMG je v skupine 1 a 2 vyšší ako 50 rokov, v skupine 3 je nižší ako 50 rokov (tab. 1).
Okulárna MuSK pozitívna MG je raritná, popísaných je v literatúre len niekoľko prípadov [15]. V celom súbore sme nezaznamenali pozitívny titer anti-MuSK protilátok u žiadneho z vyšetrených pacientov. Výskyt AChR séropozitívnej oMG je podľa jednotlivých literárnych zdrojov rozdielny. Pohybuje sa od 40 do 71 % pacientov [13,14,16– 18]. My sme zaznamenali pozitívny titer protilátok proti AChR u 70 % pacientov s G-oMG a u 57,9 % pacientov s lokalizovanou OMG, čo zodpovedá literárnym údajom.
V otázke liečby oMG sa názory líšia najmä na včasnú indikáciu imunoterapie a indikáciu tymektómie [7]. Viacerí autori odporúčajú imunosupresívnu liečbu (v prvej línii kortikoterapiu) až pri nedostatočnej efektivite IAChE v odstránení/ zmiernení okulárnych príznakov [2,19– 22]. IAChE sú v liečbe OMG efektívne a majú dobrý bezpečnostný profil [1,2], neznižujú však riziko generalizácie a sú menej účinné u pacientov s diplopiou [1,7]. Naopak vo viacerých prácach sa potvrdil pozitívny efekt kortikosteroidov na zníženie rizika generalizácie oMG [5,8,23– 25]. Preto sa títo autori, rovnako ako my, prikláňajú k včasnej liečbe kortikosteroidmi u pacientov s oMG s vyšším rizikom generalizácie [8,23– 25]. Dôvody na takýto postup sú viaceré. Generalizácia MG obvykle zhoršuje kvalitu života pacienta, je spojená s rizikom vzniku myastenických kríz a vyššieho výskytu závažnejších exacerbácií MG a nežiaducich účinkov liečby. Iniciálna dávka prednizónu ordinovaná u našich pacientov s oMG je nižšia ako u generalizovanej MG (< 1 mg/ kg denne). Pri potrebe dlhodobej liečby kortikoidmi alebo vyššej dávky kortikoidov ku kontrole príznakov pridávame do liečby aj azatioprín (1– 3 mg/ kg/ deň). Pri kontraindikácii kortikosteroidov alebo rozvoji závažných nežiaducich účinkov kortikoterapie ordinujeme samotný azatioprín v kombinácii s IAChE.
Jednoznačnou indikáciou k tymektómii u OMG je len nález tymómu, časť autorov ju inak považuje za neindikovanú [20,26]. Podľa niektorých literárnych zdrojov sa ako indikácia na tymektómiu u OMG uvádza aj vek pod 50 rokov a závažná okulárna symptomatika, rezistencia na imunoterapiu [27]. My sme tymektómiu indikovali u 28 pacientov s OMG. Jedenásť pacientov malo potvrdený tymóm. Ostatní pacienti boli mladší ako 50 rokov, s vysoko pozitívnym titromanti – AChR protilátok a výraznou okulárnou symptomatikou.
Izolované postihnutie okohybných svalov je typické pre MG v úvode ochorenia, pri prirodzenom priebehu je charakteristická tendencia ku generalizácii. V období pred rutinným zavedením imunoterapie v liečbe MG bolo riziko generalizácie vysoké. Grob et al udávajú v súbore 1 487 pacientov sledovaných v rokoch 1940– 1985 generalizáciu u 86 % pacientov s oMG [3]. V novších literárnych zdrojoch je uvádzané podstatne nižšie riziko generalizácie – od 23,3 do 53 % [5,14,15,28– 31]. Značné rozdiely sú dané odlišnou stratégiou liečby, dĺžkou celkového sledovania pacientov, veľkosťou súborov. V našom súbore je frekvencia generalizácie pomerne vysoká u 554 pacientov (58,6 %). Dôvodom častej generalizácie oMG bola najmä oneskorená diagnostika spôsobená nedostatočnou informovanosťou o oMG zo strany pacientov a/ alebo lekárov prvého kontaktu a zložitosťou diferenciálnej diagnostiky oMG. Ďalším dôvodom je nedostatočná stratifikácia rizikovosti pacientov s oMG v staršom období (80. roky 20. storočia) – u niektorých pacientov bol napriek vysokému riziku generalizácie ordinovaný len IAChE ako liek prvej voľby.
Ako rizikové faktory generalizácie oMG sa tradične podľa literárnych zdrojov uvádzajú AChR séropozitívna MG, vysoký titer protilátok proti AChR v sére, vek pri vzniku oMG nad 50 rokov, tymóm, mužské pohlavie [3– 5,7]. Novšie práce ako rizikový faktor generalizácie uvádzajú aj výskyt jednej alebo viacerých komorbidít, vrátane asociovaných autoimunitných ochorení [32], hyperpláziu týmusu [32] a patologický dekrement amplitúdy a arey CMAP pri repetitívnej nervovej stimulácii n. ulnaris [33]. V našom súbore sme ako najvýraznejšie rizikové faktory generalizácie oMG potvrdili tymóm a pozitívny titer protilátok proti AChR, pri tymóme však vzhľadom na malý počet pacientov nie je výsledok štatisticky signifikantný. Ďalšími prediktormi generalizácie v našom súbore sú vek pri vzniku oMG nad 50 rokov, asociácia s iným autoimunitným ochorením, ako aj mužské pohlavie – u tohto prediktora však výsledok nie je štatisticky signifikantný (tab. 4). Naše zistenia ohľadom rizikových faktorov generalizácie korelujú s inými literárnymi zdrojmi.
Prognóza OMG je lepšia ako u generalizovanej MG – kvalita života je vyššia, spontánne remisie sú častejšie a trvajú dlhšie, nehrozí bezprostredné ohrozenie života [3,4]. Naše výsledky tiež potvrdzujú nepriaznivejšiu prognózu u G-oMG v porovnaní s lokalizovanou OMG. Pacienti so sekundárnou generalizáciou majú 1,6-násobne vyššie riziko nepriaznivého priebehu, tvoria 80,2 % pacientov s nepriaznivým priebehom oMG (tab. 5). Dobrá terapeutická odpoveď je signifikantne častejšia u skupín lokalizovanej OMG ako u G-oMG (tab. 3), výskyt exacerbácií je v týchto skupinách tiež signifikantne zriedkavejší.
Zavedením imunoterapie do liečby oMG sa dosiahla aj lepšia kontrola okulárnych príznakov, zmiernil sa dopad na kvalitu života. V práci Suzukiho et al dosiahlo dobrú terapeutickú odpoveď 62 % pacientov s lokalizovanou OMG [12]. Ariatti et al však udávajú zlepšenie len u 39,5 % pacientov s OMG [34]. V našom súbore sme dobrý klinický stav dosiahli u 346 pacientov (62,5 %) s G-oMG, u 189 pacientov (78,8 %) s lokalizovanou OMG liečených imunoterapiou a u 117 pacientov (77,0 %) s lokalizovanou OMG neliečených imunoterapiou (tab. 3). Hlavný rozdiel vedúci k dosiahnutiu lepších výsledkov v našom súbore vidíme v stratifikácii pacientov s oMG podľa stupňa rizika generalizácie a/ alebo nepriaznivého priebehu. Počas celého priebehu MG sme indikovali niektorú z foriem dlhodobej imunoterapie (kortikoidy, imunosupresíva) u 83,9 % pacientov. Naproti tomu Suzuki et al [12] indikovali imunoterapiu len u 65,0 % pacientov a Ariatti et al u 62,6 % pacientov [34].
Pri hodnotení prognostických faktorov OMG Suzuki et al nezistili žiadne signifikantné rozdiely medzi skupinami OMG s priaznivým a nepriaznivým výsledkom liečby [12]. Podľa iných literárnych zdrojov je s nepriaznivým priebehom oMG asociovaná AChR séronegatívna oMG [35], vek pri vzniku oMG nad 50 rokov [29,35], dlhší interval medzi vznikom oMG a začiatkom liečby [35].
Na rozdiel od Suzukiho [12] sme v našom súbore identifikovali niekoľko prediktívnych faktorov nepriaznivého priebehu oMG: ženské pohlavie, AChR – séronegatívna oMG, vek pri vzniku oMG pod 50 rokov (tab. 5). V našom súbore sme zaznamenali priaznivejší priebeh u pacientov so séropozitívnou oMG v porovnaní so séronegatívnou oMG. V literatúre sa naopak uvádza lepšia prognóza u dvojito séronegatívnej MG [36]. Príčinou tohto javu v našom súbore môže byť oneskorená diagnostika a liečba séronegatívnej oMG v minulosti pri chýbaní pozitivity titra protilátok AchR, čo viedlo k nedostatočnej reakcii na liečbu. Časť pacientov v minulosti mohla mať nediagnostikovanú anti-MuSK séropozitívnu oMG, ktorá je asociovaná s horšou prognózou. Bever et al [28] a Wang et al [35] udávajú lepšiu prognózu u pacientov so vznikom oMG pred 50. rokom. V našom súbore naopak u väčšiny pacientov s late-onset oMG dochádza k rýchlej a dobrej terapeutickej odpovedi a dlhodobej kontrole príznakov (tab. 5). Len u malej časti starších pacientov sa stretávame s nepriaznivejším priebehom, hlavne pri polymorbidite a polypragmázii, s častejším rozvojom závažných nežiaducich účinkov liečby a liekových interakcií. U pacientov s early-onset oMG existuje výrazne väčšia skupina pacientov, ktorí nedostatočne reagujú na všetky typy terapie oMG (tab. 5).
Záver
Z prognostického hľadiska je u oMG najväčším problémom sekundárna generalizácia oMG a pretrvávanie takej okulárnej symptomatiky, ktorá výrazne vplýva na kvalitu života pacienta. Preto je nutné identifikovať pacientov s vyšším rizikom generalizácie a/ alebo nepriaznivého priebehu oMG a včas indikovať adekvátnu liečbu v správnej dávke.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ivan Martinka
Centrum pre neuromuskulárne ochorenia
Neurologická klinika
SZU a UN Bratislava
Ružinovská 6
826 06 Bratislava
e-mail: ivan.martinka@gmail.com
Prijato k recenzii: 4. 10. 2016
Prijato do tlače: 23. 12. 2016
Sources
1. Špalek P, Cibulčík F. Okulárna myasténia gravis – diagnostika, liečba, prognóza. [assessed 2009]. Dostupné z URL: http:/ / www.myastheniagravis.cz/ images/ spalek09.pdf.
2. Kerty E, Elsais A, Argov Z, et al. EFNS/ ENS Guidelines for the treatment of ocular myasthenia. Eur J Neurol 2014;21(5):687– 93. doi: 10.1111/ ene.12359.
3. Grob D, Arsura EL, Brunner NG, et al. The course of myasthenia gravis and therapies affecting outcome. Ann NY Acad Sci 1987;505:472– 99.
4. Grob D, Brunner N, Namba T, et al. Lifetime course of myasthenia gravis. Muscle Nerve 2008;37(2):141– 9.
5. Kupersmith MJ, Latkany R, Homel P. Development of generalized disease at 2 years in patients with ocular myasthenia gravis. Arch Neurol 2003;60(2):243– 8.
6. Luchanok V, Kaminski HJ. Natural history of myasthenia gravis. In: Engel AG, ed. Myasthenia gravis and myasthenic disorders. 2nd ed. Oxford University Press, New York 2012:93– 4.
7. Wong SH, Huda S, Vincent A, et al. Ocular myasthenia gravis: controversies and updates. Curr Neurol Neurosci Rep 2014;14(1):421. doi: 10.1007/ s11910-013-0421-9.
8. Kupersmith MJ. Ocular myasthenia gravis: treatment successes and failures in patients with long-term follow-up. J Neurol 2009;256(8):1314– 20. doi: 10.1007/ s00415-009-5120-8.
9. Pitz S, Jordan B, Zierz S. Okuläre myasthenie. Ophthalmologe 2013;110(12):1202.
10. Nair AG, Patil-Chhablani AG, Venkatramani DV, et al. Ocular myasthenia gravis: a review. Indian J Ophthalmol 2014;62(10):985– 91. doi: 10.4103/ 0301-4738.145987.
11. Jaretzki A, Barohn RJ, Ernstoff RM. Myasthenia gravis: recommendations for clinical research standards. Task force of the medical scientific advisory board of the Myasthenia gravis foundation of America. Neurology 2000;55(1):327– 34.
12. Suzuki S, Murai H, Imai T, et al. Quality of life in purely ocular myasthenia in Japan. BMC Neurol 2014;14:142. doi: 10.1186/ 1471-2377-14-142.
13. Roh HS, Lee SY, Yoon JS. Comparison of clinical manifestations between patients with ocular myasthenia gravis and generalized myasthenia gravis. Korean J Ophtalmol 2011;25(1):1– 7. doi: 10.3341/ kjo.2011.25.1.1.
14. Hong YH, Kwon SB, Kim BJ, et al. Prognosis of ocular myasthenia in Korea: a retrospective multicenter analysis of 202 patients. J Neurol Sci 2008;273(1– 2):10– 4. doi: 10.1016/ j.jns.2008.05.023.
15. Kamada M, Matsui N, Sakai W, et al. Ocular myasthenia gravis with anti-muscle-specific tyrosine kinase antibodies: two new cases and systematic literature review. Clin Experiment Neurol. In Press 2016. doi: 10.1111/ cen3.12296.
16. Lee JJ, Koh KM, Kim US. The anti-acetylcholine receptor antibody test in suspected ocular myasthenia gravis. J Ophtalmol 2014;2014:68979. doi: 10.1155/ 2014/ 689792.
17. Peeler CE, De Lott LB, Nagia L, et al. Clinical utility of acetylcholine receptor antibody testing in ocular myasthenia gravis. JAMA Neurol 2015;72(10):1170– 4. doi: 10.1001/ jamaneurol.2015.1444.
18. MacLennan C, Beeson D, Buijs AM, et al. Acetylcholine receptor expression in human extraocular muscles and their susceptibility to myasthenia gravis. Ann Neurol 1997;41(4):423– 31.
19. Evoli A, Batocchi AP, Minisci C, et al. Therapeutic options in ocular myasthenia gravis. Neuromuscul Disord 2001;11(2):208– 16.
20. Gilbert ME, De Sousa EA, Savino PJ. Ocular myasthenia gravis treatment: the case against prednisone therapy and thymectomy. Arch Neurol 2007;64(12):1790– 2.
21. Kaminski HJ, Daroff RB. Treatment of ocular myasthenia: steroids only when compelled. Arch Neurol 2000;57(5):752– 3.
22. Roach ES. Treating ocular Myasthenia Gravis with inadequate evidence. Arch Neurol 2007;64(12):1794– 5.
23. Benatar M, McDermott MP, Sanders DB, et al. Efficacy of prednisone for the treatment of ocular myasthenia (EPITOME): a randomized, controlled trial. Muscle Nerve 2016;53(3):363– 9. doi: 10.1002/ mus.24769.
24. Mee J, Paine M, Byrne E, et al. Immunotherapy of ocular myasthenia gravis reduces conversion to generalized myasthenia gravis. J Neuroophthalmol 2003;23(4):251– 5.
25. Monsul NT, Patwa HS, Knorr AM, et al. The effect of prednisone on the progression from ocular to generalized myasthenia gravis. J Neurol Sci 2004;217(2):131– 3.
26. Lanska DJ. Indications for thymectomy in myasthenia gravis. Neurology 1990;40(12):1828– 9.
27. Liu Z, Feng H, Yeung SJ, et al. Extended transsternal thymectomy for the treatment of ocular myasthenia gravis. Ann Thorac Surg 2011;92(6):1993– 9. doi: 10.1016/ j.athoracsur.2011.08.001.
28. Bever CT, Aquino AV, Penn AS, et al. Prognosis of ocular myasthenia. Ann Neurol 1983;14(5):516– 9.
29. Allen JA, Scala S, Jones HR. Ocular myasthenia gravis in a senior population, diagnosis, therapy and prognosis. Muscle Nerve 2010;41(3):379– 84. doi: 10.1002/ mus.21555.
30. Guan YZ, Cui LY, Liu MS, et al. Progression from ocular to generalized myasthenia gravis in adults. Chin J Neurol 2012;45(12):866– 8.
31. Nagia L, Lemos J, Abusamra K. Prognosis of ocular myasthenia gravis. Retrospective multicenter analysis. Ophthalmology 2015;122(7):1517– 21. doi: 10.1016/ j.ophtha.2015.03.010.
32. Wong SH, Petrie A, Plant GT. Ocular Myasthenia gravis: toward a risk of generalization score and sample size calculation for a randomized controlled trial of disease modification. J Neuroophthalmol 2016;36(3):252– 8. doi: 10.1097/ WNO.0000000000000350.
33. Hong YH, Lee KW, Sung JJ, et al. Prognostic factors of secondary generalization in patients with ocular myasthenia gravis: a retrospective single hospital-based study. Neuromusc Dis 2006;16:117.
34. Ariatti A, Stefani M, Miceli P, et al. Prognostic factors and health-related quality of life in ocular myasthenia gravis (OMG). Int J Neurosc 2014;124(6):427– 35. doi: 10.3109/ 00207454.2013.853664.
35. Wang LL, Zhang Y, He ML. Clinical features and prognosis of ocular myasthenia gravis patients with different phenotypes. Chin Med J 2015;128(19):2682– 4. doi: 10.4103/ 0366-6999.166032.
36. Romi F, Gilhus NE, Aarli JA. Myasthenia gravis: disease severity and prognosis. Acta Neurol Scand 2006;113(Suppl 183):24– 5.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 2
Most read in this issue
- Loketní nerv
- Incidence cévní mozkové příhody v Evropě – systematická review
- Anti-NMDAR encefalitida v dětském věku – kazuistika
- Febrilní křeče – doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi, adaptovaný doporučený postup American Academy of Pediatrics
