-
Home page
- Journal archive
- Current issue
Roztroušená skleróza, neplodnost a její léčba
Multiple Sclerosis, Infertility and its Treatment
Multiple sclerosis is a common autoimmune disease affecting young people, with onset usually at the age of 20 – 40 years. During these decades patients are usually planning pregnancy. In patients with multiple sclerosis fertility seems to be slightly impaired. Several factors might contribute to this condition. It is mainly sexual dysfunctions, which belong to comparatively common symptoms of the disease, hormonal alteration, concomitant (autoimmune) disease and specific therapy of multiple sclerosis. Psychosocial factors have an influence on fertility and its therapy. The aim of this review is description of factors potentially interfering with fertility in multiple, the current applications of assisted reproductive techniques and its influence on course of multiple sclerosis.
Key words:
multiple sclerosis – infertility – in vitro fertilisation – endometriosis – sexual dysfunctions – sexual hormons
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors: I. Šrotová 1,2; I. Crha 3
; E. Vlčková 1,2; M. Svobodová 1,2; E. Nekvapilová 2; P. Štourač 1,2; J. Bednařík 1,2
Authors‘ workplace: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, MU, Brno 2; Gynekologicko-porodnická klinika LF MU a FN Brno 3
Published in: Cesk Slov Neurol N 2015; 78/111(6): 655-660
Category: Review Article
Overview
Roztroušená skleróza je časté neurologické autoimunitní onemocnění, které postihuje nejvíce pacienty ve věku od 20 do 40 let. V tomto období se dostává do popředí otázka plánování těhotenství. U pacientů s roztroušenou sklerózou je popisován určitý trend ke snížené plodnosti. Její příčinou jsou jednak sexuální dysfunkce, které patří mezi relativně časté symptomy tohoto onemocnění, jednak předpokládaný vliv dalších faktorů, např. hormonální dysbalance, přidružených onemocnění a specifické terapie roztroušené sklerózy. Důležitou roli hrají také psychosociální vlivy ovlivňující plodnost i následnou terapii. Cílem tohoto sdělení je popis faktorů, které se mohou podílet na ovlivnění ženské i mužské plodnosti u pacientů s roztroušenou sklerózou, a možnosti terapie neplodnosti metodami asistované reprodukce a jejich vliv na následný průběh roztroušené sklerózy.
Klíčová slova:
roztroušená skleróza – neplodnost – fertilizace in vitro – endometrióza – sexuální dysfunkce – pohlavní hormonyÚvod
Roztroušená skleróza (RS) je časté neurologické autoimunitní onemocnění (prevalence kolísá mezi 50 – 150/ 100 000) [1], které postihuje nejčastěji pacienty ve věku od 20 do 40 let a má zřetelně vyšší výskyt u žen (poměr zastoupení obou pohlaví je 3 : 1) [2]. Podíl postižení žen navíc narůstá (2,3 – 3,5 : 1), což ukazuje skutečný nárůst prevalence mezi ženami, ale ne mezi muži [3].
Revidovaná diagnostická kritéria RS [4] v současnosti umožňují stanovení diagnózy tohoto onemocnění ihned při rozvoji prvních klinických obtíží. Tato skutečnost je podkladem změny spektra recentně diagnostikovaných pacientů s RS – obecně se dá říci, že pacienti jsou nyní v době stanovení diagnózy mladší a mají nižší stupeň disability ve srovnání s obdobím, kdy byla diagnostika založena až na recidivujícím výskytu klinických neurologických obtíží. S časnou diagnostikou souvisí také včasné zahájení efektivní imunomodulační terapie, v rámci kterého je díky moderním a stále se rozvíjejícím terapeutickým přístupům možné ve většině případů chorobu dlouhodobě stabilizovat a zabránit či alespoň zmírnit její progresi [5]. V souvislosti s časnější diagnostikou a efektivnější terapií se tak otázka reprodukce u pacientů s RS stává vysoce aktuální.
Ještě ve druhé polovině 20. století bylo ženám s RS těhotenství zakazováno z důvodu častých atak po porodu a obav z následné invalidizace matky. Díky současným terapeutickým možnostem je ale možné chorobu stabilizovat i v období většího rizika relapsu onemocnění, tj. bezprostředně po porodu a během následujících šesti měsíců [6]. Recentní studie dokonce prokazují, že v případě relabující remitující RS může mít gravidita na celkový dlouhodobý průběh RS pozitivní vliv, který se projeví především oddálením přechodu z relaps remitující fáze do fáze sekundárně progresivní [7,8]. V současnosti tak z neurologického hlediska není u většiny pacientek s RS postoj k případné graviditě negativní, a to zejména v období stabilizace onemocnění [6]. Tato skutečnost opět podporuje aktuálnost otázky poruch reprodukce u pacientů s RS.
Poruchy plodnosti jsou v obecné populaci celosvětově stále četnější a aktuálnější problém. V současné době se vyskytují u 15 – 20 % párů snažících se o těhotenství [9,10]. Stanovení hranice mezi fyziologickou plodností a její poruchou není vždy jednoznačné. Za optimálních podmínek by měla žena otěhotnět za 6 – 9 měsíců nechráněných pohlavních styků. K nejčastějším příčinám snížené plodnosti patří poruchy ovulace a genetické výbavy oocytů (věkový faktor, snížená ovariální rezerva, syndrom polycystických ovarií, dysgeneze oocytů), andrologický faktor (nízké hodnoty spermiogramu, erektilní dysfunkce), poškození vejcovodu a endometrióza. Méně často jsou diagnostikovány genetické příčiny, vrozené vady, endokrinní poruchy, trombofilní stavy a poruchy imunity. U většiny párů s reprodukčními potížemi se uplatňuje současně několik různých faktorů [10,11].
V současné době jsou nejúčinnější léčbou poruch plodnosti metody asistované reprodukce (Assisted Reproduction Techniques; ART). V České republice se v současnosti po ART rodí přibližně 3 % dětí [9,10].
Ačkoliv dosud neproběhla žádná systematická studie, která by cíleně mapovala výskyt poruch plodnosti u pacientů s RS, z dosavadních údajů vyplývá, že existuje trend ke snížené plodnosti u pacientů s RS, i když se většinou nejedná o významné narušení reprodukčních schopností [12]. Dle recentních demografických studií jsou pacienti s RS častěji bezdětní a častěji podstupují metody ART [13]. Tato skutečnost je však pouze zčásti přímým důsledkem onemocnění RS a na jejím rozvoji se může podílet také vliv dalších faktorů, jako hormonální dysbalance (např. zvýšená hladina prolaktinu, luteinizačního hormonu; LH; folikuly stimulačního hormonu; FSH; v kombinaci se sníženou hladinou estrogenů u pacientek s RS) [14,15]. Pacienti s RS mají často přidružené autoimunitní onemocnění, které se může podílet na snížené plodnosti, např. autoimunitní tyreoiditidu [16]. Nejčastější přímý důsledek onemocnění RS ovlivňující plodnost je výskyt sexuální dysfunkce (např. snížení libida a genitální porucha citlivosti) [17]. K narušení reprodukčních schopností může přispívat i specifická terapie využívaná k léčbě RS. Důležitou roli hrají i psychosociální faktory, které se mohou podílet na rozvoji poruch plodnosti [18].
Cílem tohoto sdělení je popsat nejčastější faktory, které se mohou podílet na ovlivnění ženské i mužské plodnosti u pacientů s RS, a nastínit možnosti terapie neplodnosti metodami ART a jejich vliv na následný průběh RS.
Faktory ovlivňují plodnost u pacientů a pacientek s RS
Sexuální dysfunkce a RS
Sexuální dysfunkce (SD) jsou u pacientů s RS poměrně časté a negativně ovlivňují kvalitu jejich života. Patří však mezi relativně poddiagnostikové symptomy RS. SD v důsledku RS jsou častější u mužů, jejich incidence je dle recentních studií variabilní a pohybuje se v rozmezí od 30 do 70 %, v závislosti na klinické charakteristice vyšetřované skupiny [19].
Na rozvoji SD se kromě základního postižení centrálního nervového systému podílí i další organické syndromy. Proto lze SD u pacientů s RS rozdělit na primární, sekundární a terciární. Primární SD je důsledkem přímého postižení centrálního nervového systému. Dle recentních studií zaměřených na korelaci SD s nálezy na magnetické rezonanci mozku a míchy SD úzce souvisí především s přítomností demyelinizačních lézí v mozkovém kmeni, dominantně v pontu, a s pontinní atrofií. Dále je popisována korelace s postižením pyramidových drah, celkovým objemem lézí a s přítomností demyelinizačních lézí v míše [20]. Klinicky se primární SD projevuje nejčastěji snížením až absencí libida, genitální hypestezií nebo allodynií. Mezi další primární SD patří potíže charakteru snížené vaginální lubrikace u žen a poruchy erekce a ejakulace u mužů s RS. Podkladem sekundárních sexuálních dysfunkcí jsou sfinkterové potíže a další organické symptomy doprovázející RS, jako jsou únava, spasticita, svalová slabost a neuropatická bolest. Současně jsou mezi sekundární příčiny SD zahrnuty i nežádoucí účinky terapie užívané při léčbě RS. Mezi terciární obtíže patří psychosociální problémy, které jsou důsledkem základního onemocnění [20].
Nejčastější SD, jež je popisována u pacientek s RS, je snížení libida (36 – 86 %), dále potíže při dosažení orgazmu (28 – 58 %), poruchy genitální citlivosti (43 – 62 %) a dyspareunie, tedy nepříjemné až bolestivé pocity ženy během soulože (8 – 40 %) [19,21].
Pokles libida patří mezi nejčastější SD také u mužů s RS (37 – 86 %), u kterých se často vyskytuje také erektilní dysfunkce (34 – 80 %), genitální hypestezie (21 – 72 %) a problémy s ejakulací (34 – 61 %). Předpokládá se, že erektilní dysfunkce a problémy s ejakulací souvisí mj. se sníženou hladinou testosteronu, která byla u pacientů s RS prokázána (viz níže) [19].
Dle recentních studií byla popisována pozitivní korelace mezi SD a celkovým skóre disability (EDSs) [12]. Signifikantními prediktory SD jsou také únava, poruchy paměti a koncentrace a sfinkterové obtíže [12].
Vliv RS na endokrinní systém
Hormonální dysbalance patří mezi základní příčiny neplodnosti i v obecné populaci. U demyelinizačních onemocnění charakteru RS je popisováno centrální ovlivnění funkce hypothalamo ‑ hypofyzární osy, které se může u žen klinicky projevit poruchou menstruačního cyklu a následnou neplodností. Pacientky s RS vykazují signifikantně zvýšenou hladinu folikuly stimulačního hormonu (FSH) a luteinizačního hormonu (LH) a významně sníženou hladinu estrogenů v první fázi menstruačního cyklu [12].
Předpokládá se, že zvýšená hladina FSH v první fázi menstruačního cyklu také úzce souvisí se sníženou ovariální rezervou [22]. Termín ovariální rezerva charakterizuje počet a kvalitu ovariálních folikulů v předem determinovaném chronologickém věku ženy. Velikost ovariální rezervy je nepřímým ukazatelem jejího reprodukčního věku a určuje její šance na spontánní či asistovanou koncepci bez nutnosti využití darovaných oocytů [23]. Cil et al popsali u pacientek s RS sníženou ovariální rezervu v porovnání se zdravou populací při diagnostice prostřednictvím transvaginálního ultrazvuku [24]. Výsledky předchozí studie podporují i Thöne et al, kteří prokázali sníženou ovariální rezervu u pacientek s RS oproti zdravým kontrolám pomocí biochemického vyšetření tzv. antimülleriánského hormonu (AMH) v séru [25]. AMH je glykoprotein patřící do skupiny růstových faktorů TGF‑β, který je produkován granulózovými buňkami vaječníků, a jeho sérové hladiny odrážejí ovariální rezervu [26].
Hladina estrogenu je u pacientek s RS nižší ve srovnání se zdravou populací, a to v celém průběhu menstruačního cyklu [14]. Příčina snížené hladiny estrogenů dosud není jednoznačně objasněna. Předpokládá se vliv periferní rezistence na gonadotropiny v kombinaci s abnormální centrální regulací produkce gonadotropních hormonů. Důsledkem těchto změn je snížení sekrece estrogenů u pacientek s RS [14]. Tato okolnost má současně význam v patogenezi základního onemocnění, protože estrogeny mají imunomodulační vliv vedoucí k posunu v subpopulacích lymfocytů. Jejich působením klesá počet prozánětlivě působících Th1 lymfocytů a zároveň stoupá počet protizánětlivě působících Th2 lymfocytů. Tím nastává i útlum produkce proinflamatorních cytokinů (IFN ‑ γ, IL‑2, IL‑12, TNF‑α) a naopak dochází k vzestupu hladin cytokinů s protizánětlivým působením (IL‑4, IL‑10, IL‑13, TGF‑β) [27,28]. Důsledkem uvedených účinků estrogenních hormonů je i obecně známá skutečnost, že v průběhu gravidity se stoupající hladinou estrogenů (estron, 17-β ‑ estradiol, estriol) klesá aktivita onemocnění. Příznivý vliv estrogenů prokázala i studie, ve které se nemocným ženám s relaps remitující RS podával po dobu šesti měsíců estriol v dávkách, jež odpovídaly hladině hormonů v graviditě. V tomto období byla prokázána až 80% redukce radiologické aktivity onemocnění dle magnetické rezonance mozku oproti stavu před podáním estrogenů [6,27].
RS má vliv také na hladiny dalších hormonů, zejména prolaktinu a androgenů. U pacientek s RS se proto může vyskytnout hyperprolaktinemie či hyperandrogenizmus [22]. Všechny uvedené změny se podílejí na zvýšené incidenci oligo ‑ až amenorey u pacientek s RS ve srovnání se zdravými ženami [29].
Možnou manifestací postižení hypothalamo ‑ hypofyzární osy u mužských pacientů s RS je snížení hladiny testosteronu v séru. Snížená hladina testosteronu může negativně ovlivnit spermatogenezi. Safarinejad popsal u pacientů s RS rozdíl v hodnotách spermiogramu ve srovnání se zdravou populací [30]. U pacientů s RS je při tomto vyšetření častěji diagnostikována oligozoospermie (snížený počet spermií v ejakulátu), astenozoospermie (snížená motilita spermií) a teratozoospermie (defekty morfologie spermií). Tyto nálezy mohou přispívat ke snížené plodnosti mužů s RS [30].
Koincidence RS s onemocněními ovlivňujícími fertilitu
Nejčastějším onemocněním často se vyskytujícím v koincidenci s RS, které ovlivňuje plodnost pacientek, je endometrióza. Endometrióza je estrogen ‑ dependentní, nezánětlivé, systémové a chronické onemocnění, jehož charakteristickým znakem je přítomnost tkáně připomínající endometrium mimo dutinu děložní a jehož hlavními klinickými projevy jsou neplodnost a chronická pánevní bolest. Výskyt ektopických ložisek endometria byl v těle popsán všude kromě srdce a sleziny. Nejčastější výskyt je ale na peritoneu, adnexech a v rektovaginálním septu. Endometrióza postihuje 6 – 10 % žen v reprodukčním věku, 50 – 60 % žen s pánevní bolestí a 50 % neplodných žen [31,32].
U pacientek s pánevní endometriózou je významně častěji diagnostikována RS. Multicentrická studie [33] prokázala v Severní Americe sedmkrát vyšší prevalenci RS u pacientek s endometriózou oproti zdravé populaci.
Přesná patogeneze rozvoje endometriózy není zcela známa, s největší pravděpodobností se jedná o autoimunitní etiologii zprostředkovanou lymfocyty s autoprotilátkami [34]. Jasná příčina asociace mezi RS a endometriózou dosud není objasněna, ale jednoznačně se předpokládá společný vliv narušených imunitních mechanizmů [12].
Úzký vztah k reprodukci mají také onemocnění štítné žlázy. U žen z neplodných párů je v porovnání s fertilními ženami signifikantně vyšší výskyt autoimunitních tyreopatií (autoimunitní tyreoitidy a Gravesovy ‑ Basedovowy choroby). Autoimunitní tyreoiditida může být i bez poruchy funkce štítné žlázy asociována s neplodností, opakovaným potrácením a selháním metod ART. Především to platí pro ženy s ovariálním faktorem neplodnosti a s endometriózou. Proto je systematické vyšetřování nejen funkce štítné žlázy, ale i protilátek proti štítné žláze u neplodných žen nezbytné [35]. Předpokládá se, že autoimunitní tyreoitida, Gravesova ‑ Basedovowa choroba a RS mají společnou etiopatogenezi spočívající v poruše regulace autoimunitních mechanizmů [16]. Sloka et al prokázali signifikantní koincidenci výskytu RS a Gravesovy ‑ Basedovowy choroby a trend k vyšší asociaci RS a autoimunitní tyreoitidy [16]. Na uvedených datech se může podílet i specifická terapie RS (interferon beta, alemtuzumab), která může vést k rozvoji tyreopatií [16,36].
Předpokládá se, že by koincidence RS s dalšími onemocněními mohla vést také k narušené plodnosti u mužů. Magyari et al prokázali nižší riziko rozvoje dalšího autoimunitního onemocnění u mužských pacientů s RS ve srovnání se ženami, toto riziko je však stále signifikantně zvýšené ve srovnání se zdravou populací. U pacientů s RS je významně vyšší výskyt diabetu mellitu I. typu, Crohnovy choroby a systémového lupus erythematodes [37]. Cílená multicentrická studie však významný vliv koincidence jiných autoimunitních onemocnění na plodnost pacientů s RS neprokázala [38].
Psychosociální faktory
Žádná studie, která by se cíleně věnovala přímému vlivu psychosociálních faktorů na plodnost u pacientů a pacientek s RS, nebyla dosud publikována. Psychosociální faktory však hrají významnou roli v problematice neplodnosti i v obecné populaci a jejich podíl v patogenezi neplodnosti u pacientů s RS lze tedy předpokládat. Z dostupných studií vyplývá, že neplodnost vyvolává u párů snažících se o početí řadu negativních pocitů, které mohou následně ovlivnit jejich celkový psychický, zdravotní i sociální stav. U mnohých párů může dojít k rozvoji nebo prohloubení psychických onemocnění, především deprese a úzkosti [39]. V párech s gynekologickou příčinou sterility je statisticky významně vyšší výskyt deprese a úzkosti u žen než u mužů, v párech s andrologickou příčinou sterility nejsou mezi muži a ženami statisticky významné rozdíly. Ženy jsou tedy zřejmě silněji poznamenány pocitem odpovědnosti za příčinu sterility než jejich partneři [40].
Deprese a úzkost patří současně mezi nejčastější psychiatrické symptomy u pacientů s RS. Celoživotní prevalence deprese je u nich více než 50 %, což je podle provedených metaanalýz více než u ostatních neurologických onemocnění a 3 – 10krát více než u zdravých lidí [41].
Na rozvoji deprese u pacientů s RS se může spolupodílet i medikace, především se jedná o interferony a kortikosteroidy, které mohou deprese prohlubovat [42,43].
Ačkoliv úzkost velmi negativně ovlivňuje kvalitu života u nemocných s RS, jejímu výzkumu se dosud věnuje relativně malá pozornost. Janssens et al prokázali vyšší míru úzkosti u 34 % pacientů s nově diagnostikovanou RS. Je zajímavé, že v této studii byla úzkost vyšetřována i u partnerů těchto pacientů a zde se vyskytovala dokonce ve 40 %, což může představovat další z psychosociálních faktorů s potenciálním vlivem na plodnost daného páru [44].
Pro páry snažící se o početí je stresující také terapie neplodnosti. Přitom již bylo opakovaně prokázáno, že stres a deprese snižují úspěšnost této terapie [45,46].
Terapie RS a její vliv na plodnost
V České republice je aktuálně registrováno devět preparátů určených ke specifické terapii RS.
Vliv preparátů na fertilitu pacientů s RS reflektuje dosud jediná multicentrická studie, jejíž výsledky jsou uvedeny v tab. 1 [47].
Table 1. Vliv specifické terapie RS na neplodnost. 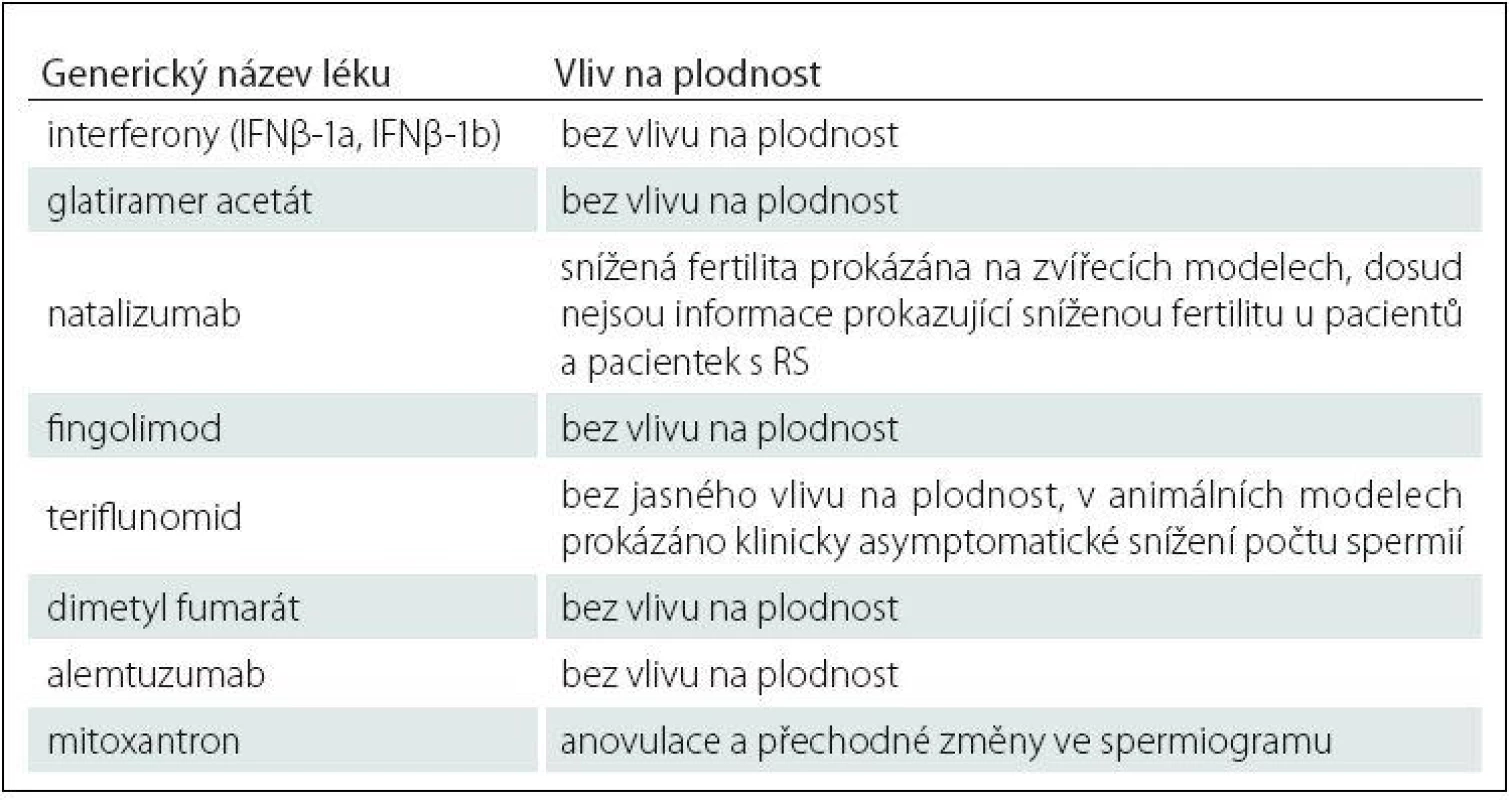
Z vyjmenovaných preparátů má největší vliv na fertilitu mitoxantron: u žen se jedná o chemoterapií indukovanou amenoreu a u mužů se jedná o přechodný negativní vliv na spermatogenezi [48 – 50].
RS a metody ART
Významným milníkem ART bylo narození prvního dítěte po in vitro fertilizaci (IVF) v roce 1978, které vedlo k jejich rychlému rozvoji a vzniku reprodukční medicíny. Nejúčinnější léčbou poruch plodnosti ženy i muže jsou v současné době metody ART.
Důležitým postupem pro získání oocytů je stimulace vaječníků. Existuje řada různých protokolů, základem je aplikace folikulostimulačního hormonu (FSH) v kombinaci s analogy (agonisté nebo antagonisté) gonadotropin releasing hormonu (GnRH), jejichž cílem je minimalizovat riziko předčasného dozrání a uvolnění vajíček. V průběhu ovariální stimulace je důležité monitorovat reakci vaječníku a předcházet vzniku možné závažné komplikace – ovariálního hyperstimulačního syndromu. Maturace oocytů – obnovení jeho meiotického dělení – je navozena aplikací lidského choriového gonadotropinu (hCG) přibližně 36 hod před plánovaným odběrem vajíček. Odběr vajíček probíhá nejčastěji v krátké celkové anestezii. Odebraná vajíčka se oplozují v embryologické laboratoři upravenými spermiemi – klasická IVF nebo přímým zavedením spermie do cytoplazmy oocytu – intracytoplazmatická injekce spermie (ICSI). Embrya se přenášejí do dutiny děložní nejčastěji za 2 – 5 dnů po odběru vajíček, jako prevence vícečetného těhotenství je preferován transfer jednoho embrya, v indikovaných případech max. dvou embryí. Sekreční transformace endometria tzv. podpora luteální fáze je zahájena před transferem embryí pomocí gestagenů – nejčastěji mikronizovaný progesteron, pokračuje dále po transferu a v počátku těhotenství (obvykle do ukončeného 1. trimestru). Těhotenství je možné prokázat vyšetřením hCG v krvi přibližně 12 dnů po transferu [9].
Mezi metody ART patří také nitroděložní inseminace – předpokladem jsou průchodné vejcovody, ovulace a adekvátní hodnoty spermiogramu.
Dosud bylo publikováno pět studií, které se zabývaly vlivem ART u pacientek s RS. Jejich výsledky jsou přehledně shrnuty v tab. 2.
Table 2. Vliv ART na průběh RS. 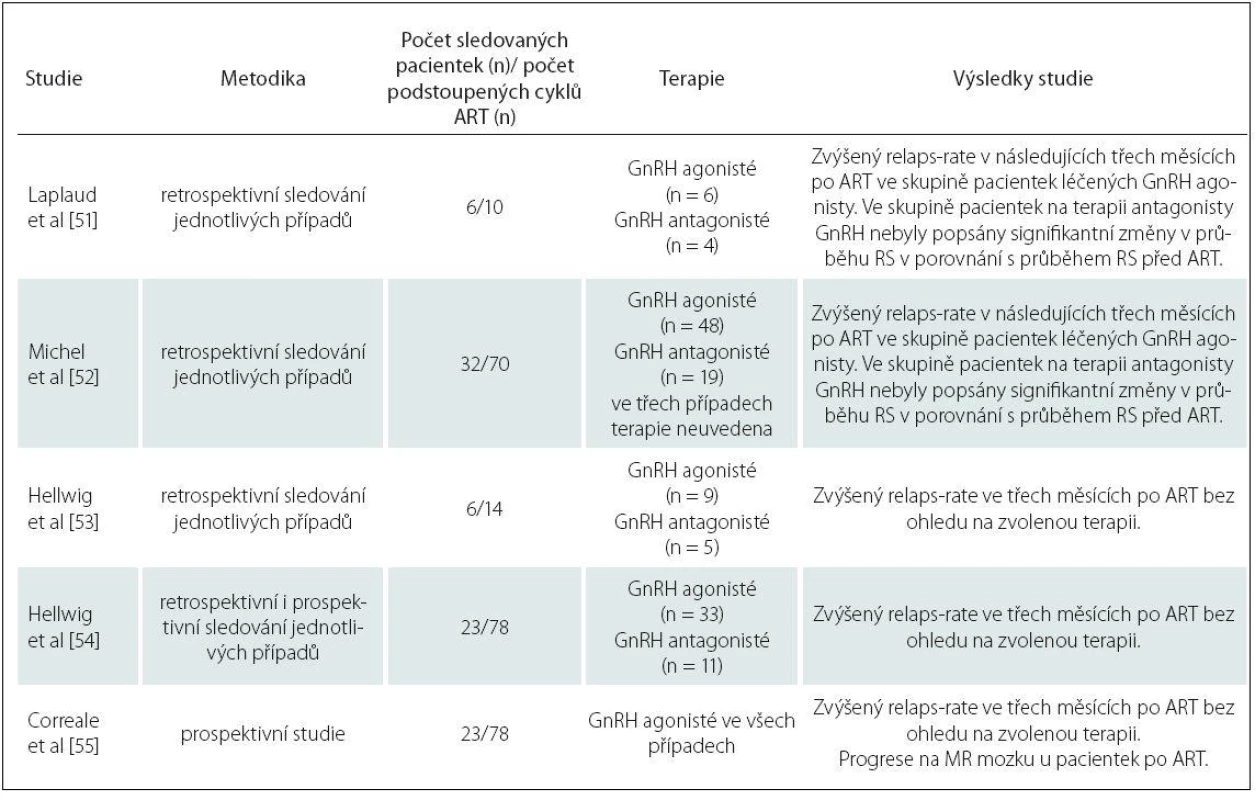
Z uvedených dat vyplývá, že hormonální stimulace během ART zvyšuje riziko relaps rate (počet relapsů za rok), a to především v prvních třech měsících po ART. Riziko je zvýšeno zejména u pacientek, které podstoupily ART a neotěhotněly [51], a také v případě ovariální stimulace pomocí GnRH agonistů ve srovnání s použitím GnRH antagonistů [52].
K ovariální stimulaci pacientek s RS je tedy vhodnější podání GnRH antagonistů [52]. Na zvýšeném relaps ratu se pravděpodobně podílí i vysazení specifické terapie RS před zahájením ART. Celková doba ART se pohybuje v rozmezí 4 – 6 týdnů, během kterých jsou tedy pacientky bez terapie RS [53]. Jak již bylo uvedeno, neplodnost a její terapie jsou spojeny se zvýšeným stresem, který se při neúspěšných ART dále zvyšuje a může se spolupodílet na progresi RS [56].
Další možnou komplikací ART u pacientek s RS je rozvoj tumoriformní varianty tohoto onemocnění po asistované reprodukci. Dosud byly publikovány dvě takové kazuistiky [57,58]. V obou případech se jednalo o ženy bez potíží charakteru RS v minulosti. Pacientky podstoupily ART opakovaně (pětkrát a sedmkrát v průběhu 2 let), ke stimulaci ovulace byly u obou využity agonisté GnRH. U obou pacientek se po posledním neúspěšném ART rozvinuly neurologické symptomy a dle radiologického a likvorologického vyšetření byla stanovena diagnóza RS. Vzhledem k rozsahu plak a velikosti edému se v obou případech jednalo o tumoriformní variantu RS [57,58].
Metody ART významně zvyšují možnost mít děti také pro muže s poruchou plodnosti. Pokud mají pacienti s RS problémy s ejakulací, je možné sperma získat pomocí mikrochirurgického zákroku přímo z varlat nebo nadvarlat. Při nízkém počtu a pohybu spermií je nejúčinnějším způsobem oplození zavedení spermie do nitra vajíčka – tzv. intracytoplazmatická injekce spermie [59].
Mezi další možnosti, které ART přináší, patří kryokonzervace embryí nebo spermatu. Tyto metody jsou využívány především u pacientů a pacientek s RS, kteří podstupují cytostatickou terapii se závažným vlivem na zárodečné buňky (např. mitoxantronem) a po ukončení terapie plánují graviditu nebo chtějí uchovat tuto možnost do budoucna [60].
Závěr
RS negativně ovlivňuje fertilitu u pacientů i pacientek, a to jednak v důsledku přímého vlivu základního onemocnění na sexuální funkce a hormonální systém, jednak také v souvislosti s psychosociálními faktory a dalšími onemocněními asociovanými s RS. Významný vliv na reprodukční funkce má také řada preparátů využívaných v terapii RS. Terapie neplodnosti vyžaduje multidisciplinární přístup. Pro lékaře RS center je důležitá informace, že ačkoliv ART přináší párům s poruchou plodnosti výraznou naději na otěhotnění, znamená současně i riziko zhoršení průběhu RS. Je tedy potřeba, aby lékaři RS center a IVF center spolupracovali a pacientky podstupující ART byly před terapií a po terapii neplodnosti zvýšeně sledovány a podstoupily ART v době klinické i radiologické stabilizace RS. Vzhledem k tomu, že GnRH agonisté vedou ke stimulaci imunitního systému a možnému vzplanutí onemocnění, je vhodné u pacientek s RS preferovat podání GnRH antagonistů.
Seznam použitých zkratek
AMH – antimülleriánský hormon
ART – asistovaná reprodukce (Assisted Reproduction Techniques)
AT – autoimunitní tyreoiditida
FSH – folikuly stimulační hormon
GnRH agonisté – agonisté gonadotropních hormonů
GnRH antagonisté – antagonisté gonadotropních hormonů
hCG – lidský choriový gonadotropin
IVF – in vitro fertilizace
LH – luteinizační hormon
RS – roztroušená skleróza
SD – sexuální dysfunkce
Práce byla podpořena interními zdroji CEITEC MUNI a projektem specifického výzkumu č. MUNI/ A/ 0935/ 2013 z programu podpory studentských projektů na Masarykově univerzitě.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 28. 8. 2015
Přijato do tisku: 9. 11. 2015
MUDr. Iva Šrotová
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: iva.srotova@seznam.cz
Sources
1. Vachová M. Epidemie roztroušené sklerózy ve světě? Cesk Slov Neurol N 2012; 75/ 108(6): 701 – 706.
2. Duquette P, Pleines J, Girard M, Charest L, Senecal ‑ Quevillon M, Masse C. The increased susceptibility of women to multiple sclerosis. Can J Neurol Sci 1992; 19(4): 466 – 471.
3. Compston A, Coles A. Multiple sclerosis. Lancet 2002; 359(9313): 1221 – 1231.
4. Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011; 69(2): 292 – 302. doi: 10.1002/ ana.22366.
5. Alwan S, Chambers CD, Armenti VT, Sadovnick AD. The need for a disease ‑ specific prospective pregnancy registry for multiple sclerosis (MS). Mult Scler Relat Disord 2015; 4(1): 6 – 17. doi: 10.1016/ j.msard.2014.10.001.
6. Meluzínová E. Těhotenství a roztroušená skleróza. Neurol Prax 2010; 11(5): 293 – 295.
7. Confavreux C, Hutchinson M, Hours M, Cortinovis ‑ Tourniaire P, Moreau T. Rate of pregnancy‑related relapse in multiple sclerosis. Pregnancy in Multiple Sclerosis Group. N Engl J Med 1998; 339(5): 285 – 291.
8. Runmarker B, Andersen O. Pregnancy is associated with a lower risk of onset and a better prognosis in multiple sclerosis. Brain 1995; 118(1): 253 – 261.
9. Crha I. Farmakoterapie v reprodukční medicíně. Prakt Lekaren 2010; 6(4): 173 – 176.
10. Řežábek K. Asistovaná reprodukce. Praha: Maxdorf 2008.
11. Mosher WD, Pratt WF. Fecundity and infertility in the United States: incidence and trends. Fertil Steril 1991; 56(2): 192 – 193.
12. Cavalla P, Rovei V, Masera S, Vercellino M, Massobrio M, Mutani R et al. Fertility in patients with multiple sclerosis: current knowledge and future perspectives. Neurol Sci 2006; 27(4): 231 – 239.
13. Jalkanen A, Alanen A, Airas L. Pregnancy outcome in women with multiple sclerosis: results from a prospective nationwide study in Finland. Mult Scler 2010; 16(8): 950 – 955. doi: 10.1177/ 1352458510372629.
14. Grinsted L, Heltberg A, Hagen C, Djursing H. Serum sex hormone and gonadotropin concentrations in premenopausal women with multiple sclerosis. J Intern Med 1989; 226(4): 241 – 244.
15. Lombardi G, Celso M, Bartelli M, Cilotti A, Del Popolo G. Female sexual dysfunction and hormonal status in multiple sclerosis patients. J Sex Med 2011; 8(4): 1138 – 1146. doi: 10.1111/ j.1743 ‑ 6109.2010.02161.x.
16. Sloka JS, Phillips PW, Stefanelli M, Joyce C. Co ‑ occurrence of autoimmune thyroid disease in a multiple sclerosis cohort. J Autoimmune Dis 2005; 2 : 9.
17. Demirkiran M, Sarica Y, Uguz S, Yerdelen D, Aslan K. Multiple sclerosis patients with and without sexual dysfunction: are there any differences? Mult Scler 2006; 12(2): 209 – 214.
18. Gnoth C, Godehardt E, Frank ‑ Herrmann P, Friol K, Tigges J, Freundl G. Definition and prevalence of subfertility and infertility. Hum Reprod 2005; 20(5): 1144 – 1147.
19. Zorzon M, Zivadinov R, Bosco A, Bragadin LM, Moretti R, Bonfigli L et al. Sexual dysfunction in multiple sclerosis: a case ‑ control study. I. Frequency and comparison of groups. Mult Scler 1999; 5(6): 418 – 427.
20. Foley FW, Zemon V, Campagnolo D, Marrie RA, Cutter G, Tyry T et al. The Multiple Sclerosis Intimacy and Sexuality Questionnaire – re‑validation and development of a 15 - item version with a large US sample. Mult Scler 2013; 19(9): 1197 – 1203. doi: 10.1177/ 1352458512471876.
21. Borello ‑ France D, Leng W, O‘Leary M, Xavier M, Erickson J, Chancellor MB et al. Bladder and sexual function among women with multiple sclerosis. Mult Scler 2004; 10(4): 455 – 461.
22. Barnhart K, Osheroff J. Follicle stimulating hormone as a predictor of fertility. Curr Opin Obstet Gynecol 1998; 10(3): 227 – 232.
23. Sills ES, Alper MM, Walsh AP. Ovarian reserve screening in infertility: practical applications and theoretical directions for research. Eur J Obstet Gynecol Reprod Biol 2009; 146(1): 30 – 36. doi: 10.1016/ j.ejogrb.2009.05.008.
24. Cil AP, Leventoğlu A, Sönmezer M, Soylukoç R, Oktay K. Assessment of ovarian reserve and Doppler characteristics in patients with multiple sclerosis using immunomodulating drugs. J Turk Ger Gynecol Assoc 2009; 10(4): 213 – 219.
25. Thöne J, Kollar S, Nousome D, Ellrichmann G, Kleiter I, Gold R et al. Serum anti‑Müllerian hormone levels in reproductive ‑ age women with relapsing ‑ remitting multiple sclerosis. Mult Scler 2015; 21(1): 41 – 47. doi: 10.1177/ 1352458514540843.
26. Kučera R, Topolčan O, Rumpíková T, Rumpík D, Dostál J. Stanovení anti‑Müllerova hormonu u žen. Čes Gynek 2013; 78(3): 282 – 288.
27. Sicotte NL, Liva SM, Klutch R, Pfeiffer P, Bouvier S, Odesa S et al. Treatment of multiple sclerosis with the pregnancy hormone estriol. Ann Neurol 2002; 52(4): 421 – 428.
28. Soldan SS, Alvarez Retuerto AI, Sicotte NL, Voskuhl RR. Immune modulation in multiple sclerosis patients treated with the pregnancy hormone estriol. J Immunol 2003; 171(11): 6267 – 6274.
29. Falaschi P, Martocchia A, Proietti A, D‘Urso R, Antonini G. High incidence of hyperandrogenism‑related clinical signs in patients with multiple sclerosis. Neuro Endocrinol Lett 2001; 22(4): 248 – 250.
30. Safarinejad MR. Evaluation of endocrine profile, hypothalamic ‑ pituitary ‑ testis axis and semen quality in multiple sclerosis. J Neuroendocrinol 2008; 20(12): 1368 – 1375.
31. Goldstein DP, deCholnoky C, Emans SJ, Leventhal JM. Laparoscopy in the diagnosis and management of pelvic pain in adolescents. J Reprod Med 1980; 24(6): 251 – 256.
32. Eskenazi B, Warner ML. Epidemiology of endometriosis. Obstet Gynecol Clin North Am 1997; 24(2): 235 – 258.
33. Sinaii N, Cleary SD, Ballweg ML, Nieman LK, Stratton P. High rates of autoimmune and endocrine disorders, fibromyalgia, chronic fatigue syndrome and atopic diseases among women with endometriosis: a survey analysis. Hum Reprod 2002; 17(10): 2715 – 2724.
34. Berkkanoglu M, Arici A. Immunology and endometriosis. Am J Reprod Immunol 2003; 50(1): 48 – 59.
35. Karásek D, Oborná I, Fryšák Z. Autoimunitní tyreoiditida a neplodnost. Interní Med 2007; 9(9): 394 – 397.
36. Havrdova E, Horakova D, Kovarova I. Alemtuzumab in the treatment of multiple sclerosis: key clinical trial results and considerations for use. Ther Adv Neurol Disord 2015; 8(1): 31 – 45.
37. Magyari M, Koch ‑ Henriksen N, Pfleger CC, Sørensen PS. Gender and autoimmune comorbidity in multiple sclerosis. Mult Scler 2014; 20(9): 1244 – 1251.
38. Lu E, Zhu F, Zhao Y, van der Kop M, Sadovnick A, Synnes A et al. Birth outcomes of pregnancies fathered by men with multiple sclerosis. Mult Scler 2014; 20(9): 1260 – 1264.
39. Khademi A, Alleyassin A, Aghhosseini M, Ramezanzadeh F, Abhari AA. Pretreatment beck depression inventory score is an important predictor for post‑treatment score in infertile patients; a before‑after study. BMC Psychiatry 2005; 5(1): 25
40. El Kissi Y, Romdhane AB, Hidar S, Bannour S, Ayoubi Idrissi K, Khairi H et al. General psychopathology, anxiety, depression and self ‑ esteem in couples undergoing infertility treatment: a comparative study between men and women. Eur J Obstet Gynecol Reprod Biol 2013; 167(2): 185 – 189. doi: 10.1016/ j.ejogrb.2012.12.014.
41. Siegert RJ, Abernethy DA. Depression in multiple sclerosis: a review. J Neurol Neurosurg Psychiatry 2005; 76(4): 469 – 475.
42. Feinstein A, O‘Connor P, Feinstein K. Multiple sclerosis, interferon beta‑1b and depression: a prospective investigation. J Neurol 2002; 249(7): 815 – 820.
43. Masopust J, Vališ M, Taláb R. Psychické příznaky roztroušené mozkomíšní sklerózy. Čes Slov Psychiat 2007; 103(1): 47 – 54.
44. Janssens AC, van Doorn PA, de Boer JB, van der Meché FG, Passchier J, Hintzen RQ. Impact of recently diagnosed multiple sclerosis on quality of life, anxiety, depression and distress of patients and partners. Acta Neurol Scand 2003; 108(6): 389 – 395.
45. Csemiczky G, Landgren BM, Collins A. The influence of stress and state anxiety on the outcome of IVF ‑ treatment: psychological and endocrinological assessment of Swedish women entering IVF ‑ treatment. Acta Obstet Gynecol Scand 2000; 79(2): 113 – 118.
46. Smeenk JM, Verhaak CM, Eugster A, van Minnen A, Zielhuis GA, Braat DD. The effect of anxiety and depression on the outcome of in vitro fertilization. Hum Reprod 2001; 16(7): 1420 – 1423.
47. Amato MP, Portaccio E. Fertility, pregnancy and childbirth in patients with multiple sclerosis: impact of disease ‑ modifying drugs. CNS Drugs 2015; 29(3): 207 – 220. doi: 10.1007/ s40263 ‑ 015 ‑ 0238 ‑ y.
48. Štourač P. Imunomodulační léčba roztroušené sklerózy mozkomíšní v klinických a zobrazovacích parametrech. Cesk Slov Neurol N 2012; 108(4): 404 – 410.
49. Meistrich ML, Wilson G, Mathur K, Fuller LM, Rodriguez MA, McLaughlin P et al. Rapid recovery of spermatogenesis after mitoxantrone, vincristine, vinblastine, and prednisone chemotherapy for Hodgkin‘s disease. J Clin Oncol 1997; 15(12): 3488 – 3495.
50. Cocco E, Sardu C, Gallo P, Capra R, Amato MP, Trojano M. Frequency and risk factors of mitoxantrone‑induced amenorrhea in multiple sclerosis: the FEMIMS study. Mult Scler 2008; 14(9): 1225 – 1233.
51. Laplaud DA, Leray E, Barriere P, Wiertlewski S,Moreau T. Increase in multiple sclerosis relapse rate following in vitro fertilization. Neurology 2006; 66(8): 1280 – 1281.
52. Michel L, Foucher Y, Vukusic S, Confavreux C, de Sèze J, Brassat D et al. Increased risk of multiple sclerosis relapse after in vitro fertilisation. J Neurol Neurosurg Psychiatry 2012; 83(8): 796 – 802.
53. Hellwig K, Beste C, Brune N, Haghikia A, Müller T, Schimrigk S et al. Increased MS relapse rate during assisted reproduction technique. J Neurol 2008; 255(4): 592 – 593. doi: 10.1007/ s00415 ‑ 008 ‑ 0607 ‑ 2.
54. Hellwig K, Schimrigk S, Beste C, Muller T, Gold R. Increase in relapse rate during assisted reproduction technique in patients with multiple sclerosis. Eur Neurol 2009; 61(2): 65 – 68. doi: 10.1159/ 000177937.
55. Correale J, Farez MF, Ysrraelit MC. Increase in multiple sclerosis activity after assisted reproduction technology. Ann Neurol 2012; 72(5): 682 – 694. doi: 10.1002/ ana.23745.
56. Heesen C, Gold SM, Huitinga I, Reul JM. Stress and hypothalamic ‑ pituitary‑adrenal axis function in experimental autoimmune encephalomyelitis and multiple sclerosis – a review. Psychoneuroendocrinology 2007; 32(6): 604 – 618.
57. Vaknin‑Dembinsky A, Bdolah Y, Karussis D, Rosenthal G, Petrou P, Fellig Y et al. Tumefactive demyelination following in vitro fertilization (IVF). J Neurol Sci 2015; 348(2): 256 – 258.
58. Okáčová I, Benešová Y, Štourač P, Pikulová H, Praksová P, Mitášová A et al. Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika. Cesk Slov Neurol N 2012; 75/ 108(5): 637 – 640.
59. Dafopoulos K, Griesinger G, Schultze ‑ Mosgau A, Orief Y, Schöpper B, Nikolettos N et al. Cumulative pregnancy rate after ICSI with cryopreserved testicular tissue in non‑obstructive azoospermia. Reprod Biomed Online 2005; 10(4): 461 – 466.
60. Huser M, Zakova J, Smardova L, Crha I, Janku P, Hudecek R et al. Combination of fertility preservation strategies in young women with recently diagnosed cancer. Eur J Gynaecol Oncol 2012; 33(1): 42 – 50.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 6-
All articles in this issue
- Nádory očnice
- Překrývání neurodegenerativních demencí
- Současný pohled na imunopatogenezi myasthenia gravis
- Roztroušená skleróza, neplodnost a její léčba
- Delirium u kriticky nemocných – prospektivní studie
- Poruchy srdečního rytmu u mladých pacientů s kryptogenní ischemickou cévní mozkovou příhodou
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Mobilita medianu před dekompresí karpálního tunelu a po ní
- Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů
- Kraniocervikální pneumatizace provázená neurologickou symptomatikou – kazuistika
- Familiární amyloidová polyneuropatie – kazuistika
- Časná rotace intratékální baklofenové pumpy – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue- Nádory očnice
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Familiární amyloidová polyneuropatie – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Journal archive
