Častý výskyt lymeské neuroboreliózy u dětí v České republice
Frequent Incidence of Lyme Neuroborreliosis in Children in the Czech Republic
Introduction:
Europe is an important endemic area for infection with the Borrelia burgdorferi sensu lato complex that includes several genospecies. Incidence and symptoms vary between areas. B. garinii has high affinity to the central nervous system and is the main genospecies in the Czech Republic. Correct diagnosis of Lyme neuroborreliosis (LNB) is crucial for its therapy. Diagnosis may be difficult and the infection may become chronic. The aim of this study was to determine the incidence of LNB and to establish clinical and laboratory findings in our pediatric patients.
Methods:
Retrospective evaluation of clinical and laboratory data obtained over a two-year period on 286 children with neurological symptoms (unconsciousness, focal deficit, headache, meningeal syndrome etc.) who underwent a lumbar puncture to exclude neuroinflammation. Antibodies against borrelia (and neurotrophic viruses) in the cerebrospinal fluid (CSF) and serum were determined. Cytological, immunological and biochemical analysis of CSF were performed as well as the PCR for the presence of borrelial DNA.
Results:
An association between neurological symptoms and borrelial infection was confirmed in 58 children (median age 7.44 years; range 0.5–17.5 years). Tick-bite was reported in 53% of children only and skin erythema in none of them. LNB was confirmed with laboratory tests in 53 children. The other 5 children had no laboratory signs of inflammation in the CNS. The main presentations of LNB were peripheral facial nerve palsy (PFNP) in 69% and meningitis in 15%. PFNP of borrelial etiology formed 53% of all PFNP in the period analyzed.
Conclusion:
LNB in children in the Czech Republic is very common. Comprehensive diagnostic approach, including lumbar puncture, is crucial. Correct therapy at the right time may prevent the chronic course of the disease.
Key words:
Borrelia burgdorferi – Lyme neuroborreliosis – peripheral facial nerve palsy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
:
Z. Libá-Vrabelová 1; J. Kayserová 2; V. Komárek 1
:
Klinika dětské neurologie
1; Ústav imunologie
2
:
Cesk Slov Neurol N 2013; 76/109(1): 63-69
:
Original Article
Úvod:
Evropa je významnou endemickou oblastí infekce komplexu Borrelia burgdorferi sensu lato, který zahrnuje několik sérotypů. Výskyt a projevy onemocnění se v jednotlivých oblastech liší. V České republice dominuje sérotyp B. garinii, který vykazuje vysokou afinitu k centrálnímu nervovému systému. Správné stanovení diagnózy lymeské neuroboreliózy (LNB) má zásadní význam pro volbu terapie. Diagnostika může být komplikovaná, onemocnění může přecházet do chronicity. Cílem práce bylo zjistit četnost výskytu LNB u našich pacientů a její klinické a laboratorní projevy.
Metodika:
Retrospektivní analýza klinických a laboratorních dat za období dvou let u 286 dětí s neurologickými potížemi (porucha vědomí, ložiskový deficit, bolest hlavy, meningeální syndrom atd.), kterým byla provedena lumbální punkce k vyloučení neuroinfekce. V mozkomíšním moku (MMM) a párovém séru byly stanoveny specifické protilátky proti boreliím (a neurotropním virům). MMM byl vyšetřován cytologicky, imunologicky, biochemicky a metodou PCR na přítomnost boreliové DNA.
Výsledky:
Souvislost neurologických potíží s boreliovou infekcí byla zjištěna u 58 dětí (medián věku 7,44 let; v rozmezí 0,5–17,5 let). Klíště v anamnéze udávalo 53 % a erytém na kůži žádné z dětí. LNB byla laboratorně prokázána u 53 dětí, ostatních pět dětí bylo bez laboratorních známek neuroinfekce. Periferní paréza lícního nervu (PPLN, 69 %) a meningitida (15 %) představovaly hlavní klinické projevy LNB. PPLN boreliové etiologie tvořila 53 % všech PPLN za sledované období.
Závěr:
U dětí v České republice je výskyt LNB častý. Komplexní diagnostický přístup a provedení lumbální punkce jsou ke stanovení diagnózy nezbytné. Včasná a správná terapie může předejít chronickému onemocnění.
Klíčová slova:
Borrelia burgdorferi – lymeská neuroborelióza – periferní paréza lícního nervu
Úvod
Lymeská borelióza
Lymeská borelióza (LB) je onemocnění způsobené bakteriálním komplexem Borrelia burgdorferi sensu lato (B. b.), který v současnosti obsahuje až 18 sérotypů [1]. Zastoupení jednotlivých sérotypů je vázáno geograficky. Evropa je významnou endemickou oblastí LB. B. b. je zde přenášena klíšťaty rodu Ixodes ricinus, jeden vektor může být nositelem více sérotypů [1–3]. Přenos B. b. na člověka pomocí jiného hematofágního hmyzu je kontroverzní [2,4]. Promořenost klíšťat boreliemi v Evropě se obecně odhaduje na 13,7 % a nejvýznamnějším sérotypem je zde B. afzelii. Nejvíce onemocnění LB bylo opakovaně hlášeno ve Slovinsku, až 200 případů/100 000 obyvatel za rok [5]. V České republice (ČR) je promořenost klíšťat boreliemi kolem 15 % (ve Středočeském a Moravskoslezském kraji až 27 %). Nejvýznamnějším sérotypem v ČR byla minulých letech B. garinii. Incidence onemocnění LB v ČR se v posledních 10 letech pohybuje průměrně kolem 35 případů/100 000 obyvatel za rok, nejvíce jsou postiženi dospělí nad 45 let a děti ve věkové skupině 5–9 let. [4].
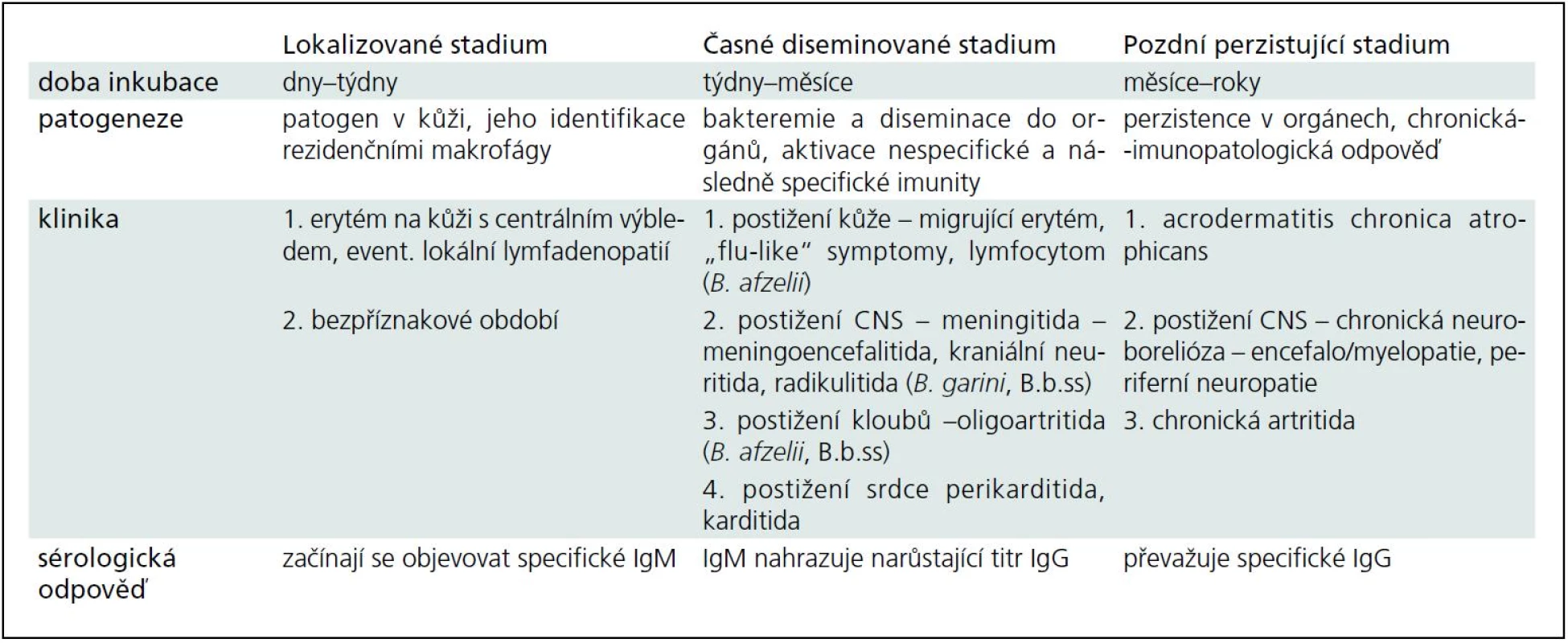
Klinické projevy a průběh boreliové infekce závisí na patogenním sérotypu a imunitní odpovědi hostitele. Teoreticky lze rozlišit tři stadia – časné lokalizované, časné diseminované a pozdní perzistující (tab. 1) [5].
Lymeská neuroborelióza a imunitní mechanizmy postižení nervového systému
Lymeská neuroborelióza (LNB) je způsobena diseminací borelií do centrálního nervového systému (CNS), kde vyvolá zánětlivou odpověď. Vysokou afinitu k CNS vykazují sérotypy B. garinii a B. b. sensu stricto [1]. Kožní nález časného lokalizovaného stadia nemusí být přítomen a neurologické příznaky mohou být prvním projevem boreliové infekce [4,7,8]. Inkubační doba se průměrně pohybuje okolo pěti týdnů od přisátí klíštěte, ale může dosahovat až několika měsíců [7]. Předpokládá se, že při hematogenním šíření B. b. prostupuje do CNS skrze cévní stěnu s využitím vazby na adhezivní molekuly endotelií a integriny [9]. Existuje také hypotéza přímého retrográdního šíření B. b. podél nervů, kterou podporuje fakt, že projevy neuritidy či radikulitidy často úzce souvisí s místem přisátí klíštěte [8–10]. Klinické potíže jsou způsobeny kombinací přímé a nepřímé cytotoxicity bakterie, která je schopna vazbou na nervové buňky vyvolat apoptózu [11]. Na přítomnost B. b. reaguje endotel, makrofágy (mikroglie) a antigen prezentující buňky (APC) produkcí chemokinů, které přivolávají imunokompetentní buňky do CNS, a produkcí cytokinů, jež dedikují zánětlivou odpověď [12–15]. Za časný marker zánětu je považován interleukin (IL)-8, který povolává neutrofily [12]. Zvýšené hladiny IL-8 a dalšího chemokinu MCP-1 („Monocyty Chemoatractant Protein“) jsou navíc spojovány s poruchou hematoencefalické bariéry (HEB) a aktivací mikroglie [16–18]. Prognosticky příznivý průběh zánětlivé reakce je spojen s krátkou intenzivní Th1 buněčnou odpovědí na počátku infekce, po které následuje přesmyk na Th2 protilátkovou odpověď [14,19]. Pokud dojde ke zpoždění přesmyku na Th2 a přetrvává Th1 cytokinové prostředí (interferon IFNγ, tumor nekrotizující faktor TNFα), zvyšuje se riziko tkáňového postižení v důsledku neurotoxického působení zánětlivých mediátorů (IL-6, kyselina chinolová, oxid dusnatý atd.) [9,18–20]. Pokud je silnější Th2 cytokinové prostředí (IL-4, IL-13), zvyšuje se riziko perzistující boreliové neuroinfekce [21,22]. Může se objevit zkřížená reaktivita mezi protilátkami proti B. b. a neurálními antigeny a může docházet k indukci vaskulitidy při ukládání imunokomplexů do cévní stěny [9,14,18,20]. Maximální zánětlivá aktivita byla prokázána v oblasti leptomening, zadních rohů míšních a nervových kořenů. Histopatologicky zde byly nalezeny převážně perivaskulární infiltráty, aktivované B a T lymfocyty, imunoglobuliny a složky komplementu. V některých případech encefalomyelitidy byla B. b. zastižena i uvnitř CNS s okolní gliózou, avšak bez výraznější imunitní reakce [18].
Klinické projevy časné-akutní LNB zahrnují meningitidu s projevy kraniální neuritidy (nejčastěji n. VII) nebo bez nich a radikuloneuritidu. Z jiných neurologických příznaků byl popsán papiloedém a zvýšený nitrolební tlak [7]. Na rozhraní akutní a chronické neuroboreliózy se vyskytují projevy encefalomyelitidy, někdy chronicky progredujícího charakteru, který může svým klinickým obrazem připomínat demyelinizační onemocnění typu roztroušené sklerózy. Klinické projevy pozdní--chronické neuroboreliózy jsou často nespecifické – únava, porucha koncentrace, porucha paměti apod. Byla také popsána periferní neuropatie, která může doprovázet chronickou akrodermatitidu [4,8,20].
V této práci jsme se zaměřili na výskyt a na klinické a laboratorní projevy LNB u našich dětských pacientů.
Soubor pacientů a metodika
Retrospektivní analýza klinických a laboratorních dat 286 dětských pacientů Dětské neurologické kliniky 2. LF UK a FN v Motole za období dvou let (09/2009–08/2011) s neurologickými potížemi, pro které byla provedena lumbální punkce k vyloučení zánětu v CNS (porucha vědomí, křeče, periferní paréza lícního nervu a jiný ložiskový neurologický deficit, bolest hlavy, meningeální syndrom atd.).
V mozkomíšním moku (MMM) a párovém séru byly stanoveny specifické protilátky proti komplexu B. b. a neurotropním virům (herpetické viry a v sezóně klíšťová meningoencefalitida) v laboratořích Ústavu lékařské mikrobiologie 2. LF UK a FN v Motole. Protilátky proti boreliím byly ve většině případů stanoveny dle standardních postupů ve dvou krocích. V prvním kroku průkaz IgM a IgG protilátek pomocí ELISA (Enzyme-Linked ImmunoSorbent Assay) a ve druhém kroku jejich potvrzení metodou Western Blott [3].
MMM byl vyšetřován cytologicky (stanovení počtu leukocytů, stav hematoencefalické bariéry – HEB), imunologicky (celkové hladiny IgM a IgG, event. přítomnost intratékální syntézy provedením izoelektrické fokuzace pro IgG anebo použitím grafu dle Reibera pro výpočet intratékální produkce protilátek ve třídě IgG a IgM), biochemicky (celková bílkovina a hladina glukózy). V některých případech byla provedena metoda PCR na přítomnost boreliové DNA [3]. Cytologické a imunologické vyšetření MMM probíhalo v likvorové laboratoři při Ústavu imunologie a Neurologické kliniky 2. LF UK a FN v Motole. Biochemické vyšetření MMM měla na starosti biochemická laboratoř při Ústavu klinické biochemie a patobiochemie 2. LF UK a FN v Motole. Stanovení boreliové DNA metodou PCR bylo prováděno v Národní referenční laboratoři pro lymeskou boreliózu při Státním zdravotním ústavu.
Diagnóza LNB byla stanovena na základě kombinace klinických a laboratorních nálezů. Přítomnost neurologických potíží, nevysvětlená jiným zřejmým důvodem, byla obligatorní podmínkou pro diagnózu LNB. Laboratorně byla diagnóza LNB stanovena na základě přímého (PCR) či nepřímého průkazu (specifické protilátky) B. b. dle následujícího protokolu:
- a) přítomnost specifických protilátek v MMM (IgM nebo IgG nebo obojí), s přítomností zánětlivého obrazu v MMM (pleiocytóza, porucha HEB, zvýšené IgM, intratékální produkce IgG anebo IgM) nebo bez ní,
- b) při negativitě specifických protilátek v MMM alespoň pozitivita PCR v MMM anebo nález specifických protilátek v séru (IgM nebo IgG nebo obojí) a přítomnost zánětlivého obrazu v MMM.
V případě neurologického deficitu (vyjma periferní parézy n. VII) byla vždy doplněna magnetická rezonance (MR) mozku a míchy. U periferní parézy n. VII zánětlivé etiologie nebyla MR mozku standardně prováděna.
V případě, že klinické i laboratorní nálezy vedly k diagnóze LNB, byly pacienti léčeni intravenózně podávaným ceftriaxonem 21 dní v dávce 50 mg/kg/den.
Výsledky
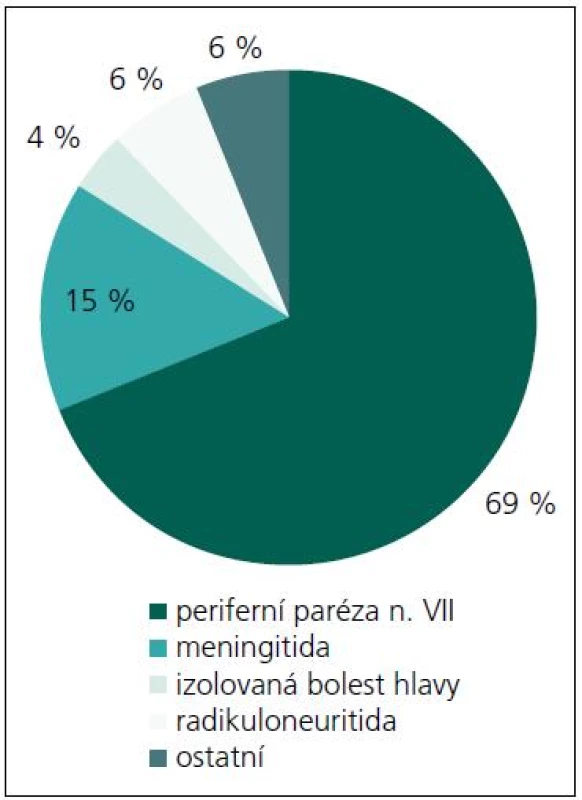
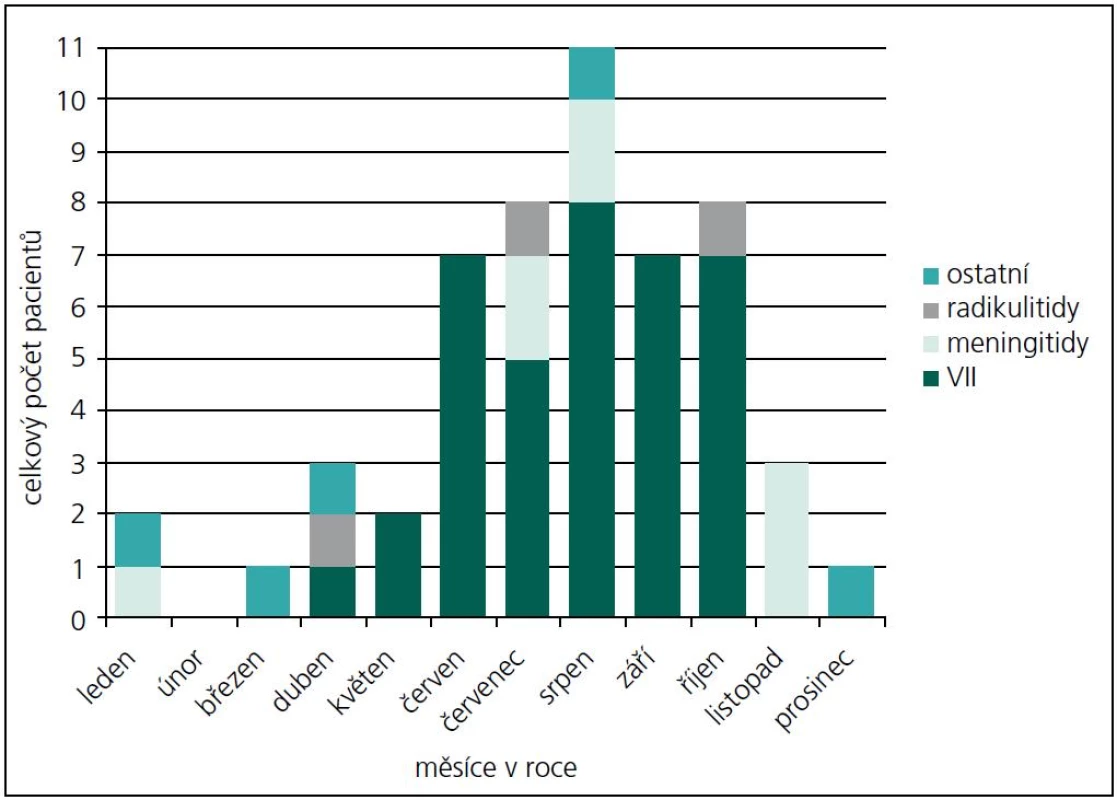
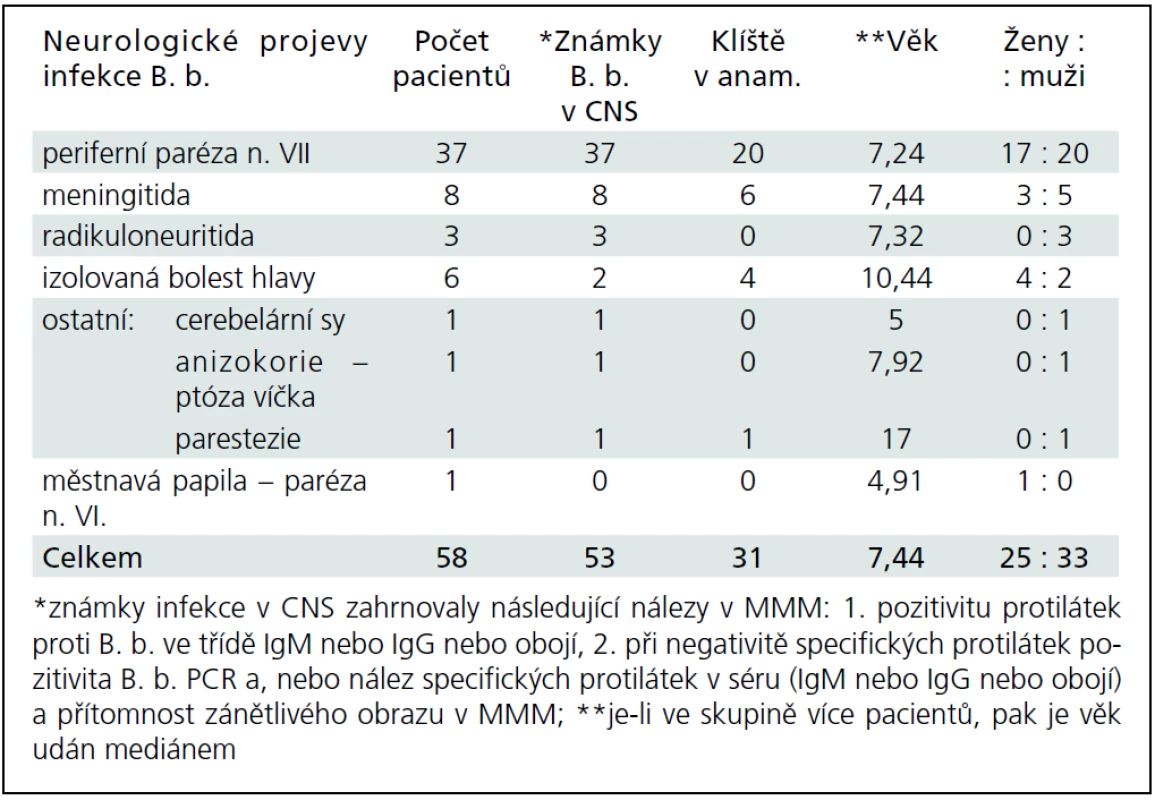
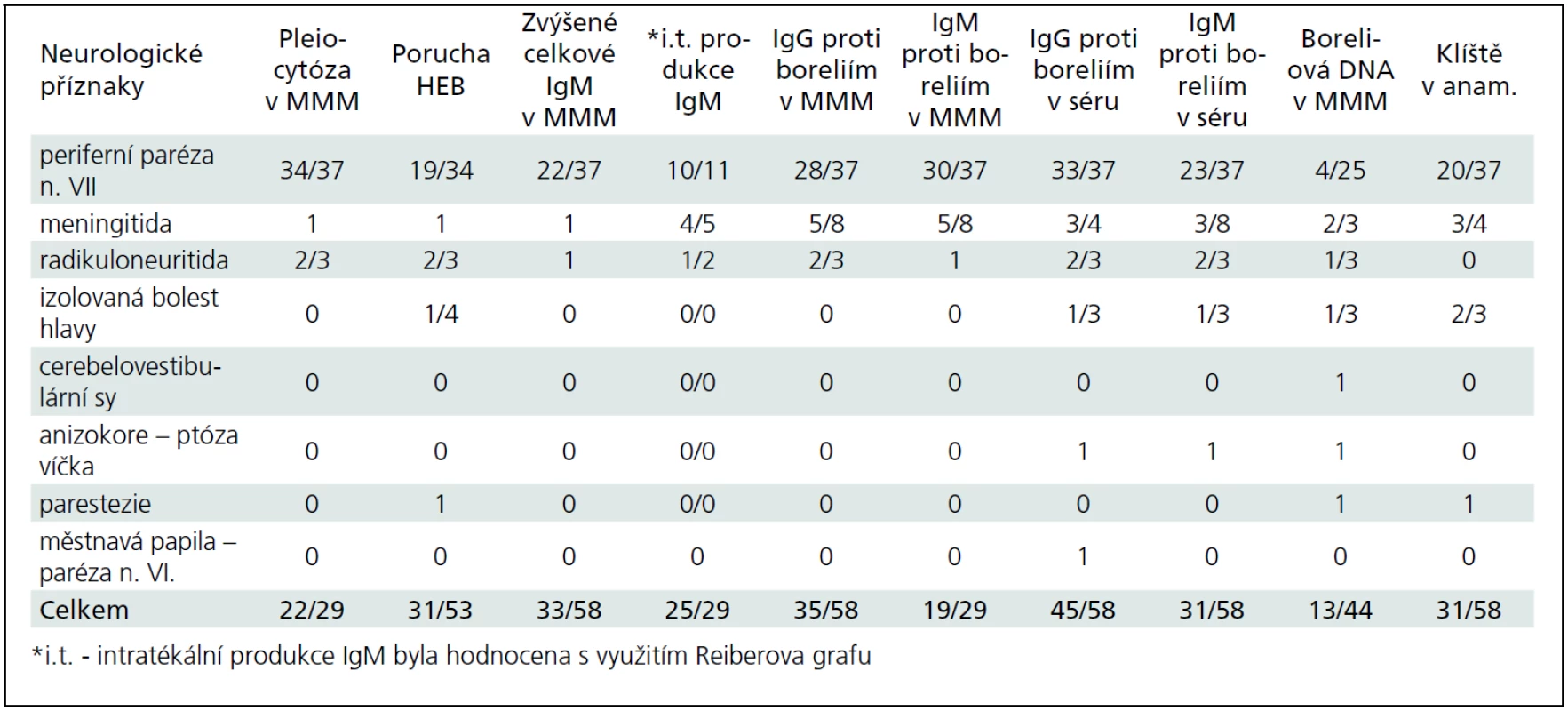
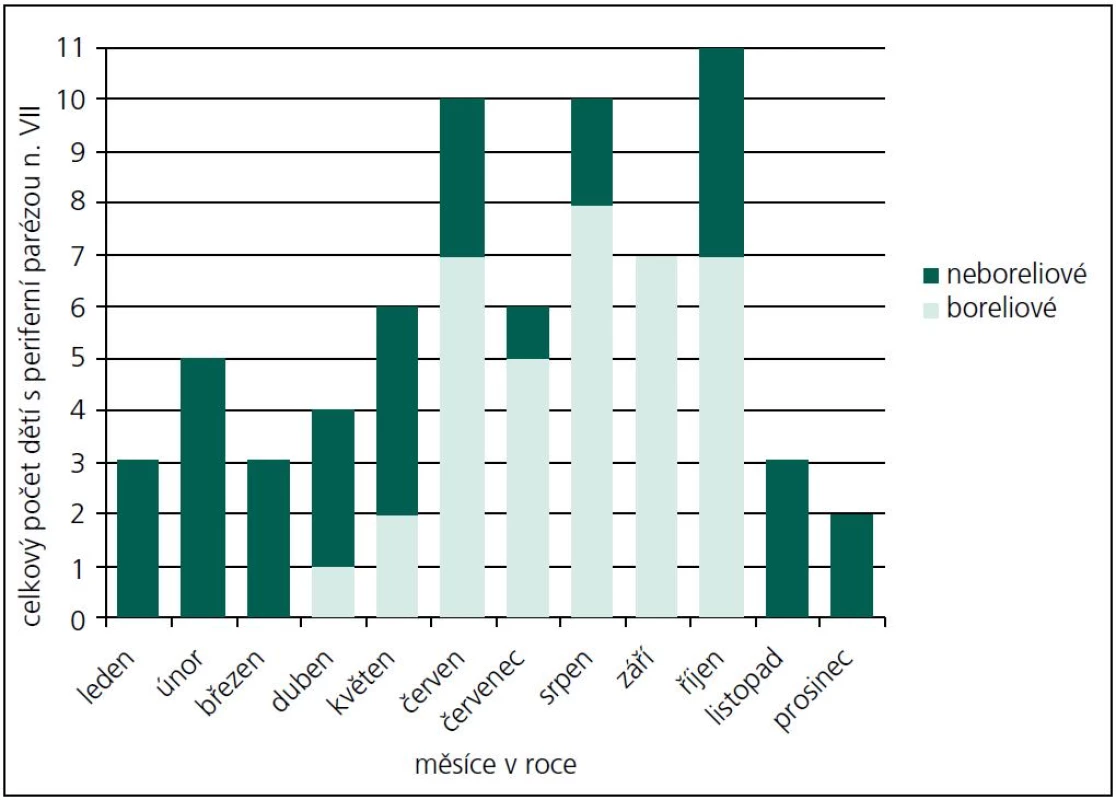
Během období 09/2009–08/2011 jsme na našem pracovišti prokázali neurologické potíže v souvislosti s boreliovou infekcí u 58 dětí. Medián věku byl 7,44 let (v rozmezí 6 měsíců–17,5 let). V 56 % byli postiženi chlapci. Zákus klíštěte v anamnéze byl přítomen pouze u 53,4 % postižených. Erythema migrans jsme nezaznamenali u žádného pacienta. LNB byla laboratorně prokázána u 53 z těchto 58 dětí s boreliovou infekcí a neurologickými potížemi. Třicet sedm z nich mělo klinické projevy periferní parézy lícního nervu, osm dětí projevy meningitidy, tři děti různé projevy radikulitidy, dvě děti trpěly pouze izolovanou intenzivní bolestí hlavy, jedno dítě mělo cerebelární syndrom, jedno dítě mělo anizokorii s ptózou víčka a jedno dítě hemiparestezie (obr. 1). Projevy onemocnění kulminovaly v letních měsících (obr. 2). Diagnóza LNB na základě přítomnosti specifických boreliových protilátek v MMM byla stanovena u 42 z 53 dětí, tedy u 79,2 %. U ostatních 11 dětí, byla diagnóza určena na základě přítomnosti boreliové DNA v MMM anebo zánětlivého obrazu v MMM a přítomnosti specifických boreliových protilátek v séru. U jednoho pacienta s hemiparestezií byl diagnostický nález boreliové DNA v MMM a signálový MR nález ložiska v míše. U jednoho pacienta s cerebelovestibulárním syndromem byl diagnostický pouze nález boreliové DNA v MMM.
Zbývajících pět dětí bylo bez laboratorního průkazu LNB, měly pouze vysoké titry IgG specifických boreliových protilátek v séru. V MMM nebyl zánětlivý obraz a boreliová DNA ani specifické boreliové protilátky nebyly v MMM prokázány. Přesto čtyři z těchto dětí trpěly intenzivní bolestí hlavy a jedno dítě mělo papiloedémem při zvýšeném nitrolebním tlaku.
Podrobněji v tab. 2 a 3. Některé klinické jednotky jsou probrány níže.
Periferní paréza lícního nervu (PPLN)
PPLN byla nejčastějším projevem LNB v našem souboru (69 %). Ve sledovaném období se na všech PPLN B. b. podílela 53 %, s maximálním výskytem v letních měsících (obr. 2, 3). Část dětí uváděla v předchorobí únavu, subfebrilie, otalgie, mírné bolesti hlavy a šíje. Artralgie ani fibromyalgie nebyly udávány. U dvou pacientů se vyvinula diparéza lícního nervu. U dvou dětí byly zachyceny poruchy srdečního rytmu, jejichž přímá souvislost s boreliovou infekcí však nebyla prokázána. Jeden z těchto pacientů měl junkční extrasystoly, které po léčbě vymizely. Druhý pacient měl atrio-ventrikulární blok I. stupně. Oba zůstali v kardiologickém sledování, bez nutnosti medikace.
U 91 % byly přítomné specifické protilátky proti boreliím v séru (ve třídě IgM a, nebo IgG). V MMM byly specifické protilátky proti boreliím (ve třídě IgM anebo IgG) přítomné u 89 % a pleiocytóza u 91 % dětí. Pleiocytóza kolísala v závislosti na poruše HEB. Porucha HEB se vyskytla jen u 51 % dětí. Medián celkového počtu leukocytů byl 403/3 (v rozmezí 16–1323/3) u porušené HEB, resp. 81/3 (v rozmezí 7–320/3) u neporušené HEB. Medián proteinorhachie byl 0,523 g/l (v rozmezí 0,299–1,58 g/l) u porušené HEB, resp. 0,197 g/l (v rozmezí 0,142–0,347 g/l) u neporušené HEB. Celkové IgM v MMM bylo zvýšeno u 89 % dětí s porušenou HEB a u 22 % dětí s neporušenou HEB. U 22 dětí ze 37 byla stanovena intratékální produkce IgM protilátek s využitím Reiberova grafu, která byla pozitivní u 20 z nich, tj. v 91 %. Pozitivní izoelektrická fokuzace pro průkaz intratékální syntézy IgG byla přítomná ve 26 %. PCR boreliové DNA v MMM byla pozitivní v 16 %, ve 4 % byla pro absenci specifických protilátek diagnosticky významná.
Všechny děti s PPLN byly léčeny ceftriaxonem podávaným intravenózně 21 dní v dávce 50 mg/kg/den. U dvou dětí se mezi 10. a 12. dnem objevila kožní alergická reakce, pro kterou bylo podávání ceftriaxonu ukončeno. U všech dětí došlo ke zlepšení potíží. V době dimise se u 78 % dětí se neurologický nález upravil ad integrum. U 13 % dětí v době propuštění přetrvávalo lehké oslabení ústního koutku. U 8 % dětí byl v době propuštění přítomen lagoftalmus do 2 mm.
Meningitida
Meningitida byla druhým nejčastějším projevem LNB v našem souboru (15 %). Dominujícím příznakem byly bolesti hlavy a v různé míře vertebrogenní obtíže s poruchou dynamiky páteře či meningeální syndrom. Febrilie se vyskytovaly častěji než u PPLN. Specifické protilátky proti boreliím v séru (ve třídě IgM a, nebo IgG) byly přítomné jen u 62 % postižených. V MMM byly specifické protilátky (ve třídě IgM a,nebo IgG) přítomné také v 62 %, zatímco pleiocytóza a porucha HEB byla prokázána ve 100 % případů. Medián celkového počtu leukocytů byl 484/3 (v rozmezí 96–808/3), medián proteinorhachie 0,455 g/l (v rozmezí 0,346–0,869 g/l). Celkové IgM v MMM bylo zvýšeno u 100 % dětí. U pěti z osmi dětí byla stanovena intratékální produkce IgM protilátek s využitím Reiberova grafu, která byla pozitivní ve čtyřech případech, tj. v 80 %. Nikdo neměl pozitivní izoelektrickou fokuzaci pro průkaz intratékální syntézy IgG. PCR boreliové DNA v MMM byla pozitivní v 50 % a ve 25 % byla pro absenci specifických protilátek diagnosticky významná (u těchto dětí byla mimo klinické potíže a pozitivitu boreliové DNA metodou PCR navíc přítomna pleiocytóza v MMM a porucha HEB).
Také tito pacienti byli všichni léčeni ceftriaxonem podávaným intravenózně 21 dní v dávce 50 mg/kg/den. U jednoho se mezi 10. a 12.dnem objevila kožní alergická reakce, pro kterou bylo podávání ceftriaxonu ukončeno. U všech dětí došlo k vymizení potíží.
Radikulitida
Klasický Bannwarthův syndrom s klinickými příznaky iritačního kořenového syndromu S1 se vyskytl pouze u jednoho pacienta ve věku 17,5 let. Další z pacientů měl projevy polyradikuloneuritidy s atypickou chůzí, slabostí v kolenou, známkami axonální léze na EMG a sycení cauda equina po podání gadolinia na MR míchy. Poslední pacient měl atypickou chůzi se spastickým nálezem na dolních končetinách a na EMG byly známky demyelinizační motoricko-senzitivní neuropatie, MR míchy bylo normální. Všichni tito tři pacienti měli pozitivní specifické protilátky v likvoru i séru alespoň v jedné třídě (IgG či IgM). Porucha HEB, pleiocytóza a zvýšená celková bílkovina v likvoru se vyskytovala jen u prvních dvou.
Všichni výše zmínění byli léčeny ceftriaxonem podávaným intravenózně 21 dní, v dávce 50 mg/kg/den. Ke zlepšení stavu došlo pouze u prvních dvou. Neurologický nález v době propuštění se upravil ad integrum pouze u pacienta s klasickým Bannwarthovým syndromem.
Diskuze
Soubor našich pacientů byl svým věkovým zastoupením v souladu s epidemiologickou situací LB na našem území [5]. Některé práce referovaly výskyt neurologických komplikací v 10–20 % pacientů s LB [7,8]. V ČR bylo v roce 2009 ve věkové skupině 5–9letých dětí hlášeno kolem 60 případů LB/100 000 [5]. Naše výsledky ukazují, že výskyt LNB může být u dětí v ČR až vícenásobně vyšší. Roli může hrát i fakt, že na území ČR převažuje výskyt B. garinii, jež vykazuje vysokou afinitu k CNS [3,5]. V našem souboru dětských pacientů dominovaly akutní projevy LNB, nejčastěji jsme zaznamenali PPLN. V souboru všech dětí s PPLN vyšetřovaných ve stejném období na naší klinice tvořila boreliová zánětlivá etiologie více než polovinu, což je výrazně více, než je obvykle publikováno [8]. Projevy meningitidy byly v našem souboru zastoupeny méně, ale děti s podezřením na akutní meningitidu a s horečkami bývají častěji hospitalizovány na pediatrickém pracovišti. Klasický Bannwarthův syndrom, který je častý u dospělých pacientů, se v našem souboru vyskytl pouze u jediného a zároveň i nejstaršího pacienta. U pacienta se spastickým nálezem na dolních končetinách a demyelinizační formou motoricko-senzitivní neuropatie se mohlo jednat o formu chronické infekce anebo souběh dvou patologií.
Diagnostika LNB byla stanovena na základě kombinace vyšetřovacích metod a vedoucím kritériem byly klinické neurologické potíže. Náš postup byl v souladu s doporučeními Evropské federace neurologických společností z roku 2010. Dle těchto postupů je diagnóza LNB jistá, pokud se u pacienta vyskytují neurologické potíže bez jiného zřejmého důvodu, současně se v MMM vyskytuje pleiocytóza a je prokázána intratékální produkce protilátek proti boreliím. Pokud není prokázána intratékální produkce protilátek, přestože je v MMM pleiocytóza, pak je diagnóza LNB považována za možnou a je léčena stejně jako jistá LNB [23].
Vyšetření MMM ukázalo široké spektrum zánětlivého nálezu – od diskrétní poruchy HEB bez pleiocytózy, po výraznou poruchu HEB s pleiocytózou. Lze uvažovat, zda jednotlivé obrazy v MMM souvisí s aktuálním stadiem onemocnění [15,19]. Přímý průkaz B. b. v CNS je obtížný, PCR vykazuje senzitivitu okolo 40 % [1,8]. Kultivace a přímá mikroskopie B. b. je možná, ale v přímé diagnostice se pro svou náročnost a nízkou senzitivitu nepoužívá [3,8]. Identifikace patogenu byla ve většině případů nepřímá pomocí vyšetření specifických protilátek v MMM a v séru. Nález intratékální syntézy specifických protilátek v MMM je považován za vysoce specifický pro LNB, ale senzitivita se odhaduje pouze na 55 % [8,23]. V našem souboru byla samotná přítomnost specifických protilátek proti boreliím v MMM stanovena u všech pacientů. Nicméně stanovení intratékální produkce s využitím Reiberova grafu anebo izoelektrické fokuzace bylo provedeno jen u některých z nich. Důvody byly převážně technické a fakt, že data byla zpracována retrospektivně. Specifické protilátky v séru (zejména ve vysokých titrech a ve třídě IgG) jsou ve spojitosti s neurologickými příznaky vysoce podezřelé z LNB. V malém procentu případů jsme prokázali, že i při negativitě specifických protilátek v séru může být pozitivní nález v MMM. V těchto případech bylo důležité cytologické vyšetření MMM a přímý průkaz B. b. metodou PCR. Zobrazení CNS pomocí magnetické rezonance bylo indikováno pouze u pacientů s ložiskovým neurologickým deficitem (vyjma PPLN). Zobrazení CNS pomocí magnetické rezonance může být s normálním nálezem. Nicméně může se objevit sycení zánětlivých lézí po podání gadolinia nebo signálové změny v parenchymu CNS někdy až imitující nádor či demyelinizační onemocnění [18]. V našem souboru bylo zobrazení přínosné pouze u dvou pacientů. U pacienta s polyradikuloneuritidou (prokázáno sycení lumbosakrálního kanálu) a u pacienta s hemiparestezií (nalezeno zánětlivé ložisko v oblasti míchy). Oba nálezy se po léčbě antibiotiky upravily.
V terapii LNB se v akutní fázi doporučuje podávání antibiotik v rozmezí 10–30 dní [23–26]. Nebyl prokázán větší rozdíl mezi 2- a 4týdenním podáváním. První volbou u dětí bývají cefalosporiny III. generace, alternativami může být podávání krystalického penicilinu G nebo doxycyklinu. Od podávání krystalického penicilinu G se upouští pro riziko komplikací. Terapie doxycyklinem je limitována věkem, lék je možno podat až od osmi let. Jeho výhodou je perorální aplikace se srovnatelným efektem oproti cefalosporinům III. generace [23]. Většina dětí se uzdraví bez trvalých následků, některé děti (více však dospělí) si po léčbě mohou stěžovat na přechodnou únavu, poruchu koncentrace, poruchy paměti, myalgie a artralgie. Tyto příznaky obvykle většinou do několika měsíců vymizí. Prolongované podávání antibiotik mělo na tyto potíže sporný efekt [10,24,25]. Všichni naši pacienti s LNB byly léčeni intravenózně aplikovaným ceftriaxonem standardně 21 dní, pouze u tří dětí se objevila kožní alergická reakce mezi 10. a 12. dnem podávání, a léčba ceftriaxonem tak byla ukončena.
Kontrolní lumbální punkci jsme standardně neprováděli. Lumbální punkci s odstupem 2–3 měsíců jsme opakovali pouze v individuálních případech, kdy byl na počátku onemocnění výrazný zánětlivý obraz v MMM. Zohlednili jsme také klinický stav dítěte a přání rodiny. Pokud byla kontrolní lumbální punkce provedena, vždy došlo ke zlepšení zánětlivých parametrů v MMM, data nejsou ukázána.
Závěr
LNB je u dětí na území ČR častá. Téměř pětina všech lumbálních punkcí prováděných na našem pracovišti k vyloučení neuroinfekce byla v kauzálním vztahu s boreliovou infekcí. Epidemiologická situace na území Slovenské republiky nám není známa. Na LNB u dětí je třeba pomýšlet zejména při projevech PPLN a meningitidy. Postižení jiných hlavových nervů, nervových kořenů, periferních nervů anebo projevy encefalitidy či encefalomyelitidy v důsledku LNB je u dětí spíše vzácné, i když možné. Chybějící anamnestické údaje o zákusu klíštěte či kožní reakci po zákusu klíštěte diagnózu LNB rozhodně nevylučují. Klasický kožní erytém, který je často uváděn jako jeden z prvních důležitých známek boreliové infekce, nemělo žádné z dětí v našem souboru. Výskyt onemocnění jednoznačně souvisí s pobytem dětí v přírodě, který závisí na klimatických poměrech v daném roce. Vzhledem k relativně dlouhé inkubační době se může LNB projevit kdykoli během roku. Nicméně nejvyšší výskyt jsme zaznamenali v období od jara do podzimu. Komplexní diagnostický přístup a provedení lumbální punkce bylo pro stanovení diagnózy LNB nezbytné. Po průkazu LNB byla indikována intravenózní terapie cefalosporiny III. generace, která pomohla naprosté většině dětí v našem souboru. Výskyt nežádoucích účinků terapie byl minimální.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Práce byla podpořena z nadačního fondu Pohyb bez pomoci.
Z. Libá-Vrabelová1, J. Kayserová2, V. Komárek1
2. LF UK a FN v Motole, Praha:
1 Klinika dětské neurologie
2 Ústav imunologie
MUDr. Zuzana Libá-Vrabelová, Ph.D.
Klinika dětské neurologie
V úvalu 84
150 06 Praha 5
e-mail: zuzanavr@email.cz
Přijato k recenzi: 8. 11. 2011
Přijato do tisku: 18. 6. 2012
Sources
1. Rizzoli A, Hauffe HC, Carpi G, Vourc’h GI, Neteler M, Rosà R. Lyme neuroborreliosis in Europe. Eurosurveillance 2011; 16(27).
2. Křupka M, Raška M, Weigl E. Lymská borelióza – biologie, patogeneze, diagnostika a léčba. Dermatol Prax 2008; 2(5–6): 236–239.
3. Hulínská D, Kybicová K. Diagnostika lymeské borreliózy v Národní referenční laboratoři pro lymeskou borreliózu, SZÚ, 2008 [on-line]. Dostupné z: http://www.szu.cz/tema/prevence/diagnostika-lymeske-borreliozy-v-nrl-lb.
4. Skowronek-Bala B, Wesolowska E, Gergont A, Kacinski M. Neuroboreliosis with motoric disturbations in the developmental age. Przegl Lek 2008; 65(11): 810–812.
5. Smith R, Takkinen J. Lyme borreliosis: Europe-wide coordinated surveillance and action needed? Eurosurveillance 2006; 11(25).
6. Kříž B, Beneš Č. Lymeská borrelióza – epidemiologická data, SZÚ, 2010 [on-line]. Dostupné z: http://www.szu.cz/tema/prevence/lymeska-borrelioza-epidemiologicka-data-1.
7. Rupprecht TA. Neuroborreliosis: Pathogenesis, Symptoms, Diagnosis, and Treatment: Epidemiology [on-line]. Dostupné z: http://www.medscape.org/viewarticle/738274_2.
8. López-Alberola RF. Neuroborreliosis and the pediatric population: a review. Rev Neurol 2006; 42 (Suppl 3): S91–S96.
9. Rupprecht TA, Koedel U, Fingerle V, Pfister HW. The pathogenesis of Lyme neuroborreliosis: from infection to inflammation. Mol Med 2008; 14(3–4): 205–212.
10. Pachner AR. Lyme neuroborreliosis. In: Antel J et al (eds). Clinical neuroimmunology. 2nd ed. Oxford, USA: Oxford University Press 2005: 301–314.
11. Ramesh G, Borda JT, Dufour J, Kaushal D, Ramamoorthy R, Lackner AA et al. Interaction of the Lyme disease spirochete Borrelia burgdorferi with brain parenchyma elicits inflammatory mediators from glial cells as well as glial and neuronal apoptosis. Am J Pathol 2008; 173(5): 1415–1427.
12. Dennis VA, Dixit S, O‘Brien SM, Alvarez X, Pahar B, Philipp MT. Live Borrelia burgdorferi spirochetes elicit inflammatory mediators from human monocytes via Toll-like receptor signaling pathway. Infect Immun 2009; 77(3): 1238–1245.
13. Kigerl KA, Lai W, Rivest S, Hart RP, Satoskar AR, Popovich PG. Toll-like receptor (TLR)-2 and TLR-4 regulate inflammation, gliosis, and myelin sparing after spinal cord injury. J Neurochem 2007; 102(1): 37–50.
14. Henningsson AJ, Tjernberg I, Malmvall BE, Forsberg P, Ernerudh J. Indications of Th1 and Th17 responses in cerebrospinal fluid from patients with Lyme neuroborreliosis: a large retrospective study. J Neuroinflammation 2011; 8: 36.
15. Janeway CA et al. T-cell mediated immunity. In: Janeway CA et al (eds). Immunology. 6th ed. New York: Garland Science publishing 2007: 319–362.
16. Hinojosa AE, Garcia-Bueno B, Leza JC, Madrigal JL. CCL2/MCP-1 modulation of microglial activation and proliferation. J Neuroinflammation 2011; 8: 77.
17. Gerszten RE, Garcia-Zepeda EA, Lim YC, Yoshida M, Ding HA, Gimbrone MA jr et al. MCP-1 and IL-8 trigger firm adhesion of monocytes to vascular endothelium under flow conditions. Nature 1999; 398(6729): 718–723.
18. Hildenbrand P, Craven DE, Jones R, Nemeskal P. Lyme neuroborreliosis: manifestations of a rapidly emerging zoonosis. AJNR Am J Neuroradiol 2009; 30(6): 1079–1087.
19. Vrethem M, Widhe M, Ernerudh J, Garpmo U, Forsberg P. Clinical, diagnostic and immunological characteristics of patients with possible neuroborreliosis without intrathecal Ig-synthesis against Borrelia antigen in the cerebrospinal fluid. Neurol Int 2011; 3(1): e2.
20. Widhe M, Jarefors S, Ekerfelt C, Vrethem M, Bergstrom S, Forsberg P et al. Borrelia-specific interferon-gamma and interleukin-4 secretion in cerebrospinal fluid and blood during Lyme borreliosis in humans: association with clinical outcome. J Infect Dis 2004; 189(10): 1881–1891.
21. Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol 2003; 3(3): 223–232.
22. Mills KH. Regulatory T cells: friend or foe in immunity to infection? Nat Rev Immunol 2004; 4(11): 841–55.
23. Mygland A, Ljøstad U, Fingerle V, Rupprecht T, Schmutzhard E, Steiner I. European Federation of Neurological Societies. EFNS guidelines on the diagnosis and management of European Lyme neuroborreliosis. Eur J Neurol 2010; 17(1): 8–16.
24. European Concerned Action on Lyme Borreliosis; Treatment of Lyme borreliosis in Europe [on-line]. Dostupné z: www.eucalb.com.
25. Stricker RB. Counterpoint: Counterpoint: long--term antibiotic therapy improves persistent symptoms associated with lyme disease. Clin Infect Dis 2007; 45(2): 149–157.
26. Gurčík L. Súčasné trendy v diagnostike a liečbě neuroboreliózy. Neurol Prax 2009; 10(3): 170–176.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 1
Most read in this issue
- Use of Botulinum Toxin in Neurology
- Frequent Incidence of Lyme Neuroborreliosis in Children in the Czech Republic
- Tetanus – a Reborn Diagnosis? A Case Report
- Hydrocephalus as a Complication of Subarachnoid Hemorrhage
