Léčba adenomů hypofýzy
Pituitary Adenoma Therapy
Pituitary adenomas constitute 10–15% of intracranial tumours. These lesions are benign in the vast majority of cases. A combination of medical, neurosurgical and radiosurgical means is applied in treating them. A ‘watch-and-wait’ strategy is also a legitimate approach to treatment in certain cases. Only an appropriate combination of these modalities yields the best possible outcome. Close collaboration between endocrinologist, neurosurgeon and radiosurgeon is therefore essential. The endoscopic technique of pituitary adenoma resection is among the newer developments in surgical treatment, and intra-operative MR facilitates improved surgical results. This leads us to believe that intra-operative MR is indicated in surgery of sellar lesions. The goal of treatment is pituitary adenoma control, enabling the patient to live a normal life, of normal life expectancy, without hormonal substitution (whenever possible) and without visual impairment.
Key words:
pituitary adenoma – endocrinology – radiosurgery – endoscopy – intraoperative magnetic resonance imaging
:
D. Netuka; V. Masopust; V. Beneš
:
Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha
:
Cesk Slov Neurol N 2011; 74/107(3): 240-253
:
Minimonography
Adenomy hypofýzy tvoří 10–15 % intrakraniálních nádorů. V naprosté většině případů se jedná o léze nezhoubné. Při léčbě těchto lézí se kombinují farmakologické, neurochirurgické a radiochirurgické postupy. Vzhledem k benignímu charakteru adenomů hypofýzy je observace ve vybraných případech zcela legitimní léčebná modalita. Jedině správná kombinace těchto postupů přináší nejlepší možné výsledky u pacientů s adenomy hypofýzy. Proto je zcela nezbytná mezioborová spolupráce endokrinologa, neurochirurga a radiochirurga. Mezi novinky v neurochirurgické oblasti léčby pacientů s adenomy hypofýzy patří zavedení endoskopických technik. Možnost intraoperační MR přináší zlepšení operačních výsledků, a proto považujeme její použití u operací selárních lézí za indikované. Cílem léčby adenomů hypofýzy je taková kontrola nádoru, aby nemocný žil svůj normální život normální délky, pokud možno bez nutnosti hormonální substituce a bez poruchy zraku.
Klíčová slova:
adenom hypofýzy – endokrinologie – radiochirurgie – endoskopie – intraoperační magnetická rezonance
Úvod
Adenomy hypofýzy jsou nejčastější nádorové léze v oblasti tureckého sedla. Vzhledem k tomu, že velká část adenomů hypofýzy je klinicky němá, je obtížné určit jejich přesnou prevalenci. V postmortem studiích je adenom hypofýzy odhalen až ve 14 % případů, dle radiologických studií dokonce až v 22 % případů [1]. Přibližná prevalence je 20/100 000, incidence 1,5–2/100 000/rok. Častěji se adenomy hypofýzy vyskytují u žen, v poměru 2 : 1. Adenomy hypofýzy vycházejí z předního laloku hypofýzy (adenohypofýzy). Základní dělení zohledňuje jejich schopnost tvořit hormony: adenomy funkční (adenomy produkující hormony a vyvolávající příslušné klinické příznaky) a adenomy afunkční (adenomy neprodukující klinicky významná množství hormonů). První skupina se nečastěji projevuje typickým klinickým obrazem odpovídajícím hormonální nadprodukci. Ve skupině druhé převládají příznaky z útlaku hypofýzy a okolních struktur (zrakový nerv, okohybné nervy, kavernózní splav, u gigantických adenomů tlakem na hypothalamus, frontální/temporální lalok). Ne příliš často se mohou adenomy hypofýzy manifestovat hydrocefalem.
Klinické a endokrinologické vyšetření
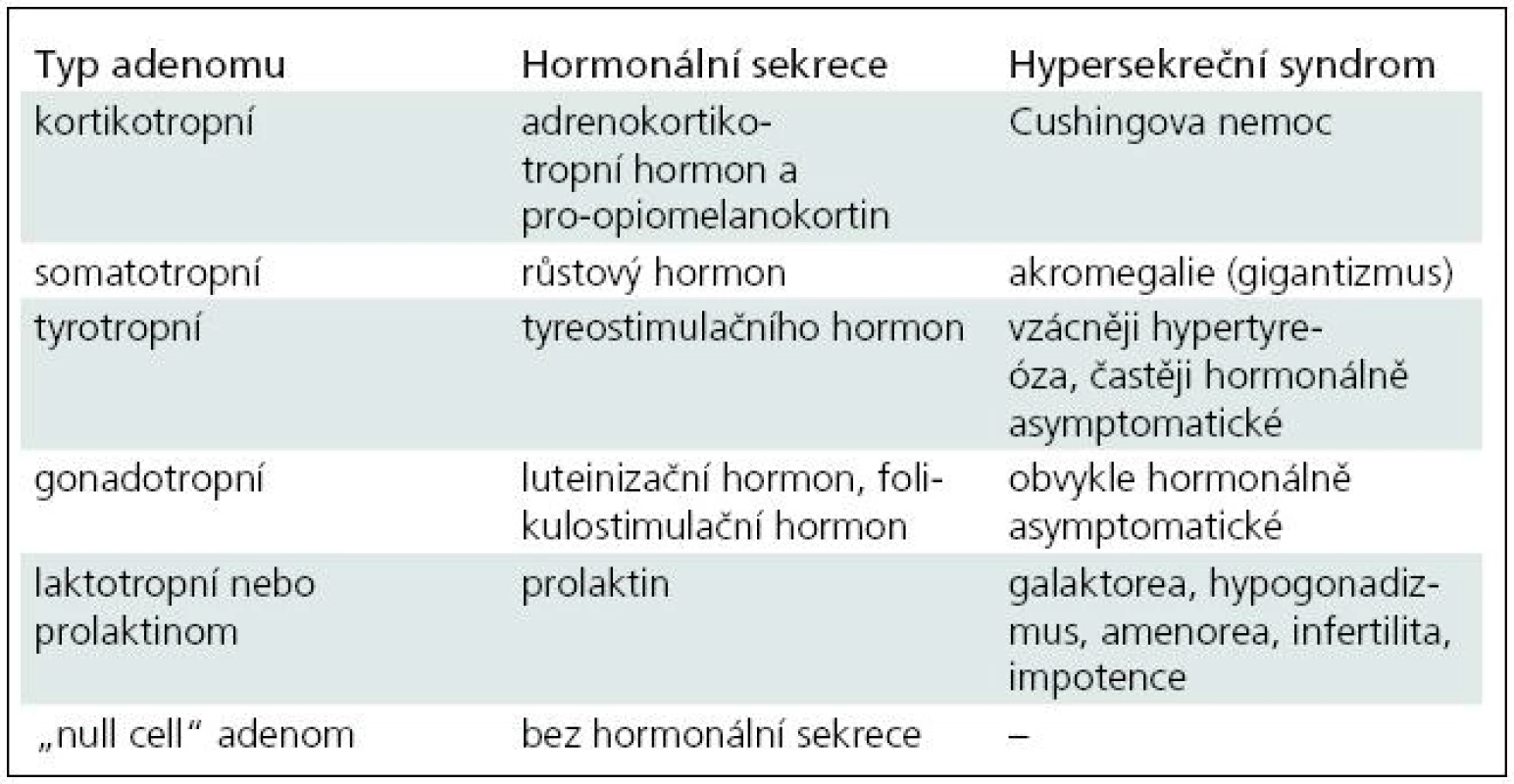
Klinické a endokrinologické vyšetření je indikováno u všech pacientů se selární lézí. Základním důvodem je identifikace případné hormonální nadprodukce a/nebo snížené sekrece hormonů adenohypofýzy (hypopituitarizmus). Hypersekreční formy jsou vzhledem k rozsahu textu popsány společně s terapeutickými postupy. Zjednodušená klasifikace tumorů hypofýzy s uvedením hormonální sekrece a základními hypersekrečními syndromy je uvedena v tab. 1. Nedostatečná sekrece růstového hormonu (STH) vede u dětí k hypofyzárnímu nanizmu, u dospělých se projeví nadváhou, snížením svalové hmoty, nevýkonností a sníženou vitalitou. Deficit folikulostimulačního hormonu vede k hypogonadizmu, u žen se projevuje poruchou menstruačního cyklu, u mužů snížením libida. Nedostatek tyreostimulačního hormonu (TSH) způsobuje sekundární hypotyreózu, mezi nejčastější příznaky patří intolerance chladu, změny kognitivních funkcí a suchost kůže. Deficit prolaktinu (PRL) má za následek poruchu laktace u kojících žen. Snížená produkce adrenokortikotropního hormonu (ACTH) způsobuje svalovou slabost, celkovou únavu. Porucha zadního laloku hypofýzy způsobuje diabetes insipidus. Vyznačuje se nadměrnou produkcí hypoosomolální moči a polydipsií. Příčinou je nedostatečný výdej antidiuretického hormonu.
Oční vyšetření
Oční vyšetření je zcela jednoznačně indikováno u všech pacientů se selárními lézemi, které se propagují supraselárně. Indikováno je vyšetření vizu a očního pozadí, které může odhalit např. atrofii zrakového nervu. Zásadní je však vyšetření perimetru. Adenom atakující chiazma nejprve způsobuje horní temporální kvadrantopsii, později bitemporální hemianopsii. To je dáno nejčastějším směrem růstu nádoru – nahoru a dopředu mezi oba zrakové nervy. V klinické praxi se však často setkáváme s asymetrickými výpady způsobenými nestejnoměrnou kompresí zrakové dráhy.
Grafické zobrazení
Magnetická rezonance (MR) je v dnešní době modalita číslo jedna při zobrazování selární krajiny. MR přístroje o síle magnetického pole alespoň 1,5 T nabízejí větší potenciál k lepšímu zobrazení struktur v selární oblasti. MR vyšetření se standardně provádí v T1 i T2 vážených obrazech, jsou provedeny tenké koronární a sagitální řezy, doplňuje se vyšetření po podání kontrastní látky. U mikroadenomů špatně zobrazených na MR lze použít vyšetření dynamické. Po podání kontrastní látky je mikroadenom nejprve hypointenzní, později se jeho intenzita zvyšuje, až dochází k setření rozdílu mezi mikroadenomem a okolní hypofýzou. MR poskytuje detailní informaci o selární lézi, její velikosti, vztahu k okolním strukturám a směru růstu. V případech podezření na cévní patologii v oblasti tureckého sedla se doplňuje MR angiografie nebo CT angiografie. CT mozku s podáním kontrastní látky se používá u pacientů, u kterých je MR kontraindikováno nebo není z jiných důvodů proveditelné. RTG lbi má již jen historickou hodnotu.
Dle velikosti se adenomy arbitrážně dělí na mikroadenomy (< 10 mm v průměru) a makroadenomy (> 10 mm). Gigantické adenomy mají průměr > 25 mm. Autorem chirurgické klasifikace adenomů hypofýzy z 60. let minulého století je J. Hardy. Jeho klasifikace zohledňovala velikost adenomu, invazivitu růstu adenomu (ohraničený vs difuzní) a lokalizaci adenomu (intraselární vs supraselární růst) [2].
V roce 1993 Knosp et al publikovali klasifikaci adenomů zaměřenou na invazi adenomu hypofýzy do kavernózního splavu. Klasifikace je založena na vztahu laterálního okraje adenomu a krkavice v kavernózním splavu [3]. V roce 1997 vznikla další klasifikace, jejímiž autory jsou Edal et al [4]. Tato klasifikace hodnotí šest směrů růstu adenomu. Z praktického hlediska je však dle našeho názoru příliš komplikovaná.
Za rozhodující považujeme vztah adenomu a kavernózního splavu. Je známo, že 30 % adenomů hypofýzy roste invazivně a toto jsou právě ty nádory, které vyžadující specifickou léčbu a sledování. K dobrému rozpoznání vztahu adenomu ke kavernóznímu splavu je vhodná MR o síle 3 T, která dokáže zobrazit i stěnu žilního splavu.
Diferenciální diagnostika selárních lézí
V selární krajině se vyskytuje mnoho rozdílných lézí. Jejich kompletní popis překračuje rozsah této práce. Vhodné je rozlišení na cystické a solidní selární léze. Mezi cystické léze selární krajiny patří kraniofaryngeomy, cysty Rathkeho výchlipky, cystické adenomy hypofýzy, arachnoidální cysty, mukokély sfenoidálního sinu, epidermoid a dermoid. Kraniofaryngeomy představují 6–8 % intrakraniálních tumorů. Mají obvykle solidní i cystickou složku. Mohou obsahovat kalcifikace. Cystická složka je většinou hyperintenzní v T1 váženém obrazu. Kalcifikace jsou hypointenzní v T2 váženém obrazu. Solidní složka se sytí po podání kontrastní látky. Cysta Rathkeho výchlipky má na MR velmi heterogenní obraz. Její pouzdro se ve většině případů nesytí po podání kontrastní látky. Operace je indikována u symptomatických pacientů. U asymptomatických pacientů je vhodná observace. Cystické adenomy hypofýzy jsou hypointenzní na T1 vážených obrazech. Jejich okraj se sytí po podání kontrastní látky. Arachnoidální cysty jsou v oblasti tureckého sedla relativně vzácné. Na MR jsou typické tím, že obsah cysty má zcela identický signál s okolním mozkomíšním mokem. Pokud dojde k obstrukci sfenoidálního ostia, může se vyvinout mukokéla sfenoidálního sinu, která se v ojedinělých případech propaguje i do tureckého sedla a dále intrakraniálně. Dermoid i epidermoid se vyskytují v tureckém sedle relativně vzácně. Ve většině případů jsou hypointenzní na T1 a hyperintenzní na T2 vážených sekvencích.
Mezi solidní léze selární krajiny patří chordom, který je nejčastěji uložen v klivu. Může však růst paraselárně, vzácně i supraselárně. Jedná se o nehomogenní lézi s kalcifikacemi a hemoragiemi, která destruuje okolní kostěné struktury. Indikována je co nejradikálnější resekce s následnou radioterapií. V selární krajině může také růst meningiom. Nacházíme ho v oblasti tubercullum sellae, diafragma sellae, předního či zadního klinoidu. Na MR je typické výrazné sycení po podání kontrastní látky a případný nález sycení okolní dury (tzv. dura tail). U symptomatických meningiomů je indikován chirurgický výkon, buď za použití endonazálního endoskopického rozšířeného přístupu, anebo výkon transkraniální. Vzácně se může do tureckého sedla propagovat také aneuryzma, které často bývá parciálně trombotizované. Hodnocení předoperační MR a odhalení této patologie má zcela zásadní význam, aneuryzma je kontraindikací transsfenoidálního výkonu.
Hypersekreční syndromy a jejich léčba
Prolaktinomy
Incidence těchto tumorů je 0,6–1/100 000//rok, prevalence 6–10/100 000 obyvatel [5]. Vzhledem k excelentním výsledkům farmakologické léčby těchto adenomů představují v chirurgických sériích méně než 10 % pacientů. Nejčastěji se vyskytují u žen mezi 20–50 lety, po páté dekádě je více nacházíme u mužů [6]. Hlavní inhibiční faktor sekrece prolaktinu je dopamin, který se váže na D2 receptory. Každý proces, jenž vede ke snížení tvorby dopaminu, jeho transportu nebo blokuje jeho vazbu na D2 receptory, způsobuje nadprodukci prolaktinu. Symptomatologie u žen: amenorea a infertilita (výskyt až v 90 % případů), galaktorea (v 50–80 %) [7]. U mužů jsou prolaktinomy v 80 % spojovány s bolestmi hlavy, neurologickým deficitem a poruchou zraku [8]. Hypogonadální příznaky většinou nevedou k lékařskému vyšetření, ale zvýšená hladina prolaktinu způsobuje impotenci, infertilitu, snížení libida a oligospermii. Gynekomastie a galaktorea jsou vzácné. U mužů je vyšší výskyt makroprolatinomů než u žen. Příčinou je zřejmě pozdější diagnóza těchto adenomů. Vzácně se mohou gigantické prolaktinomy, které uzurují bazi lební, projevit likvoreou.
Normální hladina prolaktinu je v rozmezí 5–20 ng/ ml. Hodnoty nad 150 ng/ ml s velkou pravděpodobností svědčí pro prolaktinom. Hodnoty 20–150 ng/ ml obvykle ukazují na pseudoprolaktinom. Pseudoprolaktinomy jsou afunkční adenomy, které kompresí stopky hypofýzy omezují transport dopaminu, a tím vyvolávají zvýšení hladiny prolaktinu (tzv. fenomén stopky hypofýzy). U makroprolaktinomů nejsou vzácností hodnoty až 10 000 ng/ ml. U gigantických adenomů s extrémní nadprodukcí prolaktinu může docházet k tzv. hook efektu. U těchto prolaktinomů může být laboratorní vyšetření falešně negativní a je nutné naředit vyšetřovaný vzorek k získání správné hladiny prolaktinu [9]. Proto je u invazivně rostoucích gigantických adenomů vždy indikováno vyšetření po naředění vzorku. Falešně negativní hodnota by jinak mohla vést ke špatnému terapeutickému postupu, v tomto případě k operaci. Ojediněle může být tento efekt přítomen i u jiných vysokých hladin hormonů, např. STH a ACTH.
Léčba prolaktinomů
Prakticky ve všech případech je indikována farmakologická léčba agonisty dopaminu. Snížení hladiny prolaktinu je dosaženo v řádu dnů, zmenšení adenomu v řádu týdnů až měsíců. Nejčastěji se používá bromokriptin nebo kabergolin. Webster et al publikovali randomizovanou studii porovnávající efekt kabergolinu s bromokriptinem, která prokázala vyšší efekt kabergolinu (83 vs 59 % normalizace hladin prolaktinu) [10]. Pouze u 10–20 % pacientů s mikroprolaktinomem a u 20–30 % s makroprolaktinomem je farmakologická léčba neúčinná a tito pacienti jsou považováni za farmakologicky rezistentní [11]. Mezi vedlejší efekty léčby patří nauzea, ortostatická hypotenze, gastrointestinální obtíže a teoretické riziko regurgitační chlopenní vady.
Chirurgický zákrok je indikován pouze u tumorů refrakterních na farmakologickou léčbu a v relativně vzácných případech pituitární apoplexie vzniklé při farmakologické léčbě. Radiochirurgické ozáření je indikováno u farmakologicky rezistentních pacientů s adenomem, u kterých není možné MR radikální operační řešení (např. reziduum adenomu po farmakologické léčbě uložené v kavernózním splavu).
Adenomy secernující růstový hormon
Incidence adenomů secernujících růstový hormon 0,2–0,4/100 000/rok, prevalence 6/100 000 [12]. Růstový hormon (STH) reguluje produkci jaterního peptidu somatomedinu (IGF-I, insulin-like growth factor). U dětí vede nadprodukce STH ke gigantizmu, v případě trvající hypersekrece i po uzavření růstových štěrbin ke gigantoakromegalii, v dospělosti k akromegalii. Mezi klinické příznaky nadprodukce STH patří zvětšení aker, nadočnicových oblouků, mandibuly, bolesti kloubů, ztluštění kůže, hyperhidróza, změna hlasu, makroglosie, zvětšení měkkého patra. Nadprodukce STH zvyšuje výskyt „sleep apnea syndrome“, způsobuje zvětšení štítné žlázy. Důsledkem dlouhodobě neléčeného onemocnění může být kardiomyopatie a hypertenze. U většiny pacientů nacházíme také v různé míře vyjádřenou inzulinovou rezistenci. Mortalita pacientů s nadprodukcí STH je v příslušném věku dvakrát vyšší než ve všeobecné populaci, nejčastěji z příčin kardiálních a vaskulárních [13].
Laboratorní diagnostika
Nutné je měření jak hladiny STH, tak IGF-I. U většiny pacientů s nadprodukcí STH je jeho sérová hladina > 5 ng/ ml. Vzhledem k tomu, že sekrece STH je ovlivněna stresem, námahou, hladověním a dalšími faktory, je doporučeno provádět orální glukózový test. U zdravé osoby dojde po podání 75 g glukózy k supresi koncentrace STH pod 1 ng/ ml (diskriminační hodnota ale záleží na použité metodě stanovení). U pacienta s STH produkujícím adenomem nedojde k supresi vůbec nebo jen minimální či nastane paradoxní zvýšení hladiny STH.
Za endokrinologickou normalizaci po léčbě STH produkujícího adenomu je považována hladina STH pod 2,5 ng/ ml, suprese po orálním glukózovém testu pod 1 ng/ ml a hodnota IGF-I odpovídají dané věkové skupině a pohlaví [14].
Na rozdíl od STH je hladina IGF-I velmi stabilní. IGF-I je zvýšeno až u 99 % pacientů s prokázanou hypersekrecí STH. Jeho stanovení je velmi citlivý diagnostický test a je také vhodné k sledování efektu léčby. V klinické praxi se však setkáváme s dvěma základními problémy při stanovování hladiny IGF-I. Hladina STH se liší dle věku pacienta, v pubertě je 3–4krát vyšší než v dospělosti, a to způsobuje zvýšené hladiny IGF-I v pubertě. Tato hladina je vyšší než hladina používaná k diagnóze akromegalie. Proto je vždy zcela zásadní vztahovat tyto hladiny k věku pacienta a řídit se věkově specifickými normami. Druhý problém se stanovením IGF-I představuje překrývání jeho normálních hodnot pro jednotlivé skupiny podle věku a pohlaví. Proto například 2,5 % zdravých jedinců má zvýšené hladiny IGF-I, protože tito zdraví jedinci mají hodnoty vyšší než 95% interval spolehlivosti. Tudíž je vždy nutné tyto nálezy korelovat s klinickým stavem, hladinami STH a orálním glukózovým testem.
Léčba STH produkujících adenomů
V posledních letech došlo k rozvoji farmakologické léčby STH secernujících adenomů. K dispozici jsou tři druhy farmakologické léčby: agonisté dopaminu, somatostatinová analoga a antagonisté STH receptoru. Agonisté dopaminu vazbou na dopaminové receptory mohou paradoxně snižovat nadprodukci STH, ale efekt této léčby je relativně nízký. Bromokriptin vede k supresi STH pouze u 20 % pacientů a normalizaci IGF-I u 10 % pacientů. Efekt kabergolinu je vyšší, přesto k dlouhodobé normalizaci IGF-I dochází nejvíce u cca 20 % pacientů [15]. Parciální redukce objemu STH secernujícího adenomu nastává vzácně, prakticky výhradně u smíšených STH a PRL secernujících adenomů [16]. Mezi nejčastější vedlejší účinky patří nauzea, zácpa, bolesti hlavy, kolísání nálady, zimomřivost a hypotenze.
Analoga somatostatinu jsou účinnější ve farmakologické léčbě STH secernujících adenomů. K dispozici jsou dlouhodobě účinné formy oktreotidu a lanreotidu, které mají největší afinitu k somatostatinovým receptorům subtypu 2 a 5. Tato léčba je obvykle používána zejména po nedostatečném efektu léčby chirurgické nebo v kombinaci s radiochirugickým výkonem. Pokud slouží tato léčba jako adjuvantní, tak k poklesu STH pod 2,5 ng/ ml (tzv. safe limit) dochází u 33–46 % pacientů, k normalizaci IGF-I u 39–54 % pacientů [17,18]. Je-li farmakologická léčba použita jako primární léčebná alternativa, je dosaženo suprese STH pod 2,5 ng/ ml u 53 % pacientů, normalizace IGF-I u 54 % pacientů [19]. Klinické příznaky, jako bolesti hlavy, otok měkkých tkání, bolesti kloubů, syndrom karpálního tunelu, jsou při farmakologické léčbě zmírněny u cca 70 % pacientů. Ke zmenšení objemu adenomu (obvykle o 20–50 %) dochází u 21–47 % pacientů [19]. Mezi nejčastější vedlejší účinky patří gastrointestinální obtíže, zejména bolest břicha a průjem. Potenciálně závažný je vznik cholecystolitiázy (až ve 30 % případů).
Další možností je použití antagonisty STH receptoru: pegvisomantu. Pegvisomant blokuje dimerizaci, a tím stimulaci STH receptoru. Následně dochází k poklesu produkce IGF-I. Efekt této léčby je monitorován dle hladin IGF-I, protože dochází k očekávanému zvýšení hladin STH po vyblokování STH receptorů. Navíc pegvisomant interferuje s většinou metod ke stanovení hladiny STH. Efekt léčby se dostavuje podle některých prací v 54–89 % případů [20], ale při adekvátním dávkování je možné docílit normalizace koncentrace IGF-I téměř u všech pacientů. Další možností je kombinace léčby pegvisomantem se somatostatinovými analogy. Mezi vedlejší účinky léčby patří zvýšení jaterních enzymů. Při léčbě pegvisomantem však nedochází ke zmenšení adenomu, naopak u 2–3 % pacientů dochází k jeho signifikantnímu nárůstu [21].
Mezi nevýhody farmakologické léčby patří její vysoká cena a nežádoucí účinky.
Přes pokroky ve farmakologické léčbě zůstává chirurgická léčba ve většině případů primární léčebnou modalitou. U velké části pacientů přináší okamžitý pokles hormonální nadprodukce a odstraňuje symptomy způsobené kompresí např. chiazmatu v případě makroadenomu. V neposlední řadě je chirurgická léčba ekonomičtější v porovnání s trvalou farmakologickou léčbou. K operaci jsou jednoznačně indikováni pacienti, u kterých lze očekávat radikální odstranění adenomu. U pacientů, u kterých to není možné, je indikace k operaci relativní. Zmenšení adenomu může přinést úpravu/zmírnění kompresivních účinků makroadenomu (porucha zraku aj.) a zřejmě zlepšuje i šanci na další farmakologickou či radiochirurgickou léčbu [22].
Dle kritérií z roku 2000 je po chirurgickém výkonu dosaženo farmakologické remise u 10–75,3 % pacientů. U mikroadenomů se tento cíl realizuje až u 88 % pacientů, u gigantických adenomů vzácně [23]. Efekt chirurgické léčby závisí na invazivitě růstu adenomu, stupni postižení kavernózních splavů a případným paraselárním růstem. Dle Nomikose et al je farmakologické remise dosaženo celkově u 56 % pacientů, 78 % mikroadenomů a 50 % makroadenomů [24]. Dle Lawse et al je farmakologické remise dosaženo u 67 % pacientů, 87 % mikroadenomů a 50,5 % makroadenomů [25]. Recidiva akromegalie při použití současných kritérií farmakologické remise hormonální nadprodukce je velmi vzácná, dle Nomikose et al se vyskytuje jen v 0,4 % případů [24]. Při použití starších, méně přísných kritérií farmakologické remise nadprodukce je výskyt recidiv významně vyšší, až v 17,8 % případů dle Davise et al [26].
Farmakologická léčba se v současné době stává druhou léčebnou linií, pokud nedojde k hormonální normalizaci po chirurgickém výkonu. Radiochirurgický zákrok se dnes častěji stává až třetí léčebnou alternativou vzhledem k délce doby k dosažení endokrinní normalizace a riziku rozvoje hypopituitarizmu po této léčbě (byť dnes již zcela minimálnímu) [27]. Dle autorů Ježková et al je dosaženo hormonální normalizace u 50 % pacientů během 42–66 měsíců od ozáření [28]. Nový hormonální deficit byl zaznamenán celkem u 27 % pacientů. Avšak ve skupině pacientů, u nichž okrajová dávka záření na adenohypofýzu byla menší než 15 Gy, nedošlo k rozvoji hypopituitarizmu ani v jednom případě. Další možností je kombinace farmakologické léčby s radiochirurgickým výkonem, pokud nedojde k hormonální normalizaci po iniciálním chirurgickém výkonu. Po dobu před dosažením efektu ozáření rezidua adenomu je podávána farmakologické léčba, kterou je možno s odstupem 2–3 let u velké části pacientů přerušit.
Nadprodukce ACTH hypofýzou – Cushingova nemoc
Výskyt centrální formy nadprodukce ACTH je relativně vzácný, incidence je přibližně 0,2/100 000/rok. Je zde jasně vyšší výskyt u žen (68–87 %), průměrný věk při stanovení diagnózy je 35–39 let.
Klinické příznaky
Trunkální typ obezity, zakulacení obličeje, strie, atrofie podkožní tkáně s ekchymózami, myopatie, zástava růstu (u dětí), diabetes mellitus, hypertenze, hyperlipidemie, syndrom polycystických ovárií, hypogonadizmus, osteoporóza.
Diagnostické testy
Hodnoty ranní kortizolemie nejsou diagnostické. Významnější je určení vylučování volného kortizolu v moči za 24 hod. Patologické hodnoty jsou > 250 mmol//24 hod. Toto vyšetření má senzitivitu 45–70 % [29]. Dalším velmi citlivým testem je měření noční hladiny (ve 23.00) kortizolu ve slinách. Tento test dosahuje až 93% senzitivity a 100% specificity [30]. V ČR toto vyšetření není na většině pracovišť dostupné, proto se častěji využívá stanovení koncentrace kortizolu ve spánku ve 24.00. Hodnota kortizolemie u zdravého člověka by měla klesnout pod 140 mmol/ l. Autonomii sekrece kortizolu prokazujeme dexametazonovým supresním testem s nízkou dávkou dexametazonu. Ve zkrácené variantně s 1 mg dexametazonu podaným ve 23.00 má ranní kortizolemie v 08.00 poklesnout pod 50 nmol/ l. Dexametazonový supresní test vychází z faktu, že podáním kortikoidů dojde ke zpětnovazebnému snížení sekrece ACTH, a tím ke snížení sérové hladiny kortizolu [31].
Při diferenciální diagnostice hyperkortizolizmu musíme někdy odlišit tzv. pseudo-Cushingův syndrom (aktivace osy hypothalamus-hypofýza-nadledviny) při následujících stavech: alkoholizmus, porucha příjmu potravy, závažné psychiatrické onemocnění, roztroušená skleróza, těhotenství, špatně kontrolovaný diabetes mellitus.
Cushingův syndrom s endogenní autonomní nadprodukcí kortizolu se rozděluje na ACTH dependentní syndrom způsobený adenomem hypofýzy secernujícím ACTH (Cushingova nemoc) a syndrom způsobený ektopickou produkcí ACTH (bronchiální karcinoid, karcinoid tymu, neuroendokrinní tumor nadledvin aj.). Jinou formou je ACTH independentní syndrom, který je vyvolán nádorovým onemocněním nadledvin nebo bilaterální modulární adrenální hyperplazií.
U ACTH independentní hypekortizolemie je hladina ACTH obvykle snížená, často je nedekovatelná. U ACTH dependentní hyperkortizolemie je hladina ACTH nesuprimovaná. K rozlišení, zda se jedná o Cushingovu nemoc, nebo zda je sekrece ACTH ektopická, se používají následující testy.
Dexametazonový supresní test s podáním 8 mg dexametazonu vede k supresi kortizolemie pod 50 % bazální hodnoty u většiny ACTH secernujích adenomů. Vzácně však může dojít k supresi i u pacientů s ektopickou sekrecí ACTH [32]. K rozlišení formy nadprodukce ACTH se též používá stimulace kortikotropin uvolňujícím hormonem, u většiny ACTH adenomů dojde k vzestupu ACTH po této stimulaci na rozdíl od ektopické sekrece ACTH. Ale ani tento test není zcela specifický.
Pokud se prokáže, že se jedná o ACTH--dependentní hyperkortikolizmus, je indikováno doplnění MR se zaměřením na selární krajinu. Jasný nález mikroadenomu dále upřesňuje diagnózu Cushingovy nemoci. Nelze však opomenout fakt, že až 50 % pacientů s ACTH-secernujícími mikroadenomy má incidální MR negativní [33]. Ke zpřesnění nálezů lze použít dynamické MR studie [34]. Dalším závažným faktem je, že 10 % populace má incidentální mikroadenom [35]. V případě nejasného nebo negativního nálezu na MR je indikováno provedení katetrizace dolních petrózních splavů. Gradient mezi hladinou ACTH v petrózním splavu a periferní žilní krví větší než 2 bazálně a gradient větší než 3 po podání CRH prokazuje centrální formu nadprodukce ACTH.
Léčba ACTH secernujících adenomů
Primární léčebná modalita pacientů s ACTH produkujícím adenomem je operační výkon. Prakticky vždy je indikována transsfenoidální resekce. Transsfenoidální selektivní resekci ACTH produkujících adenomů začal provádět J. Hardy v 60. letech minulého století. Účinnost chirurgického výkonu je 69–98 %, výskyt recidiv je v 3–17 % a perioperační mortalita je 0–1,9 % [36]. Efekt léčby je nižší u makroadenomů (31–83 %) a invazivně rostoucích adenomů (22–65 %). Indikováno je dlouhodobé sledování pacientů po operaci, protože medián doby od operace k recidivě je 2,3–7,2 let. Pooperační hypopituitarizmus se vyskytuje u méně než 20 % pacientů, permanentní diabetes insipidus u 3–9 % pacientů [36]. Ve vzácných případech lze též provést neselektivní hypofysektomii.
V případě nedostatečného efektu operace je možné indikovat časnou reoperaci. Další alternativou je radiochirurgický výkon, farmakologická terapie a kombinace těchto možností. Radiochirurgické ozáření sedla pro nadprodukci ACTH dosahuje remise onemocnění v 63–73 % případů, recidivy se vyskytují v 11 % [37]. Radiochirurgický výkon je obvykle indikován u pacientů, u kterých operace nedosáhla dostatečného efektu. Nejedná se o primární léčebnou alternativu, často se kombinuje s farmakologickou léčbou po dobu, než nastoupí efekt ozařování.
K farmakologické léčbě se používají inhibitory steroidogeneze (metyrapon, ketokonazol), neuromodulační léky (např. dopaminoví agonisté, somatostatinová analoga) nebo antagonista glukokortikoidních receptorů mifepriston. Farmakologická léčba Cushingovy nemoci však zdaleka nedosahuje účinnosti farmakologické léčby, např. prolaktinomů. Je indikována pouze jako léčba adjuvantní při selhání jiných postupů.
Jen v případě jinak neřešitelného Cushingova syndromu lze zvážit provedení bilaterální adrenalektomie. Adrenalektomie se prováděla od 50. let minulého století. Vzhledem k tomu, že riziko rozvoje Nelsonova syndromu je 25–30 %, indikuje se tato operace nyní jen zcela výjimečně [38].
Adenomy produkující TSH
Představují méně než 1 % adenomů hypofýzy, mohou způsobovat hypertyreózu. U části pacientů však mohou být dlouhou dobu klinicky němé [39]. Velmi často tyto adenomy rostou invazivně. Chirurgická léčba je indikovaná, často doplněná o radiochirurgické ozáření. Tyreostatika se používají k iniciální normalizaci funkce štítné žlázy, ale jejich dlouhodobé podávání je méně vhodné pro riziko zvýšení sekrece TSH. Část pacientů příznivě reaguje na podávání superaktivních analog somatostatinu.
Afunkční adenomy hypofýzy
Tento termín reflektuje fakt, že tyto adenomy nezpůsobují klinicky významnou hormonální nadprodukci, a tím nevytvářejí hypersekreční syndromy. Histologické studie přesto prokazují expresi hormonů až ve 40 % případů [40]. Imunohistochemické vyšetření ve většině případů prokáže výskyt gonadotropinů. Tyto adenomy představují až 80 % klinicky afunkčních adenomů hypofýzy. „Null cell“ adenomy jsou adenomy bez průkazu klinické a imunohistochemické hormonální produkce. Vyskytují se u starších pacientů, velmi často rostou supraselárně a do kavernózních splavů.
Klinická symptomatologie je nejčastěji způsobena expanzivním chováním adenomu hypofýzy. Především tlak adenomu na adenohypofýzu může vést k hypopituitarizmu. Nejdříve je poškozena gonadotropní osa, později osa růstového hormonu a teprve naposled TSH a ACTH produkce. Hypogonadizmus způsobuje amenoreu, hypogonadizmus, snížení libida. Hypokortikalizmus a hypotyroidizmus může vést k depresím, zvýšené únavnosti a mentálnímu postižení. Tyto příznaky se obvykle projevují plíživě. Pokud však nejsou včas rozpoznány a léčeny, mohou vyústit v život ohrožující hypopituitární krizi. Afunkční adenomy mohou také způsobit zvýšení hladiny prolaktinu. To je důsledkem tlaku adenomu na stopku hypofýzy, které způsobí snížení inhibice tvorby prolaktinu sníženým přísunem dopaminu (tzv. fenomén stopky, pseudoprolaktinom). Supraselární růst adenomu nejprve vytváří horní temporální kvadrantopsii, později bitemporální hemianopsii. Růst adenomu do kavernózních splavů může vzácně vést k lézi okohybných nervů a vláken sympatiku v kavernózním splavu. Při dalším růstu může adenom způsobovat příznaky spojené s tlakem na frontální nebo temporální lalok, případně může vytvářet hydrocefalus.
U pacientů se selární lézí je vždy zcela zásadní endokrinologické vyšetření. Je nutné prokázat, zda se jedná o afunkční lézi a vyšetřit, zda pacient nemá již předoperačně hypopituitarizmus. Neurooftalmologické vyšetření je též zcela nezbytné. Dále je indikováno MR vyšetření na přístroji s vyšší sílou magnetického pole. CT je ještě na některých pracovištích prováděno jako skríningové vyšetření. Pokud však není MR vyšetření kontraindikováno, je vždy nutné je předoperačně doplnit. MR přesně odhalí rozsah selární léze, případnou invazi kavernózních splavů, paraselární růst, směr a typ supraselárního růstu atd. MR je též zásadní pro diferenciální diagnostiku selárních lézí.
U naprosté většiny symptomatických afunkčních adenomů hypofýzy je indikována transsfenoidální resekce. U asymptomatických lézí závisí terapeutický postup na velikosti léze, věku pacienta a míře jistoty, zda se jedná o adenom hypofýzy dle MR. Dle těchto faktorů je poté rozhodnuto, zda je indikována transsfenoidální operace nebo je doporučena iniciální observace. Další postup se v tomto případě řídí dynamikou nálezů na MR. Transkraniální resekce jako primární léčebná modalita se používá zcela ojediněle. Jinou možností je radiochirurgické ozáření selární léze. Ozáření není indikováno jako primární léčebný postup. Je vyhrazeno pro recidivy adenomu hypofýzy, pokud není indikována reoperace, nebo pro pacienty s vysokým rizikem výkonu v celkové anestezii. I po úspěšné primární operaci je nutné dlouhodobé sledování pacienta, protože v 10–20 % případů dochází během 5–6 let k rozvoji recidivy adenomu hypofýzy [41]. Z těchto důvodů některá centra indikují radiochirurgické ozáření ihned při nálezu rezidua adenomu hypofýzy. Vzhledem k faktu, že část reziduálních adenomů hypofýzy, zejména u starších pacientů, neroste vůbec nebo minimálně [42] a že i ozáření přináší pacientovi rizika (byť velmi nízká), doporučuje naše pracoviště ozáření v případě prokázaného růstu reziduálního adenomu. Pravidelné kontroly dle MR doporučujeme indiciálně tři měsíce po operaci, poté po 6–12 měsících a následně po dvou letech.
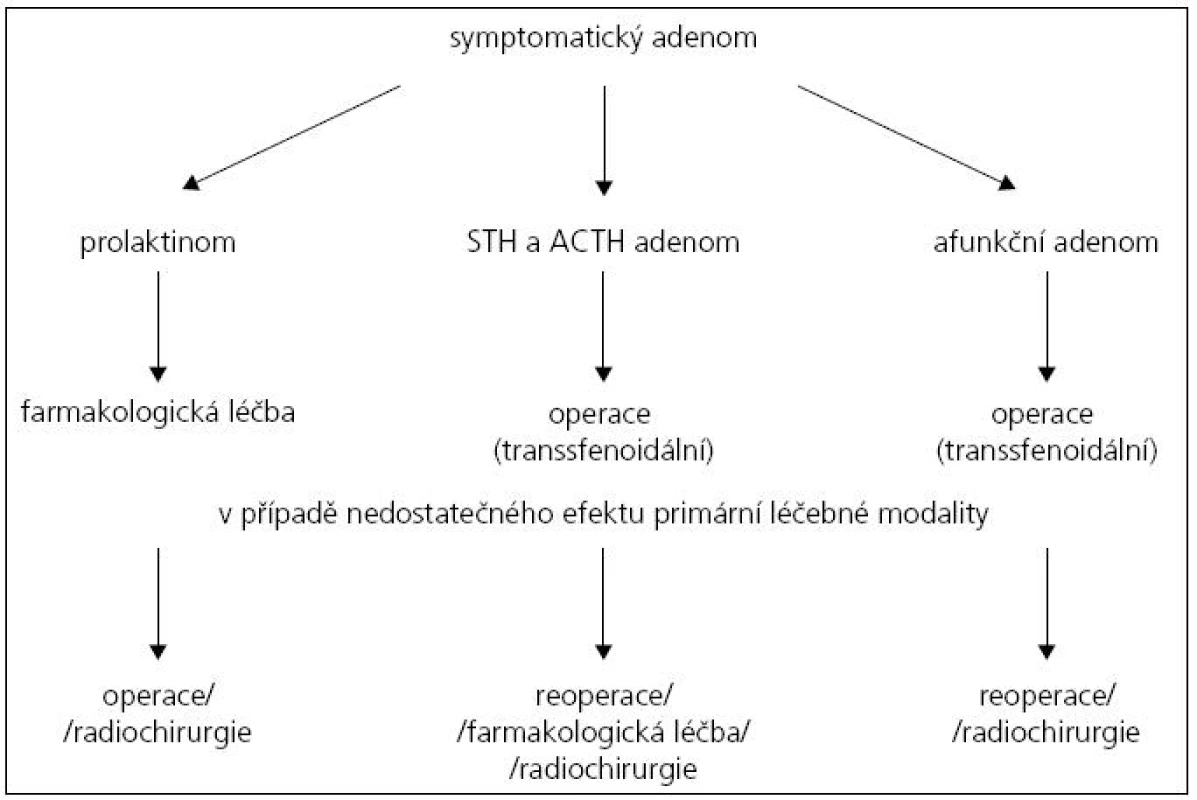
Výrazně zjednodušený terapeutický algoritmus u symptomatických adenomů hypofýzy je uveden na obr. 1.
Karcinomy hypofýzy
Karcinomy hypofýzy jsou extrémně vzácné a jsou definovány výskytem metastáz nebo diseminací v mozkomíšním moku [43]. Publikováno bylo pouze přes 100 případů karcinomů hypofýzy [44]. Terapie je paliativní, kombinuje se chirurgická cytoredukce, korigují se endokrinologické abnormality a indikována je radioterapie. Lze zvážit podání chemoterapie včetně biologické léčby.
Nádor z granulárních buněk hypofýzy
Jedná se zřejmě o nezhoubný nádor z gliálního elementu neurohypofýzy – pituicytů. U symptomatických lézí je indikován chirurgický výkon, pooperační ozařování není nutné [2].
Lymfocytární hypofyzitida
Lymfocytární hypofyzitida představuje autoimunitní zánětlivé onemocnění, které způsobuje hypopituitarizmus různého stupně. Vzhledem k možnosti postižení stopky (infundibulohypofyzitida) může způsobovat diabetes insipidus. Mezi další příznaky patří bolest hlavy a příznaky z útlaku okolních struktur. Vyskytuje se častěji u mladších žen. Toto onemocnění v iniciální fázi způsobuje symetrické zvětšení hypofýzy a difuzní sycení stopky hypofýzy a bazální části hypothalamu po podání kontrastní látky. Léčba spočívá v hormonální substituci, podávání glukokortikoidů a imunosupresivní medikaci. V nejasných případech může být indikována biopsie. Dále jsou popsány granulomatózní a xantomatózní hypofyzitidy. Sekundární hypofyzitidy jsou projevem systémového zánětlivého nebo infekčního onemocnění (nejčastěji sarkoidóza, Wegenerova granulomatoza, histiocytóza Langerhansových buněk).
Pituitární apoplexie
Tento jev je charakterizován náhlým vznikem klinické symptomatologie způsobené krvácením do hypofýzy. Mezi nejčastější příznaky patří bolest hlavy (89 % pacientů), nauzea/zvracení (57 %), porucha zraku (50 %) a léze okohybných nervů (46 %). Zřejmě jako první popsal krvácení do hypofýzy P. Bailey v roce 1898 [46]. Diagnóza je ztížena faktem, že jen u 17 % pacientů je známo, že pacient má adenom hypofýzy [47]. Klinický obraz může připomínat subarachnoidální krvácení. Proto je velmi často jako iniciální vyšetření provedeno CT. To může prokázat selární lézi, případně známky krvácení do selární léze. Následně je indikováno doplnění MR, které diagnózu potvrdí, určí rozsah selární léze a rozsah krvácení. Krvácení je nejlépe zobrazeno na T1 vážených obrazech jako oblast vysokého signálu v selární lézi. Obraz na MR však významně závisí na době mezi krvácením a provedením MR. Po stanovení diagnózy je indikováno podání kortikoidů vzhledem k riziku rozvoje akutního hypokortikalizmu. Při poruše zraku je indikována akutní chirurgická revize sedla, evakuace hematomu a resekce adenomu hypofýzy.
Management incidentalomů
Náhodně nalezené adenomy hypofýzy lze charakterizovat jako onemocnění rozvoje zobrazovacích technik. První nálezy zcela asymptomatických adenomů hypofýzy byly popsány po rutinním zavedení CT do klinické praxe v 80. letech minulého století [48]. Teprve však MR přineslo významné zvýšení detekce těchto lézí. V MR sériích je mikroadenom nalezen až v 10 % případů [49]. Při náhodném nálezu selární léze je nejprve nutné zvážit míru jistoty odlišení adenomu hypofýzy od jiné selární léze – viz diferenciální diagnostika. K dispozici jsou jen relativně omezená data o přirozeném průběhu afunkčních incidentálních adenomů hypofýzy. Oyama et al publikovali studii, která sledovala léčbu incidentálních adenomů v Japonsku [50]. Tato studie zahrnovala 550 incidentalomů. Celkem 47 % z nich bylo indikováno k operaci pro jejich supraselární růst, průměr adenomů 25 mm. Ostatní incidentalomy byly sledovány, průměrný rozměr 13 mm. Během dvouletého sledování byl prokázán růst u 22 % adenomů. Afunkční mikroincidentalomy jsou jednoznačně indikovány k observaci. Postup u afunkčních makroincidentalomů závisí na jejich velikosti, případném kontaktu s chiazmatem, věku a přání pacienta.
Chirurgické techniky
Trassfenoidální přístup
První transsfenoidální operaci provedl v roce 1907 H. Schloffer a použil k tomu paranazální řez [51]. H. Cushing provedl první transsfenoidální operaci tímto přístupem v roce 1909. V roce 1910 opustil paranazální řez a začal používat řez sublabiální, který navrhli A. E. Halstead a T. Kocher [52]. Tímto byl položen základ pro budoucí chirurgickou léčbu adenomů hypofýzy. H. Cushing však transsfenoidální přístup v roce 1925 opustil ve prospěch přístupu transkraniálního. Sublabiální transsfenoidální přístup nebyl zapomenut zejména díky N. Dottovi a G. Guiotovi. G. Guiot zavedl použití intraoperační flouroskopie, přesto až do 60. let minulého století dominuje transkraniální přístup. Zásadní zlom nastal až zásluhou J. Hardyho, který do pituitární chirurgie zavedl operační mikroskop. Následně došlo k celosvětové renezanci tohoto přístupu, která proběhla v 70. letech [53]. V bývalém Československu lze za průkopníka transnazální techniky považovat A. Přecechtěla, jenž tento přístup použil v roce 1922. O rok později ho následoval O. Kutwirt. K reálnému rozvoji transsfenoidální operativy v bývalém Československu došlo v 70. letech minulého století, a to v Hradci Králové, kde tuto operativu zavedl R. Petr [54], a v Ústřední vojenské nemocnici v Praze. Zde první transsfenoidální operaci provedl E. Černý. Později se touto problematikou zabýval zejména I. Fusek [55,56].
Sublabiální transsfenoidální přístup
Při sublabiálním přístupu je prováděn řez pod horním rtem nad řezáky, následně se submukózně získá přístup do nosní dutiny. Submukózně je vytvořen středočárový přístup, chrupavčitá část nosního septa je odtlačena stranou, následně je odstraněna část vomeru a otevřena sfenoidální dutina. K udržení chirurgického přístupu je používáno spekulum. Tento tradiční přístup se již ve velké míře opouští vzhledem k výskytu poruchy citlivosti v místě přístupu z dutiny ústní do dutiny nosní, poškození sliznice v této oblasti a nutnosti aplikace relativně extenzivní nosní tamponády do obou nosních průchodů.
Transnazální-transseptální transsfenoidální přístup
Tento přístup popsal v roce 1910 O. Hirsch [57]. Při něm je incize provedena v místě mukózy na nosní přepážce. Je vytvořen submukózní přístup ke chrupavčité části nosního septa a poté je pokračováno směrem ke sfenoidální dutině. V hloubi je odstraněna část septa a je vytvořen oboustranný submukózní přístup. Nevýhoda tohoto přístupu je opět nutnost nosní tamponády a riziko vzniku perforace v přední části nosního septa.
Přímý transnazální transsfenoidální přístup
Tento přístup popsali H. B. Griffith a R. Veerapen v roce 1987 [58]. Při tomto přístupu se provádí řez ve sliznici nosní nad rostrum sphenoidale, poté je otevřen sfenoidální sinus z jedné strany. Následně je uvolněna zadní část septa a lateralizována (obvykle doleva). Pak je provedeno otevření druhostranné části sfenoidální dutiny.
Endoskopický endonazální přístup
Endoskopická technika chirurgie vedlejších dutin nosních vznikla v 80. letech minulého století v Evropě [59]. Tato technika se stala rutinní technikou v ORL komunitě. První zmínka o endoskopické endonazální resekci adenomu hypofýzy bez použití mikroskopu pochází z roku 1992 [60]. Sethi et al publikovali techniku endoskopické resekce adenomů hypofýzy transseptálním přístupem za použití endonazálního retraktoru [61]. V roce 1996 Carrau et al prezentovali svoji techniku přímé endoskopické endonazální resekce adenomů hypofýzy [62,63]. Binostrální endoskopickou techniku jako první popsali Rodziewicz et al v roce 1996 [64].
V roce 1998 Cappabianca et al prezentovali zkušenosti a první výsledky s endoskopickou technikou resekce adenomů hypofýzy [65]. Z tohoto krátkého výčtu je zřejmé, že se jedná o techniku stále ještě relativně novou. Na našem pracovišti jsme tuto techniku zavedli v roce 2006 [66]. Sami jsme se tuto techniku naučili od kolegů z Neapole (Itálie) a Pittsburku (USA).
Při použití této techniky není nutný řez ve sliznici přední části septa, přímo je otevřena sfenoidální dutina, obvykle rozšířením sfenoidálního ostia. Některé skupiny provádějí uninostrální přístup. Tento přístup je velmi šetrný ve vztahu k zadní části septa a druhé nostrile. Dle našeho názoru však neumožňuje dostatečný manévrovací prostor. Při této technice se získá dostatek prostoru pro jeden nástroj a endoskop, nikoliv pro nástroje dva a endoskop. Z tohoto důvodu doporučujeme ve shodě s dalšími autory binostrální přístup [67–69]. Tato technika umožní zcela volný pohyb minimálně pro dva pracovní nástroje a endoskop, ve speciálních případech je možno použít nástroje i tři. Při rozsáhlejších výkonech v oblasti baze lební Kassam et al resekují jednu střední konchu a druhou lateralizují [67–69].
Takto lze získat ještě větší rozsah pohybů, který je nutný při operacích tumorů v oblasti přední jámy lební, kavernózního splavu a klivu. Na našem pracovišti tuto techniku používáme od roku 2008. Je sice při ní vyšší výskyt nazální morbidity, avšak ta je ve většině případů pouze přechodná [70] a nesnižuje významně kvalitu života při dlouhodobém hodnocení [71].
Výhodou endoskopické techniky je lepší obraz tureckého sedla a přilehlých struktur. Při použití 30st endoskopu je rozsah pohledu neporovnatelný s obrazem mikroskopickým. Nevýhodou je, že současné endoskopy umožňují 2D obraz na rozdíl od 3D obrazu v mikroskopu. Tuto nevýhodu lze eliminovat střídáním poloh endoskopu, které ve vztahu s nástroji umožní operatérovi získat představu o třetím rozměru obrazu („virtuální 3D obraz v hlavě operatéra“). Nevýhodou je učební křivka u neurochirurgů, kteří nejsou vyškoleni v endonazální endoskopické chirurgii. To lze jednak překonat výukou na kadaverech, jednak zahraničními stážemi, případně lze do operačního týmu angažovat ORL lékaře, který má zkušenosti s endoskopickou technikou vedlejších dutin nosních. Zcela zásadní význam při operacích selárních lézí jak klasickou, tak endoskopickou technikou má počet operací prováděných daným týmem (tzv. volume dependent outcome). Za minimální počet operací na operatéra je považováno 30/rok.
Endoskopickou techniku z naší vlastní zkušenosti považujeme za přínosnou a lepší v porovnání s přístupem mikrochirurgickým. Nelze však tvrdit, že technika starší (použití mikroskopu) je zastaralá. Některá zahraniční pracoviště tento přístup stále doporučují [72–75]. Z českých autorů je vhodné ocenit práce Náhlovského et al, kteří analyzovali rizika transsfenoidálních výkonů při použití mikrochirurgické techniky [76], a Sameše et al, kteří prezentovali výsledky přímého endonazálního přístupu mikrochirurgickou technikou [77]. V posledních letech se však endoskopická technika stává stále populárnější.
Rozšířený endoskopický endonazální přístup
Endoskopická technika umožňuje rozšířit přístup mimo sfenoidální dutinu odstraněním tubercullum sellae, planum sphenoidale, otevřením předních a zadních etmoidů. Dále je možné snést část klivu. Tento přístup byl popularizován díky neurochirurgům z Pittsburku, USA [67–69,78], Neapole, Itálie [79], a Los Angeles, USA [80]. U adenomů hypofýzy se však tento přístup používá relativně méně často, obvykle u gigantických adenomů se subfrotálním růstem a u vícelaločnatých adenomů.
Transkraniální přístupy
Transkraniální přístupy k adenomům hypofýzy se v dnešní době používají vzácně. Na našem pracovišti v poměru 1 : 100 oproti transsfenoidálním endoskopickým přístupům. Transkraniální přístup je vhodný zejména pro adenomy s paraselárním růstem a pro adenomy extrémně tuhé, které nelze adekvátně odstranit transsfenoidálně. V naší současné praxi volíme transkraniální přístup prakticky vždy jen jako přístup sekundární.
Všechny základní transkraniální přístupy k selární krajině byly popsány do roku 1914. V. Horsley popsal v roce 1906 přístup subtemporální [81], F. Krause v roce 1914 přístup subfrontální [82], L. L. McArthur [83] a C. H. Frazier [84] přístup extradurální. G. J. Heuer používal přístup frontotemporální od roku 1913, literárně jej však zveřejnil až v roce 1920 [85].
Unilaterální subfrontální přístup
Pravostranný unilaterální subfrontální přístup je stále nejčastěji používaný transkraniální přístup k adenomům hypofýzy. Při tomto přístupu po částečném vypuštění mozkomíšního moku (pomocí lumbální drenáže nebo z intrakraniálního subarachnoidálního prostoru) je mírně elevován frontální lalok, jsou identifikovány optické nervy, chiazma, vnitřní krkavice a následně je postupně odstraňován adenom hypofýzy. Pokud adenom roste do III. komory, je možné nádor odstranit též penetrací lamina terminalis.
Frontolaterální přístup/pterionální přístup
Pokud má adenom zjevnou paraselární část, je vhodné zvážit provedení frontolaterálního/pterionálního přístupu. Po otevření dury je otevřena Sylviova rýha, vypuštěn mok, temporální lalok a frontální lalok jsou mírně elevovány, odhalen je ipsilaterální optický nerv a krkavice.
Transventrikulární přístup
Tento přístup, který lze provést transkortikálně nebo transkalózně, je indikován ve zcela výjimečných situacích, kdy nádor vyplňuje třetí komoru a eventuálně se propaguje až do komor postranních.
Použití intraoperační MR (iMR) při operacích selárních lézí
Intraoperační zobrazení během neurochirurgických výkonů se v posledních deseti letech postupně dostává do širší praxe. Původní systémy pro iMR (např. double donut systems) byly nahrazeny dvěma základními systémy. Jeden směr vývoje představují co nejmenší a nejvíce mobilní MR přístroje. Tyto přístroje mají zásadní nevýhodu v tom, že používají magnetické pole pouze o síle 0,15–0,2 T [86,87]. Zobrazení v T1 vážení je však obvykle dostatečně kvalitní (nejlepší obraz je ve středu snímaného pole). Kvalita T2 vážených obrazů je ovšem nedostatečná. Výhodou těchto systémů je jejich nižší cena a větší mobilita. Druhým směrem vývoje jsou stacionárních MR přístroje o vyšší síle (dnes již 1,5 T nebo 3,0 T) [88–90]. Nevýhodou těchto systémů je jejich vyšší cena, výhodou lepší intraoperační zobrazení. iMR umožňuje zobrazit rozsah neurochirurgického výkonu během operace a dle intraoperačních nálezů se může operatér rozhodnout, zda bylo dosaženo chirurgického cíle, nebo je vhodné v operačním výkonu pokračovat. Za zásadní považujeme fakt, zda iMR ovlivní rozsah chirurgického výkonu, nebo rozsah výkonu pouze potvrdí. Jedna z nejstarších prací na toto téma pochází od autorů Martin et al [91]. Ti již v roce 1999 prezentovali zkušenosti u pěti pacientů s adenomem hypofýzy, u kterých byla provedena iMR (síla pole 0,5 T). U dvou pacientů byl operatér přesvědčen o radikalitě výkonu, ale iMR odhalila reziduum adenomu, které bylo následně doresekováno.
Nimsky et al hodnotili výsledky 200 operací s použitím iMR (síla magnetického pole 1,5 T) [92]. Většina výkonů byla realizována u pacientů s gliomy nebo adenomy hypofýzy. V daném souboru u adenomů hypofýzy byl rozsah výkonu ovlivněn u 39 % pacientů. iMR prokázala, že radikální resekce byla provedena v 56,2 % případů. Po iMR a následné resekci rezidua adenomu hypofýzy bylo dosaženo radikálního výkonu u 87,5 % pacientů.
Stejná skupina autorů hodnotila výsledky transsfenoidálních operací s použitím iMR u pacientů s naprodukcí růstového hormonu [93]. Hodnoceno bylo 33 pacientů. U pěti pacientů vedla iMR k další resekci rezidua adenomu hypofýzy. U tří pacientů nejen bylo dosaženo radikality výkonu dle MR, ale došlo též k endokrinologické normalizaci. Radikální resekce byla plánována celkem u 18 pacientů. Další resekce dle iMR zvýšila endokrinologickou normalizaci z 33 na 44 % pacientů, u jiných dvou bylo dosaženo „téměř úplné normalizace“. Nimsky et al hodnotili výsledky u hormonálně afunkčních adenomů hypofýzy [94]. Soubor tvořilo 106 pacientů. U 85 % pacientů byla plánována radikální resekce. iMR odhalilo reziduum adenomu u 36 pacientů (42 %). V resekci se pokračovalo v 29 případech (34 % z celkového souboru pacientů, kde byla plánována radikální resekce). U 21 pacientů z výše uvedených 29 pacientů bylo dosaženo resekce radikální. Díky resekci po iMR byla zvýšena radikalita operačního výkonu z 58 na 82 %. Ve skupině pacientů, ve které byla plánována parciální resekce (21 pacientů), byl rozsah resekce modifikován dle iMR u osmi pacientů (38 %).
Jones et al prezentovali soubor transsfenoidálních operací s pomocí iMR se zaměřením na oftalmologické výsledky [95]. Hodnotili pouze pacienty s makroadenomy hypofýzy s poruchou zraku. Zaměřili se zejména na fakt, zda pokračování v resekci po iMR nepřiměje operatéra k radikálnějšímu výkonu, který by mohl poškodit (již kompromitovaný) zrak pacienta. U osmi pacientů iMR ovlivnila rozsah výkonu. Ani u jednoho pacienta nedošlo k pooperačnímu zhoršení zraku. Naše vlastní zkušenosti jednoznačně prokazují efekt iMR u operací v selární krajině [96,97]. Z těchto důvodů považujeme použití iMR při operacích selárních lézí za plně indikované. Obecně lze říci, že u nemocných, kde plánujeme radikální resekci, iMR zvyšuje úspěšnost a radikalitu operace o 20 %. Obr. 2–4 ilustrují využití iMR u pacientky, u které bylo cílem MR radikální odstranění adenomu hypofýzy. Na obr. 5–7 jsou MR nálezy pacienta, kde cílem bylo subtotální odstranění afunkčního adenomu s ponecháním rezidua v kavernózním splavu.






Sterotaktické ozáření adenomů hypofýzy
Tato léčba je excelentní léčebná modalita u pacientů, u kterých operační léčba nedosáhla dostatečného efektu (např. snížení hormonální nadprodukce), nebo je prokázán růst reziduální části adenomu. Pokud je ozáření reziduálního či recidivujícího adenomu indikované, tak v naprosté většině se zákrok provádí na Leksellově gama noži. Další možností je stereotaktické ozáření na lineárním urychlovači. Frakciované ozáření je indikováno zcela ojediněle, a to jen u rozsáhlých chirurgicky neřešitelných adenomů hypofýzy.
Efekt radiochirurgického ozáření
Zástavy růstu afunkčních adenomů je dosaženo v 92–100 % případů při délce sledování 2–4 roky [98]. Okrajová dávka záření je v jednotlivých studiích mezi 14 a 25 Gy. Stále není uzavřena diskuze o tom, zda je vhodné ozařovat reziduum adenomu před prokázáním jeho růstu nebo až při průkazu růstu. Naše pracoviště se kloní k druhému postupu. R. Liščák et al prezentovali zcela vynikající výsledky v této oblasti: u žádného pacienta nezaznamenali růst adenomu po ozáření a u 89 % pacientů zaznamenali zmenšení velikosti adenomu, medián zmenšení adenomů 61 % [99].
ACTH produkující adenomy patří mezi radiosenzitivní adenomy. Četnost endokrinologické normalizace je závislá na ozařovací dávce (okrajová dávka 15–34 Gy) a délce sledování. V publikovaných sériích je tohoto efektu dosaženo nejčastěji v 60–70 % případů [98]. U Cushingovy nemoci se v jednotlivých studiích používá okrajová dávka 15–32 Gy. Endokrinologické normalizace je dosaženo obvykle v 60–80 % případů [98]. U prolaktinomů je ozařování indikováno v případě nedostatečného farmakologického efektu a selhání chirurgické léčby farmakorezistentních prolaktinomů. Efekt je mírně nižší než u jiných adenomů, obvykle v 50 % případů [98]. Dle autorů Ježková et al je dosaženo normalizace hladiny prolaktinu u 37,1 % pacientů, kteří přerušili léčbu dopaminovými agonisty a u 42,9 % pacientů, kteří pokračovali v léčbě dopaminovými agonisty [100]. Autoři J. Marek et al zaznamenali rozvoj hypopituitarizmu po ozáření dávkou < 15 Gy pouze v 2,2 % případů [101]. Dle P. J. Sheehana et al dochází k poruše zraku u 0,5–1% pacientů, k lézi okohybných nervů v 0,5 % případů. Rozvoj radionekrózy je zcela ojedinělý. Zvýšení rizika vzniku sekundárních tumorů po stereotaktickém ozáření lézí v tureckém sedle nebylo prokázáno [98].
Závěr
Léčba pacientů s adenomy hypofýzy vyžaduje spolupráci endokrinologa, neurochirurga a radiochirurga. Cílem léčby adenomů hypofýzy je taková kontrola nádoru, aby nemocný žil svůj normální život normální délky, pokud možno bez nutnosti hormonální substituce a bez poruchy zraku. Pituitární chirurgie představuje složitý, ale optimistický úsek neurochirurgie, u něhož určitě lze očekávat nejen značný chirurgický rozvoj, ale i další rozvoj medikamentózní léčby.
doc.
MUDr. David Netuka, Ph.D.
Neurochirurgická
klinika
1.
LF UK, IPVZ a ÚVN
U
Vojenské nemocnice 1200
169
02 Praha 6
e-mail:
david.netuka@uvn.cz
Přijato
k recenzi: 1. 3. 2011
Přijato
do tisku: 3. 5. 2011
Recenzenti:
doc.
MUDr. Roman Liščák, CSc.
doc.
MUDr. Jiří Náhlovský, CSc.
doc.
MUDr. Martin Sameš, CSc.
Poděkování náleží kolegům z III. interní kliniky 1. LF UK a VFN v Praze za neocenitelnou péči o naše společné pacienty, zejména prof. MUDr. Josefu Markovi, DrSc., prof. MUDr. Václavu Hánovi, CSc., a prof. MUDr. Michaelu Krškovi, CSc. Dále děkujeme doc. MUDr. Romanu Liščákovi, CSc., za spolupráci při indikování a provádění radiochirurgické léčby selárních lézí.
doc. MUDr. David Netuka, Ph.D.
David Netuka studoval v letech 1994–2000 na 1. LF UK v Praze (obor lékařství). Od roku 2000 působí na Neurochirurgické klinice 1. LF UK, IPVZ a ÚVN Praha, od roku 2009 jako vedoucí lékař. V letech 2000–2005 úspěšně absolvoval doktorské studium v oboru Neurovědy na 1. LF UK (téma: Stenóza vnitřní krkavice – morfologická korelace digitální subtrakční angiografie a dopplerovské ultrasonografie s nálezy na histologicky zpracovaných aterosklerotických plátech, školitel: prof. MUDr. Vladimír Beneš, DrSc.). Atestoval v roce 2003 z neurologie, v roce 2007 složil atestaci z neurochirurgie. Na podzim 2010 obhájil habilitační práci na téma Stenózy cév zásobujících mozek. Přednáší na 1. LF UK v Praze od roku 2005. Opakovaně absolvoval stáže v USA, Německu, Itálii a Švýcarsku. Jako spoluřešitel získal cenu ministra zdravotnictví za grant IGA MZ ČR (2005), dále cenu ESBS pro mladého specialistu v oblasti chirurgie baze lební (2007). Přednáší na evropských kurzech neurochirurgie, dále je členem výboru mladých neurochirurgů EANS. Je členem České a Slovenské neurochirurgické společnosti a individuálním členem EANS. Je autorem nebo spoluautorem více než 30 článků publikovaných v časopisech s IF. Od roku 2006 se zaměřuje na problematiku tumorů selární krajiny. V současné době se též věnuje neuroonkologické operativě, operativě extrakraniálních tepen a aplikaci intraoperační MR v neurochirurgii.
Vědomostní test
1. Adenomy hypofýzy jsou histologicky:
- a) maligní
- b) semimaligní
- c) zcela heterogenní skupinou, u které se stejně často vyskytují benigní i maligní formy adenomů hypofýzy
- d) v naprosté většině případů benigní
2. U pacienta/ky se selární lézí je endokrinologické vyšetření indikováno:
- a) pokud je mladší 35 let
- b) vždy
- c) pokud předpokládáme, že se jedná o adenom hypofýzy
- d) pokud předpokládáme, že se jedná o adenom hypofýzy nebo kraniofaryngeom
3. V selární krajině se může mimo adenomu hypofýzy a kraniofaryngeomu vyskytovat:
- a) cysta Rathkeho výchlipky
- b) aneuryzma
- c) meningeom
- d) všechny uvedené patologie
4. Základní léčebnou modalitou u prolaktinomů je:
- a) farmakologická léčba dopaminovými agonisty
- b) chirurgická léčba
- c) radiochirurgická léčba
- d) farmakologická léčba somatostatiny
5. K monitoraci efektu léčby u pacienta s STH produkujícím adenomem se používá zejména:
- a) hladina ACTH
- b) hladina glykemie
- c) hladina IGF-I, kterou je nutné mimo jiné vztáhnout k věku a pohlaví pacienta
- d) hladina IGF-I, která je nezávislá na věku pacienta
6. Mezi typické příznaky Cushingovy nemoci nepatří:
- a) trunkální obezita
- b) diabetes mellitus
- c) hyperlipidemie
- d) nadměrný růst
7. Pituitární apoplexie se neprojevuje:
- a) poruchou sluchu
- b) bolestí hlavy
- c) poruchou zraku
- d) zvracením
8. Afunkční mikroadenom je indikován k:
- a) transsfenoidální resekci
- b) observaci
- c) radiochirurgickému ozáření
- d) transkraniální resekci
9. Růst incidentálního makroadenomu během dvou let se vyskytuje přibližně v:
- a) 20 % případů
- b) 1 % případů
- c) 50 % případů
- d) 80 % případů
10. První transsfenoidální operaci provedl:
- a) H. Cushing
- b) H. Schloffer
- c) J. Hardy
- d) N. Dott
11. Použití iMR u operací lézí v selární krajině
- a) je kontraindikováno
- b) neovlivňuje výsledek operace
- c) dle dostupných dat zvyšuje radikalitu operací
- d) zvyšuje chirurgická rizika
12. Endoskopická technika endonazálních operací:
- a) je opuštěna ve prospěch výkonů mikroskopických
- b) umožňuje lepší intraoperační zobrazení selární krajiny oproti technice mikroskopické
- c) se rutinně používá od 50. let
- d) nemá význam vzhledem k přechodu na transkraniální operace
13. K transkraniální resekci adenomu hypofýzy se nepoužívá přístup:
- a) unilaterální subfrontální
- b) frontolaterální
- c) retromastoidální
- d) transventrikulární
14. Porucha zraku po radiochirurgickém ozáření se:
- a) vyskytuje u 40 % pacientů
- b) vyskytuje u cca 0,5–1 % pacientů
- c) nevyskytuje nikdy
- d) vyskytuje u 10 % pacientů
15. K farmakologické normalizaci po operaci mikroadenomu hypofýzy secernujícího STH je dosaženo přibližně u:
- a) 80 % pacientů
- b) 99 % pacientů
- c) 20 % pacientů
- d) 5 % pacientů
16. Primární léčebnou modalitou u Cushingovy nemoci je:
- a) transsfenoidální operace
- b) transkraniální operace
- c) radiochirurgické ozáření
- d) farmakologická léčba
17. Mezi typické příznaky nadprodukce prolaktinu u žen nepatří:
- a) galaktorea
- b) infertilita
- c) gynekomastie
- d) porucha čichu
18. Léze zadního laloku hypofýzy se projevuje:
- a) sníženou sekrecí ACTH
- b) zvýšenou sekrecí STH
- c) sníženou sekrecí prolaktinu
- d) diabetem insipidem
19. Při léčbě lymfocytární hypofyzitidy není indikováno:
- a) hormonální substituce
- b) podávání glukokortikoidů
- c) transkraniální operace
- d) imunosupresivní medikace
20. Při nejistotě, zda pacient trpí Cushingovou chorobou, se k upřesnění nálezů neprovádí:
- a) dynamická MR
- b) panangiografie
- c) katetrizace dolních petrózních splavů
- d) stimulace sekrece ACTH kortikotropinem
Správně je jedna odpověď.
Za správné vyřešení testu získá řešitel 5 kreditů ČLK. Test můžete vyplnit na:
Sources
1. Ezzat S, Asa SL, Couldwell WT, Barr CE, Dodge WE, Vance ML et al. The prevalence of pituitary adenomas: a systematic review. Cancer 2004; 101(3): 613–619.
2. Česák T, Náhlovský J, Látr I, Čáp J, Ryška P. Nádorová onemocnění hypofýzy. In: Náhlovský J (ed). Neurochirurgie. Praha: Galén 2006: 155–174.
3. Knosp E, Steiner E, Kitz K, Matula C. Pituitary adenomas with invasion of the cavernous sinus space. A magnetic resonance imaging classification compared with surgical findings. Neurosurgery 1993; 33(4): 610–617.
4. Edal AL, Skjodt K, Nepper-Rasmussen HJ. SIPAP – a new MR classification for pituitary adenomas. Acta Radiologica 1997; 38(1): 30–36.
5. Ciccarelli A, Daly AF, Beckers A. The epidemiology of prolactinomas. Pituitary 2005; 8(1): 3–6.
6. Mindermann T, Wilson CB. Age-related and gender-related occurrence of pituitary adenomas. Clin Endocrinol (Oxf) 1994; 41(3): 359–364.
7. Touraine P, Plu-Bureau G, Beji C, Maivais-Jarvis P, Kuttenn F. Long-term follow-up of 246 hyperprolactinemic patients. Acta Obstet Gynecol Scand 2001; 80(2): 162–168.
8. Colao A, Vitale G, Cappabianca P. Outcome of carbegoline treatment in men with prolactinoma: effects of a 24-month treatment on prolacin levels, tumor mass, recovery of pituitary function and semen analysis. J Clin Endocrinol Metab 2004; 89(4): 1704–1711.
9. Fleseriu M, Lee M, Pineyro MM, Skugor M, Reddy SK, Siraj ES et al. Giant invasive pituitary prolactinoma with falsely low serum prolactin: the significance of ‘hook effect’. J Neurooncol 2006; 79(1): 41–43.
10. Webster J, Piscitelli G, Polli A, Ferrari CI, Ismail I, Scanlon MF. A comparison of cabergoline and bromcriptine in the treatment of hyperprolactineminic amenorrhea. N Engl J Med 1994; 331(14): 904–909.
11. Colao A, Di Sarno A, Sarnacchiaro S. Prolactinomas resistant to standard dopamine agonists to chronic cabergoline treatment. J Clin Endocrinol Metab 1997; 82(3): 876–873.
12. Holdaway IM, Rajasoorya C. Epidemiology of acromegaly. Pituitary 1999; 2(1): 29–41.
13. Orme SM, McNally RJ, Cartwright RA, Belchetz PE. Mortality and cancer incidence in acromegaly: a retrospective cohort study. United Kingdom Acromegaly Study Group. J Clin Endoscrinol Metab 1998; 83(8): 2730–2734.
14. Giustina A, Barkan A, Casanueva FF. Criteria for cure of acromegaly: a consensus statement. J Clin Endoscrinol Metab 2000; 85(2): 526–529.
15. Freda PU, Reyes CM, Nuruzzaman AT, Sundeen RE, Khandji AG, Post KD. Cabergoline therapy of growth hormone and growth mormone/prolactin secreting pituitary tumors. Pituitary 2004; 7(1): 21–30.
16. Abs R, Verhelst J, Maiter D. Cabergoline in the treatment of acromegaly: a study in 64 patients. J Clin Endocrinol Metab 1998; 83(2): 374–378.
17. Caron P, Beckers A, Cullen DR. Efficacy of the new long-acting formulation of lanreotide (lanreotide autogel) in the management of acromegaly. J Clin Endocrinol Metab 2002; 87(1): 99–104.
18. Caron P, Cogne M, Raingeard I, Bex-Bachallerie V, Khun JM. Effectiveness and tolerability of 3-year lanreotide Autogel treatment in patients with acromegaly. Clin Endocrinol (Oxf) 2006; 64(2): 209–214.
19. Freda PU, Katznelson L, van der Lely AJ, Reyes CM, Zhao S, Rabinowitz D. Long-acting somatostatin analog therapy of acromegaly: a meta-analysis. J Clin Endocrinol Metab 2005; 90(8): 4465–4473.
20. Trainer PJ, Drake WM, Katznelson L. Treatment of acromegaly with growth hormone-receptor antagonist pegvisomant. N Eng J Med 2000; 342(16): 1171–1177.
21. Besser GM, Burman P, Daly AF. Predictors and rates of treatment-resistant tumor growth in acromegaly. Eur J Endocrinol 2005; 153(2): 187–193.
22. Colao A, Attanasio R, Pivonello R. Partial surgical removal of growth hormone secreting pituitary tumors enhances response to somatostatin analogs in acromegaly. J Clin Endocrinol Metab 2006; 91(1): 85–92.
23. Giustina A, Barkan A, Casanueva FF. Criteria for cure of acromegaly: a consensus statement. J Clin Endoscrinol Metab 2000: 85(2): 3417–3424.
24. Nomikos P, Buchfelder M, Fahlbusch R. Outcome of surgery in 668 patients with acromegaly using current criteria of biochemical “cure”. Eur J Endocrinol 2005; 152(3): 379–387.
25. Laws ER, Vance ML, Thapar K. Pituitary surgery for the management of acromegaly. Horm Res 2000; 53 (Suppl 3): 71–75.
26. Davis DH, Laws ER jr, Ilstrup DM. Results of surgical treatment for growth hormone-secreting pituitary adenomas. J Neurosurg 1993; 79(1): 70–75.
27. Freda PU. How effective are current therapies for acromegaly? Growth Horm IGF Res 2003; 13 (Suppl A): S144–S151.
28. Jezková J, Marek J, Hána V, Krsek M, Weiss V, Vladyka V et al. Gamma knife radiosurgery for acromegaly – long-term experience. Clin Endocrinol (Oxf) 2006; 64(5): 588–595.
29. Findling JW, Raff H. Screening and diagnosis of Cushing’s syndrome. Endocrinol Metab Clin N Am 2005; 34(2): 341–356.
30. Findling JW, Raff H. Cushing’s syndrome: important issues in diagnosis and management. J Clin Endocrinol Metab 2006; 91(10): 3746–3753.
31. Arnaldi G, Angeli A, Atkinson AB. Diagnosis and complications of Cushing’s syndrome: a consensus statement. J Clin Endocrinol Metab 2003; 88(12): 5593–5602.
32. Aron DC, Raff H, Findling JW. Effectiveness versus efficacy: The limited value in clinical practise of high dose dexamethasone suppression testing in the differential diagnosis of adrenocorticotrophin-dependend Cushing’s syndrome. J Clin Endocrinol Metab 1997; 82(6): 1780–1785.
33. Tabarin A, Laurent F, Catargi B. Comparative evaluation of conventional and dynamic magnetic resonance imaging of the pituitary glang for the diagnosis of of Cushing’s dinase. Clin Endocrinol (Oxf) 1998; 49(3): 293–300.
34. Patronas N, Bulakbasi N, Stratakis CA. Spoiled gradient recalled acquisition in the steady state technique is superior to conventional postcontrast spin echo technique for magnetic resonance imaging detection of adrenocorticotrophin-secreting pituitary tumors. J Clin Endocrinol Metab 2003; 88(4): 1565–1569.
35. Hall WA, Luciano MG, Doppman JL, Patronas NJ, Oldfield EH. Pituitary magnetic resonance imaging in normal human volunteers: occult adenomas in the general population. Ann Intern Med 1994; 120(10): 817–820.
36. Kelly DF. Cushing’s disease: Surgical Management. In: Swearingen B, Biller BMK (eds). Diagnosis and Management of pituitary disorders. Totowa, NJ: Humana Press 2008: 203–222.
37. Sheehan JM, Vance ML, Sheehan JP. Radiosurgery for Cushing’s disease after failed transsphenoidal surgery. J Neurosurg 2000; 93(5): 738–742.
38. Sonino N, Zielezny M, Fava GA. Risk factors and long-term outcome in pituitary-dependent Cushing’s disease. J Clin Endocrinol Metab 1996; 81(7): 2647–2652.
39. Smallridge RC. Thyrotropin-secreting pituitary tumors. Endocrinol Metab Clin North AM 1987; 16(3): 765–792.
40. Katznelson L, Alexander JM, Klibanski A. Clinical review 45: Clinically nonfunctioning pituitary adenomas. J Clin Endoscrinol Metab 1993; 76(5): 1089–1094.
41. Shimon I, Melmed S. Management of pituitary tumors Ann Intern Med 1998; 129(6): 472–483.
42. Česák T, Náhlovský J, Hosszú T, Řehák S, Látr I, Němeček S et al. Longitudinální sledování růstu pooperačních reziduí afunkčních adenomů hypofýzy. Cesk Slov Neurol N 2009; 75/105(2): 115–124.
43. DeLellis RA, Lloyd RV, Heitz PU, Eng C. Pathology and Genetics of Tumours of Endocrine Organs, WHO Classification of Tumours. Lyon: IARC Press 2004.
44. Pernicone PJ, Scheithauer BW, Sebo TJ. Pituitary carcinoma: a clinicopathologic study of 15 cases. Cancer 1997; 79(4): 804–812.
45. Ulmer S, Byrne TN. Lymphocytic Hypophysitis adn Inflammatory Disease of the Pituitary. In: Swearingen B, Biller BMK (eds). Diagnosis and Management of pituitary disorders. Totowa, NJ: Humana Press 2008: 339–352.
46. Bailey P. Pathological report of a case of acromegaly, with special reference to the lesions in the hypophysis cerebri and in the thyroid gland; and of a case of hemorrhage into the pituitary. Philadelphia Med J 1898; 1(18): 789–792.
47. Randeva HS, Schoebel J, Byrne J, Esiri M, Adams CB, Wass JA. Classical pituitary apoplexy: clinical features, management and outcome. Clin Endocrinol (Oxf) 1999; 51(2): 181–188.
48. Molitch ME, Russell EJ. The pituitary “incidentaloma”. Ann Intern Med 1990; 112(12): 925–931.
49. Hall WA, Luciano MG, Doppman JL, Patronas NJ, Oldfield EH. Pituitary magnetic resonance imaging in normal human volunteers: occult adenomas in the general population. Ann Intern Med 1994; 120(10): 817–820.
50. Oyama K, Sanno N, Tahara S, Teramoto A. Management of pituitary incidentalomas: according to survey of pituitary incidentalomas in Japan. Semin Ultrasound CT MR 2005; 26(1): 47–50.
51. Lindholm J. A century of pituitary surgery: Schloffer’s legacy. Neurosurgery 2007; 61(4): 865–867.
52. Cohen-Gadol AA, Liu JK, Laws ER jr. Cushing’s first case of transsphenoidal surgery: the launch of the pituitary surgery era. J Neurosurg 2005; 103(3): 570–574.
53. Liu JK, Das K, Weiss MH, Laws ER jr, Couldwell WT. The history and evolution of transsphenoidal surgery. J Neurosurg 2001; 95(6): 1083–1096.
54. 50 let Neurochirurgické kliniky v Hradci Králové: almanach k 50. výročí založení neurochirurgické kliniky v Hradci Králové. Hradec Králové: Zetka 2002: 31.
55. Fusek I, Černý E. Transsphenoidal operation of hypophyseal tumors. J Neurosurg Sci 1977; 21, 159–160.
56. Fusek I, Černý E. Naše zkušenosti s indikacemi transsfenoidálních operací nádorů tureckého sedla. Cesk Slov Neurol N 1978; 41/74: 107–114.
57. Hirsch O. Endonasal method of removal hypophyseal tumors. JAMA 1910; 55(9): 772–774.
58. Griffith HB, Veerapen R. A direct transnasal approach to the sfenoid sinus. Technical note. J Neurosurg 1987; 66(1): 140–142.
59. Stammberger H. Endoscopic endonasal surgery – Concepts in treatment of recurring rhinosinusitis. Part II. Surgical technique. Otolaryngol Head Neck Surg 1986; 94(2): 147–156.
60. Jankowski R, Auque J, Simon C, Marchal JC, Hepner H, Wayoff M. Endoscopic pituitary tumor surgery. Laryngoscope 1992; 102(2): 198–202.
61. Sethi DS, Pillay PK. Endoscopic management of lesions of the sella turcica. J Laryngol Otol 1995; 109(10): 956–962.
62. Carrau RL, Jho HD, Ko Y. Transnasal-transsphenoidal endoscopic surgery of the pituitary gland. Laryngoscope 1996; 106(7): 914–918.
63. Jho HD, Carrau RL. Endoscopic endonasal transsphenoidal surgery: Experience with 50 patients. J Neurosurg 1997; 87(1): 44–51.
64. Rodziewicz GS, Kelly RT, Kellman RM, Smith MV. Transnasal endoscopic surgery of the pituitary gland: Technical note. Neurosurgery 1996; 39(1): 189–193.
65. Cappabianca P, Alfieri A, de Divitiis E. Endoscopic endonasal transsphenoidal approach to the sella: Towards functional endoscopic pituitary surgery (FEPS). Minim Invas Neurosurg 1998; 41(2): 66–73.
66. Masopust V, Netuka D, Beneš V. Endonazální endoskopická transsfenoidální resekce selárních lézí. Cesk Slov Neurol N 2008; 71/104(6): 704–710.
67. Kassam A, Snyderman CH, Mintz A, Gardner P, Carrau RL. Expanded endonasal approach: the rostrocaudal axis. Part I. Crista galli to the sella turcica. Neurosurg Focus 2005; 19(1): E3.
68. Kassam A, Snyderman CH, Mintz A, Gardner P, Carrau RL. Expanded endonasal approach: the rostrocaudal axis. Part II. Posterior clinoids to the foramen magnum. Neurosurg Focus 2005; 19(1): E4.
69. Kassam AB, Gardner P, Snyderman C, Mintz A, Carrau R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurg Focus 2005; 19(1): E6.
70. de Almeida JR, Snyderman CH, Gardner PA, Carrau RL, Vescan AD. Nasal morbidity following endoscopic skull base surgery: A prospective cohort study. Head Neck 2010; 33(4): 547–551.
71. Pant H, Bhatki AM, Snyderman CH, Vescan AD, Carrau RL, Gardner P et al. Quality of life following endonasal skull base surgery. Skull Base 2010; 20(1): 35–40.
72. Dusick JR, Esposito F, Mattozo CA, Chaloner C, McArthur DL, Kelly DF. Endonasal transsphenoidal surgery: the patient‘s perspective-survey results from 259 patients. Surg Neurol 2006; 65(4): 332–341.
73. Ludecke DK, Abe T. Transsphenoidal microsurgery for newly diagnosed acromegaly: a personal view after more than 1,000 operations. Neuroendocrinology 2006; 83(3–4): 230–239.
74. Nimsky C, von Keller B, Ganslandt O, Fahlbusch R. Intraoperative high-field magnetic resonance imaging in transsphenoidal surgery of hormonally inactive pituitary macroadenomas. Neurosurgery 2006; 59(1): 105–114.
75. Shou XF, Li SQ, Wang YF, Zhao Y, Jia PF, Zhou LF. Treatment of pituitary adenomas with a transsphenoidal approach. Neurosurgery 2005; 56(2): 249–256.
76. Náhlovský J, Česák J, Látr I, Čáp J, Žižka J, Krajina A. Komplikace transsfenoidálních operací u našich nemocných – příčiny, řešení. Cesk Slov Neurol N 2004; 67/100(2): 112–119.
77. Sameš M, Vachata P, Saur K, Budíková M. Přímý transnazální miniinvazivní přístup pro mikrochirurgickou resekci adenomů hypofýzy. Cesk Slov Neurol N 2005; 68/101(5): 337–341.
78. Jho H. Endoscopic endonasal approach to the optic nerve: a technical note. Minim Invasive Neurosurg 2001; 44(4): 190–193.
79. Dusick JR, Esposito F, Kelly DF. The extended direct endonasal transsphenoidal approach for nonadenomatous suprasellar tumors. J Neurosurg 2005; 102(5): 825–827.
80. Cavallo LM, Prevedello DM, Solari D, Gardner PA, Esposito F, Snyderman CH et al. Extended endoscopic endonasal transsphenoidal approach for residual or recurrent craniopharyngiomas. J Neurosurg 2009; 111(3): 578–589.
81. Horsley V. On the technique of operations on the central nervous system. Br Med J 1906; 2: 411–423.
82. Krause F. Freilegung der hypofyse. In: Krause F (ed). Die allgemeine Chirurgie der Gehirnkrankheiten, Part II. Suttgart: Ferdinand Enke 1914: 465–470.
83. McArthur LL. An aseptic surgical approach to the pituitary body and its neighborhood. JAMA 1912; 58: 2009–2011.
84. Frazier CH. Lesions of the hypophysis from the viewpoint of the surgeon. Surg Gyn Obst 1913; 17: 724–736.
85. Heuer GJ. Surgical experiences with an intracranial approach to chiasmal lesions. Arch Surg 1920; 1: 368–381.
86. Gerlach R, du Mesnil de Rochemont R, Gasser T, Marquardt G, Reusch J, Imoehl L et al. Feasibility of Polestar N20, an ultra-low-field intraoperative magnetic resonance imaging system in resection control of pituitary macroadenomas: lessons learned from the first 40 cases. Neurosurgery 2008; 63(2): 272–284.
87. Hadani M, Spiegelman R, Feldman Z, Berkenstadt H, Ram Z. Novel, compact, intraoperative magnetic resonance imaging-guided system for conventional neurosurgical operating rooms. Neurosurgery 2001; 48(4): 799–807.
88. Hall WA, Liu H, Martin AJ, Pozza CH, Maxwell RE, Truwit CL. Safety, efficacy, and functionality of high-field strength interventional magnetic resonance imaging for neurosurgery. Neurosurgery 2000; 46(3): 632–641.
89. Jankovski A, Raftopoulos C, Vaz G, Hermoye L, Cosnard G, Francotte F et al. Intra-operative MR at 3T: short report. JBR-BTR 2007; 90(4): 249–251.
90. Sutherland GR, Kaibara T, Louw D, Hoult DI, Tomanek B, Saunders J. A mobile high-field magnetic resonance system for neurosurgery. J Neurosurg 1999; 91(5): 804–813.
91. Martin CH, Schwartz R, Jolesz F, Black PM. Transsphenoidal resection of pituitary adenomas in an intraoperative MR unit. Pituitary 1999; 2(2): 155–162.
92. Nimsky C, Ganslandt O, Von Keller B, Romstöck J, Fahlbusch R. Intraoperative high-field-strength MR imaging: implementation and experience in 200 patients. Radiology 2004; 233(1): 67–78.
93. Fahlbusch R, Keller B, Ganslandt O, Kreutzer J, Nimsky C. Transsphenoidal surgery in acromegaly investigated by intraoperative high-field magnetic resonance imaging. Eur J Endocrinol 2005; 153(2): 239–248.
94. Nimsky C, von Keller B, Ganslandt O, Fahlbusch R. Intraoperative high-field magnetic resonance imaging in transsphenoidal surgery of hormonally inactive pituitary macroadenomas. Neurosurgery 2006; 59(1): 105–114.
95. Jones J, Ruge J. Intraoperative magnetic resonance imaging in pituitary macroadenoma surgery: an assessment of visual outcome. Neurosurg Focus 2007; 23(5): E12.
96. Netuka D, Masopust V, Belšán T, Kramář F, Beneš V. One year experience with 3.0 T intraoperative MRI in pituitary surgery. Acta Neurochir Suppl 2011; 109: 157–159.
97. Netuka D, Masopust V, Belšán T, Kramář F, Beneš V. První zkušenosti s použitím intraoperační MR při operacích adenomů hypofýzy. Cesk Slov Neurol N 2009; 72/105(1): 45–50.
98. Sheehan JP, Niranjan A, Sheehan JM. Sterotactic radiosurgery for pituitary adenomas: an intermediate review of its safety, efficacy, and role in the neurosurgical armamentarium. J Neurosurg 2005; 102(4): 678–691.
99. Liscák R, Vladyka V, Marek J, Simonová G, Vymazal J. Gamma knife radiosurgery for endocrine-inactive pituitary adenomas. Acta Neurochir (Wien) 2007; 149(10): 999–1006.
100. Jezková J, Hána V, Krsek M, Weiss V, Vladyka V, Liscák R et al. Use of the Leksell gamma knife in the treatment of prolactinoma patients. Clin Endocrinol (Oxf) 2009; 70(5): 732–741.
101. Marek J, Jezková J, Hána V, Krsek M, Bandúrová L, Pecen L et al. Is it possible to avoid hypopituitarism after irradiation of pituitary adenomas by the Leksell gamma knife? Eur J Endocrinol 2011; 164(2): 169–178.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2011 Issue 3
Most read in this issue
- Pituitary Adenoma Therapy
- Limbic Encephalitis – Two Case Reports
- A patient in Persistent Vegetative State and his Rehabilitation
- Mild Brain Injury – Intracranial Complications and Indication Criteria for CT Imaging

