Resekční epileptochirurgie u pacientů s perirolandickou epilepsií
Resection Surgery in Patients with Perirolandic Epilepsy
Purpose:
To assess the efficacy and safety of resective epilepsy surgery in unselected patients with both lesional and nonlesional perirolandic epilepsy.
Methods:
A group of 15 consecutive patients who had undergone perirolandic cortical resection (without multiple subpial transections) for intractable epilepsy between 1995 and 2009 was identified. This number represented 5.2% of all resective epilepsy surgeries at the Brno Epilepsy Centre. A detailed analysis was performed in 13 patients with a minimum postoperative follow-up 2 years (average 7 years). The average age at the time of surgery was 27 years (range 13–50 years). Pre-operative MRI disclosed restricted lesion in the perirolandic cortex in nine patients; in four subjects repeated and thorough neuro-imaging investigation failed to identify any structural pathology. Most patients underwent pre-operative chronic invasive video-EEG (70%). Advanced neuro-imaging (including fMRI, subtraction ictal single photon emission tomography coregistered to MRI, magnetic resonance spectroscopy, voxel-based morphometry, etc.) was progressively introduced into the pre-operative set-up and completed whenever possible.
Results:
At the last recorded follow-up, nine patients remained seizure-free – Engel class I (70%); two patients were class II (15%), and two patients class IV (15%). Postoperative neurological deficits were present in four patients (30%). In all these cases, intensive rehabilitation resulted in significant improvement, while a mild functional deficit still remained in two patients (15%).
Conclusion:
Resective epilepsy surgery is an effective and relatively safe therapeutic strategy in properly selected patients with intractable perirolandic epilepsy. This conclusion holds for both lesional and nonlesional cases.
Key words:
central region – epilepsy surgery – intractable epilepsy – focal cortical dysplasia – neuro-imaging
Authors:
M. Brázdil 1; R. Kuba 1; J. Chrastina 2; Z. Novák 2; J. Hemza 2; M. Hermanová 3; I. Tyrlíková 1; M. Ryzí 4; H. Ošlejšková 4; B. Slaná 3; M. Mikl 1; M. Pažourková 5; I. Rektor 1
Authors‘ workplace:
Centrum pro epilepsie Brno
I. neurologická klinika LF MU a FN u sv. Anny v Brně
1; Centrum pro epilepsie Brno
Neurochirurgická klinika LF MU a FN u sv. Anny v Brně
2; Centrum pro epilepsie Brno
Patologicko-anatomický ústav LF MU a FN u sv. Anny v Brně
3; Centrum pro epilepsie Brno
Klinika dětské neurologie LF MU a FN Brno
4; Centrum pro epilepsie Brno
Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně
5
Published in:
Cesk Slov Neurol N 2011; 74/107(1): 43-48
Category:
Original Paper
Overview
Cíl:
Zhodnotit úspěšnost a bezpečnost resekční epileptochirurgické léčby v neselektovaném souboru pacientů s lezionální i non-lezionální perirolandickou epilepsií.
Soubor a metodika:
Retrospektivně jsme identifikovali všechny pacienty, kteří v letech 1995–2009 podstoupili v rámci epileptochirurgického programu Centra pro epilepsie Brno resekční výkon v perirolandické oblasti. Jednalo se o 15 pacientů, tj. 5,2 % všech provedených resekčních epileptochirurgických zákroků. Detailně jsme zpracovali výsledky u 13 operovaných pacientů s minimální dobou pooperačního sledování dva roky (průměrná doba od operace byla sedm let). V hodnoceném souboru byl průměrný věk pacientů v době zákroku 27 let (min. 13 let, max. 50 let). Předoperační MR vyšetření prokázalo ohraničenou strukturální lézi v centrální krajině u devíti pacientů, u zbývajících čtyř jedinců se jednalo o MR-negativní perirolandickou epilepsii. Většina pacientů předoperačně podstoupila chronické invazivní video-EEG vyšetření (70 %), u ostatních pak byla doplněna peroperační elektrokortikografie. Dle možností byly pro přesnější lokalizaci epileptogenní zóny předoperačně doplněny další neurozobrazovací vyšetření (PET, SPECT, subtrakční iktální SPECT koregistrovaný s MR, voxel-based morfometrie, MR spektroskopické zobrazení, EEG výboji spouštěné fMR).
Výsledky:
Pooperačně došlo k praktickému vymizení záchvatů (Engel I) u devíti pacientů (70 %), téměř bez záchvatů (Engel II) byli dva pacienti (15 %), a u dvou pacientů nedošlo po operaci k významnému zlepšení (Engel IV; 15 %). Predikovatelný pooperační funkční deficit se objevil u čtyř pacientů (30 %), ve všech případech však došlo po intenzivní rehabilitaci k výraznému ústupu nálezu, u dvou pacientů (15 %) přetrvává reziduální frustní (nelimitující) oslabení akra kontralaterální horní končetiny.
Závěr:
V indikovaných případech se jeví resekční epileptochirurgie jako jednoznačně úspěšná a poměrně bezpečná metoda léčby farmakorezistentních pacientů s perirolandickou epilepsií, a to včetně MR-negativních případů.
Klíčová slova:
centrální krajina – epileptochirurgie – farmakorezistentní epilepsie – fokální kortikální dysplazie – neurozobrazování
Úvod
Operační léčba farmakorezistentní epi-lepsie je v současnosti považována za plnohodnotný a vysoce efektivní postup v terapii pacientů s daným onemocněním. Jednoznačně nejlepších pooperačních výsledků je dosahováno u epilepsie temporálního laloku, operace jedinců s extratemporální epilepsií jsou pro svoji náročnější předoperační diagnostiku, nižší účinnost a vyšší riziko komplikací prováděny méně často. Mezi nejobávanější zákroky v rámci epileptochirurgie bezpochyby patří resekční výkony v perirolandické oblasti. Hlavním důvodem je vysoké riziko významného pooperačního senzo-motorického deficitu [1]. Ten je uváděn v raritních recentně publikovaných souborech u 50–59 % operovaných jedinců [2,3]. Úplného vymizení záchvatů pooperačně je pak dosahováno v poměrně širokém rozmezí – u 19,5–78 % operovaných jedinců, celkově vykazují lepší výsledky recentní studie [2–5]. Až do nedávné minulosti byli resekčním epileptochirurgickým zákrokem v diskutované lokalitě ošetřováni pouze tzv. lezionální pacienti (tedy jedinci s průkazem kauzální léze při neurozobrazovacích vyšetřeních), teprve v letošním roce byla publikována první studie zahrnující i pacienty s MR-negativní fokální kortikální dysplazií [3]. Cílem naší práce bylo zhodnotit úspěšnost a bezpečnost resekční léčby u perirolandické epilepsie v souboru pacientů řešených v rámci epileptochirurgického programu Centra pro epilepsie Brno. Do analýzy byli zahrnuti pacienti se strukturální lézí i jedinci MR-negativní, u nichž byly v maximální možné míře předoperačně využity i možnosti kombinovaného pokročilého neurozobrazování.
Soubor a metodika
Retrospektivně jsme analyzovali záznamy všech pacientů v epileptochirurgickém programu Centra pro epilepsie Brno, u nichž byl v letech 1995–2009 proveden resekční výkon v centrální (perirolandické) krajině (tj. precentrální a/nebo postcentrální gyrus včetně svých okrajů – sulcus precentralis/postcentralis – a přechodu do lobulus paracentralis). Z detailní analýzy jsme vyloučili pacienty, u nichž nebyla splněna podmínka minimálně dvouletého pooperačního sledování. Všichni pacienti zařazení do analýzy podstoupili standardní předoperační vyšetření (anamnéza, objektivní neurologické vyšetření, dlouhodobé neinvazivní video-EEG vyšetření, magnetická rezonance a neuropsychologické vyšetření). Dle možností byla v indikovaných případech za účelem přesnější lokalizace epileptogenní zóny doplněna další neurozobrazovací vyšetření – interiktální SPECT, interiktální PET, iktální SPECT, SISCOM (subtrakční iktální SPECT koregistrovaný s MR), voxel-based morfometrie (VBM), MR spektroskopické zobrazení (MRSI), postiktální difuzně-vážené MR zobrazení (postictal DWI), iktální funkční MR (fMR) a EEG výboji spouštěné fMR (EEG-fMR). Invazivní video-EEG monitorování bylo v případě nutnosti provedeno s použitím intracerebrálních (hlubokých) elektrod, alternativně subdurálních elektrod, či vzácně jejich kombinací. U významné části pacientů byla provedena peroperační elektrokortikografie (ECoG). Ta byla obligátně doplněna u všech pacientů, kteří předoperačně nepodstoupili dlouhodobé invazivní EEG vyšetření, a dále u tří pacientů, u nichž bylo předchozí chronické invazivní EEG vyšetření touto cestou upřesňováno. Mapování elokventního kortexu bylo provedeno peroperační elektrickou stimulací a/nebo fMR [6].
Vlastní resekční zákrok (lokalizace a rozsah) byl prováděn individuálně na základě výsledků předoperačních a peroperačních vyšetření s cílem v maximální možné míře odstranit epileptogenní zónu a současně maximálně šetřit elokventní kortex. Všichni pacienti byli před operací důkladně poučeni o vysokém riziku potenciálního funkčního deficitu a toto riziko akceptovali. Pooperačně bylo provedeno standardní histopatologické vyšetření resekátu, opakované objektivní neurologické vyšetření s průběžným hodnocením případného pooperačního funkčního deficitu a konečně byl hodnocen efekt epileptochirurgického zákroku na vlastní záchvaty (outcome) při poslední kontrole pacienta na našem pracovišti (follow-up). Pro tyto účely byla použita standardní Engelova klasifikace, jež rozděluje pacienty do čtyř hlavních tříd (Engel I = bez omezujících záchvatů; II = vzácné omezující záchvaty; III = významné zlepšení; IV = bez významného zlepšení). Třída I je pak dále členěna na Ia = pacient zcela bez záchvatů od operace; Ib = od operace pouze aury; Ic = několik větších záchvatů krátce po operaci, ale dále dva roky bez záchvatů. Kategorie IIa zahrnuje pacienty iniciálně bez záchvatů, nyní s ojedinělými záchvaty [7].
Výsledky
V letech 1995–2009 bylo v rámci operačního programu Centra pro epilepsie Brno provedeno 287 resekčních epileptochirurgických výkonů, z toho u 15 pacientů (10 mužů/5 žen) byla provedena kortikální resekce v centrální (perirolandické) krajině (5,2 %).
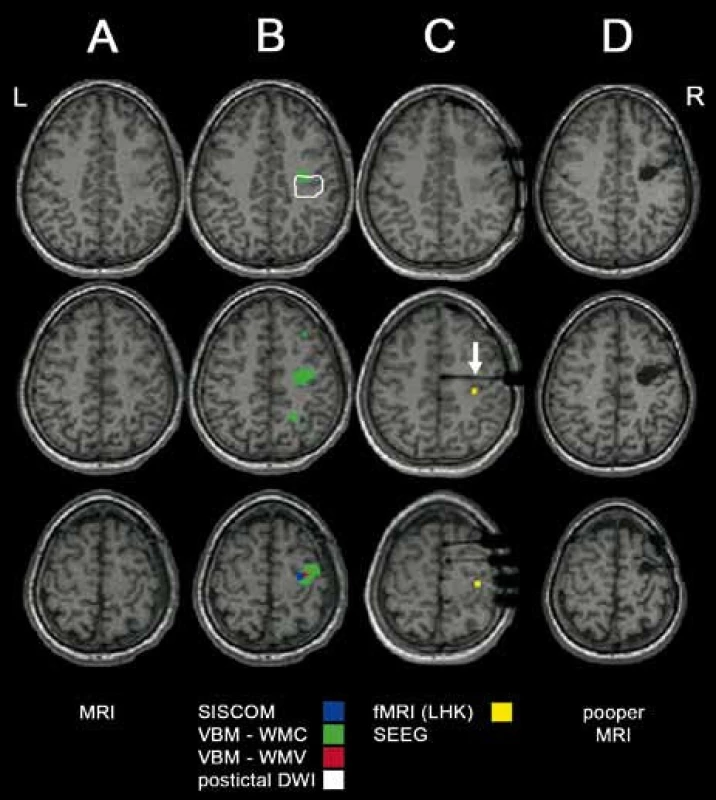
Třináct pacientů (9 mužů/4 ženy) splnilo základní vstupní kritérium minimálně dvouletého pooperačního sledování (průměrná doba od operace byla 7 let; std. 4,1). V tomto hodnoceném souboru byl průměrný věk pacientů v době zákroku 27 ± 11,2 let (min. 13 let, max. 50 let). Detailní charakteristika jednotlivých pacientů je uvedena v tab. 1. Předoperační MR vyšetření prokázalo ohraničenou strukturální lézi v centrální krajině (gyrus precentralis a/nebo gyrus postcentralis, eventuálně s postižením sousedního kortexu) u devíti pacientů, u zbývajících čtyř jedinců se jednalo o MR-negativní perirolandickou epilepsii. Interiktální SPECT či PET byly provedeny u devíti pacientů (od roku 2003 PET zcela nahradil interiktální SPECT). Pokročilé neurozobrazovací metody byly zaváděny do vyšetřování teprve v posledních pěti letech, u dvou MR-negativních pacientů (léčených v tomto období) jsme předoperačně použili hned několik těchto metod. V obou případech konvergence nalezených abnormit výrazně napomohla k přesnější lokalizaci epileptogenní zóny (obr. 1).
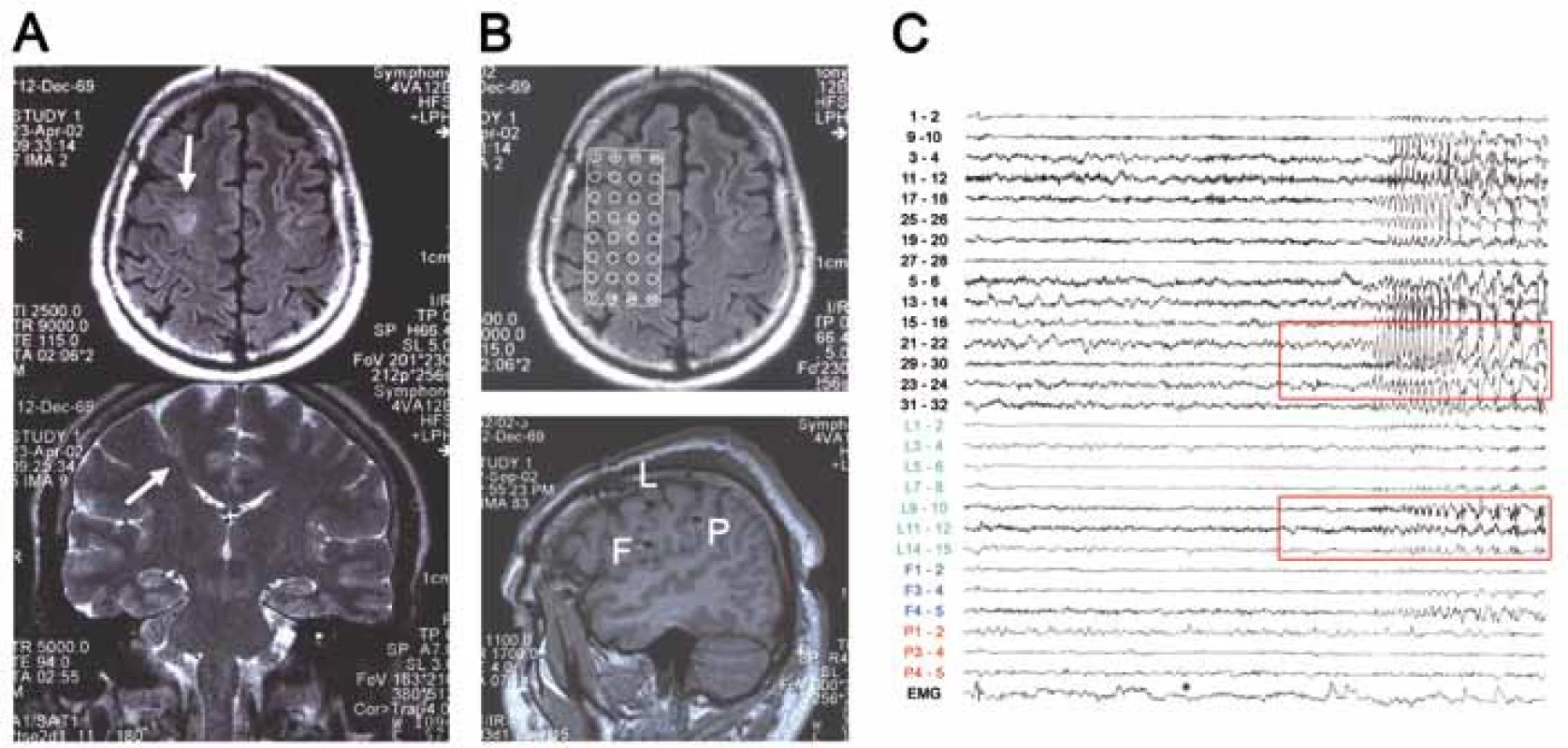
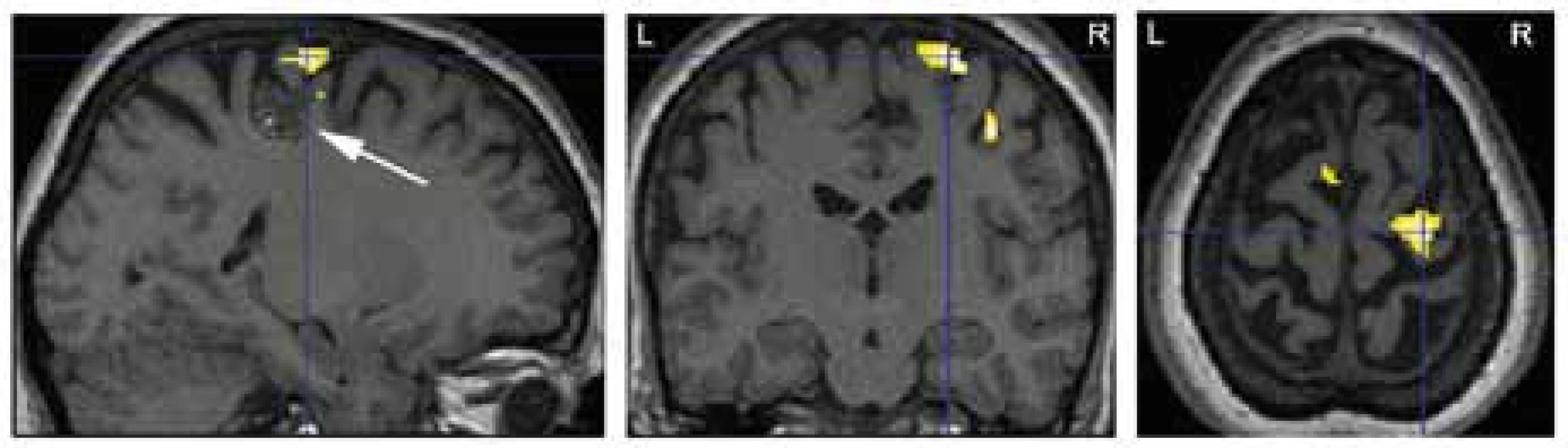
Chronické invazivní video-EEG vyšetření podstoupila většina pacientů v hodnoceném souboru (N = 9). Častější bylo použití intracerebrálních elektrod (samostatně u čtyř jedinců, v kombinaci se subdurálními elektrodami u tří jedinců), vzácněji byly implantovány pouze subdurální elektrody (u dvou pacientů). Ve všech případech provedené vyšetření dobře lokalizovalo zónu počátku záchvatů (obr. 2). Peroperační ECoG byla použita u sedmi pacientů. Funkční MR vyšetření, provedené u všech devíti pacientů operovaných od roku 2001, adekvátně identifikovalo vyšetřovaný motorický či řečový kortex (obr. 3). Upřesňující mapování elokventního kortexu elektrickou stimulací bylo peroperačně anebo v průběhu chronického invazivního EEG vyšetření provedeno u většiny pacientů (N = 11).
Pooperačně došlo k praktickému vymizení záchvatů (Engel I) u devíti pacientů (70 %), téměř bez záchvatů (Engel II) byli dva pacienti (15 %) a u dvou pacientů nedošlo po operaci k významnému zlepšení (Engel IV; 15 %). U dvou pacientů ze skupiny Engel I bylo možné standardním způsobem po operaci antiepileptika zcela vysadit (pacienti č. 4 a 7). Predikovatelný pooperační funkční deficit se objevil u čtyř pacientů (30 %), ve všech případech však po intenzivní rehabilitaci došlo k výraznému ústupu nálezu, u dvou pacientů (15 %) přetrvává reziduální frustní (nelimitující) oslabení akra kontralaterální horní končetiny (tab. 2).
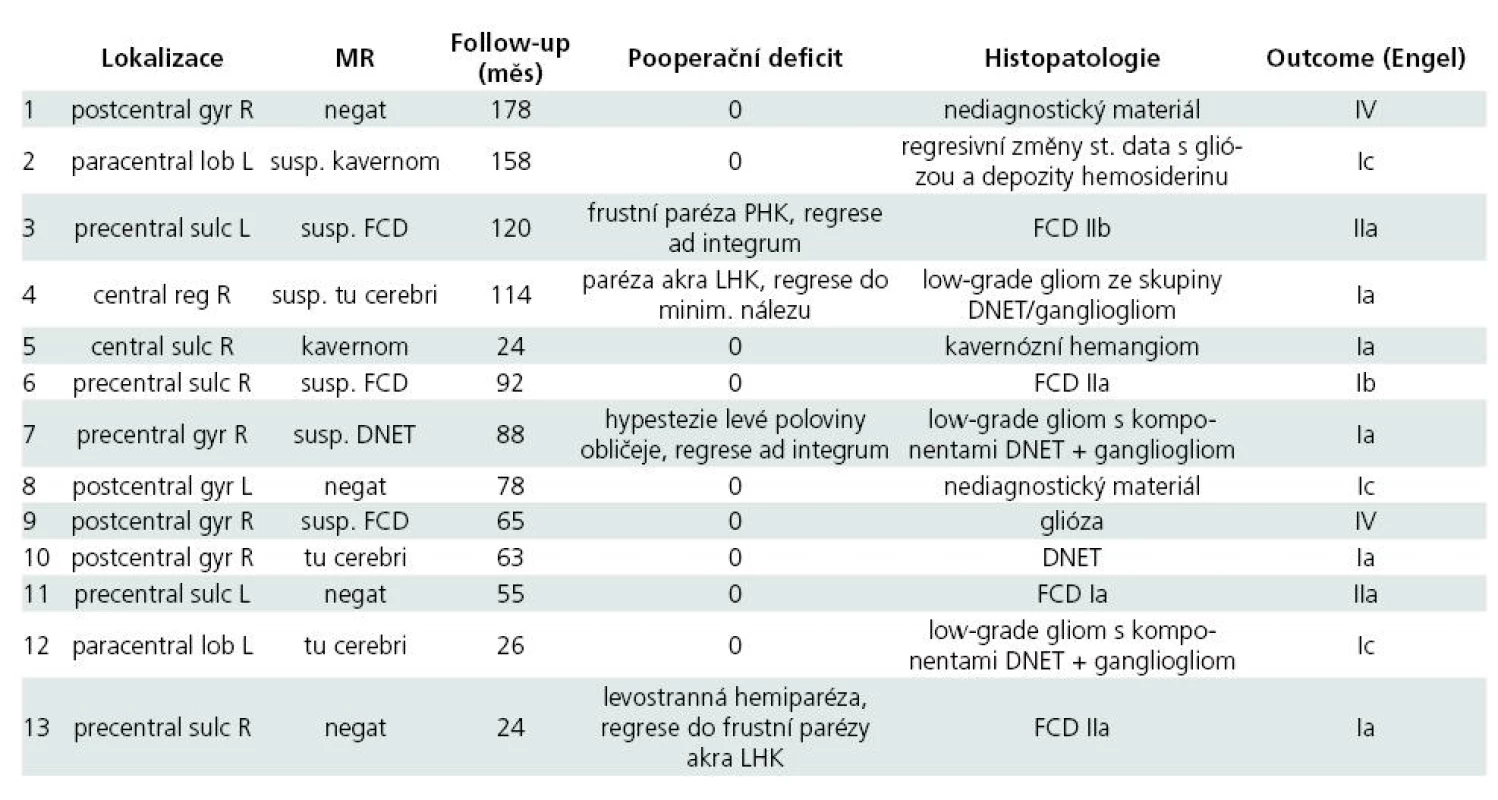
Histopatologické vyšetření prokázalo u čtyř pacientů fokální kortikální dysplazii (FCD) – typy Ia, IIa a IIb dle Palminiho [8], u čtyř pacientů vývojový low-grade gliom (z okruhu DNET/gangliogliom), a vždy u jednoho pacienta kavernózní hemangiom, potraumatické regresivní změny a chronickou reaktivní (astrocytickou) gliózu. Histopatologické vyšetření nebylo možné provést u dvou pacientů.
Diskuze
V odborné literatuře jen poměrně vzácně narazíme na práce úzce zaměřené na operační léčbu farmakorezistentních perirolandických epilepsií [2–5,9–12]. Tato skutečnost je nepochybně dána obecně nízkými počty prováděných resekčních epileptochirurgických zákroků v okolí sulcus centralis. Riziko závažného pooperačního funkčního deficitu je v těchto případech vysoké a prostor pro nezbytné kompletní odstranění epileptogenní zóny bohužel často značně limitovaný. Přesto můžeme v publikovaných souborech narazit na pozoruhodně dobré pooperační výsledky. Zatímco v již historickém souboru Pilchera a spolupracovníků z roku 1947 [4] vedly velké kortikální resekce senzomotorického kortexu k úplnému vymizení záchvatů jen u 19,5 % pacientů, práce z poslední doby uvádí dosažení bezzáchvatovosti až u 78 % operovaných jedinců [3,5,10–12]. Zajímavé je, že v rozsáhlém neselektovaném souboru pacientů publikovaném v roce 2006 uvádějí jeho autoři pooperační vymizení záchvatů pouze u 31 % pacientů [2]. Poměrně rozdílné výsledky jsou zdůvodňovány nejen rozsahem či charakterem operačního zákroku (v poslední citované práci kromě resekcí byla používána i metoda mnohotných subpiálních transsekcí), ale též kauzální patologií či jiným poměrem v zastoupení tzv. horních (v části kortexu funkčně odpovídající noze, ruce a obličeji) a dolních resekcí. Výsledky operační léčby v našem souboru jsou z pohledu srovnání s výše uvedenými velmi dobré. Dosažení bezzáchvatovosti v 70 % operovaných jedinců odpovídá nejlepším recentně publikovaným výsledkům, a to i navzdory skutečnosti, že v našem souboru byly zastoupeni i tzv. non-lezionální (MR-negativní) pacienti, a navíc většina našich pacientů (85 %) byla operována v nepříznivější horní části perirolandické krajiny [2,5].
Podobně příznivé výsledky jsme zjistili při hodnocení bezpečnosti operační léčby. Permanentní neurologický deficit (byť jen frustní a v běžných denních aktivitách nelimitující) se vyskytl u 15 % našich pacientů. Podobně jako v dosažení bezzáchvatovosti, stejně široké rozmezí je v literatuře uváděno různými autory ve výskytu permanentního pooperačního funkčního deficitu. V rozsáhlejších souborech je tento deficit přítomen u cca poloviny operovaných jedinců [2,4]. V selektovaných souborech je vcelku logicky výskyt komplikací výrazně nižší, přičemž opět závisí především na lokalizaci a rozsahu kortikální resekce. Lehman et al přiznávají výskyt permanentního deficitu u 30 % z 20 operovaných jedinců [9], v sérii 14 lezionálních pacientů udávají Sandok et al výskyt permanentního neurologického deficitu pouze v 7 % [5]. V malém souboru sedmi pediatrických pacientů Otsubo et al uvádějí dokonce nulový výskyt těchto komplikací [11]. Překvapivě dobré výsledky poslední citované skupiny mohou také souviset s jediným prokázaným prediktorem pro vznik permanentního neurologického deficitu u diskutovaných pacientů, a tím je vyšší věk (≥ 25 let) [2]. Tento prediktor velmi pravděpodobně souvisí s neurální plasticitou a schopností funkční reorganizace senzomotorického kortexu, která s věkem klesá. Čím dříve tedy přistoupíme u farmakorezistentních perirolandických epilepsií k chirurgickému zákroku, tím nižší je pravděpodobnost vzniku trvalého funkčního deficitu. A naopak resekční zákrok u starších pacientů s překryvem epileptogenního a elokventního kortexu je nutné vždy velmi pečlivě zvažovat, neboť riziko trvalého poškození po operaci je velmi vysoké.
Cestou k vyšší účinnosti a bezpečnosti zákroku v centrální krajině je zcela nepochybně maximální kvalita předoperačního vyšetření. Zde je nutno nejen co nejpřesněji identifikovat tzv. epileptogenní zónu (tedy tu část kortexu, jejíž operační odstranění je nezbytné k dosažení bezzáchvatovosti), ale současně přesně stanovit anatomické vztahy mezi touto oblastí a elokventním kortexem. Standardně se proto u pacientů s perirolandickou epilepsií provádí invazivní video-EEG vyšetření, v jehož průběhu se prostřednictvím elektrické stimulace také standardně co nejpřesněji mapuje kortex v okolí epileptogenní zóny. Operace bez předchozího invazivního EEG došetření jsou i v současnosti spíše výjimkou možnou pouze u lezionálních pacientů s dokonalou shodou výsledků neinvazivních vyšetření. Ve snaze nahradit invazivní EEG se v posledních letech stále výrazněji zavádí v epileptochirurgii do předoperační přípravy tzv. pokročilé neurozobrazování [6]. V podstatě jde o řadu sofistikovaných vyšetřovacích metodik založených na dodatečném zpracování dat z MR a SPECT vyšetření (tzv. post-processing). Nejdále v tomto směru je tzv. SISCOM, při němž je interiktální SPECT nález odečten od iktálního a nadprahové hodnoty rozdílu jsou pak přeloženy přes MR snímky. Tato metoda, intenzivně využívaná na řadě pracovišť, nám výrazně napomáhá v lokalizaci epileptogenní zóny. Na zpracování MR dat s vysokým rozlišením je založena tzv. voxel-based morfometrie, při níž jsou zjišťovány u vyšetřovaného jedince drobné odchylky v objemu a koncentraci šedé/bílé hmoty oproti zdravé populaci. Zjištěné abnormity mohou opět přispět k lokalizaci epileptogenní zóny, podobně jako abnormní nález při postiktální registraci difuzně-vážených MR dat (DWI) či patologie v rozložení mozkových metabolitů cestou MR spektroskopického zobrazení (MRSI). Naopak jen výjimečně lze provést iktální fMR, iktální PET vyšetření či fMR iniciované epileptickými výboji (EEG-fMR). Zejména u posledně jmenovaného vyšetření se o jeho přínosu pro klinickou praxi stále intenzivně diskutuje. Každopádně je doplnění uvedených vyšetření doporučováno především u pacientů s negativním nálezem při opakovaném detailním MR vyšetření. Na druhé straně je třeba velká obezřetnost při interpretaci jejich výsledků. Mnohem vyšší přínos má opakovaný nález vyskytující se konzistentně a v identické lokalizaci napříč jednotlivými metodami. Metody pokročilého neurozobrazování pak mohou znamenat významný přínos právě u nelezionálních pacientů s epileptickým ložiskem v centrální krajině, kde jsou navíc snadno a výhodně kombinovatelné s fMR elokventního kortexu [13]. Jejich kombinací s invazivním EEG vyšetřením pak zpravidla posilujeme přesnost v identifikaci epileptogenní zóny, zvyšujeme pravděpodobnost dosažení bezzáchvatovosti a současně minimalizujeme riziko vzniku pooperačního poškození.
Zvláštní pozornost si zaslouží kategorie fokálních kortikálních dysplazií jako stále častěji zjišťované kauzální léze u pacientů s farmakorezistentní perirolandickou epilepsií. V publikovaných souborech z poslední dekády se FCD nachází v 10–40 % případů [2,10,11]. V našem souboru tvořily FCD současně s vývojovými tumory nejčastější nález při histopatologickém vyšetření (31 %). Současně byly zjištěny u obou nelezionálních histopatologicky vyšetřených pacientů. Dvakrát bylo FCD potvrzeno v resekátu pacientů se suspektem na kortikální dysplazii již v předoperačním MR vyšetření. Byť jde o velmi limitovaný počet pacientů, zajímavé jsou i pooperační výsledky ve smyslu dosažení bezzáchvatovosti. U poloviny z čtyř našich pacientů po operaci záchvaty prakticky vymizely, a u druhé poloviny došlo k významnému zlepšení s pouze ojedinělými záchvaty. Prakticky identickou účinnost při operační léčbě uvádí recentní práce clevelandské skupiny, v níž bylo dosaženo bezzáchvatovosti u 59 % ze 17 pacientů s perirolandicky lokalizovanou FCD [3]. Stejně tak lze v clevelandském i našem souboru shodně pozorovat poměrně vysoké procento trvalého pooperačního deficitu – 25–50 %. Je pozoruhodné, že polovina pooperačního oslabení v celém našem souboru se objevila právě u pacientů s FCD. To je zřejmě podmíněno schopností dysplastického kortexu uchovat si původní funkčnost, čímž se riziko pooperační dysfunkce zvyšuje a naopak vzrůstá nutnost provedení pouze inkompletní resekce [14,15]. Naneštěstí takové případy mohou vést k akutnímu pooperačnímu zhoršení záchvatů [3]. V námi hodnoceném souboru jsme takovou situaci nezaznamenali, pooperační zhoršení se však objevilo u pacienta s FCD v perirolandické krajině, který pro nedostatečný odstup od operace nebyl do detailní analýzy zařazen (cca jeden rok po operaci).
Závěr
Na základě vlastních zkušeností i poměrně vzácných literárních dat se jeví v indikovaných případech resekční epileptochirurgie jako jednoznačně úspěšná a poměrně bezpečná metoda léčby farmakorezistentních pacientů s perirolandickou epilepsií, a to včetně MR negativních případů. Se stále intenzivnějším zaváděním pokročilých neurozobrazovacích metod (včetně funkční MR) a dnes již rutinní peroperační stereotaktickou navigací lze očekávat další minimalizaci existujícího operačního rizika. U pacientů s vysokým rizikem těžkého pooperačního neurologického deficitu je pak plně na místě zvážit stimulační terapii (stimulace nervus vagus, výhledově snad i hluboká mozková stimulace).
prof.
MUDr. Milan Brázdil, Ph.D.
Centrum
pro epilepsie Brno
I.
neurologická klinika
LF
MU a FN u sv. Anny v Brně
Pekařská
53
656
91 Brno
e-mail:
mbrazd@med.muni.cz
Sources
1. Cascino GD. Surgical treatment for extratemporal epilepsy. Curr Treat Options Neurol 2004; 6(3): 257–262.
2. Pondal-Sordo M, Diosy D, Téllez-Zenteno JF, GirvinJP, Wiebe S. Epilepsy surgery involving the sensory-motor cortex. Brain 2006; 129(12): 3307–3314.
3. Sarkis RA, Jehi LE, Bingaman WE, Najm IM. Surgical outcome following resection of rolandic focal cortical dysplasia. Epilepsy Res 2010; 90(3): 240–247.
4. Pilcher C, Meacham WR, Holbrook TJ. Partial excision of the motor cortex in treatment of jacksonian convulsions; results in 41 cases. Arch Surg 1947; 54(6): 633–643.
5. Sandok EK, Cascino GD. Surgical treatment for perirolandic lesional epilepsy. Epilepsia 1998; 39 (Suppl 4): S42–S48.
6. Brázdil M, Hadač J, Marusič P. Farmakorezistentní epilepsie. Praha: Triton 2004.
7. Engel J, Van Ness PC, Rasmussen TB, Ojemann LM. Outcome with respect to epileptic seizures. Surgical treatment of epilepsies. New York: Raven Press 1993: 609–621.
8. Palmini A, Najm I, Avanzini G, Babb T, Guerrini R, Foldvary-Schaefer N et al. Terminology and classification of the cortical dysplasias. Neurology 2004; 62 (Suppl 3): S2–S8.
9. Lehman R, Andermann F, Olivier A, Tandon PN, Quesney LF, Rasmussen TB. Seizures with onset in the sensorimotor face area: clinical patterns and results of surgical treatment in 20 patients. Epilepsia 1994; 35(6): 1117–1124.
10. Cukiert A, Buratini JA, Machado E, Sousa A, Vieira J, Forster M et al. Seizure’s outcome after cortical resections including the face and tongue rolandic areas in patients with refractory epilepsy and normal MRI submitted to subdural grids’ implantation. Arq Neuropsiquiatr 2001; 59(3B): 717–721.
11. Otsubo H, Chitoku S, Ochi A, Jay V, Rutka JT, Smith ML et al. Malignant rolandic-sylvian epilepsy in children: diagnosis, treatment, and outcomes. Neurology 2001; 57(4): 590–596.
12. Cohen-Gadol AA, Britton JW, Collignon FP, Bates LM, Cascino GD, Meyer FB. Nonlesional central lobule seizures: use of awake cortical mapping and subdural grid monitoring for resection of seizure focus. J Neurosurg 2003; 98(6): 1255–1262.
13. Brázdil M, Mikl M, Chlebus P, Pažourková M, Novák Z, Chrastina J et al. Combining advanced neuroimaging techniques in presurgical workup of non-lesional intractable epilepsy. Epileptic Disord 2006; 8(3): 190–194.
14. Preul MC, Leblanc R, Cendes F, Dubeau F, Reutens D, Spreafico R et al. Function and organization in dysgenic cortex. Case report. J Neurosurg 1997; 87(1): 113–121.
15. Vitali P, Minati L, D’Incerti L, Maccagnano E, Mavilio N, Capello D et al. Functional MRI in malformations of cortical development: activation of dysplastic tissue and functional reorganization. J Neuroimaging 2008; 18(3): 296–305.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery
2011 Issue 1
Most read in this issue
- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
