Ložiskové léze CNS u pacientů s HIV infekcí
Focal Affections of CNS in Patients with HIV Infection
Focal affections of the CNS are an important cause of morbidity and mortality in HIV-infected patients. HIV infection is rarely considered in patients with focal CNS symptomatology in the Czech Republic, a setting with low prevalence of HIV positivity. Nevertheless, delay in establishing a correct diagnosis has a negative influence on the patient’s prognosis and puts health-care workers at risk of infection. The most important causes of focal CNS affections in HIV-positive patients are: brain toxoplasmosis, primary CNS lymphoma, and progressive multifocal leuko-encephalopathy. The aetiology of other focal CNS affections in HIV-positive persons is similar to the situation in the normal population, but the incidence of these CNS affections in HIV-positive patients tends to be higher. A possible connection with HIV infection should be always taken in account, in order to establish a correct diagnosis as soon as possible, when the therapy can be most effective.
Key words:
HIV – focal CNS affections – brain toxoplasmosis – primary lymphoma
Authors:
R. Černý 1; J. Kapla 2; L. Machala 3
Authors‘ workplace:
Neurologická klinika dospělých 2. LF UK a FN v Motole, Praha
1; Klinika infekčních nemocí LF UK a FN Hradec Králové
2; I. infekční klinika 2. LF UK a Klinika infekčních nemocí 3. LF UK, FN Na Bulovce, Praha
3
Published in:
Cesk Slov Neurol N 2010; 73/106(4): 374-378
Category:
Review Article
Overview
Fokální afekce CNS jsou význačnou příčinou morbidity i mortality pacientů s HIV infekcí. V podmínkách nízké prevalence HIV infekce je u pacientů s projevy fokálního postižení CNS bohužel na tuto souvislost pomýšleno zřídka, a opožďuje se tak stanovení správné diagnózy, což může mít pro prognózu zásadní význam. Nejvýznamnějšími příčinami fokálního postižení CNS je u těchto pacientů mozková toxoplazmóza a primární lymfom CNS následovaný progresivní multifokální leukoencefalopatií. Etiologie ostatních ložiskových afekcí CNS se u HIV pozitivních osob zásadně neliší od situace v normální populaci, ale incidence těchto poruch CNS je u HIV pozitivních pacientů vyšší. Při diferenciální diagnóze u pacientů s ložiskovými afekcemi CNS by proto mělo vždy být zvažována i možná souvislost s HIV infekcí, aby mohla být včas stanovena správná diagnóza, kdy má léčba největší naději na úspěch.
Klíčová slova:
HIV – fokální afekce CNS – mozková toxoplazmóza – primární lymfom
Vypracováno s částečnou podporou grantu IGA NI5673
Úvod
Neurologické komplikace představují jednu z hlavních příčin morbidity i mortality pacientů s HIV infekcí. Nejméně třetina pacientů prodělá alespoň jedno neurologické onemocnění související s HIV a u zemřelých HIV pozitivních osob je při pitvě nalézáno postižení nervového systému ve více než 50 % [1]. Postižena může být kterákoliv část centrálního i periferního nervového systému, ovšem nejzávažnějším typem komplikací jsou ložiskové afekce CNS [2–8].
Přestože u nás zůstává prevalence HIV infekce dosud poměrně nízká, představují pacienti s HIV infekcí v praxi klinicky významnou a diagnosticky komplikovanou skupinu neurologicky nemocných a do budoucna lze očekávat výrazný narůst jejich počtů.
Problém je, že možnost neurologického onemocnění souvisejícího s HIV infekcí je u nás stále zvažována spíše výjimečně a pozdě. Autoři se opakovaně setkali s případy, kdy pacienti s ložiskovou lézí CNS byli podrobováni rozsáhlé diagnostice včetně invazivních zákroků a o možnosti diagnózy HIV infekce se uvažovalo až po vyčerpání všech dostupných diagnostických možností. Přitom však právě znalost HIV pozitivity by diferenciálnědiagnostický postup jednoznačně orientovala správným směrem. Včasné odhalení HIV infekce by na straně jedné pacienta ušetřilo zátěže spojené s operačním výkonem a umožnilo co nejdříve zahájit optimální léčbu, na straně druhé by zdravotníky zbytečně nevystavovalo riziku profesionální infekce.
Uvádíme zde proto přehled nejdůležitějších fokálních lézí u pacientů s HIV infekcí a doporučujeme, aby vyšetření na HIV bylo zahrnuto do základního algoritmu diferenciální diagnostiky ložiskových lézí CNS.
Výskyt neurologických komplikací sdružených s HIV infekcí stoupá především v pozdních stadiích choroby, ale objevit se mohou ve všech fázích onemocnění včetně akutní HIV infekce [9]. Přibližně u 10–15 % pacientů jsou neurologické komplikace dokonce prvními klinickými symptomy, které na přítomnost infekce HIV upozorní [10].
S HIV infekcí jsou typicky úzce asociované mozková toxoplazmóza a primární lymfom CNS, které se vyskytují prakticky výhradně ve stadiu hlubokého imunodeficitu. S pokročilou HIV infekcí je též spojen výskyt progresivní multifokální leukoencefalopatie.
U HIV pozitivních pacientů s méně pokročilým imunodeficitem se etiologie fokálních lézí CNS sice zásadně neliší od situace u osob HIV negativních, tyto se však zde vyskytují častěji než ve srovnatelné populaci.
Mozková toxoplazmóza
Na počátku pandemie HIV byla mozková toxoplazmóza nejčastější příčinou ložiskového postižení CNS u pacientů s HIV infekcí, ovšem po zavedení kombinované antiretrovirové terapie (cART) a účinné chemoprofylaxe její výskyt významně poklesl [11]. Mozková toxoplazmóza se tak v současné době vyskytuje především u osob, které o své HIV pozitivitě dosud nevěděly, nebo u HIV pozitivních pacientů, kteří odmítají léčbu [12].
Původcem onemocnění je prvok Toxoplasma gondii a u pacientů s HIV infekcí se jedná výhradně o reaktivace latentní infekce. Onemocnění se vyskytuje při pokročilé HIV infekci s počtem CD4+ T lymfocytů < 100/μl.
Onemocnění se obvykle rozvíjí v průběhu dní. Nejčastějším úvodním příznakem je bolest hlavy, postupně se přidávají fokální příznaky. Teplota může být normální nebo zvýšená, ale není horečka. Ložiskové neurologické příznaky, jako parézy, fokální epileptické záchvaty, poruchy čití nebo poruchy funkce mozkových nervů, jsou určeny lokalizací lézí v CNS. Vyskytují se ale i poruchy vědomí a chování, kognitivní poruchy, výpadky zorného pole, dysmetrie, tremor, ataxie, hemichorea a parkinsonizmus. Meningeální příznaky obvykle nebývají pozitivní [1].
Na CT nebo MR jsou typicky přítomné hypodenzní léze s postkontrastně se sytícím prstenčitým lemem (ring enhancing), charakteristický je perifokální edém a expanzivní chování [13]. Léze jsou obvykle mnohočetné, často bilaterální, průměr je většinou méně než 4 cm a typicky se vyskytují supratentoriálně na rozhraní kortexu a bílé hmoty [1,14].
Diagnózu mozkové toxoplazmózy významně podporuje přítomnost IgG protilátek v séru, séronegativita však onemocnění nevylučuje [13].
Vyšetření likvoru je pro diagnózu málo přínosné, nejčastěji nacházíme nespecifickou hyperproteinorhachii a lymfocytární pleocytózu, nález může ale být i zcela normální. Definitivní stanovení diagnózy je možné histologicky, ale provedení mozkové biopsie není v praxi obvykle indikováno, proto diagnózu obvykle potvrzujeme empiricky metodou tzv. terapeutického pokusu. Zahájení terapeutického pokusu se považuje za dostatečně odůvodněné, když je u HIV+ pacienta s hlubokým imunodeficitem, který neužívá profylaxi, přítomen následující soubor příznaků: fokální neurologické projevy, charakteristický rentgenologický nález a pozitivita sérových protilátek [1,15]. Základem léčby je kombinace pyrimetamin + sulfadiazin po dobu alespoň 6 týdnů. Dojde-li po 2–3 týdnech útočné léčby ke klinickému zlepšení a po 4–8 týdnech k ústupu rentgenologického nálezu, považuje se diagnóza mozkové toxoplazmózy za prokázanou; v opačném případě je nutno pomýšlet především na primární lymfom CNS [15,16].
Neléčená mozková toxoplazmóza je vždy smrtelné onemocnění, naopak řádně léčení pacienti mají dobrou prognózu. Včasné stanovení diagnózy mozkové toxoplazmózy je tedy pro přežití pacienta, jak demonstruje následující kazuistika, naprosto rozhodující.
Kazuistika pozdě rozpoznané mozkové toxoplazmózy
Dosud zdravý muž starý 40 let byl akutně hospitalizován pro záchvaty bezvědomí a tranzientní expresivní afázie. Záchvaty trvající řádově minuty se začaly objevovat několik dní před přijetím. CT a MR mozku prokázalo solitární, prstenčitě se opacifikující expanzi ve frontálním laloku parasagitálně vlevo s perifokálním edémem (obr. 1).
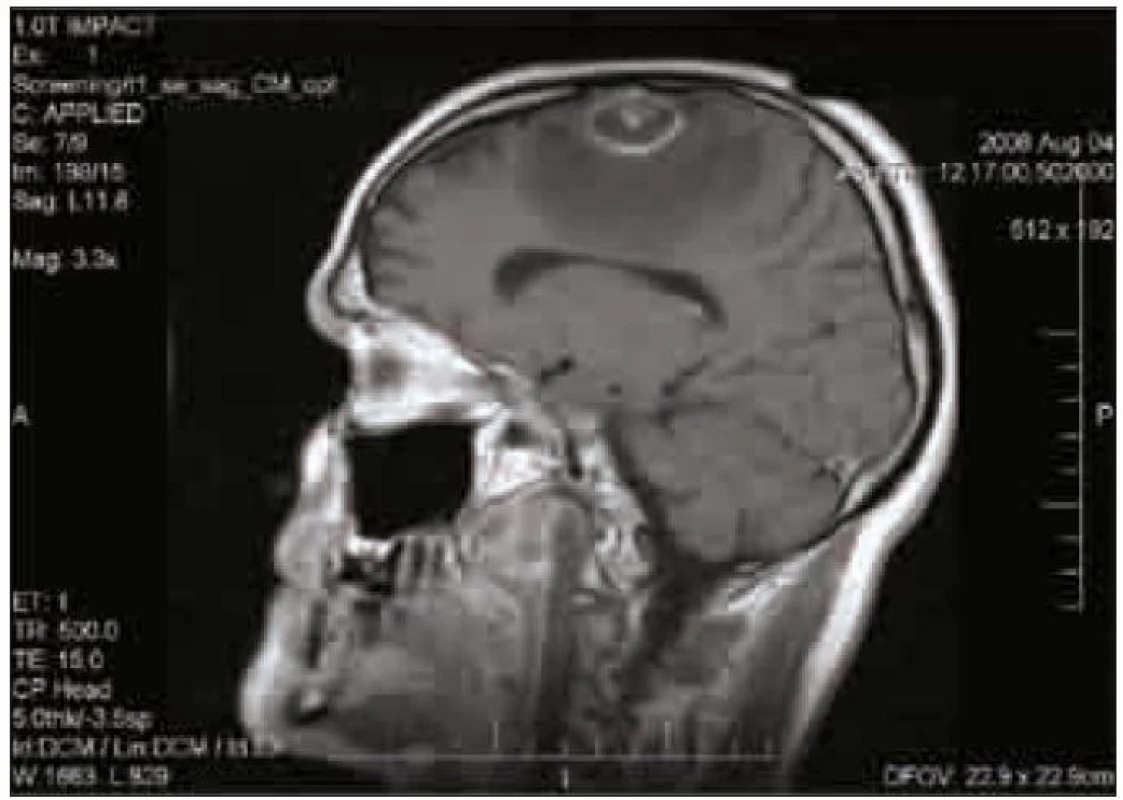
Stav byl hodnocen jako solitární tumor mozku, a proto byla provedena resekce ložiska. Ihned po výkonu se manifestovala pravostranná hemiparéza a expresivní fatická porucha. Dva dny po operaci došlo ke kumulaci epileptických záchvatů a rozvoji kvantitativní poruchy vědomí. Kontrolní MR mozku prokázala mnohočetná drobná ložiska kortikálně i subkortikálně bez specifické predilekce. V dalších dnech se porucha vědomí prohloubila do hlubokého kómatu s nutností umělé plicní ventilace. Teprve v této fázi bylo k dispozici histologické vyšetření, které v resekované tkáni prokázalo velké množství tachyzoitů Toxoplasma gondii. Následně byla potvrzena pokročilá HIV infekce ve stadiu hlubokého imunodeficitu s počtem CD4+ T lymfocytů 10/μl a masivní virovou náloží HIV RNA 902 000 kopií/ml. Ihned byla zahájena antiparazitární léčba kombinací pyrimetamin + sulfadiazin + klindamycin a cART (tenofovir + emtricitabin+lopinavir/ritonavir), která však již nedokázala průběh onemocnění příznivě ovlivnit. Stav se dále komplikoval CMV pneumonií a sepsí a přes další intenzivní terapii pacient umírá.
Kazuistika demonstruje nepříznivý průběh pozdě diagnostikované mozkové toxoplazmózy u pacienta s HIV infekcí. Včas a správně léčená toxoplazmóza má i u pacientů s velmi hlubokým imunodeficitem většinou příznivou prognózu quoad vitam. V daném případě není jisté, zda by i včas zahájená terapie pacienta zachránila, je však zřejmé, že nevhodně indikovaný neurochirurgický výkon a pozdní zahájení kauzální terapie mělo na fatální zakončení případu podstatný vliv.
Primární lymfom CNS
Primární lymfom CNS (PLCNS) je u HIV pozitivních osob nejčastějším nádorem CNS a po mozkové toxoplazmóze druhou nejčastější příčinu fokálních příznaků. Postihuje převážně HIV pozitivní osoby s hlubokým imunodeficitem s počtem CD4+ T lymfocytů < 50/μl a jeho výskyt je u těchto pacientů 1 000krát vyšší než v ostatní populaci [17]. Etiologie PLCNS je jednoznačně dávána do souvislosti s virem Epsteina-Barrové (EBV). Histologicky jde o nádor z B lymfocytů, který vytváří solitární nebo mnohočetná ložiska v mozku, zvláště periventrikulárně. Projevy onemocnění se rozvíjí subakutně v průběhu týdnů, možný je i akutní počátek – např. při krvácení do tumoru. Neurologické příznaky zahrnují projevy nitrolební hypertenze s bolestí hlavy, letargií a zmateností, a dále projevy fokální, jakými jsou afázie, výpadky zorného pole, hemiparézy či fokální epileptické záchvaty. Meningeální příznaky bývají pozitivní vzácně.
Pro diagnózu je nejdůležitější MR nebo CT mozku. Charakteristickým nálezem na MR je přítomnost obvykle solitárních, postkontrastně se sytících lézí v periependymální oblasti či periventrikulárně. Léze často postihují corpus callosum, bývají větší než 4 cm, mají obvykle homogenní strukturu a jsou obklopeny rozsáhlým edémem.
Pokud není kontraindikována lumbální punkce, je v likvoru téměř ve 100 % prokazatelná přítomnost EBV pomocí PCR. V likvoru bývá pleocytóza tvořená zčásti nádorovými buňkami, ostatní změny v likvoru jsou nespecifické.
U HIV pozitivních pacientů je třeba diferenciálně diagnosticky odlišit PLCNS především od mozkové toxoplazmózy, jak je uvedeno v tab. 1 [15].

Léčebné možnosti PLCNS zůstávají dosud velmi omezené, a prognóza je tak stále infaustní – v současné době se střední doba přežití pohybuje mezi 11–22 měsíci [18]. Standardní terapií je ozařování ložiska a CNS v dávce 40 až 50 Gy provázené podáváním kortikoidů, které snižují mozkový edém před zahájením aktinoterapie a v jejím průběhu [19]. S cytostatickou chemoterapií je u HIV pozitivních pacientů dosud málo zkušeností [20,21].
Progresivní multifokální leukoencefalopatie
Progresivní multifokální leukoencefalopatie (PML) je subakutní demyelinizační onemocnění CNS způsobené reaktivací latentní infekce lidským polyomavirem JC (JCV), které postihuje prakticky výhradně imunodeficitní osoby. U HIV pozitivních pacientů se obvykle objevuje při poklesu CD4+ T lymfocytů hluboko pod 100/μl a má zpravidla fatální průběh. Před zavedením antiretrovirové terapie cART postihovala PML kolem 4 % pacientů s HIV infekcí, v současné době je s PML třeba počítat především u pacientů s rezistencí na terapii či u dosud neléčených pacientů včetně těch, kteří o své HIV pozitivitě dosud nevědí [22,23].
Klinicky je PML subakutně až chronicky probíhající afebrilní onemocnění s obvykle plíživým začátkem v průběhu týdnů. Charakteristickými příznaky jsou poruchy zraku, řeči, paměti, kognitivních funkcí, spastické parézy a ataxie.
Typickým CT nálezem je asymetrické hypodenzní postižení bílé hmoty bez známek expanzivního chování s chybějícím nebo jen naznačeným postkontrastním enhancementem. Zvláště na počátku onemocnění ale může být CT mozku normální.
Citlivější metodou je MR, která na T2 vážených obrazech a FLAIR sekvencích ukazuje mnohočetná hyperintenzní ložiska lokalizovaná především v subkortikální bílé hmotě. Při PML asociované s HIV se léze obvykle lokálně kumulují v určitých oblastech CNS, zatímco u pacientů bez HIV infekce postihuje PML obvykle difuzně obě mozkové hemisféry [24].
V likvoru bývá u 50 % pacientů mírná hyperproteinorhachie a u 15 % nemocných pleocytóza maximálně do 50 buněk/μl, často ale bývá likvorový nález normální. Diagnózu potvrdí průkaz JCV v likvoru pomocí PCR, toto vyšetření je sice vysoce specifické, ale senzitivita se udává jen 65–80 % [22,25]. K potvrzení diagnózy lze použít vyšetření mozkové biopsie, tu však má smysl indikovat jen u pacientů s negativním výsledkem PCR v likvoru.
Léčebné výsledky všech dosud užitých terapeutických postupů jsou velmi neuspokojivé a bez zásadního vlivu na průběh onemocnění. Zavedení cART vedlo sice k výraznému poklesu výskytu PML, ovšem na prognózu manifestního onemocnění tato léčba již zřejmě valný vliv nemá [26,27].
Cerebrovaskulární komplikace
Riziko cerebrovaskulárních onemocnění je u pacientů s HIV infekcí přibližně o 10 % vyšší nežli u ostatních osob stejného věku a dále narůstá s délkou trvání HIV infekce, poklesem počtu CD4 lymfocytů a vzestupem virové nálože. Příčinou této situace je kromě vlivu všeobecně známých rizik též kumulace dalších faktorů – imunodeficitu a chronické infekce, nutriční poruchy, abúzus drog, toxicita některých antiretrovirotik a zřejmě i vliv HIV infekce samotné [28,29].
U pacientů s HIV infekcí výrazně převažují ischemické CMP proti hemoragiím, kterých je jen asi 1 % [30].
V pozdějších fázích HIV infekce s hlubším imunodeficitem se objevují vaskulitidy způsobené infekcemi, jakými jsou syfilis nebo infekce virem varicella-zoster [31–34].
Již v počátečních fázích HIV infekce je přítomno zvýšené riziko vzniku ischemického poškození CNS podmíněného přítomností antifosfolipidových protilátek následkem chronické aktivace B lymfocytů při HIV infekci [35].
Další důležitou příčinou vzniku cerebrovaskulárních komplikací je metabolický syndrom s hyperlipidemií způsobený antiretrovirovou terapií, který postihuje 20–80 % léčených pacientů [36,37]. Z tohoto hlediska riziko zvyšují zejména inhibitory HIV proteázy, které jsou součástí většiny léčebných režimů [38–40].
V časných stadiích HIV infekce se hemoragické CMP vzácně objevují v souvislosti s HIV asociovanou idiopatickou trombocytopenickou purpurou [43].
Krvácení do CNS je dále vzácnou komplikací při léčbě inhibitory HIV proteázy, která postihuje zvláště hemofiliky, mechanizmus vzniku dosud není jasný [41].
Tuberkulóza a kryptokokóza CNS
S HIV infekcí je typicky asociována kryptokoková meningitida a tuberkulóza. Obě tyto infekce mohou být komplikovány vznikem fokálních lézí CNS.
Tuberkulóza CNS je v našich podmínkách vzácná, v rozvojových zemích však mozkový tuberkulom patří k nejčastějším příčinám fokálních afekcí CNS vůbec. Mozková tuberkulóza je ve více než polovině případů sdružena s postižením plicním a může se vyskytnout i u pacientů bez výrazného imunodeficitu [42]. Na CT se tuberkulom prezentuje jako solidní nebo prstenčité ložisko, obvykle bez expanzivního chování, častá je centrální kalcifikace. MR nálezy jsou variabilní, typické jsou nodulární léze s prstenčitým enhancementem, které mohou být hyperintenzní i hypointenzní v T2 vážených obrazech [43].
Kryptokokom se u HIV pozitivních pacientů vyskytuje prakticky výhradně jako komplikace kryptokokové meningitidy u pacientů s CD4+ T lymfocyty < 100/μl. Pro kryptokokovou meningitidu je v MR obraze typické enhancující ztluštění mening a přítomnost mnohočetných drobných tečkovitých lézí v oblasti bazálních ganglií. Tyto léze jsou hyperintenzní v T2 a hypointenzní v T1 vážených obrazech a vznikají akumulací blastocyst ve Virchow-Robinových prostorách. Kryptokokom se na MR projeví obvykle jako solitární, méně často vícečetný hypointenzní útvar bez postkontrastního lemu a perifokálního edému [44].
Demyelinizační onemocnění CNS
U pacientů s HIV infekcí se velmi vzácně může objevit onemocnění, jehož klinický průběh i MR nález připomíná roztroušenou sklerózu mozkomíšní (RS) – tzv. multiple sclerosis-like illness [45]. Dosud byl popsán jen omezený počet případů a není jasné, zda se jedná o náhodnou koincidenci roztroušené sklerózy a HIV infekce, nebo skutečnou RS indukovanou HIV virem. Akutně remitentní průběh je prakticky neodlišitelný od vývoje RS u HIV negativních osob. Nejčastější manifestací je optická neuritida a fokální demyelinizace mozku a míchy [46,47].
Závěr
HIV infekce významně zvyšuje riziko vzniku fokálního postižení CNS, a je tedy nutné i u nás, kde je dosud nízká prevalence, počítat s výskytem pacientů, kteří mají příznaky ložiskového postižení CNS a dosud o své HIV infekci neví nebo o ní zdravotníky neinformují.
Opožděná diagnóza HIV infekce znamená výrazné zhoršení prognózy, protože pacient je zbytečně zatěžován mnohdy invazivními diagnostickými zákroky a není včas zahájena optimální léčba. Nesprávně indikované neurochirurgické výkony navíc představují i zbytečné riziko infekce pro operatéra.
Včasné stanovení diagnózy je zásadně důležité zejména u mozkové toxoplazmózy, protože pozdní zahájení specifické chemoterapie podstatně snižuje šance pacienta na přežití. Tuto skutečnost dokumentuje výše uvedená kazuistika, která bohužel není zdaleka ojedinělá.
Lékaři, a zejména neurologové, by měli proto vždy v diferenciální diagnostice ložiskových afekcí CNS pomýšlet i na možnost HIV infekce, aby mohla být stanovena správná diagnóza již v časné fázi rozvoje, kdy má léčba největší naději na úspěch.
MUDr. Rudolf Černý, CSc.
Neurologická klinika dospělých
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: rudolf.cerny@lfmotol.cuni.cz
Přijato k recenzi: 3. 12. 2009
Přijato do tisku: 10. 3. 2010
Sources
1. Brew B. HIV Neurology. In: Gilman S, Herdman W (eds). Contemporary Neurology Series. New York: Oxford University Press 2001.
2. Britton CB, Miller JR. Neurologic complications in acquired immunodeficiency syndrome (AIDS). Neurol Clin 1984; 2(2): 315–339.
3. Gong V. Acquired immunodeficiency syndrome (AIDS). Am J Emerg Med 1984; 2(4): 336–346.
4. Levy JA, Kaminsky LS, Morrow WJ, Steimer K, Luciw P, Dina D et al. Infection by the retrovirus associated with the acquired immunodeficiency syndrome. Clinical, biological, and molecular features. Ann Intern Med 1985; 103(5): 694–699.
5. Portegies P, Solod L, Cinque P, Chaudhuri A, Begovac J, Everall I et al. Guidelines for the diagnosis and management of neurological complications of HIV infection. Eur J Neurol 2004; 11(5): 297–304.
6. Snider WD, Simpson DM, Nielsen S, Gold JW, Metroka CE, Posner JB. Neurological complications of acquired immune deficiency syndrome: analysis of 50 patients. Ann Neurol 1983; 14(4): 403–418.
7. Whelan MA, Kricheff II, Handler M, Ho V, Crystal K, Gopinathan G et al. Acquired immunodeficiency syndrome: cerebral computed tomographic manifestations. Radiology 1983; 149(2): 477–484.
8. Koppel BS, Wormser GP, Tuchman AJ, Maayan S, Hewlett D Jr, Daras M. Central nervous system involvement in patients with acquired immune deficiency syndrome (AIDS). Acta Neurol Scand 1985; 71(5): 337–353.
9. Černý R, Machala L, Hobstová J. Neurologické projevy akutní HIV infekce. Cesk Slov Neurol N 2004; 67/100(2): 84–88.
10. Trujillo JR, Jaramillo-Rangel G, Ortega-Martinez M, Penalva de Oliveira AC, Vidal JE, Bryant J et al. International NeuroAIDS: prospects of HIV-1 associated neurological complications. Cell Res 2005; 15(11–12): 962–969.
11. Abgrall S, Rabaud C, Costagliola D. Incidence and risk factors for toxoplasmic encephalitis in human immunodeficiency virus-infected patients before and during the highly active antiretroviral therapy era. Clin Infect Dis 2001; 33(10): 1747–1755.
12. Olatinwo TF, Herbowy MT, Hewitt RG. Toxoplasmic encephalitis and primary lymphoma of the brain - the shift in epidemiology: a case series and review of the literature. AIDS Read 2001; 11(9): 444–449.
13. Bohutová J, Štrof J, Staňková M. Postižení mozku u nemocných s HIV/AIDS v CT obraze. Ces Radiol 2001; 55: 351–355.
14. Sell M, Sander B, Klingebiel R. Ventriculitis and hydrocephalus as the primary manifestation of cerebral toxoplasmosis associated with AIDS. J Neurol 2005; 252(2): 234–236.
15. Bartlett J, Gallant J. Medical management of HIV infection. Baltimore: John Hopkins Medicine Health Publishing Business Group 2004.
16. Gildenberg PL, Gathe JC Jr, Kim JH. Stereotactic biopsy of cerebral lesions in AIDS. Clin Infect Dis 2000; 30(3): 491–499.
17. MacMahon EM, Glass JD, Hayward SD, Mann RB, Becker PS, Charache P et al. Epstein-Barr virus in AIDS-related primary central nervous system lymphoma. Lancet 1991; 338(8773): 969–973.
18. Skiest DJ, Crosby C. Survival is prolonged by highly active antiretroviral therapy in AIDS patients with primary central nervous system lymphoma. AIDS 2003; 17(12): 1787–1793.
19. Korfel A, Thiel E. Successful treatment of non-Hodgkin’s lymphoma of the central nervous system with BMPD chemotherapy followed by radiotherapy. Leuk Lymphoma 1998; 30(5–6): 609–617.
20. Gavrilovic IT, Abrey LE. Diagnosis and treatment of primary central nervous system lymphoma. Curr Oncol Rep 2005; 7(1): 47–54.
21. Pels H, Schmidt-Wolf IG, Glasmacher A, Schulz H, Engert A, Diehl V et al. Primary central nervous system lymphoma: results of a pilot and phase II study of systemic and intraventricular chemotherapy with deferred radiotherapy. J Clin Oncol 2003; 21(24): 4489–4495.
22. Weber T. Progressive multifocal leukoencephalopathy. Neurol Clin 2008; 26(3): 833–854.
23. Berger J, Levy M. Progressive multifocal leukoencephalopathy. In: Berger J, Levy R (eds). AIDS and the Nervous System. 2nd ed. Philadelphia: Lippincott-Raven Publishers 1997: 569–594.
24. Bakshi R. Neuroimaging of HIV and AIDS related illnesses: a review. Front Biosci 2004; 9: 632–646.
25. Cinque P, Scarpellini P, Vago L, Linde A, Lazzarin A. Diagnosis of central nervous system complications in HIV-infected patients: cerebrospinal fluid analysis by the polymerase chain reaction. AIDS 1997; 11(1): 1–17.
26. Aksamit AJ. Progressive multifocal leukoencephalopathy. Curr Treat Options Neurol 2008; 10(3): 178–185.
27. d’Arminio Monforte A, Cinque P, Mocroft A, Goebel FD, Antunes F, Katlama C et al. Changing incidence of central nervous system diseases in the EuroSIDA cohort. Ann Neurol 2004; 55(3): 320–328.
28. Cole JW, Pinto AN, Hebel JR, Buchholz DW, Earley CJ, Johnson CJ et al. Acquired immunodeficiency syndrome and the risk of stroke. Stroke 2004; 35(1): 51–56.
29. d’Arminio A, Sabin CA, Phillips AN, Reiss P, Weber R, Kirk O et al. Cardio- and cerebrovascular events in HIV-infected persons. AIDS 2004; 18(13): 1811–1817.
30. Ortiz G, Koch S, Romano JG, Forteza AM, Rabinstein AA. Mechanisms of ischemic stroke in HIV-infected patients. Neurology 2007; 68(16): 1257–1261.
31. Engstrom JW, Lowenstein DH, Bredesen DE. Cerebral infarctions and transient neurologic deficits associated with acquired immunodeficiency syndrome. Am J Med 1989; 86(5): 528–532.
32. Picard O, Brunereau L, Pelosse B, Kerob D, Cabane J, Imbert JC. Cerebral infarction associated with vasculitis due to varicella zoster virus in patients infected with the human immunodeficiency virus. Biomed Pharmacother 1997; 51(10): 449–454.
33. Peters M, Gottschalk D, Boit R, Pohle HD, Ruf B. Meningovascular neurosyphilis in human immunodeficiency virus infection as a differential diagnosis of focal CNS lesions: a clinicopathological study. J Infect 1993; 27(1): 57–62.
34. Zellan J, Augenbraun M. Syphilis in the HIV-infected patient: an update on epidemiology, diagnosis, and management. Curr HIV/AIDS Rep 2004; 1(3): 142–147.
35. de Larrañaga GF, Forastiero RR, Carreras LO, Alonso BS. Different types of antiphospholipid antibodies in AIDS: a comparison with syphilis and the antiphospholipid syndrome. Thromb Res 1999; 96(1): 19–25.
36. Bozzette SA, Ake CF, Tam HK, Chang SW, Louis TA. Cardiovascular and cerebrovascular events in patients treated for human immunodeficiency virus infection. N Engl J Med 2003; 348(8): 702–710.
37. Kulasekaram R, Peters BS, Wierzbicki AS. Dyslipidaemia and cardiovascular risk in HIV infection. Curr Med Res Opin 2005; 21(11): 1717–1725.
38. Taiwo BO. Insulin resistance, HIV infection, and anti-HIV therapies. AIDS Read 2005; 15(4): 171–176, 179–180.
39. Friis-Møller N, Weber R, Reiss P, Thiébaut R, Kirk O, d’Arminio Monforte A et al. Cardiovascular disease risk factors in HIV patients – association with antiretroviral therapy. Results from the DAD study. AIDS 2003; 17(8): 1179–1193.
40. Sax PE. Strategies for management and treatment of dyslipidemia in HIV/AIDS. AIDS Care 2006; 18(2): 149–157.
41.Arbuthnot C, Wilde JT. Increased risk of bleeding with the use of tipranavir boosted with ritonavir in haemophilic patients. Haemophilia 2008; 14(1): 140–141.
42. Modi M, Mochan A, Modi G. Management of HIV-associated focal brain lesions in developing countries. QJM 2004; 97(7): 413–421.
43. Wasay M, Kheleani KB, Moolani MK, Zaheer J, Pui M, Hasan S et al. Brain CT and MRI findings in 100 consecutive patients with intracranial tuberculoma. J Neuroimaging 2003 13(3): 240–247.
44. Corti M, Villafañe M, Negroni R, Arechavala A, Maiolo E. Magnetic resonance imaging findings in AIDS patients with central nervous system cryptococcosis. Rev Iberoam Micol 2008; 25(4): 211–214.
45. Berger JR, Sheremata WA, Resnick L, Atherton S, Fletcher MA, Norenberg M. Multiple sclerosis-like illness occurring with human immunodeficiency virus infection. Neurology 1989; 39(3): 324–329.
46. Coban A, Akman-Demir G, Ozsut H, Eraksoy M. Multiple sclerosis-like clinical and magnetic resonance imaging findings in human immunodeficiency virus positive-case. Neurologist 2007; 13(3): 154–157.
47. Durán E, Gálvez J, Patrignani G, Izquierdo G. Multiple sclerosis-like illness in a HIV-1 patient. J Neurol 2004; 251(9): 1142–1144.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 4
Most read in this issue
- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Farmakologická léčba epilepsie
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
- Funkční význam pólu temporálního laloku
