Změny na perfuzní počítačové tomografii po konvenčním extra‑ intrakraniálním bypassu
Changes in Perfusion Computed Tomography after Conventional Extra‑ Intracranial Bypass Surgery
Aim:
The aim of this study was to evaluate the perfusion parameters acquired by perfusion computed tomography (CT) examination of patients after extra- intracranial (EC- IC) bypass surgery. Patients and methods: The set consisted of 14 patients who underwent conventional bypass surgery at our department during the years 2005– 2008. In all patients, perfusion CT was performed before and after surgery and perfusion magnetic resonance after surgery. The results of the measurements of specific perfusion parameters were compared and the statistical significance of pre‑ and postoperative differences was evaluated. Results: After the EC- IC bypass surgery, reconstitution of cerebrovascular reserve capacity (CVRC) was achieved, according to the perfusion CT results, in all but one of the patients. A significant difference (p = 0.001) of the change index of cerebral blood flow (at rest/ in stress conditions) in pre‑operative and postoperative examinations was found using the paired T- test. However, there was no significant difference between pre‑ and postoperative cerebral blood flow values at rest. A significant (p <0.05) difference was found between pre‑operative and postoperative time to peak (TTP) values at rest, and also a borderline significant difference of TTP change index (p = 0.049). Conclusion: A significant improvement in CVRC after EC- IC bypass surgery was confirmed in patients with preoperative deficit, using the perfusion CT examination.
Key words:
perfusion computed tomography – extra-intracranial bypass – cerebrovascular reserve capacity
Authors:
M. Sameš 1; T. Radovnický 1; A. Zolal 1; M. Nováková 2; M. Derner 2; P. Vachata 1; R. Bartoš 1
Authors‘ workplace:
Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
Neurochirurgická klinika Univerzity J. E. Purkyně
1; Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
Radiodiagnostické odd.
2
Published in:
Cesk Slov Neurol N 2010; 73/106(3): 267-273
Category:
Original Paper
Overview
Cíl:
Cílem této práce bylo zhodnotit vývoj perfuzních parametrů vyšetřovaných pomocí perfuzního CT u pacientů po extra‑ intrakraniálním (EC‑IC) bypassu. Soubor a metodika: Soubor obsahuje 14 pacientů, kteří na naší klinice podstoupili konvenční bypass v letech 2005– 2008. U všech pacientů bylo provedeno perfuzní CT před operací i po ní a perfuzní MR po operaci, výsledky měření jednotlivých perfuzních parametrů pak byly porovnány a byla zhodnocena statistická významnost rozdílu před operací a po ní. Výsledky: U všech pacientů kromě jednoho došlo po EC- IC bypassu k restituci cerebrovaskulární rezervní kapacity (CVRC) dle výsledků perfuzního CT. Při analýze pomocí párového t‑testu byl nalezen signifikantní rozdíl (p = 0,001) při porovnání indexu změny mozkového průtoku (CBF) (v klidu/ po zátěži) v předoperačních a pooperačních vyšetřeních, naopak významný rozdíl mezi klidovými hodnotami CBF nalezen nebyl. Signifikantní (p < 0,05) rozdíl mezi předoperačními a pooperačními výsledky byl taktéž nalezen jak pro hodnoty TTP (time to peak) při klidovém vyšetření, tak pro index změny TTP, kde však byla signifikance rozdílu již hraniční (p = 0,049). Závěr: Pomocí perfuzního CT bylo prokázáno výrazné zlepšení CVRC po provedení EC- IC bypassu u pacientů s předoperačně prokázaným deficitem.
Klíčová slova:
perfuzní počítačová tomografie – extra-intrakraniální bypass – cerebrovaskulární rezervní kapacita
Podpořeno grantem IGA MZČR NR 8849- 4/ 2006
Úvod
Extra- intrakraniální anastomóza (EC‑IC bypass) je v současné době všeobecně uznávaný revaskularizační výkon u pacientů se symptomatickou okluzí arteria carotis interna (ACI) a vyčerpanou cerebrovaskulární rezervní kapacitou (CVRC, cerebrovascular reserve capacity). Historie této operace je však komplikovaná a své místo ve spektru neurochirurgických výkonů si tento postup musel obhájit. První výkon tohoto typu byl proveden již v roce 1967 Yaşargilem a Donaghym. Poté se indikace EC‑IC bypassu postupně rozšiřovala, tento typ operace byl prováděn téměř u všech pacientů s okluzí ACI. V roce 1985 však byla publikována Barnettova mezinárodní studie, která neprokázala účinek výkonu v prevenci iktu, proto se na dlouhou dobu od tohoto typu operace upustilo [1]. Do této studie však byli zařazeni všichni pacienti s okluzí ACI, bez ohledu na hemodynamické poměry. Význam hemodynamických poměrů v patofyziologii iktu nebyl do té doby rozpoznán a vyšetřování cerebrovaskulární rezervní kapacity nebylo známo. Až v roce 1994 Schmiedek, Piepgras et al publikovali svou práci, která obhajuje indikaci EC‑IC bypassu u přísně selektovaných pacientů. Jako indikační kritéria tato práce uvádí symptomatickou okluzi vnitřní karotidy, dostatečně průchodnou kontralaterální ACI, absenci velkého ischemického ložiska na CT či MR mozku (přítomnost tzv. borderzone ischemie však indikaci neomezuje) a zejména vyčerpanou CVRC [2]. Po této publikaci se EC‑IC bypass opět postupně rozšiřoval do té míry, že je u selektovaných pacientů považován za indikovaný [3,4].
Perfuzní CT mozku představuje perspektivní vyšetřovací modalitu jak pro vyšetření akutních stavů vyžadujících posouzení mozkové perfuze, tak stavů s chronicky nedostatečným zásobením mozkové tkáně krví. Jeho hlavními výhodami jsou široká dostupnost přístrojového vybavení a zejména pak rychlost a nekomplikovanost provedení, která nemá v rámci zobrazovacích metod použitelných pro vyšetření cerebrovaskulární rezervní kapacity konkurenci [5]. Komerčně dostupný software, většinou dodávaný přímo výrobcem CT, pak často umožňuje i semikvantitativní nebo kvantitativní analýzu získaných dat na základě určení oblastí zájmu (ROI, region of interest). Mezi nevýhody tohoto způsobu vyšetření pak samozřejmě patří radiační zátěž, jíž je pacient vystaven, dále nutnost použití jódové kontrastní látky, v případě starších CT přístrojů malý rozsah zobrazené mozkové tkáně a v neposlední řadě pak matematická komplexnost zpracování dat a závislost některých výsledků na volbě oblasti ke zjištění parametru vstupní arteriální funkce (AIF, arterial input function) použité v dekonvolučním algoritmu. Přitom vliv volby oblasti k detekci AIF na konečné výsledky zůstává přes extenzivní vědeckou diskuzi v odborném tisku přesně neurčen [6].
Na našem pracovišti bylo od května roku 1998 do července 2008 provedeno 76 EC‑IC bypassů. Předmětem našeho zájmu byli pacienti s předoperačně provedeným perfuzním CT mozku, toto vyšetření se předoperačně na našem pracovišti provádí standardně od roku 2005. Cílem práce bylo porovnat výsledky původních předoperačních vyšetření s výsledky vyšetření provedených s odstupem od operace, zaznamenat klinický stav pacientů a výskyt eventuálních ischemických příhod v období po operaci a určit použitelnost vyšetření pro rutinní klinické vyšetření pacientů po standardním EC‑IC bypassu. Dalším cílem práce pak bylo porovnání výsledků perfuzního CT s výsledky perfuzní magnetické rezonance (DSC, dynamic susceptibility contrast), neboť tato metoda přes jistou technologickou náročnost představuje možnost vyšetření perfuze v celém objemu mozku.
Pacienti a metody
Všichni pacienti v našem souboru byli předoperačně vyšetřeni perfuzním CT mozku v klidu a při hyperkapnii. Mezi lety 2005– 2008 podstoupilo na naší klinice operaci EC‑IC bypassu celkem 27 pacientů. Šest pacientů pooperační vyšetření v rámci studie odmítlo, dva pacienti v mezidobí zemřeli na onkologická onemocnění, tři pacienty se nám nepodařilo kontaktovat, u dvou pacientů pak data z předoperační perfuzní CT studie nebyla dostupná pro technickou poruchu systému uchovávání snímků. Celkový počet pacientů zařazených do studie je tedy 14. Věkový průměr v našem souboru je 59 let (49– 68 let, směrodatná odchylka 6,4). Mezi pacienty jsou dvě ženy a 12 mužů. První klinická kontrola proběhla v době tří měsíců od operace, další pak v intervalech po půl roce s výsledky ultrasonografického vyšetření karotid. Tento způsob dispenzarizace je na našem oddělení aplikován u všech pacientů sledovaných s cerebrovaskulárním stenookluzivním onemocněním.
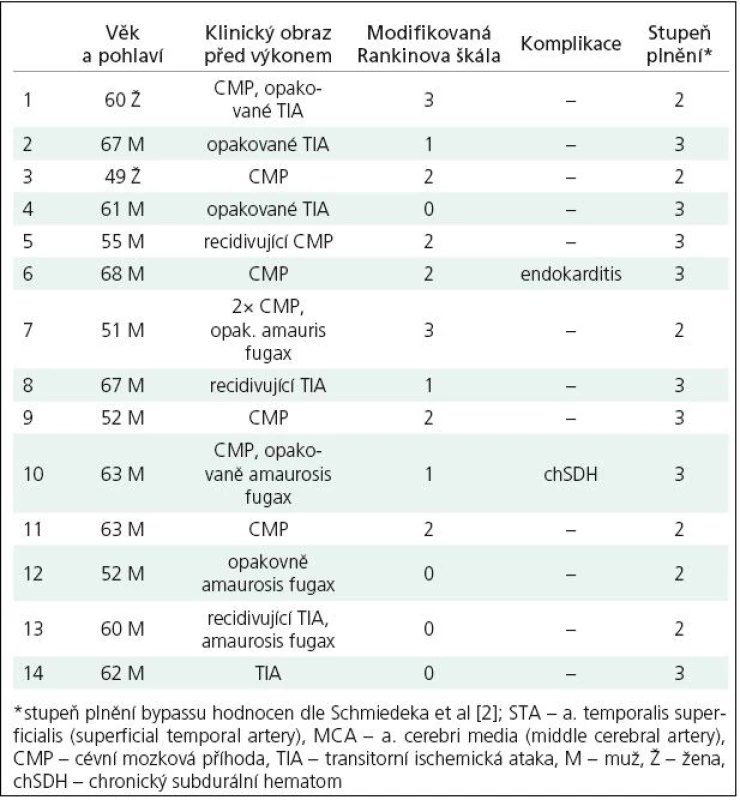
U všech pacientů byl našit nízkoprůtokový konvenční EC‑IC bypass, tedy anastomóza mezi arteria temporalis superficialis a periferní větví arteria cerebri media (MCA). V tomto souboru pacientů nebyl použit intergraft. Funkčnost anastomózy byla u všech pacientů ověřena angiografií prováděnou třetí pooperační den a ohodnocena dle Schmiedeka [2]. Jako stupeň 0 je v této klasifikaci označen stav, kdy je bypass bez průtoku, při stupni I se plní jedna či dvě větve a. cerebri media anterográdně, ohodnocení stupněm II vyjadřuje anterográdní plnění vícečetných větví tepny a konečně stupeň III znamená jak anterográdní plnění celého povodí a. cerebri media od bifurkace M1– 2, možné retrográdní plnění M1 a dále do povodí a. cerebri anterior či kontralaterálně. Přehled pacientů zahrnutých do této studie spolu s angiografickým hodnocením funkčnosti bypassu a předoperačním hodnocením klinického stavu dle modifikované Rankinovy škály je uveden v tab. 1.
V časovém odstupu od výkonu (6 měsícůaž 3 roky, průměrná doba 698,57 dnů ±± 346,9) bylo u pacientů provedeno kontrolní perfuzní CT mozku. Jako kontrastní látka byl použit iomeprol (Iomeron 400, Altana, Konstanz, Německo) aplikovaný intravenózně bolusově v dávce 40 ml na počátku skenování. Vyšetření CT perfuze mozku za bazálních podmínek by nemělo dostatečnou vypovídající hodnotu, neboť námi sledované parametry mohou být v mezích normy [7]. Proto vyšetřujeme pacienty perfuzním CT mozku i při hemodynamické zátěži, tzn. při inhalaci směsi se zvýšeným obsahem CO2 (5% CO2 + 21% O2 + 74% N2). Pacienti inhalovali uvedenou směs po tři minuty před vlastním vyšetřením a pak v průběhu celého vyšetření v CT přístroji, inhalovaná směs byla podána maskou fixovanou k obličeji pacienta, použit byl jednoduchý výdechový ventil (nádech ze systému, výdech do okolního prostředí), na vdechovou část byl připojen rezervoár o velikosti 20 l, tento byl naplněn před vlastním vyšetřením pro případ nedostatečného přívodu plynu z nádoby.
Vyšetření mozkové perfuze CT bylo provedeno na stroji Sensation 16 (Siemens, Erlangen, Německo). U každého pacientapak byly zvoleny dvě úrovně v oblasti komor a supraventrikulárně, sken byl proveden s parametry 80 kVp, 280 mA, 2 × 12mm sekce po 50, celkem 100 akvizic, trvání skenu 38 vteřin. Pro hodnocení byl použit software syngo Perfusion CT (Siemens, Erlangen, Německo), tento software umožňuje automatickou detekci přívodné cévy pro zjištění arteriální přítokové funkce (AIF, arterial input function) nutné pro dekonvoluční algoritmus použitý k výpočtu jednotlivých perfuzních parametrů. Byly vytvořeny barevné mapy CBF (cerebral blood flow), CBV (cerebral blood volume) a TTP (time to peak). Ty byly hodnoceny vizuálně dvěma hodnotiteli nezávisle na sobě, výsledky hodnocení byly posléze porovnány. Poloautomatické hodnocení bylo provedeno pomocí oblastí zájmu (ROI, region of interest), které byly definovány ve stejném rozsahu symetricky v obou hemisférách. Pro tyto oblasti pak byly zjištěny průměrné arbitrární hodnoty výše uvedených parametrů, z obou zobrazených 12 mm sekcí pak byla u každé hemiféry spočtena a zaznamenána průměrná hodnota jednotlivých parametrů v arbitrárních jednotkách a určen poměr operovaná hemisféra/ zdravá hemisféra. Pro každý výše uvedený parametr pak byl určen index změny, spočtený jako rozdíl mezi interhemisferálním poměrem v klidové a zátěžové fázi.
U stejného souboru pacientů vyjma čtyř (n = 10) jsme provedli taktéž vyšetření perfuzní MR (DSC- MR, dynamic susceptibility contrast MR) za účelem porovnání získaných dat, byla získána data z celého objemu mozku (TR 1 430 ms, TE 46 ms, flip angle 90°, matrix 120 × 128, velikost voxelu 1,8 × 1,8 × 5 mm, interslice gap 6,5 mm, 50 akvizicí) po aplikaci bolusu gadobutrolu (Gadovist, Bayer Schering Pharma AG, Berlín, Německo) do periferní žíly během inhalace stejné zátěžové směsi jako v případě CT po třech minutách inhalace před vlastním skenováním. Klidový sken pak byl proveden za 60 min od zátěžového nebo následující den. U dvou pacientů ze zde popsané studijní skupiny nebylo vyšetření provedeno pro klaustrofobii, jeden pacient MR odmítl pro bolesti zubů při metalických zubních náhradách, jeden nesouhlasil s pooperačním vyšetřením MR po absolvování vyšetření CT. Pro vyhodnocení bylo po předzpracování obrazů pomocí aplikace Statistic Parametric Mapping (SPM5, http:/ / www.fil.ion.ucl.ac.uk/ spm/ ) použito vlastního softwaru k určení parametru time to peak (TTP) a tvorbě barevné mapy, výsledné průměrné hodnoty byly zaznamenány pro ROI v obou hemisférách a spočteny poměry operovaná/ zdravá hemisféra analogicky k poměrům získaným při hodnocení perfuzního CT.
Předoperační a pooperační parametry a indexy změny byly porovnány pomocí párového t‑testu, korelace mezi výsledky určení TTP pomocí CT a MR pak byla určena jako Pearsonův korelační koeficient. Pro statistickou analýzu byl použit jazyk R a nástroj R Commander (Free Software Foundation, www.gnu.org).
U všech pacientů bylo provedeno angiografické vyšetření průchodnosti bypassu, obrazy plnění mozkového řečiště byly hodnoceny dle Schmiedeka a tyto výsledky byly zaznamenány k porovnání s výsledky perfuzního CT.
Celá problematika vyšetřování CVRC, indikace a vlastní operační výkon včetně pooperačních kontrol byly součástí grantu IGA MZ ČR NR/ 8849- 4 a ten byl schválen etickou komisí Masarykovy nemocnice v Ústí nad Labem.
Výsledky
V pooperačním průběhu ve sledované skupině 14 pacientů došlo ke dvěma komplikacím – chronický subdurální hematom u pacienta č. 10 a infekční endokarditis u pacienta č. 6. Během pooperační dispenzarizace pak u žádného z pacientů nenastaly nové ischemické ataky, neurologický stav pacientů hodnocený dle modifikované Rankinovy škály se během pooperačního sledování v intervalu výše uvedených kontrol neměnil.
Dle vizuálního hodnocení výsledků perfuzního CT ve formě barevných map jednotlivých parametrů zkušeným radiologem a neurochirurgem (MD, MS) došlo u všech vyšetřených pacientů kromě jednoho (92,9 %) po provedení EC‑IC bypassu k restituci CVRC (pacient č. 13). Hodnocení výsledků perfuzních studií bylo u těchto dvou hodnotitelů v celém rozsahu souboru kongruentní. Dobré plnění bypassu i větví arteria cerebri media na operované straně prokázala i pooperační angiografie, dle těchto výsledků jsou v našem souboru zastoupeni pacienti s plněním stupně II a III. Podrobně výsledky udávají tab. 1– 3. Předoperační vyšetření (tab. 2) prokázalo u všech pacientů relativní zhoršení krevního průtoku symptomatickou hemisférou, tedy pokles parametru CBF v porovnání s kontralaterální hemisférou po podané zátěži. Tento výsledek byl jednou z podmínek indikace operačního výkonu na našem pracovišti. U sedmi pacientů (3, 7, 8, 9, 11, 13 a 14) bylo v předoperačním vyšetření zjištěno zvýšení CBV v postižené hemisféře v porovnání se zdravou stranou, eventuální změnu tohoto parametru po zátěži je při semikvantitativním hodnocení porovnáním s kontralaterální hemisférou obtížné hodnotit. V parametru TTP došlo předoperačně k relativně většímu zpoždění přítoku bolusu kontrastní látky po zátěži u deseti pacientů v naší skupině.
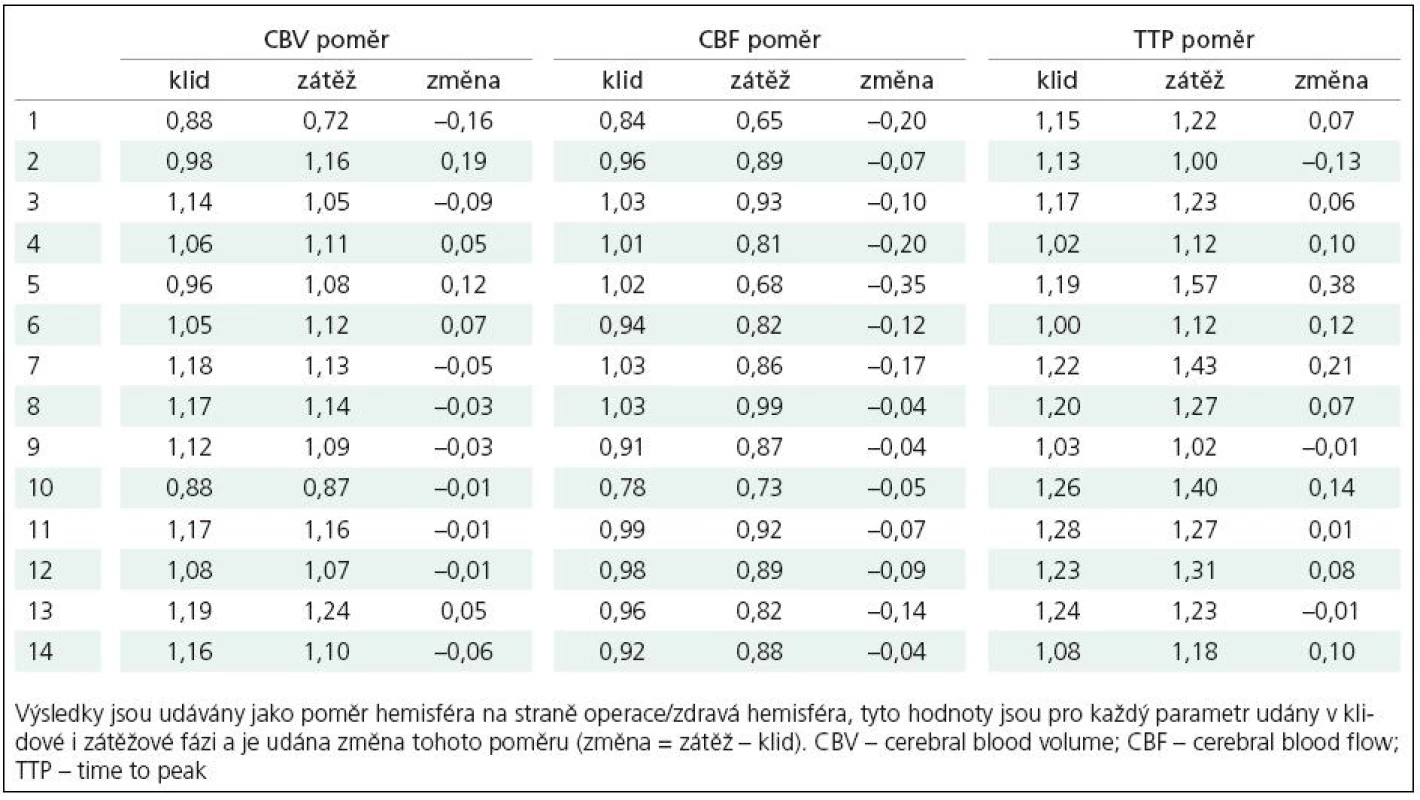
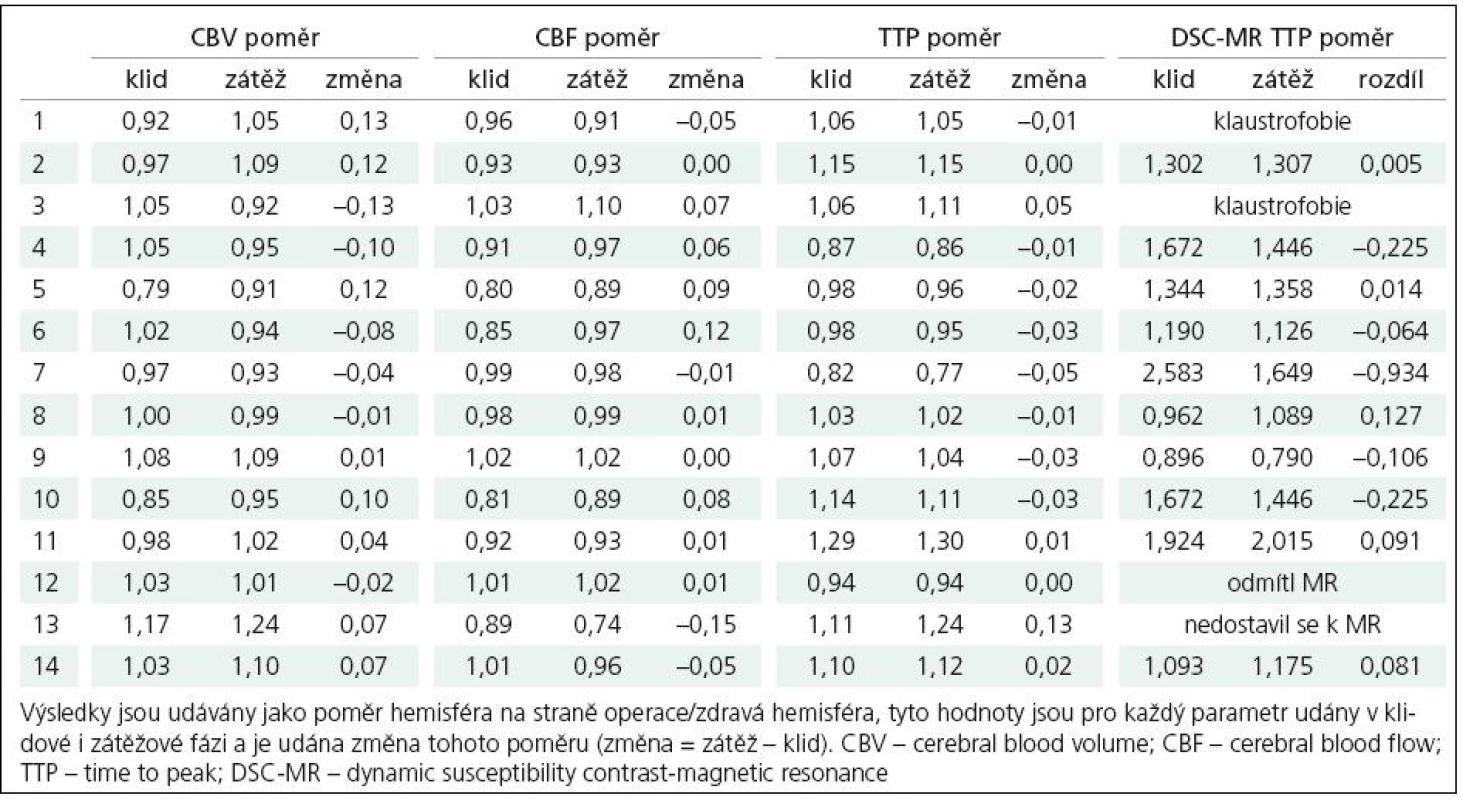
Pooperačně (tab. 3) dochází dle parametru CBF při podané hemodynamické zátěži ke zhoršení poměru krevního průtoku hemisférami u čtyř pacientů (1, 7, 13 a 14), u tří z toho přitom jde jen o minimální změnu interhemisferálního poměru, u jednoho pacienta je pak změna poměru relativně výraznější (13) s hodnotou prakticky neměnnou proti předoperačnímu vyšetření. U pacientů 1 a 7 bylo předoperační snížení CBF po zátěži poměrně výrazné, po operaci pak byl zjištěný rozdíl v porovnání s výchozím stavem minimální. U pacienta č. 13 se předoperačně zjištěné snížení krevního průtoku postiženou hemisférou po zátěži prakticky nezměnilo. Klidový krevní průtok zůstává i po provedení EC‑IC bypassu nižší než na kontralaterální straně u 11 z 14 pacientů. Stran parametru CBV pak došlo ke snížení objemu krve na postižené straně u většiny pacientů, markantní nepoměr ve smyslu vyššího CBV pak přetrvává u pacienta číslo 13. V parametru TTP vykazují zhoršení interhemisferického poměru ve smyslu prodloužení doby TTP na operované straně v porovnání se stranou kontralaterální čtyři pacienti (3, 11, 13 a 14), přičemž nejvýraznější je zhoršení tohoto poměru opět u pacienta č. 13.
Výsledné hodnoty byly statisticky zpracovány, pro porovnání skupin výsledků byl použit párový t‑test. Porovnávány byly klidové hodnoty jednotlivých parametrů předoperačně s pooperační hodnotou, dále pak rozdíly mezi klidovou a zátěžovou hodnotou při vyšetření předoperačně a pooperačně. Tato analýza odhalila signifikantní (p = 0,001) změnu při porovnání indexu změny CBF v předoperačních a pooperačních vyšetřeních, naopak významný rozdíl mezi klidovými hodnotami CBF nalezen nebyl. Signifikantní (p < 0,05) rozdíl mezi předoperačními a pooperačními výsledky byl nalezen jak pro hodnoty TTP při klidovém vyšetření, tak pro index změny TTP, kde však byla signifikance rozdílu již hraniční (p = 0,049).
Výsledky určení TTP pomocí metody DSC- MR jsou taktéž shrnuty v tab. 3, ke zhoršení interhemisferického poměru po podání zátěže došlo u čtyř pacientů (5, 8, 11 a 14), k výraznějšímu ovšem jen u jednoho pacienta (8). Pearsonův korelační koeficient při porovnání změny interhemisferického poměru TTP u perfuzního CT a MR je v této skupině pacientů 0,729 se signifikancí p = 0,017.
Z hlediska angiografického hodnocení se v našem souboru nevyskytl žádný pacient s plněním stupně 0 a I, jako stupeň II bylo hodnoceno šest pacientů, jako stupeň III pak pacientů osm.
Diskuze
Naše studie prokázala výrazné zlepšení perfuzních parametrů v postižené hemisféře po provedení EC‑IC bypassu, stejně tak nedošlo u popsané skupiny pacientů k výskytu dalších cerebrovaskulárních příhod v pooperačním období. Všechny provedené bypassy byly na kontrolní digitální subtrakční angiografii (DSA) patentní a podílely se významnou měrou na plnění řečiště MCA v postižené hemisféře.
V našem souboru nebyla potvrzena statisticky významná změna klidového CBF v postižené hemisféře. Předchozí zprávy nejsou jednoznačné v popisu hemodynamických změn probíhajících po EC‑IC bypassu ohledně klidového krevního průtoku danou hemisférou. Di Piero et al [8] ve své práci nenašli signifikantní změnu CBF v porovnání s předoperačními studiemi, mnoho dalších prací na téma u CBF detekované různými metodami prezentuje rozdílné výsledky. Dle převládajícího názoru je pak efektem operace spíše zvýšení reaktivity po zátěži [9] než samotné zvýšení klidového CBF.
Změny v parametru CBV pak provází v relevantní literatuře ještě větší nejistota v interpretaci výsledků, nejnovější studie pak popisují zvýšené CBV na postižené straně jako rizikový faktor pro ischemickou příhodu, zvýšení CBV je zde pak vnímáno jako výraz vazodilatace při chronickém nedostatečném zásobení mozkové tkáně [10]. Z tohoto pohledu došlo v našem souboru ke zlepšení stavu při pooperačním vyšetření.
Parametr TTP je v některých recentníchpracích popisován jako nejspolehlivější pro určení oblastí mozkové tkáně s nedostatečnou cerebrovaskulární rezervní kapacitou (obr. 1a, b). Schubert et al [11] popisují dobrou korelaci tohoto parametru u perfuzního MR s výsledky vyšetření xenonového CT (XeCT), Kajimoto et al pak popisují shodu výsledků získaných analýzou tohoto parametru dokonce s oblastmi se sníženou extrakční frakcí kyslíku zjištěnou pomocí pozitronové emisní tomografie (PET) [12]. U obou zde citovaných prací bylo možno určit časový práh dosažení vrcholové intenzity, při jehož překročení dané oblasti s určitou specificitou a senzitivitou odpovídaly oblastem vyčerpané CVRC, resp. zvýšené extrakční frakci kyslíku (OEF, oxygen extraction fraction). V naší práci nebylo z technických důvodů možné použití podobného prahu, výsledky pooperačních studií však ukazují na markantní zkrácení sledované doby v porovnání s předoperačním stavem. Z hlediska vyšetření většího objemu mozkové tkáně, než umožňuje současné perfuzní CT (dvě 12mm sekce), pak je dle našeho názoru vhodné využití metod magnetické rezonance – i v našich výsledcích je však patrné jisté omezení zvláště vzhledem k intoleranci tohoto typu vyšetření ze strany některých pacientů. Porovnání výsledků vyšetření TTP pomocí CT a MR odhalilo poměrně silnou korelaci u obou typů vyšetření, což bylo možné předpokládat i kvůli prakticky stejnému principu dynamického sledování distribuce kontrastní látky ve tkáni a výpočtu parametru TTP. Další výhodou použití tohoto parametru v hodnocení je dle našeho názoru nezávislost na výše zmíněné volbě oblasti pro detekci AIF, a tedy i menší závislost výsledků na způsobu výpočtu.


Použití arbitrárních jednotek při semikvantitativním hodnocení mozkové perfuze je plně opodstatněné, přestože některé práce popisují kvantitativní určení jednotlivých parametrů, neboť přesnost takového určení nebyla zatím validována [13]. Na rozdíl od PET tedy nebyla zatím stanovena normativní data, která by přímé kvantitativní určení perfuzních parametrů umožňovala. Furukawa et al [14] popisují dobrou korelaci semikvantitativně hodnocených výsledků perfuzního CT s výsledky xenonového CT, přičemž principem semikvantitativního hodnocení bylo stejně jako v naší studii porovnání interhemisferických poměrů daných parametrů. Tato práce mimo jiné potvrzuje dobrou vizuální shodu mezi mapami TTP vytvořenými na podkladě perfuzního CT a snížením krevního průtoku dle XeCT. Wintermark et al [15] popisují rovněž dobrou korelaci mezi těmito typy vyšetření, a to i v absolutních hodnotách bez porovnávání s druhostrannou hemisférou, nicméně poukazují na závislost výsledků na volbě vstupní arterie pro detekci AIF. Dalším zde uváděným poznatkem jsou pak vyšší hodnoty CBF naměřené pomocí perfuzního CT v porovnání s XeCT v oblastech v blízkosti velkých cerebrálních arterií. Podobný efekt popisují ve své práci Gillard et al [16], kteří ovšem celkově potvrzují dobrou korelaci výsledků perfuzního CT s výsledky PET.
Perfuzní CT je dle našich výsledků spolehlivou metodou jak pro diagnostiku poruch CVRC, tak i pro sledování vývoje CVRC po EC‑IC anastomóze. Nevýhodou vyšetření je radiační zatížení pacienta a nutnost intravenózní aplikace kontrastní látky. Nezátěžovou metodou vyšetřování poruch CVRC, kterou na našem pracovišti rutinně používáme, je transkraniální dopplerometrie (TCD). Spolehlivosti metody v detekci změn CVRC po EC‑IC bypassu jsme věnovali pozornost v dřívější publikaci [17]. Krahulík et al popisují dobrou korelaci TCD a funkční magnetické rezonance a doporučují tyto metody jako vhodné modality pro předoperační i pooperační vyšetřování změn CVRC [18]. Metody funkční magnetické rezonance na našem pracovišti používáme prozatím experimentálně a dosud nejsou ve standardním vyšetřovacím schématu pacientů s okluzí ACI.
Závěr
Dle výsledků perfuzního CT došlo u 92,9 %vyšetřených pacientů k restituci CVRC v postižené hemisféře. Perfuzní CT je rychlá a spolehlivá metoda, využitelná pro předoperační diagnostiku vyčerpání CVRC i pooperační sledování pacientů po EC‑IC bypassu. Vyšetření TTP pomocí perfuzního MR dobře odpovídá výsledkům perfuzního CT.
doc. MUDr. Martin Sameš, CSc.
Neurochirurgická klinika Univerzity J. E. Purkyně
Krajská zdravotní a.s., Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 12A
401 13 Ústí nad Labem-Bukov
e-mail: martin.sames@mnul.cz
Sources
1. The EC/ IC Bypass Study Group. Failure of extracranial- intracranial arterial bypass to reduce the risk of ischemic stroke. Results of an international randomized trial. N Engl J Med 1985; 313(19): 1191– 1200.
2. Schmiedek P, Piepgras A, Leinsinger G, Kirsch CM, Einhüpl K. Improvement of cerebrovascular reserve capacity by EC‑IC arterial bypass surgery in patients with ICA occlusion and hemodynamic cerebral ischemia. J Neurosurg 1994; 81(2): 236– 244.
3. Garrett MC, Komotar RJ, Starke RM, Merkow MB, Otten ML, Sciacca RR et al. The efficiacy of direct extracranial- intracranial bypass in the treatment of symptomatic hemodynamic failure secondary to athero‑-occlusive disease: a systematic review. Clin Neurol Neurosurg 2009; 111(4): 319– 326.
4. Mehdorn HM. Cerebral revascularization by EC‑ICvypase – present status. Acta Neurochir 2008; 103 (Suppl): 73– 77.
5. Wintermark M, Sesay M, Barbier E, Borbély K, Dillon WP, Eastwood JD et al. Comparative overview of brain perfusion imaging techniques. Stroke 2005; 36(9): 83– 99.
6. Bisdas S, Nemitz O, Berding G, Weissenborn K, Ahl B,Becker H et al. Correlative assessment of cerebral blood flow obtained with perfusion CT and positron emission tomography in symptomatic stenotic carotid disease. Eur Radiol 2006; 16(10): 2220– 2228.
7. Derdeyn CP, Grubb RL jr, Powers WJ. Indications for cerebral revascularization for patients with atherosclerotic carotid occlusion. Skull Base 2005; 15(1): 7– 14.
8. Di Piero V, Lenzi GL, Collice M, Triulzi F, Gerundini P,Perani D et al. Long‑term noninvasive single photon emission computed tomography monitoring of perfusional changes after EC‑IC bypass surgery. J Neurol Neurosurg Psychiatry 1987; 50(8): 988– 996.
9. Wanebo JE, Amin‑Hanjani S, Boyd C, Peery T. Assessing success after cerebral revascularization for ischemia. Skull Base 2005; 15(3): 215– 227.
10. Derdeyn CP, Videen TO, Yundt KD, Fritsch SM, Car-penter DA, Grubb RL et al. Variability of cerebral bloodvolume and oxygen extraction: stages of cerebral haemodynamic impairment revisited. Brain 2002; 125(3): 595– 607.
11. Schubert GA, Weinmann C, Seiz M, Gerigk L, Weiss C,Horn P et al. Cerebrovascular insufficiency as the criterion for revascularization procedures in selected patients: a correlation study of xenon contrast- enhanced CT and PWI. Neurosurg Rev 2009; 32(1): 29– 35.
12. Kajimoto K, Moriwaki H, Yamada N, Hayashida K,Kobayashi J, Miyashita K et al. Cerebral hemodynamic evaluation using perfusion‑ weighted magnetic resonance imaging: comparison with positron emission tomography values in chronic occlusive carotid disease. Stroke 2003; 34(7): 1662– 1666.
13. Hoeffner EG, Case I, Jain R, Gujar SK, Shah GV, Deveikis JP et al. Cerebral perfusion CT: technique and clinical applications. Radiology 2004; 231(3): 632– 644.
14. Furukawa M, Kashiwagi S, Matsunaga N, Suzuki M,Kishimoto K, Shirao S. Evaluation of cerebral perfusion parameters measured by perfusion CT in chronic cerebral ischemia: comparison with xenon CT. J Comput Assist Tomogr 2002; 26(2): 272– 278.
15. Wintermark M, Thiran JP, Maeder P, Schnyder P, Meuli R. Simultaneous measurement of regional cerebral blood flow by perfusion CT and stable xenon CT: a validation study. Am J Neuroradiol 2001; 22(5): 905– 914.
16. Gillard JH, Minhas PS, Hayball MP, Bearcroft PW, Antoun NM, Freer CE et al. Assessment of quantitative computed tomographic cerebral perfusion imaging with H2(15)O positron emission tomography. Neurol Res 2000; 22(5): 457– 464.
17. Sameš M, Bartoš R, Vachata P, Zolal A, Cihlář F, Derner M et al. Hodnocení cerebrovaskulární rezervní kapacity po EC‑IC bypassu pomocí TCD. Cesk Slov Neurol N 2009; 72/ 105(4): 359– 363.
18. Krahulík D, Vaverka M, Herzig R, Hluštík P, Houdek M. Extra- intrakraniální arteriální mikroanastomóza. Cesk Slov Neurol N 2009; 72/ 105(2): 142– 146.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 3
Most read in this issue
- Spondylogenní cervikální myelopatie
- Zlomeniny pátého bederního obratle
- Standardizace české verze The Confusion Assessment Method for the Intensive Care Unit (CAM‑ICUcz)
- Komplikovaná herpetická nekrotizující meningoencefalitida s nutností neurochirurgické intervence – kazuistika