Použití titanových a PEEKových implantátů při ALIF stand alone u degenerativního onemocnění lumbosakrální páteře – prospektivní studie
The Use of Titan and PEEK Implants in Stand Alone ALIF Surgery for Degenerative Disease of the Lumbosacral Spine – a Prospective Study
The use of cages is one of the methods to obtain anterior lumbar fusion (ALIF). The study reviews the clinical results in correlation with radiological findings for two types of implants: a titan implant (SynCage, Synthes, USA) is compared with a PEEK implant (Visios, Synthes, USA) used in a stand-alone ALIF surgery in patients with degenerative disease of the lumbosacral spine. The set of patients is made up of two identical groups each consisting of 14 patients, with a follow-up time of at least one year. The correlations between the clinical findings expressed by Visual Analogue Scale, Oswestry Disability Index and neurological examination and the CT and MRI findings prior to surgery and one year post-op were assessed by standard statistical methods. The presence of Modic changes type 1 in MRI one year post-op was associated with a lower degree of improvement of clinical status as compared with other Modic changes. Modic changes type 1 developed post-op in five patients (35.7%) with a PEEK implant. Cystic bone changes detected by CT one year after the implantation of PEEK cages was recorded in eight patients (57.1%) and was also associated with a lower degree of improvement of clinical status as compared with patients without such changes. Implant-based comparison of the two groups of patients showed worse clinical results for the patients with a PEEK implant. Modic changes type 1 in MRI images and bone cysts in CT findings probably reflect insufficient healing of the PEEK implant in the stand-alone ALIF procedure. Additional posterior transpedicular fixation and subsequent increase of stability reduces the number of the above-mentioned CT and MRI findings and results in an improved clinical status. The authors therefore recommend only the titan implant for stand-alone ALIF. The PEEK implant should be used only with posterior transpedicular fixation and is not suitable for the stand-alone ALIF procedure.
Key words:
lumbar spine – ALIF – magnetic resonance imaging – Modic changes – titan implant – PEE K implant – SynCage – Visios
Authors:
L. Hrabálek 1; I. Rešková 1; J. Bučil 2; M. Vaverka 1; M. Houdek 1
Authors‘ workplace:
Neurochirurgická klinika LF UP a FN Olomouc
1; Radiologická klinika LF UP a FN Olomouc
2
Published in:
Cesk Slov Neurol N 2009; 72/105(1): 38-44
Category:
Original Paper
Overview
Použití klícek je jednou z metod, jak dosáhnout přední bederní meziobratlové fúze (ALIF). Studie sleduje klinické výsledky v korelaci s radiologickými nálezy při použití dvou typů náhrad: porovnává titanový implantát (SynCage, Synthes, USA) a PEEKový implantát (Visios, Synthes, USA) při ALIF typu stand-alone u pacientů s degenerativním onemocněním lumbosakrální páteře. Soubor je tvořen dvěma stejnými skupinami po 14 pacientech s dobou sledování minimálně jeden rok. Vztahy mezi klinickým nálezem vyjádřeným pomocí vizulní analogové škály (VAS), škálou Oswestry (ODI) a neurologickým vyšetřením a CT a MR nálezy před operací a jeden rok po operaci byly zpracovány obvyklými statistickými metodami. Nález změn typu Modic 1 na MR jeden rok po operaci byl provázen menší mírou zlepšení klinického stavu než při nálezu ostatních Modicových změn. Změny typu Modic 1 se po operaci nově vytvořily u pěti pacientů (35,7 %) s PEEKovým implantátem. Vznik kostních cystických změn na CT jeden rok po implantaci PEEKových klícek byl zaznamenán u osmi pacientů (57,1 %) a byl rovněž provázen menší mírou zlepšení klinického stavu oproti pacientům, kde k těmto změnám nedošlo. Při srovnání obou skupin pacientů podle typu implantátu byly horší klinické výsledky u pacientů při použití PEEKového implantátu. Změny v MR obraze typu Modic 1 a kostní cysty na CT jsou zřejmě výrazem nedostatečného kostního přihojení PEEKového implantátu při modifikaci ALIF typu stand-alone. Doplnění zadní transpedikulární fixace, a tedy zvýšení stability vede k ústupu těchto nálezů na CT a MR a ke zlepšení klinického stavu. Pro ALIF stand-alone doporučují autoři pouze titanový implantát. PEEKový implantát by měl být používán jen se současnou zadní transpedikulární fixací a pro ALIF typu stand- alone není vhodný.
Klíčová slova:
bederní páteř – ALIF – magnetická rezonance – Modicovy změny – titanový implantát – PEE K implantát – SynCage – Visios
Úvod
Podstatou operace ALIF (Anterior Lumbar Interbody Fusion, přední bederní meziobratlová fúze) typu stand-alone je izolovaná náhrada disku lumbosakrální páteře z předního operačního přístupu bez zadní operační revize a stabilizace. Vyhýbá se tak poranění paravertebrálních svalů a nedochází k rozvoji pooperační epidurální jizvy a perineurální fibrózy.
Použití klícek je jednou z metod, jak dosáhnout přední bederní meziobratlové fúze při léčbě degenerativního onemocnění lumbosakrální páteře. Klícky vyplněné kostními štěpy umožní zachovat osu páteře a její stabilitu do doby dosažení definitivní kostní fúze – artrodézy. Nejčastěji používané jsou titanové implantáty a jejich hlavní nevýhodou je, že titan radiologicky znesnadní posouzení míry kostní fúze. Klícky zhotovené z radiolucentních materiálů dovolí skiagraficky spolehlivěji zhodnotit míru dosažené meziobratlové fúze a vyšetření magnetickou rezonancí není zatíženo artefakty. Příkladem takového materiálu je Poly-Ether-Ether-Keton (PEEK).
Cílem studie bylo porovnání klinických výsledků a radiologických nálezů po použití titanových a PEEKových implantátů při ALIF typu stand-alone indikovaných pro degenerativní onemocnění lumbosakrální páteře.
Materiál a metodika
Autoři prospektivně sledovali a hodnotili pacienty s diagnózou symptomatické diskopatie degenerativního původu, tedy Degenerative Disc Disease (DDD) a pacienty s Failed Back Surgery Syndromem (FBSS), indikované k ALIF typu stand-alone. V obou případech se onemocnění vždy projevovalo axiální bolestí a kořenovými příznaky a podmínkou byla předchozí minimálně šest měsíců trvající neúspěšná konzervativní terapie. Kontraindikováni pro ALIF stand-alone byli nemocní s prokázanou osteoporózou, nádorem páteře, segmentální nestabilitou, spondylolistézou a pacienti po předchozí výraznější operační destabilizaci páteře, zejména po laminektomii nebo rozsáhlejší facetektomii.
Do studie byli zařazeni pacienti operovaní na Neurochirurgické klinice LF UP a FN Olomouc v období od října 2005 do března 2007. Doba sledování činila minimálně 12 měsíců. Soubor tvořilo 28 pacientů ve věku 31–67 let (průměrný věk 46,71 roku), z toho bylo 11 mužů (průměrný věk 45,36 let) a 17 žen (průměrný věk 47,35 let).
Před operací byli všichni nemocní podrobeni standardnímu klinickému a neurologickému vyšetření. Pomocí Visual Analogue Scale (VAS) byl hodnocen stupeň axiální bolesti v rozmezí 0–10 a pomocí dotazníku Oswestry Disability Index (ODI) autoři sledovali funkční stav pacienta, vyjádřený skórem v rozmezí 0–100 bodů [1,2]. Pacienti byli informováni o prováděné studii a podepsali informovaný souhlas pacienta. Z důvodu posouzení osy páteře a případných známek významnější páteřní nestability, zejména spondylolistézy, byly provedeny skiagrafické snímky lumbosakrální páteře ve statické předozadní a bočné projekci a v dynamické bočné projekci. Před operací bylo vždy rovněž provedeno CT vyšetření tří kaudálních meziobratlových plotének bederní páteře (Hi-Speed Cti-Pro, General Electric, USA) spirální technikou ve vrstvách 1mm a byl hodnocen stav kostní krycí desky. Všem pacientům byla doplněna magnetická rezonance (MR) na přístroji Magnetom Symphony 1.5T (Siemens, Německo), v sagitální rovině v sekvenci T2 tse – rst sag pat 2/i PAT/, v T1 tse – sag /i PAT/ a ve STIR sag Hi Res /i PAT/. Rozsah byl biforaminální, s tloušťkou vrstvy 4mm, TR/TE (msec) pro T2 bylo 3520/95, pro T1 bylo 564/14 a pro STIR 4500/70. V transverzální rovině bylo vyšetření jen v T2 váženém obraze. MR byla provedena s cílem vyloučit hernii disku a významnější stenózu kanálu páteřního v rozsahu celé bederní páteře, spondylodiscitidu nebo nádorové změny a dále MR umožnila posoudit intenzitu signálu disku odpovídající jakémukoliv stupni degenerativních změn a zhodnotit Modicovy změny v operovaném segmentu [3].
Pacienti byli operováni v celkové anestezii pod clonou antibiotik ve standardním profylaktickém antibiotickém režimu. Poloha pacienta závisela na operované etáži. Při operaci v prostoru L5/S1 ležel pacient na zádech v Trendelenburgově pozici a 6cm dlouhý kožní řez byl veden ve střední čáře v hypogastriu s následnou preparací zprava extraperitoneálně až na promontorium. Rozvěrač Synframe (Synthes, USA) zajistil bezpečné odtažení velkých cév, tedy bifurkace aorty a vv. iliacae communes, dále plexus hypogastricus superior a orgánů dutiny břišní s dostatečnou přední expozicí disku L5/S1. Při operaci v prostoru L4/5 a výše ležel pacient na pravém boku a 6cm dlouhý kožní řez byl veden v levém mezogastriu po předchozím zaměření rentgenovým C-ramenem. Zvyklá retroperitoneální preparace a nasazení Synframe rozvěrače s odtažením aorty, v. iliaca communisl. sin., orgánů dutiny břišní am. psoasl. sin. umožnilo laterální expozici disku L4/5 a disků vyšších. Před diskektomií jsme preparovali a uchovávali v maximální možné míře i struktury truncus sympaticus.
Následně byla odstraněna kompletně celá meziobratlová ploténka i s chrupavčitými krycími deskami. Naopak kostní obratlové krycí desky byly zachovány. V mírné distrakci byla implantována náhrada disku, vyplněná autologní spongiózní kostí odebranou z hřebene kosti kyčelní. Tak tomu bylo vždy jen u nejmenších velikostí klícek, pro větší klícky byl objem takto odebrané kostní tkáně malý, a proto jsme doplnili výplň implantátu umělou kostí (Chronos, Synthes, USA). Poměr umělé kosti a autologní kosti byl vždy přibližně 1:1.
K náhradě disku byl implantován Visios (Synthes, USA) z PEEKu nebo SynCage (Synthes, USA) z titanu. Prvních 14 operovaných pacientů bylo indikováno pro Visios a dalších 14 pro SynCage. Oba implantáty jsou přibližně diskového tvaru, klínovité, směrem dorzálním se snižující, na plochách přiléhajících k obratlovým tělům opatřené drobnými 1mm vysokými zoubky, vnitřní část je dutá a slouží k výplni kostní tkání. Velikost plochy naléhající na obratlová těla je v obou případech 30 × 24mm, výška přední strany Visiosu je 11–19mm (vždy po 2mm), SynCage 13–19mm (vždy po 2mm) a k dispozici je tedy pět velikostí Visiosu a čtyři velikosti SynCage. Jejich nosná konstrukce je ale poněkud odlišná, Visios tvoří 5mm silný prstenec a SynCage připomíná perforovanou skořepinu (obr. 1).

Po operaci byli pacienti vertikalizováni druhý den, po dobu hospitalizace dostávali profylaktickou antiagregační léčbu nízkomolekulárním heparinem, tři měsíce nosili snímatelný textilní korzet s pelotou a neposazovali se. Pooperační statické skiagramy bederní páteře byly provedeny vždy v 1. a 6. týdnu, v 6. měsíci a dynamické ve 12. měsíci. Na těchto snímcích autoři hodnotili pozici implantátu a případné skiagrafické známky pseudoartrózy. Za známky pseudoartrózy byly považovány radiolucentní linie na hranici implantátu a obratlového těla, dislokace implantátu nebo pohyblivost operovaného segmentu na dynamických snímcích nad 5° dle Pavlova [4]. Po 12 měsících bylo dále všem pacientům provedeno CT vyšetření operovaného segmentu a MR lumbosakrální páteře a současně autoři zhodnotili VAS pro lumbago, ODI a neurologický stav. Na CT snímcích byly hodnoceny změny po ALIF ve srovnání s předoperačním vyšetřením a zejména dobře prokazatelné byly cystické léze v krycích deskách a přilehlé subchondrální části obratlových těl na styčné ploše s implantátem. Na MR snímcích autoři hodnotili v operovaném segmentu nálezy Modicova typu.
V tab. 1 je postupně uvedeno pořadí pacientů, věk v době operace, pohlaví, operační indikace, operovaná etáž, typ použitého implantátu, nálezy na CT před operací a jeden rok po operaci, nálezy na MR před operací a jeden rok po operaci, VAS před operací a jeden rok po operaci, ODI před operací a jeden rok po operaci a reziduální neurologický nález jeden rok po operaci.
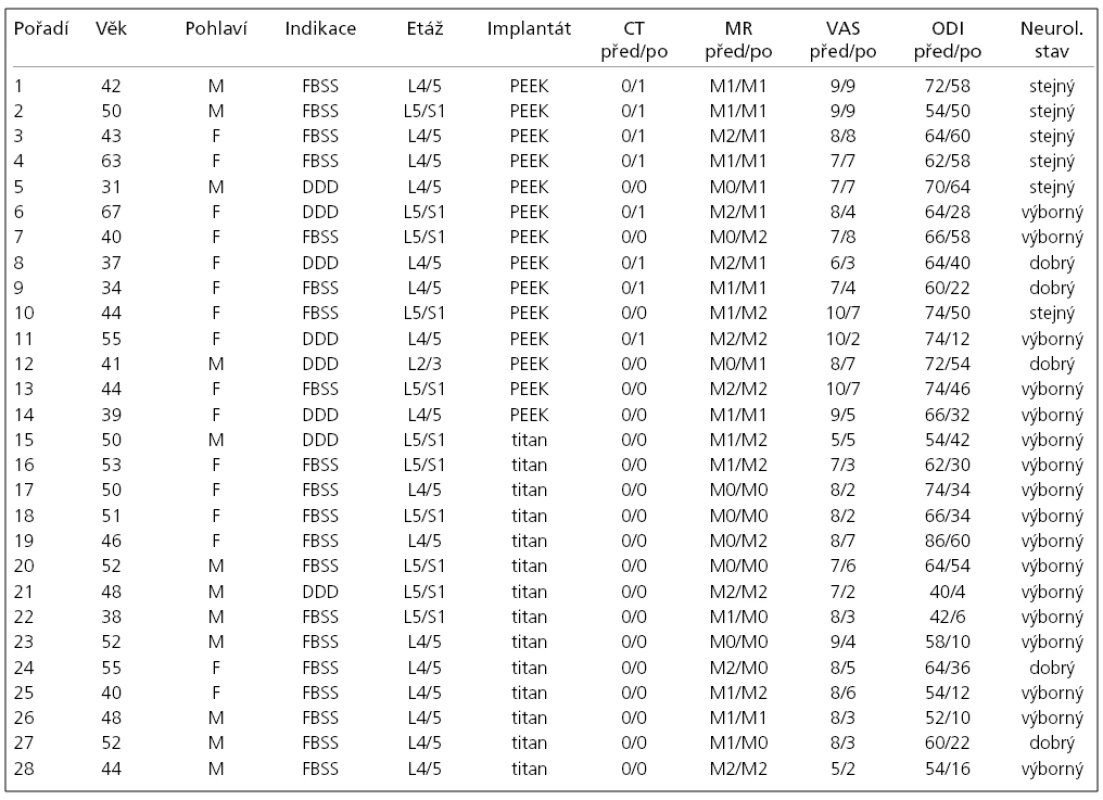
Ke statistickému zpracování byly využity testy mnohonásobného porovnání LSD, analýza rozptylu (ANOVA), Studentův dvouvýběrový t test a chí-kvadrát test. Statisticky významné byly výsledky pod 0,05. U všech pacientů jsme srovnali, zda nález kostních cystických lézí na CT a změn Modicova typu na MR 12 měsíců po operaci má statisticky významnou závislost na pohlaví, operované etáži, indikacích, VAS a ODI. Dále byl soubor rozdělen na dvě skupiny podle použitého typu implantátu (Visios nebo SynCage) a autoři hledali statisticky významné rozdíly mezi oběma skupinami pacientů v nálezech na CT, MR, VAS a ODI.
Výsledky
Soubor všech pacientů
1. Srovnání závislosti změn VAS na vývoji kostních cystických změn na CT ve sledovaném intervalu 12 měsíců:
Vývoj kostních cystických změn 12 měsíců po operaci nastal u osmi pacientů a byl provázen statisticky významně menší mírou snížení VAS (snížení VAS v průměru o 2,25) než u pacientů, kde k těmto změnám nedošlo (snížení VAS v průměru o 3,05).
2. Srovnání závislosti změn ODI na vývoji kostních cystických změn na CT ve sledovaném intervalu 12 měsíců:
Vývoj kostních cystických změn 12 měsíců po operaci (8 pacientů) byl provázen statisticky významně menší mírou snížení ODI (snížení ODI v průměru o 23,25), než u pacientů, kde k těmto změnám nedošlo (snížení ODI v průměru o 30,40).
3. Srovnání závislosti změn VAS na vývoji Modicových změn na MR ve sledovaném intervalu 12 měsíců:
Nález změn typu Modic 1 za 12 měsíců po operaci byl prokázán u 11 pacientů a byl provázen statisticky významně menší mírou snížení VAS (snížení VAS v průměru o 1,81), než u nálezu ostatních Modicových změn, tj. typu Modic 2 nebo Modic 0 (snížení VAS v průměru o 3,47).
4. Srovnání závislosti změn ODI na vývoji Modicových změn na MR ve sledovaném intervalu 12 měsíců:
Nález změn typu Modic 1 za 12 měsíců po operaci (11 pacientů) byl provázen statisticky významně menší mírou snížení ODI (snížení ODI v průměru o 20,73) než u ostatních Modicových změn (snížení ODI v průměru o 32,00).
5. Autoři neprokázali ve sledovaném intervalu 12 měsíců statisticky významnou závislost vývoje kostních cystických změn a Modicových změn na pohlaví, operované etáži ani na operační indikaci.
Srovnání skupiny pacientů s PEEKovými implantáty (Visios) a titanovými implantáty (SynCage)
Obě skupiny měly podobné charakteristiky ve svém složení, tedy v počtu pacientů (14 s implantátem Visios a 14 se SynCage), v rozložení pohlaví (u skupiny s použitým Visios bylo 10 žen a 4 muži, u skupiny se SynCage bylo 7 žen a 7 mužů), ve věkovém rozložení (u pacientů s Visios klíckou byl průměrný věk 46,43 let a u pacientů se SynCage klíckou byl průměrný věk 47,00 let) a v operovaných prostorech (u skupiny s Visios byly operovány prostory L4/5 nebo vyšší u 8 pacientů a L5/S1 u 6 pacientů, u skupiny se SynCage prostory L4/5 u 9 pacientů a L5/S1 u 5 pacientů). Proto byly tyto dvě skupiny nemocných vzájemně dobře srovnatelné.
1. Srovnání vývoje kostních cystických změn na CT ve sledovaném intervalu 12 měsíců u obou skupin:
Kostní cysty se vytvořily statisticky významně častěji u pacientů s PEEKovým implantátem Visios (8 pacientů, tj. v 57,1%) než u pacientů s titanovým implantátem SynCage (žádný pacient, tj. v 0%).
2. Srovnání vývoje Modicových 1změn na MR ve sledovaném intervalu 12 měsíců u obou skupin:
K progresi z předoperačních Modicových 2nebo Modicových 0 do typu Modic 1 změn 12 měsíců po operaci došlo statisticky významně častěji u pacientů s PEEKovým implantátem Visios (5 pacientů, tj. v 35,7%), než u pacientů s titanovým implantátem SynCage (žádný pacient, tj. v 0%). Dalších 5 pacientů s implantací Visios a 1 pacient se SynCage mělo Modicovy 1 změny již před operací a ty zůstaly i 12 měsíců po operaci.
3. Srovnání změn VAS ve sledovaném intervalu 12 měsíců u obou skupin:
Snížení VAS bylo statisticky významně menší u pacientů s PEEKovým implantátem Visios (VAS zlepšeno z průměrných 8,21 na 5,71, rozdíl byl 2,50), než u pacientů s titanovým implantátem SynCage (VAS zlepšeno z průměrných 7,43 na 3,79, rozdíl byl 3,64).
4. Srovnání změn ODI ve sledovaném intervalu 12 měsíců u obou skupin:
Snížení ODI bylo statisticky významně menší u pacientů s PEEKovým implantátem Visios (ODI zlepšeno z průměrných 66,86 na 45,14, tedy o 21,71) než u pacientů s titanovým implantátem SynCage (ODI zlepšeno z průměrných 59,29 na 26,43, tedy o 33,14).
U skupiny pacientů operovaných implantátem Visios došlo v pěti případech k ústupu kořenových bolestí a zlepšení zánikových neurologických příznaků, ve třech případech se kořenové iritace zmírnily a u šesti nemocných, přes počáteční úlevu trvající 2–3 měsíce, došlo k recidivě kořenových obtíží v původním rozsahu jako před operací.
U skupiny pacientů operovaných implantátem SynCage ustoupilo kořenové dráždění ve 12 případech zcela a ve dvou případech částečně. Vždy se zmírnily i zánikové kořenové příznaky.
Komplikace
Operační přístup nebyl provázen žádnými závažnými komplikacemi, tedy nedošlo k poranění velkých cév, orgánů dutiny břišní, pooperačnímu krvácení, trombóze nebo infekci. Dvě pacientky po operaci prostoru L4/5 udávaly přechodně postsympatektomické změny, zejména sníženou potivost dolní končetiny. Jeden pacient má celkové oslabení břišní stěny, bez průkazu kýly v jizvě. V pooperačním období v průběhu jednoho roku nedošlo k dislokaci žádného implantátu nebo rozvoji skiagraficky přesvědčivě hodnotitelné pseudoartrózy.
V případě neuspokojivého klinického výsledku, zejména z důvodu recidivy kořenových obtíží, byli po jednom roce od operace ALIF stand alone indikováni někteří pacienti k dodatečné operační stabilizaci. Celkem se jednalo o šest pacientů po implantaci PEEKových Visios klícek, všichni tito nemocní měli na MR změny typu Modic 1a pět z nich mělo na CT známky kostních cyst. Ve všech případech byla doplněna zadní transpedikulární fixace (Legacy, Medtronic, USA) operovaného segmentu. Při hodnocení po šesti měsících se u těchto pacientů snížil VAS z průměrných 8,00 na 6,17 a ODI z průměrných 57,33 na 39,52. Kořenové dráždění ustoupilo u tří nemocných a zmírnilo se u dalších tří. Zlepšení klinického stavu odpovídaly po šesti měsících i změny na CT a MR. K vymizení cystických změn na CT došlo u dvou pacientů a ke zmírnění rozsahu kostních cyst u zbylých tří nemocných. Na MR se Modicovy změny typu 1 transformovaly na Modicovy změny typu 2 u tří nemocných, typ Modic 1ustoupil do typu Modic 0 u jednoho nemocného a obraz typu Modic 1 zůstal u dvou pacientů.
Příklad nálezů na CT a MR u pacienta před operací, po implantaci PEEKové klícky Visios a po transpedikulární fixaci je uveden na obr. 2–6. MR je pro zjednodušení zobrazeno ve STIR modu, kde hyperintenzivní změny odpovídají hypointenzivním změnám v T1 modu a hyperintenzivním změnám v T2 modu a v subchondrální lokalizaci korespondují s nálezem typu Modic 1.
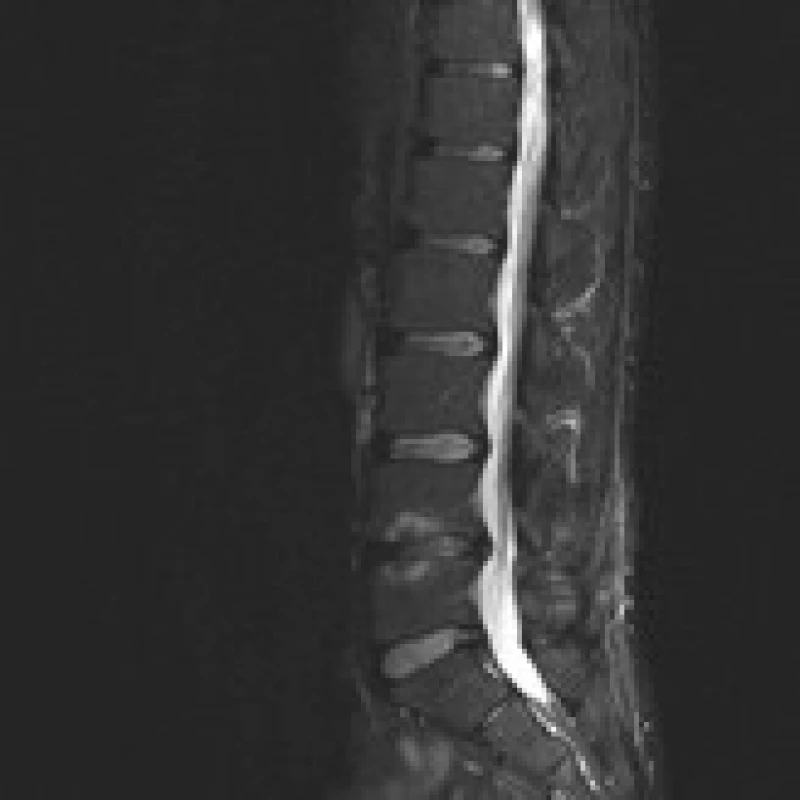
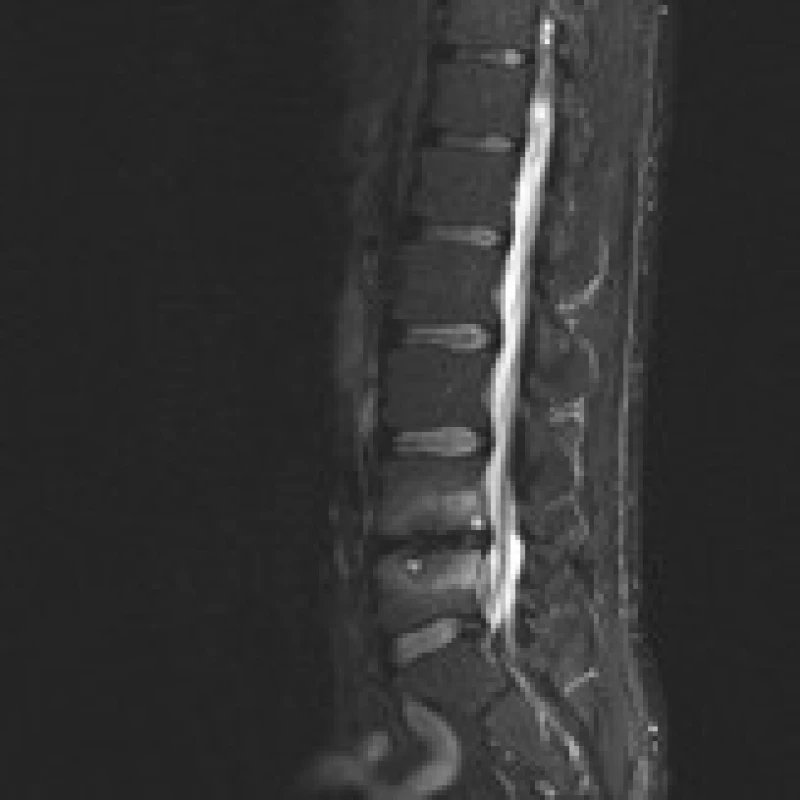
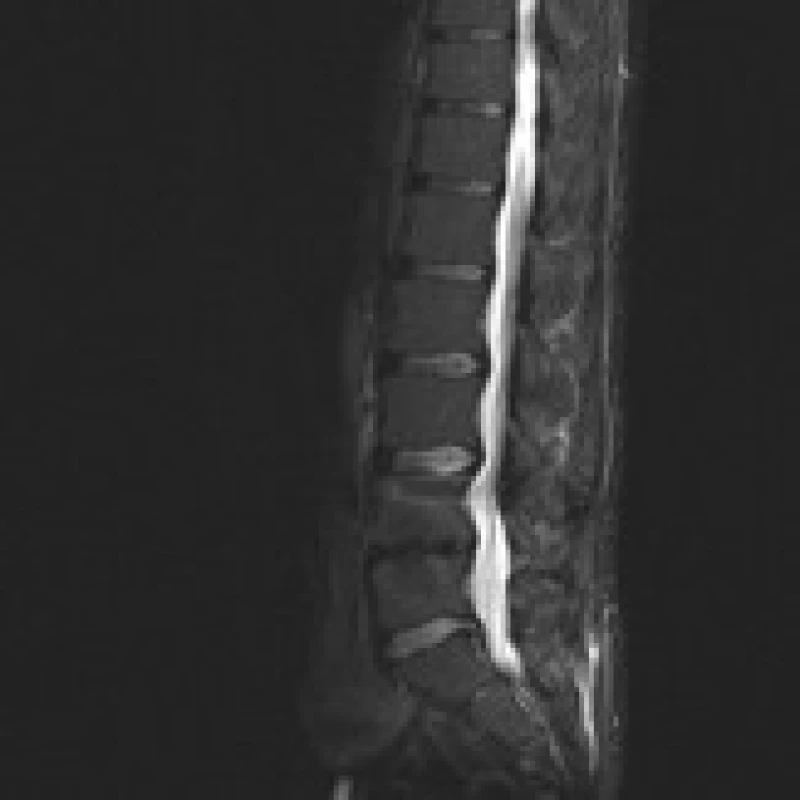
Diskuze
Operace ALIF stand-alone umožní mezitělovou artrodézu, zachování výšky prostoru a normalizaci osy páteře [5–7]. Odstraněním postižené meziobratlové ploténky dochází k odstranění zdroje obtíží, protože patologicky změněný disk je díky novému neurálnímu zásobení chápán jako generátor bolesti. V případech protruze disku umožní diskektomie přímou dekompresi nervových struktur a následnou distrakcí foramen intervertebrale implantátem dochází i k nepřímé dekompresi vystupujících nervových kořenů [8].
Přední operační přístup může být provázen komplikacemi. Faciszewski et al udávají celkovou míru komplikací 40,5% se zvýšeným rizikem u pacientů ve věku nad 60 let, u žen a u pacientů s vícečetnými zdravotními problémy. Mezi závažné komplikace řadí „postsympatektomickou neuralgii“, která je definována jako silná pálivá bolest, obvykle zhoršená v noci, lokalizovaná v proximální části dolní končetiny, třísla a přední strany stehna [9]. Rajaraman et al popisují komplikace po ALIF ve 38,3% a obdobně zdůrazňují u 10% pacientů často podceňovanou sympatickou dysfunkci [10]. Dickman popsal neurologické komplikace ve 2%, povrchovou infekci ve 3,1%, pooperační ileus ve 2,2%, retrográdní ejakulaci v 1,9%, poranění velkých cév v 1,7%, trombózu žil dolní končetiny v 0,7% a migraci implantátu v 1,5% [11]. V námi prezentovaném souboru se vyskytly jen nezávažné komplikace u 3 z 28 pacientů (10,7%), tedy v menší míře, než je uvedeno v literatuře. Autoři proto považují přední operační přístup za dostatečně bezpečný výkon. Podmínkou a naším doporučením je šetrná a minimálně invazivní operační technika, se zvláštním zřetelem na zachování veškerých nervových struktur, vč. truncus sympaticus a plexus hypogastricus superior, dále použití speciálních rozvěračů, dobrá znalost anatomie a antibiotická a antiagregační profylaxe. Přítomnost břišního chirurga autoři nepovažují za nezbytnost.
Při biomechanických testech po ALIF stand alone je opakovaně prokazovaná nedostatečná stabilita v extenzi. Pravděpodobnou příčinou je nadměrná distrakce kloubních facet a dále resekce předního podélného vazu při přední implantaci v L5/S1. Proto je často doporučeno doplnění stabilizace ještě zadní transpedikulární nebo translaminární fixací [4,6,12,13]. V případě doplnění zadní fixace se však ztrácí výhoda izolovaného předního přístupu, neboť pacient je zatěžován další operací, zvyšuje se pravděpodobnost komplikací z jiného operačního přístupu a jsou vyšší náklady. Požadovaná míra biomechanické stability pro získání kostní fúze není přesně definována [13]. ALIF stand alone proto může být dostačující výkon zaručující kvalitní artrodézu a dobrou klinickou odezvu, ale jen za podmínky, že příčinou obtíží je diskopatie s menší mírou nestability. Správná indikace je proto pro výsledek operace rozhodující. Alternativou pro ALIF stand alone jsou artroplastiky podléhající ale ještě přísnějším indikačním kritériím.
Kumar et al rozlišují u operací ALIF stand alone tři stupně kostního hojení a spolehlivou artrodézu popisují na základě skiagrafických snímků jen při průkazu kostních přemosťujících trabekul, při vyloučení nálezu radiolucentních linií, a pokud na funkčních snímcích nepřesáhne rozsah pohybu z flexe do extenze 2° [14]. Pavlov et al považovali za kritérium kostní fúze absenci pohybu nad 5° na funkčních snímcích, chybění radiolucentní linie a vyloučení dislokace implantátu [4]. Žádný z našich pacientů nesplňoval kritéria pro pseudoartrózu dle Pavlova. Posouzení artrodézy ze skiagrafických snímků průkazem prorůstání kostní tkáně implantátem je zvláště u titanových náhrad obtížné a zhodnocení dynamických snímků je zatíženo chybou, protože pacienti jsou v případech přetrvávající axiální bolesti omezeni v rozsahu pohybu.
Implantát SynCage je vyroben ze slitiny titanu, hliníku a niobu. Při mechanickém testování došlo k jeho selhání až při kompresivní zátěži 90 kN a únavové testy po cyklickém zatížení pětimilionkrát neprokázaly žádné poškození implantátu. Při biomechanických testech bylo prokázáno, že implantace titanového SynCage vede ke snížení rozsahu pohybu, tedy Range Of Motion (ROM) ve srovnání s neoperovanou páteří na hodnotu 41% ve flexi, na 34% v rotaci, na 35% v laterálním ohybu a na 68% v extenzi [12]. Poly-Eether-Ether-Keton (PEEK) je biomateriál vyznačující se dostatečnou chemickou a hydrolytickou odolností, dále odolností proti ionizujícímu záření, vysokou pevností a biokompatibilitou a může být opakovaně sterilizován. PEEK se používá jako alternativa ke standardním titanovým implantátům a má proti nim některé výhody. Zejména nevyvolá alergické reakce na kovové prvky, je radiolucentní a nezpůsobuje artefakty na MR. Ferguson et al testovali mechanickou odolnost PEEKového implantátu SynCage LR tlakem 10 MPa po dobu 2 000 hod a neprokázali selhání mechanických vlastností. Prokázali dále, že maximální koncentrace zátěže po implantaci je na hranici klícky a kostní krycí desky a distribuce těchto sil je závislá na tvaru implantátu [15]. U konvexního, tedy anatomického tvaru je zátěž lokalizována centrálně, zatímco u plochých implantátů je lokalizována do periferie klícky [15,16]. Spruit et al testovali biomechanicky primární stabilizují efekt titanových a PEEKových klícek stejného tvaru a velikosti a prokázali, že titanový implantát byl efektivnější v redukci míry ROM v axiální rotaci než PEEKový implantát. Příčinou jsou pravděpodobně ostřejší zuby na styčné ploše u klícky zhotovené z titanu než u měkčího PEEKu a to je umožněno odlišnými konstrukčními možnostmi obou materiálů [13]. Tvrdší titan se více zanoří do kostní krycí desky a zajistí větší primární stabilitu.
Crock popsal na CT snímcích cystické defekty kostní obratlové krycí desky u části pacientů s izolovanou resorpcí disku a vnímal tyto nálezy jako zdroj silné bolesti [17]. Obdobné nálezy kostních změn 12 měsíců po operaci v místech kontaktu implantátu Visios a kostní krycí desky obratlového těla byly prokázány u části našich pacientů a byly provázeny i menší mírou zlepšení klinického stavu než u pacientů, kde k těmto změnám nedošlo. Příčinou je pravděpodobně velký axiální tlak působící na periferii implantátu, způsobující následně tlakovou nekrózu kosti. Po doplnění zadní stabilizace se tlaková zátěž sníží a to vede k ústupu cystických kostních změn. U titanového SynCage tyto změny sledovány nebyly, neboť tlakové zatížení je po celém povrchu implantátu, celkově na větší ploše a tedy rovnoměrnější. Nepříznivé chování PEEKového implantátu Visios může být dáno i jeho větší pružností a nedostatečnou primární stabilitou, která neumožní včasné a dostatečně kvalitní kostní přihojení. Cystické defekty krycích desek nejsou projevem rejekce implantátu následkem imunitní nebo alergické reakce na PEEK materiál, protože kostní cysty by jinak musely přetrvávat i po doplnění stabilizace zadní fixací. Sledovatelné změny na CT jsou tedy důsledkem nevhodných biomechanických vlastností implantátu Visios a mohou být i jedním z projevů pseudoartrózy, navzdory tomu, že se ji skiagraficky nepodařilo prokázat.
Modic et al v roce 1988 popsali na MR změny intenzity signálu v subchondrální lokalizaci [3]. Modic 1 typ se v T1 modu zobrazí hypointenzivním a v T2 modu hyperintenzivním signálem a je nespecifickým projevem otoku. Nálezy Modicových změn jsou na MR velmi dobře reprodukovatelné [3,18]. Kjaer et al srovnali abnormální nálezy na MR u pacientů s axiální bolestí a zjistil nejvýraznější asociaci míry lumbaga právě s Modicovými změnami a dále s nálezem spondylolistézy [19]. Vital et al provedli zadní transpedikulární fixaci s posterolaterální dézou u 17 pacientů s chronickým lumbagem a s Modicovými 1 změnami na MR. Po šesti měsících pak prokázali transformaci změn typu Modic 1 na typ Modic 0 u 4 pacientů a na typ Modic 2 u zbylých 13 pacientů. Tyto změny byly provázeny zlepšeným klinickým stavem pacientů. Modic 1 signál tedy byl dobrým indikátorem pro selhání konzervativní léčby a pro indikaci ke stabilizační operaci [20]. Také v naší práci jsme prokázali statisticky významnou korelaci mezi Modicovými 1 změnami a horším klinickým stavem pacientů. Modicovy 1 změny souvisely s menší mírou stability a hojení u pacientů s PEEKovými klíckami než u pacientů s titanovými klíckami. Souvislost se stabilitou páteře s vyloučením vlivu alergické nebo imunitní reakce na PEEK materiál byla prokázána v naší práci tím, že po doplnění zadní transpedikulární fixace u části pacientů s PEEKovými klíckami a tedy zvýšením míry stability došlo k ústupu Modicových 1 změn. Modicovy 1 nálezy mohou být proto výrazem určitého stupně pseudoartrózy.
Průkaz kostních cystických změn na CT a Modicových 1 změn na MR po ALIF byl tedy u našich pacientů dobrým indikátorem nepříznivého hojení.
Závěr
Vznik kostních cystických změn 12 měsíců po operaci byl provázen menší mírou zlepšení klinického stavu než u pacientů, kde k těmto změnám nedošlo.
Nález Modicových 1 změn 12 měsíců po operaci byl provázen menší mírou zlepšení klinického stavu než při nálezu ostatních Modicových změn, tj. typu Modic 2 nebo Modic 0.
Kostní cysty a Modicovy 1 změny 12 měsíců po operaci se vytvořily pouze u pacientů s PEEKovým implantátem. S tím korespondoval i horší klinický stav pacientů s PEEKovým implantátem než u pacientů s titanovým implantátem.
Modicovy 1 změny na MR a kostní cysty na CT po použití PEEKového implantátu při ALIF stand alone vznikají v důsledku nestability a jsou zřejmě výrazem nedostatečného kostního přihojení implantátu. Doplnění zadní transpedikulární fixace, a tedy zvýšení stability vede k ústupu těchto nálezů na CT a MR a ke zlepšení klinického stavu pacientů.
Pro ALIF stand alone doporučují autoři použití titanového implantátu. PEEKový implantát by měl být používán jen se současnou zadní transpedikulární fixací a pro ALIF typu stand alone není vhodný.
Poděkování paní Mgr. Kateřině Langové za provedení statistických výpočtů.
MUDr. Lumír Hrabálek, Ph.D.
Neurochirurgická klinika
LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e‑mail: lumir.hrabalek@seznam.cz
Sources
1. Carlsson AM. Assessment of chronic pain. I. Aspects of the reliability and validity of the visual analogue scale. Pain 1983; 16(1): 87–101.
2. Fairbank JC, Pynsent PB. The Oswestry Disability Index. Spine 2000; 25(22): 2940–2953.
3. Modic MT, Steinberg PM, Ross JS, Masaryk TJ, Carter JR. Degenerative disc disease: assessment of changes in vertebral body marrow with MR Imaging. Radiology 1988; 166(1): 193–199.
4. Pavlov PW, Meijers H, van Limbeek J, Jacobs WCH, Lemmens AM, Obradov-Rajic M et al. Good outcome and restoration of lordosis after anterior lumbar interbody fusion with additional posterior fixation. Spine 2004; 29(17): 1893–1900.
5. Crock HV. Anterior lumbar interbody fusion: indications for its use and notes on surgical techniques. Clin Orthop Relat Res 1982; 165: 157–163.
6. Kim SM, Lim TJ, Paterno J, Park J, Kim DH. Biomechanical comparison: stability of lateral-approach anterior lumbar interbody fusion and lateral fixation compared with anterior-approach anterior lumbar interbody fusion and posterior fixation in lower lumbar spine. J Neurosurg Spine 2005; 2(1): 62–68.
7. Mayer HM. A new microsurgical technique for minimally invasive anterior lumbar interbody fusion. Spine 1997; 22(6): 691–700.
8. Chen D, Fay LA, Lok J, Yuan P, Edwards WT, Yuan HA. Increasing neuroforaminal volume by anterior interbody distraction in degenerative lumbar spine. Spine 1995, 20(1): 74–79.
9. Faciszewski T, Winter RB, Lonstein JE, Denis F, Johnson L. The surgical and medical perioperative complications of anterior spinal fusion surgery in the thoracic and lumbar spine in adults. A review of 1 223 procedures. Spine 1995; 20(14):1592–1599.
10. Rajaraman V, Vingan R, Roth P, Heary RF, Conklin L,Jacobs GB. Visceral and vascular complications resulting from anterior lumbar interbody fusion. J Neurosurg 1999; 91 (Suppl 1): 60–64.
11. Dickman CA. Internal fixation and fusion of the lumbar spine using threaded interbody cages. BNI Q 1997; 13: 425.
12. Spruit M. SynCage: a titanium alloy implant for ALIF. Riv Neuroradiol 1999; 12 (Suppl 1): 115–119.
13. Spruit M, Falk RG, Beckmann L, Steffen T, Castelein RM. The in vitro stabilising effect of polyetheretherketone cages versus a titanium cage of similar design for anterior lumbar interbody fusion. Eur Spine J 2005; 14(8): 752–758.
14. Kumar A, Kozak JA, Doherty BJ, Dickson JH. Interspace distraction and graft subsidence after anterior lumbar fusion with femoral strut allograft. Spine 1993; 18(16): 2393–2400.
15. Ferguson SJ, Visser JMA, Polikeit A. The long term mechanical integrity of non reinforced PEEK-OPTIMA polymer for demanding spinal applications: experimental and finite-element analysis. Eur Spine J 2006; 15(2): 149–156.
16. Kumar N, Judith MR, Kumar A, Mishra V, Robert MC. Analysis of stress distribution in lumbar interbody fusion. Spine 2005; 30(15): 1731–1735.
17. Crock HV. Spinal instability as an iatrogenic condition and its future management. In: Szpalski M, Gunzburg R,Pope MH. Lumbar segmental instability. Philadelphia: Lippincott Williams and Wilkins 1999: 103–111.
18. Jones A, Clarke A, Freeman BJC, Lam KS, Grevitt MP. The Modic classification. Inter- and intraobserver error in clinical practice. Spine 2005; 30(16): 1867–1869.
19. Kjaer P, Leboeuf-Yde C, Korsholm L, Sorensen JS, Bendix T. Magnetic resonance imaging and low back pain in adults: A diagnostic imaging study of 40-year-old men and women. Spine 2005; 30(10): 1173–1180.
20. Vital JM, Gille O, Pointillart V, Pedram M, Bacon P,Razanabola F, Schaelderle C et al. Course of Modic 1six months after lumbar posterior osteosynthesis. Spine 2003; 28(7): 715–721.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2009 Issue 1
Most read in this issue
- Trombotická trombocytopenická purpura (TTP) u pacientky s roztroušenou sklerózou – kazuistika
- Hereditární neuropatie
- Možnost predikce průběhu herpetické encefalitidy pomocí magnetické rezonance – kazuistika
- Diferenciální diagnostika neuroakantocytóz
