Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózy
Total and Phosphorylated Tau-protein and Beta-Amyloid42 in Cerebrospinal Fluid in Dementias and Multiple Sclerosis
Introduction:
Differential diagnosis of dementias is often difficult, and for this reason research into biomarkers that can assist in the diagnostic process has lately become important. The current study focuses on the diagnostic value of beta-amyloid42 (Aß-42), overall tau protein and phosphorylated tau protein for the diagnosis of Alzheimer's disease (AD), Creutzfeldt-Jakob disease (CJD) and multiple sclerosis (MS).
Methods:
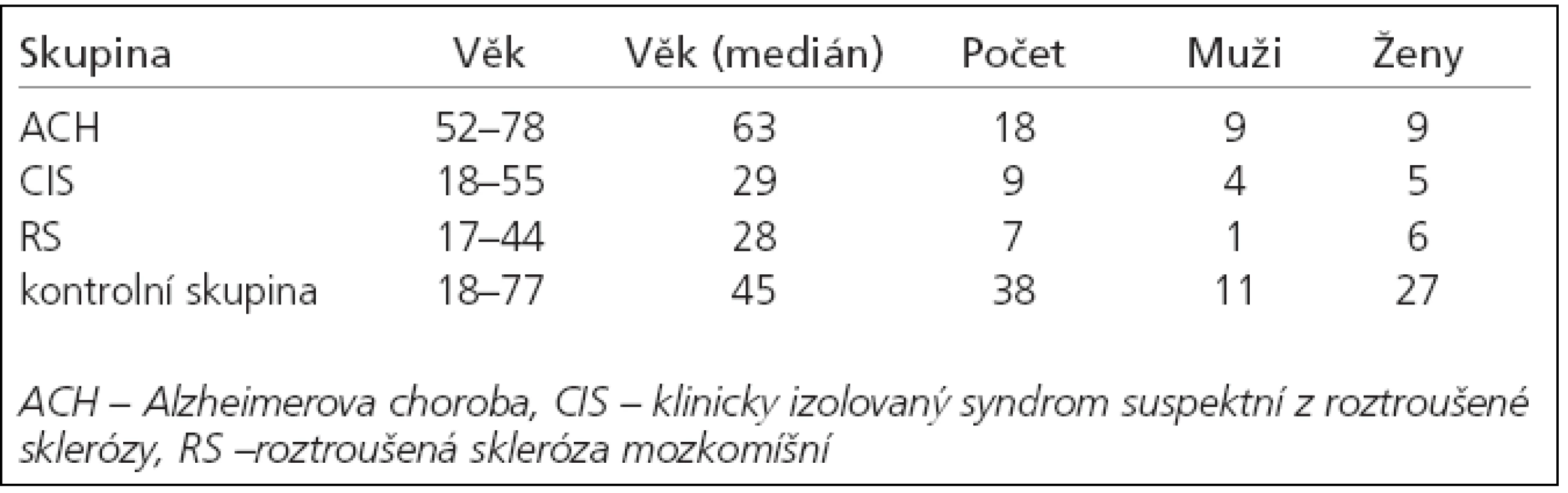
18 patients diagnosed as having AD according to NINCDS-ADRDA criteria, 16 patients with isolated clinical syndrome suspected of MS (7 of them fulfilling McDonald's criteria) and 3 patients with CJD (WHO criteria) were included into the study together with a cognitive intact control group consisting of 38 individuals. A curve analysis for receiver operating characteristics (ROCs) was calculated to define the cut off concentrations for the biomarkers and the maximum sensitivity and specificity for the given group. Correlation was used in the final analysis.
Results:
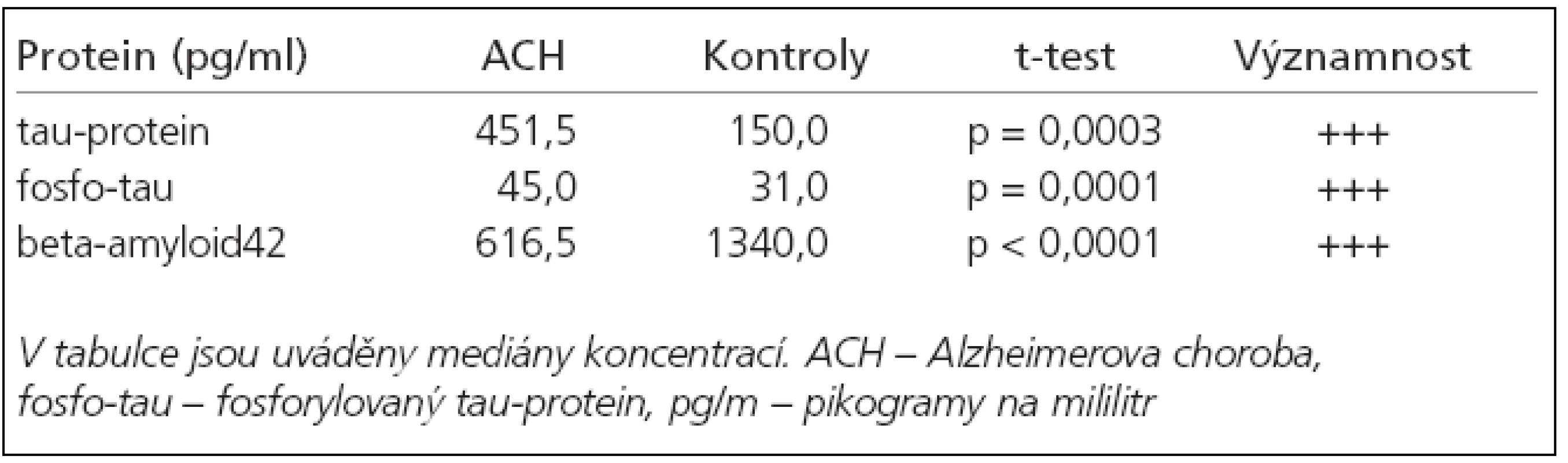
In patients diagnosed with AD there was significant decrease of beta-amyloid42 level (616.5 pg/ml, p < 0.0001) and increase of tau protein level (451 pg/ml, p = 0.0003) compared to control group. In CJD there was marked elevation of tau protein level and increased total tau versus phosphorylated tau protein ratio in comparison with the AD group as well as the control group. No significant changes in biomarker levels were found for patients with MS.
Conclusion:
Our results are in line with the current literature on the value of the three biomarkers mentioned above in the differential diagnosis of AD and CJD. We have not found any such evidence in relation to MS.
Key words:
Alzheimer's disease – Creutzfeldt-Jakob disease – multiple sclerosis – beta-amyloid42 – total tau-protein – phosphorylated tau-protein
Authors:
M. Vališ 1; R. Taláb 1; C. Andrýs 2
; P. Štourač 3; J. Masopust 4; D. Kalnická 5; G. Waberžinek 1
Authors‘ workplace:
Neurologická klinika LF UK a FN Hradec Králové
1; Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové
2; Neurologická klinika LF MU a FN Brno
3; Psychiatrická klinika LF UK a FN Hradec Králové
4; Psychiatrická léčebna Havlíčkův Brod
5
Published in:
Cesk Slov Neurol N 2008; 71/104(3): 329-335
Category:
Short Communication
Overview
Cíl:
Diferenciální diagnostika demencí je složitá, a proto se v současné době klade důraz na výzkum biomarkerů vhodných pro zpřesnění diagnostického procesu. Prezentovaná studie se zabývá významem měření hladiny beta-amyloidu42 (Aß-42), celkového tau-proteinu a fosforylovaného tau-proteinu pro diagnostiku Alzheimerovy choroby (ACH), Creutzfeldtovy-Jakobovy demence (CJD) a roztroušené sklerózy mozkomíšní (RS).
Soubor a metodika:
Do studie bylo zařazeno 18 pacientů s diagnózou pravděpodobné ACH dle kritérií National Institute of Neurological and Communicative Disorders and Stroke and Alzheimer's Disease and Related Disorders Association (NINCDS – ADRDA), 16 pacientů s klinicky izolovaným syndromem suspektním pro RS (z toho 7 pacientů splnilo McDonaldova kritéria pro RS) a 3 pacienti s diagnózou CJD dle WHO (World Health Organization). Kontrolní soubor tvořilo 38 pacientů vyšetřovaných pro možnost organického poškození mozku, které nebylo prokázáno. Pomocí křivky ROC (Receiver Operating Characteristic) byly pro každý marker stanoveny hraniční hodnoty s nejvyšší senzitivitou a specificitou pro uvedený soubor a následně byla provedena korelační analýza výsledků.
Výsledky:
U nemocných s diagnózou ACH jsme v porovnání s kontrolní skupinou zjistili statisticky významný pokles beta-amyloidu42 (616,5 pg/ml, p < 0,0001) a elevaci tau-proteinu (451 pg/ml, p = 0,0003). Pacienti s CJD měli oproti pacientům s ACH a kontrolám statisticky signifikantně zvýšen celkový tau-protein a poměr celkového a fosforylovaného tau-proteinu. U pacientů s RS jsme neprokázali statisticky významné změny hladin biomarkerů.
Závěry:
Výsledky naší studie jsou v souladu s literaturou a ukazují na možné využití uvedených biomarkerů v diagnostice ACH a CJD. Význam pro diferenciální diagnózu RS jsme nepotvrdili.
Klíčová slova:
Alzheimerova choroba – Creutzfeldtova Jakobova demence – roztroušená skleróza – beta-amyloid42 – tau-protein – fosforylovaný tau-protein
Úvod
Rychlý rozvoj laboratorních a zobrazovacích metod v posledních letech rozšířil a zpřesnil diagnostické možnosti neurodegenerativních onemocnění. Jejich význam spočívá jak v oblasti diferenciální diagnostiky, tak i v monitorování průběhu onemocnění s možností odhadu prognózy, nebo v hodnocení efektu léčby. U neurodegenerativních onemocnění byla diagnostika až dosud založena většinou pouze na klinickém obrazu, což ji činí v mnoha případech obtížnou [1]. Definitivní diagnózu je prakticky možné stanovit až post mortem. Mozková biopsie se jako invazivní vyšetření téměř neprovádí [2]. V současné době roste význam biochemických markerů v diagnostice některých neurodegenerativních onemocnění. Důležité je najít biomarkery s dostatečnou senzitivitou a specificitou pro dané onemocnění.
V naší práci jsme se zaměřili na vybraný okruh neurologických chorob s neurodegenerativním procesem. Jedná se o nemocné s Alzheimerovou chorobou (ACH), Creutzfeldtovou-Jakobovou chorobou (CJD), klinicky izolovaným syndromem suspektním z roztroušené sklerózy a roztroušenou sklerózou mozkomíšní (RS).
Alzheimerova choroba je nejčastějším typem demence ve starší populaci s typickým výskytem nad 65 let věku života [3]. S prodlužováním průměrné délky života, zejména ve vyspělých státech světa, její prevalence významně narůstá [4]. Intenzivní výzkum patogenetických mechanizmů a z toho plynoucí nové možnosti léčby, představují šanci pro tyto nemocné a mohou přispět k řešení závažného medicínského, ekonomického a sociálního problému [5]. Stanovení diagnózy ACH je výsledkem vyhodnocení anamnestických dat a klinických příznaků, mentálního stavu dle dosaženého skóre v neuropsychologické škále (např. Mini-Mental State Examination – MMSE), zobrazení mozku počítačovou tomografií či magnetickou rezonancí a případně dalších vyšetření potřebných k vyloučení jiné organické příčiny stavu. Na stejném základě jsou definována i aktuálně užívaná kritéria pro diagnostiku ACH NINCDS-ADRDA [6]. Diagnóza je definitivní až po rozboru mozkové tkáně na patologii s průkazem typických neurofibrilárních lézí a amyloidních plaků [2]. V literatuře jsou ve spojitosti s ACH nejčastěji zmiňovány 3 biomarkery. Prvním je beta-amyloid vznikající z amyloidového prekurzorového proteinu, který se fyziologicky účastní tvorby buněčné membrány. Beta-amyloid je u ACH součástí perineuronálních neuritických plaků . Tím se vysvětluje jeho snížená hladina v mozkomíšním moku (CSF) nemocných [5–7]. Nejvíce se využívá izoforma Aß-42, která vykazuje nejvyšší stupeň adherence v placích, a tím nejvýraznější pokles hladin u ACH [7]. Dalším zkoumaným markerem je tau-protein. Ten tvoří jednu z hlavních součástí sítě cytoskeletu neuronu a podílí se na transportním systému axonu. Do likvoru se uvolňuje při zániku neuronů, a to zejména při atroficko-degenerativním postižení charakteristickém pro ACH. Lze soudit, že množství tau-proteinu v likvoru je závislé na rychlosti progrese onemocnění zodpovědného za poškození nervových buněk. Nejvyšší hladiny jsou popsané u pacientů s CJD [9]. Později se mezi více specifické a senzitivní markery pro ACH zařadil fosforylovaný tau-protein. K hyperfosforylaci tau-proteinu dochází během vývoje nervového systému a nacházíme ji u širšího okruhu neurodegenerativních onemocnění včetně ACH. Zde je opakovaně nalézána elevace hladin v CSF a pravděpodobně při vzniku typických neuronálních klubek také dochází ke spolupodílu glykozylace a ubikvitinizace [10]. Pro účely diferenciální diagnostiky, pro kterou je potřebná vysoká specificita i senzitivita vyšetřovacího nástroje, se u biomarkerů posuzují jak jejich absolutní hladiny, tak i poměry jejich vzájemných kombinací.
Sporadická Creutzfeldtova-Jakobova choroba je vzácné, ale rychle progredující a fatální neurodegenerativní onemocnění. Náleží do skupiny prionových nemocí. Klinický obraz je charakterizován triádou progresivní demence, myoklonu a charakteristických změn na EEG. Diagnostická kritéria dle WHO jsou postavena na klinickém obraze a pozitivitě proteinu 14-3-3 [12]. 14-3-3 protein se vyskytuje ve všech eukaryotických buňkách. Tento marker ale není pro CJD specifický a nemusí být ve všech případech pozitivní. Definitivní diagnóza je pak stanovena post mortem na základě nálezu patologické izoformy prionového proteinu v mozkové tkáni. Největší diferenciálně diagnostické obtíže vůči CJD působí ACH, která s CJD sdílí některé společné klinické i neuropatologické znaky [13]. Dosavadní výzkum této oblasti naznačuje, že rozdílná hladina tau-proteinu a poměr tau/fosfo-tau v likvoru nemocných je dostatečně senzitivní a specifická k odlišení těchto 2 nozologických jednotek [9].
Roztroušená skleróza mozkomíšní je chronické handicapující onemocnění, charakterizované demyelinizací a kombinací zánětlivého postižení s axonální ztrátou v CNS. Od roku 2001 jsou pro diagnózu v platnosti McDonaldova kritéria [14]. Vedle klinického obrazu se využívá přítomnosti specifického nálezu na MRI mozku a jeho diseminaci v čase a prostoru, nálezu pozitivní syntézy oligoklonálních imunoglobulinů v CSF, které nejsou v séru a abnormní zrakové evokované potenciály. Protože na počátku demyelinizace u RS hraje významnou roli i axonální destrukce, výzkum se zaměřil na identifikaci specifických biomarkerů tohoto procesu [15]. Nadějným se zde jeví právě tau-protein, i když výsledky studií nejsou tak přesvědčivé [16–18]. Objevení markeru axonálního poškození u RS by
přispělo k zpřesnění diferenciální diagnostiky a pomohlo identifikovat jedince s klinicky izolovaným syndromem (CIS) představujícím časnou fázi roztroušené sklerózy [19].
Prezentovaná studie se zabývá významem měření hladiny beta-amyloidu42 (Aß-42), celkového tau-proteinu a fosforylovaného tau-proteinu pro diagnostiku ACH, CJD a RS. Také jsme hodnotili senzitivitu a specificitu těchto biomarkerů pro účely diferenciální diagnostiky, závislost hladin na demografických proměnných, stupni onemocnění a tíži kognitivního deficitu. Výsledky byly porovnány
s dostupnou literaturou.
Soubor a metodika
Do studie bylo zařazeno 18 pacientů s diagnózou pravděpodobné ACH dle kritérií NINCDS-ADRDA, 9 pacientů s klinicky izolovaným syndromem (CIS), 7 pacientů s diagnózou RS dle McDonaldových kritérií a 3 pacienti s diagnózou CJD dle WHO potvrzenou sekčním nálezem. Všichni pacienti byli bílé rasy a české národnosti, vyšetřeni a léčeni na Neurologické klinice FN v Hradci Králové. Podepsali informovaný souhlas s odběrem mozkomíšního moku. Výsledky jejich vyšetření byly porovnány s kontrolní skupinou 38 pacientů, u kterých se původní klinické podezření na organický neuropatologický proces nervového systému dalšími klinickými, laboratorními a zobrazovacími metodami nepotvrdilo – zejména podezření na subarachnoidální krvácení či neuroinfekci (tab. 1). Na základě naměřených hodnot u pacientů i kontrol byly pomocí ROC křivky stanoveny hraniční hodnoty markerů s nejvyšší specificitou a senzitivitou pro zkoumané onemocnění. Všichni zařazení pacienti byli vyšetřeni pomocí MRI či CT mozku, MMSE a byl jim odebrán mozkomíšní mok k analýze. Mozkomíšní mok byl odebírán standardní technikou lumbální punkce atraumatickou jehlou k jednorázovému užití. Metodou enzymové imunoanalýzy (ELISA), INNOTEST ß-AMYLOID(1-42) a INNOTEST hTAU Ag belgické firmy INNOGENETICS N.V., jsme vyšetřili koncentrace tau-proteinu + fosforylovaného tau-proteinu a beta-amyloidu42. U pacientů s RS a CIS nebyl vyšetřen fosforylovaný tau-protein z ekonomických důvodů. Ke statistickým výpočtům byl použit sofware MedCalc (Belgie). Korelace naměřených koncentrací byla hodnocena na základě vypočteného korelačního koeficientu (R) a hladiny významnosti (p). Byla posuzována závislost koncentrací celkového tau-proteinu (h-TAU), fosforylovaného tau-proteinu (p-TAU) a beta-amyloidu42 na demografických proměnných, diagnóze, délce trvání nemoci a stupni kognitivního deficitu stanoveného pomocí MMSE. U vybraných nemocí byly vypočteny vhodné koeficienty biomarkerů (h-TAU/beta-amyloid42, p-TAU/betaamyloid42, h-TAU/p-TAU).
Výsledky
U nemocných s ACH byla proti kontrolní skupině signifikantně zvýšená hladina tau-proteinu a fosforylovaného tau-proteinu a snížená hladina beta-amyloidu42 (tab. 2). Dle křivky ROC byla stanovena hraniční hodnota pro tau-protein 234 pg/ml (specificita/senzitivita = 77,8/78,2 %) a pro beta-amyloid42 byla stanovena hodnota 1 180 pg/ml (specificita/ senzitivita = 72,2/80,0 %). Neprokázali jsme korelaci hladin beta-amyloidu42 a tau-proteinu s věkem pacientů, dobou trvání nemoci ani skóre MMSE (zde pouze slabá korelace s beta-amyloidem42) (tab. 3). Hladina fosforylovaného tau-proteinu korelovala s věkem pacientů (p = 0,0249) a s výsledkem MMSE (p = 0,0001).
Skupinu pacientů s klinicky izolovaným syndromem a roztroušenou sklerózou jsme nejprve porovnali s kontrolní skupinou. Nemocní měli medián koncentrace tau-proteinu 160 pg/ml a beta-amyloidu42
1 437 pg/ml. U kontrol byly tyto hodnoty 150 pg/ml a 1 340 pg/ml. Rozdíly nebyly statisticky významné. Nepodařilo se prokázat korelaci mezi testovanými biomarkery a přítomností či absencí nemoci (tau-protein: p = 0,3915, betaamyloid42: p = 0,3915). Rozdíly v koncentraci tau-proteinu a beta-amyloidu42 mezi skupinou s CIS a definitivní RS (tab. 4) také nedosáhly statistické významnosti. Pro posouzení tíže onemocnění jsme zvolili škálu Expanded Disability Status Scale (EDSS). Vztah biomarkerů k této škále jsme u nemocných neprokázali. Hodnoty pro pacienty s CIS jsou znázorněny
na obrázcích (grafy 1, 2).



U pacientů s CJD byly nalezeny následující mediány: tau-protein 2 250 pg/ml, fosforylovaný tau-protein 54 pg/ml a beta-amyloid42 673 pg/ml. U všech pacientů byly výrazně zvýšeny hladiny tau-proteinu (592, 2 250, 2 730 pg/ml). Tyto hladiny byly mnohem vyšší než hladiny naměřené u kontrol, ale také u našeho souboru pacientů s ACH, CIS a RS. Z poměrových ukazatelů (h-TAU/beta-amyloid42, p-TAU/beta-amyloid42, h-TAU/p-TAU) bylo nejcitlivější pro odlišení CJD od kontrol stanovení poměru h-TAU/p-TAU, ale hlavně z důvodu výrazného zvýšení tauproteinu ve skupině nemocných.
Diskuse
V naší práci jsme se zaměřili na 3 jednotky z okruhu závažných neurologických onemocnění – ACH, CJD a RS. Zkoumali jsme možnosti využití 3 biomarkerů: tauproteinu, fosforylovaného tau-proteinu
a beta-amyloidu42 v diagnostice těchto nemocí. U ACH jsme v našem souboru ve shodě s dostupnou literaturou [2,20,21] prokázali nižší hladinu beta-amyloidu42 a vyšší koncentrace tau-proteinu a fosforylovaného tau-proteinu v likvoru nemocných oproti kontrolám. Klíčovým problémem u nově zaváděných analytických postupů je konstrukce referenčních (fyziologických) hodnot či intervalů. V této práci byly fyziologické koncentrace získány pomocí statistického nástroje ROC (Receiver Operating Characteristic), který umožňuje stanovit hodnotu senzitivity a specificity pro různé koncentrace měřených markerů. Fyziologická mez je taková koncentrace, pro kterou lze najít optimální poměr senzitivity a specificity. Skutečností je, že nejsou k dispozici hranice hodnot, které lze považovat za fyziologické, a musí je každá laboratoř stanovit individuálně. Námi zjištěný stupeň senzitivity/specificity 80 % sice není optimální jako nástroj diferenciální diagnostiky, ale splňuje předepsaná kritéria a lze jej zvýšit použitím kombinace biomarkerů. Kapaki et al ve své studii se 49 pacienty s ACH dosáhli při využití beta-amyloidu42 specificitu 80 % a senzitivitu 82 % pro odlišení ACH od normálního stárnutí [2]. Při použití tau-proteinu tyto hodnoty mírně vzrostly a po vypočtení poměru tau-protein/beta-amyloid42 dosáhli 83%a 94% pro odlišení od kontrol a dokonce 100 % a 71 % pro odlišení od ostatních neurodegenerativních onemocnění. V porovnání s výsledky studií našich autorů Horta et al a Pidrmana et al jsme naměřili vyšší hladinu beta-amyloidu v kontrolním souboru. Příčinou může být nehomogenita kontrolního souboru. Byl tvořen pacienty vyšetřovanými pro organické postižení mozku, které nebylo prokázáno [8,22]. Stěžejní zůstává potvrzení statisticky významného poklesu eta-amyloidu, vzestupu tau-proteinu a fosforylovaného tau-proteinu u skupiny ACH a kompatibilní výsledky se světovým písemnictvím u ostatních skupin nervových onemocnění. Fosforylovaný tau-protein, substance běžně se vyskytující v organizmu při vývoji nervového systému, se dostala do popředí zájmu nejpozději. Dle dostupných sdělení se může jednat o nejcitlivější ze 3 markerů pro ACH [11,23]. Hu et al udávají pro kombinaci tau-proteinu a fosforylovaného tau-proteinu u ACH senzitivitu 96 % a specificitu 100 % [24].
V námi prezentované studii byl fosforylovaný tau-protein jediný, který výrazněji koreloval s věkem pacientů a skóre MMSE u ACH. Patofyziologický podklad této korelace není zcela jasný a publikované
studie se v tomto ohledu neshodují. Sjögren et al [25] ve své práci popsali závislost beta-amyloidu na věku pacientů, kterou jsme v naší studii neprokázali. Tapiola et al [21] zjistili nižší koncentraci beta-amyoidu42 u pacientů s delším trváním nemoci. Tau-protein dle jejich výsledků tuto závislost nevykazoval.
U roztroušené sklerózy je rozbor mozkomíšního moku nutnou součástí diagnostického procesu. Není však k dispozici test specifický pouze pro RS [14,15]. Myšlenka testovat tau-protein u této nemoci vychází z nálezu časného axonálního poškození u RS. Předpokládané vyšší hladiny v likvoru u nemocných oproti zdravým kontrolám však potvrdilo pouze několik studií [16,18,19]. Naproti
tomu Guimaraes et al [17] v souboru 50 pacientů s RS neprokázali rozdíl v hladině tau-proteinu oproti zdravým kontrolám stejně jako závislost tohoto markeru na průběhu, délce trvání nemoci či EDSS škále. V naší studii jsme dosáhli shodných výsledků a došli ke stejnému závěru jako ve studii posledně citované. Tauprotein se nejeví jako vhodný biomarker pro diagnostiku RS.
Vzácný výskyt CJD (incidence 1 : 1 000 000) komplikuje provádění studií s validními výstupy. V dnešní době je diagnóza CJD založena kromě klinických znaků a nálezu periodických komplexů ostrých vln na záznamu EEG také na pozitivitě proteinu 14-3-3 [12]. Problémem je nedostatečná specificita proteinu 14-3-3 pro CJD, zejména při nutnosti odlišení od ostatních typů demencí [10]. Výhodou naší malé skupiny (n = 3) byla definitivní diagnóza CJD založená na sekčním nálezu. V souladu s dostupnou literaturou jsme u všech pacientů nalezli výrazné zvýšení hladiny tau-proteinu [9,26]. Vysvětlením tohoto jevu je pravděpodobně masivní uvolnění tau-proteinu z mozkové tkáně při rychlé ztrátě neuronů podobně jako například u cévních mozkových příhod. Důležitým faktorem jsou také anatomické poměry a kontakt destruované tkáně s likvorovými prostorami. U JCD probíhá relativně rychlá destrukce lokalizovaná v blízkosti likvorového kompartmentu, a proto jsou zvýšení velmi zřetelná. U AD
je proces pomalejší, s menší intenzitou včetně subkortikálních změn. U RS je maximum strukturálních změn intraparenchymatózně s omezenou komunikací s CSF. Kapaki et al [9] ve své studii stanovili hraniční hodnotu tau-proteinu 2 131 pg/ml, která s vysokou přesností odlišila pacienty s CJD jednak od kontrolní skupiny, ale také od pacientů s ACH. Pouze 2 z našich 3 pacientů měli hladinu tau-proteinu nad touto hranicí. Skutečnost, že diagnóza byla v našem souboru potvrzena post mortem, zpochybňuje zákonitost takto extrémní elevace tauproteinu u CJD. Hladina tau-proteinu i 14-3-3 proteinu je také závislá na délce a pokročilosti onemocnění [27,28].
Závěr
Výsledky provedených prací na dané téma jsme potvrdili na české populaci. Rozdílné hodnoty beta-amyloidu proti jiným českým autorům potvrzují vhodnost stanovení vlastních norem pro každou laboratoř [8,22]. Naměřené hodnoty zvýšené koncentrace tau-proteinu i fosfo-tau-proteinu a snížení beta-amyloidu42 v mozkomíšním moku u pacientů s ACH splňující požadovaný stupeň senzitivity/specificity 80 % podporují indikaci vyšetřování uvedených biomarkerů v diferenciální diagnostice této nemoci. Průkaz nezávislosti zkoumaných hodnot na délce trvání onemocnění a stupni poškození CNS by mohl představovat nepřímý důkaz existence onemocnění. V těchto případech by léčba mohla být zahájena u počátečních a neúplně vyjádřených forem ACH, s možností výrazného zlepšení prognózy pacientů. Pro CJD se jako výrazně specifický marker jeví vysoká elevace hladin tauproteinu. Stanovení přesného diagnostického rozmezí je však otázkou dalšího výzkumu. Možnost využití tau-proteinu a beta-amyloidu42 v diagnostice roztroušené sklerózy se na základě našich výsledků nejeví jako přínosné.
Práce vznikla bez podpory grantu či výzkumného záměru a nejsou přítomny ani jiné závazky, které by mohly vést ke konfliktu zájmů.
Poděkování: Rád bych poděkoval MUDr. Františku Koukolíkovi, DrSc. a spolupracovníkům za provedená neuropatologická vyšetření.
MUDr. Martin Vališ
Neurologická klinika LF UK a FN Hradec Králové
Nezvalova 265,
500 05 Hradec Králové
e-mail: Valismar@seznam.cz
Přijato k recenzi: 4. 12. 2007
Přijato do tisku: 10. 1. 2008
Sources
1. Bibl M, Mollenhauer B, Esselmann H, Lewczuk P, Klafki H-W, Sparbier K et al. CSF amyloid-ß-peptides in Alzheimer's disease, dementia with Lewy bodies and Parkinson's disease dementia. Brain 2006; 129(Pt 5): 1177–1178.
2. Kapaki E, Paraskevas GP, Zalonis I, Zournas C. CSF tau-protein and ß-amyloid (1–42) in Alzheimer's disease diagnosis: discriminatiom from normal ageing and other dementias in the Greek population. Eur J Neurol 2003; 10(2): 119–128.
3. Friedland RP. Epidemiology, education and ecology of Alzheimer's disease. Neurology 1993; 43(2): 246–249.
4. Breteler MM, van Harskamp F, Claus JJ, van der Cammen TJ, Grobbee DE, Hofman A et al. Prevalence of Alzheimer’s disease and vascular dementia: association with education. The Rotterdam study. BMJ 1995; 310(6985): 970–973.
5. Wolfe MS. Therapeutic strategies for Alzheimer’s disease. Nat Rev Drug Discov 2002; 1(11): 859–866.
6. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: Report of the NINCDS-ADRDA Work group under the auspices of the Department of Health and Human Services Task Force on Alzheimer’s disease. Neurology 1984; 34(7): 939–944.
7. Small DH, McLean CA. Alzheimer's disease and the amyloid beta protein: What is the role of amyloid? J Neurochem 1999; 73(2): 43–449.
8. Hort J, Glosová l, Vyhnálek M, Bojar M, Škoda D, Hladíková M. Tau-protein a beta amyloid v likvoru u Alzheimerovy choroby. Cesk Slov Neurol N 2007; 70/103(1): 30–36.
9. Kapaki E, Kilidireas K, Paraskevas GP, Michalopoulou M, Patsouris E. Highly increased CSF tau-protein and decreased betaamyloid (1-42) in sporadic CJD: a discrimination from Alzheimer’s disease? J Neurol Neurosurg Psychiatry 2001; 71(3): 401–403.
10. Ledesma M, Medina M, Avila J. The invitro formation of recombinant tau polymer effect of phosphorylation and glycation. Mol Chem Neuropathol 1996; 27(3): 249–258.
11. Parnetti L, Lanari A, Amici S, Gallai V, Vanmechelen E, Hulstaert F. CSF phosphorylated tau is a possible marker for discriminating
Alzheimer’s disease from dementia with Lewy bodies. Phospho-Tau International Study group. Neurol Sci 2001; 22(1): 77–78.
12. Zeider M, Gibbs C, Meslin F. WHO manual for strengthening diagnosis and surveillance of Creutzfeldt-Jakob disease. World Health Organization 1998; 7–8 : 47–51.
13. Hainfellner JA, Wanschitz J, Jellinger K, Liberski PP, Gullotta F, Budka H. Coexistence of Alzheimer-type neuropathology in Creutzfeldt-Jakob disease. Acta Neuropathol 1998; 96(2): 116–122.
14. McDonald WI, Compston A, Edan G, Goodkin D, Hartung H-P, Lublin FD et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the international panel on the diagnosis of multiple sclerosis. Ann Neurol 2001; 50(1): 121–127.
15. Luque FA, Jaffe SL. Cerebrospinal fluid analysis in multiple sclerosis. Int Rev Neurobiol 2007; 79 : 341–356.
16. Brettschneider J, Maier M, Arda S, Claus A, Sussmuth SD, Kassubek J et al. Tau-protein level in cerebrospinal fluid is increased in patients with early multiple sclerosis. Mult Scler 2005; 11 : 261–265.
17. Guimares I, Cardoso MI, Sá MJ. Tauprotein seems not to be a useful routine clinical marker of axonal damage in multiple sclerosis. Mult Scler 2006; 12(3): 354–356.
18. Kapaki E, Paraskevas GP, Michalopoulou M, Kilidireas K. Increased cerebrospinal fluid tau-protein in multiple sclerosis. Eur Neurol 2000; 43(4): 228–232.
19. Brettschneider J, Petzhold A, Junker A, Tumani H. Axonal damage markers in the cerebrospinal fluid of patients with clinically isolated syndrome improve predicting conversion to definite multiple sclerosis. Mult Scler 2006; 12(2): 143–148.
20. Munroe WA, Southwick PC, Chang L, Scharre DW, Echols CL, Fu PC et al. Tauprotein in cerebrospinal fluid as an aid in the diagnosis of Alzheimer’s disease. Ann Clin Lab Sci 1995; 25(3): 207–217.
21. Tapiola T, Pirttila T, Mikkonen M, Mehta PD, Alafuzoff I, Koivisto K et al. Three-years follow-up of cerebrospinal fluid tau, beta-amyloid 42 and 40 concentrations in Alzheimer’s disease. Neurosci Lett 2000; 280 : 119–122.
22. Pidrman V, Látalová K, Mareš J, Urbánek K, Herzig R, Bekárek V et al. Stanovení tau-proteinu a beta amyloidu jako možných diagnostických markerů demencí. Cesk Slov Neurol N 2004; 67/100(5): 330–334.
23. Nägga K, Gottfries J, Blennow K, Marcusson J. Cerebrospinal fluid phospho-tau, total tau and beta-amyloid (1-42) in the differentiation between Alzheimer’s disease and vascular dementia. Dement Geriatr Cogn Disord 2002; 14(4): 183–190.
24. Hu YY, He SS, Wang X, Duan QH, Grundke-Igbal I, Igbal K et al. Levels of nonphosphorylated and phosphorylated tau in cerebrospinal fluid of Alzheimer's disease patients: an ultrasensitive bioenzyme - substrate-recycle enzyme linked immunosorbent assay. Am J Pathol 2002; 160(4): 1269–1278.
25. Sjögren M, Vanderstichele H, Agren H, Zachrisson O, Edsbagge M, Wikkelso C et al. Tau and Aß42 in cerebrospinal fluid from healthy adults 21–93 years of age: Establishment of reference values. Clin Chem 2001; 47(10): 1776–1781.
26. Otto M, Wiltfang J, Tumani H, Zerr I, Lantsch M, Kornhuber J et al. Elevated levels of tau-protein in cerebrospinal fluid of patients with Creutzfeldt-Jakob disease. Neurosci Lett 1997; 225(3): 210–212.
27. Giraud P, Biacabe AG, Chazot G, Later R, Joyeux O, Moene Y et al. Increased detection of 14-3-3 protein in cerebrospinal fluid in sporadic Creutzfeldt-Jakob disease during the disease course. Eur Neurol 2002; 48(4): 218–221.
28. Van Everbroeck B, Green A, Vanmechelen E, Vanderstichele H, Pals P, Sanchez-Valle R et al. Phosphorylated tau in cerebrospinal fluid as a marker for Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry 2002; 73(1): 79–81.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2008 Issue 3
Most read in this issue
- Depersonalizace a derealizace – současné nálezy
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Migréna v těhotenství
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
