Komplementarita stentingu a endarterektomie karotid: tříleté zkušenosti
Carotid Endarterectomy and Carotid Angioplasty Stenting as Complementary Treatment Methods: Three Years Experience
Aim:
Carotid artery angioplasty with stenting (CAS) is relatively new interventional technique in secondary prevention of brain ischemia. In comparison with carotid endarterectomy (CEA) indications of CAS are not unambiguously established. The aim of our study was retrospective comparison of 30-d neurological morbidity/mortality of elective CAS and CEA in our department during 3 year period.
Methods:
In 1. 2003 - 10. 2006 were performed 481 elective interventions in our institution: 391 CEA and 90 CAS. CAS indications were: ICA restenosis, comorbid conditions, radiation-induced stenosis and difficult acces surgically. Pre-operative symptoms were congruent in both groups.
Results:
30-d neurological morbidity in CEA group was 1.5%, mortality was recorded in 0.3%. In CEA group was neurological morbidity present in 2.2%, mortality has not been recorded.
Conclusion:
30-d morbidity/mortality in CAS group in above mentioned indications was comparable with CEA group. Authors thus consider CAS in indications of carotid restenosis, radiation-induced stenosis, medical conditions and anatomical reasons legitimate.The results are in conformity with AHA/ASA Guidelines.
Key words:
carotid endarterectomy, carotid artery stenting, complementarity
Authors:
V. Přibáň 1; J. Fiedler 1; L. Baránková 1; M. Bombic 1; L. Štěrba 2
Authors‘ workplace:
neurochirurgické oddělení, radiodiagnostické oddělení
Nemocnice České Budějovice
1
Published in:
Cesk Slov Neurol N 2008; 71/104(1): 75-80
Category:
Short Communication
Overview
Cíl:
Angioplastika karotických tepen s implantací stentu (CAS) je relativně novou intervenční technikou sekundární prevence ischemie mozkové. Na rozdíl od karotické endarterektomie (CEA) nejsou indikace CAS jasně stanoveny. Cílem studie bylo retrospektivní porovnání 30denní neurologické morbidity a mortality elektivních CAS a CEA na našem pracovišti za 3leté období.
Soubor a metodika:
V období 2003 - 2006 bylo provedeno 481 elektivních intervencí: 391 CEA a 90 CAS. Indikací CAS byla restenóza po CEA, komorbidita, poiradiační stenóza karotidy a technická kontraindikace CEA. Předoperační symptomy pacientů byly v obou souborech srovnatelné.
Výsledky:
30denní neurologická morbidita činila v souboru CEA 1,5 %, mortalita byla zaznamenána v 0,3 %. V souboru CAS byla neurologická morbidita přítomna v 2,2 %, mortalita nebyla zaznamenána.
Závěr:
CAS v našem souboru vykazoval ve výše uvedených indikacích nízkou 30denní neurologickou morbiditu/mortalitu, srovnatelnou s CEA. Autoři považují proto CAS v indikaci karotických restenóz, poiradiačních stenóz, závažných přidružených interních chorob a anatomických důvodů za plně oprávněný.
Závěr je ve shodě s novými doporučeními American Heart Association (AHA).
Klíčová slova:
karotická endarterektomie, karotický stenting, komplementarita
Úvod
Angioplastika karotických tepen se zavedením stentu je relativně novou metodou sekundární prevence mozkové ischemie. Jde o nadějnou intervenční metodu, s potenciálně nižší zátěží pacienta ve srovnání s CEA. Její výsledky jsou proto pochopitelně porovnávány s karotickou endarterektomií, která je v této indikaci zlatým standardem [1-4]. Angioplastiky jsou prováděny od 80. let 20. století. Počáteční četnost komplikací byla relativně vysoká a převyšovala komplikace po CEA. Zlepšení výsledků CAS přinesla zvýšená erudice intervenčních neuroradiologů a zdokonalení instrumentária, zejména rutinní zavedení protekčních zařízení. Přestože proběhlo několik prospektivních studií srovnávajících výsledky CEA a CAS, nebyly dosud indikace stentingu jasně definovány. V současnosti platí doporučení americké kardiologické asociace [5], která indikuje použití stentu u karotických restenóz, poiradiačních stenóz, závažných přidružených interních chorob a stenóz anatomicky nevhodných k CEA.
Cílem naší studie je retrospektivní zhodnocení 30denní neurologické morbidity/mortality karotické endarterektomie a angioplastiky karotidy s užitím stentu na našem pracovišti v letech 2003–2006. Volba metody byla v souladu s doporučeními AHA.
Soubor a Metodika
V období leden 2003 – říjen 2006 podstoupilo plánovanou intervenci pro významnou stenózu vnitřní karotidy (ACI) na našem pracovišti 481 pacientů: 391 CEA a 90 CAS. Počet výkonů v jednotlivých letech zobrazuje tab. 1.
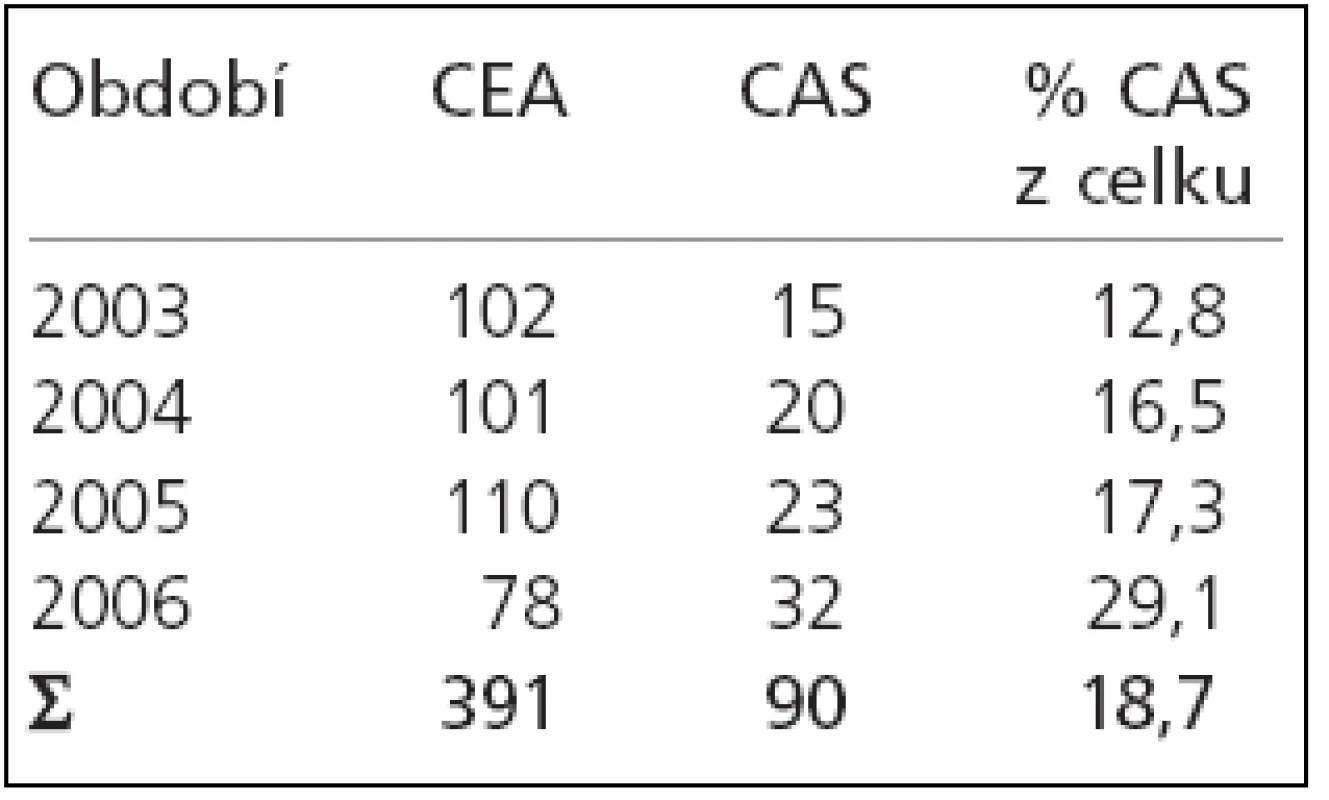
Z tab. 1 je patrný relativní nárůst CAS ve sledovaném období z 12,8 % iniciálně na 29,1 % intervencí v roce 2006.
Indikací k CEA i CAS byla minimálně 60 % symptomatická nebo asymptomatická stenóza ACI, hodnocená dle kritérií NASCET [1]. Indikace k použití CAS respektovala pravidla, která byla naposledy shrnuta v AHA doporučeních [5]. Z tohoto důvodu nemohly být soubory homogenní. V obou skupinách bylo stejné zastoupení žen a mužů. Četnost výskytu hypertenze, kardiologických onemocnění a dyslipidemie byla srovnatelná. Klinickou symptomatologii pacientů v obou skupinách charakterizuje graf 1. a,b.
Do podskupiny asymptomatické byli zahrnutí pacienti s absencí anamnézy ischemické cévní mozkové příhody a zároveň negativním nálezem na CT nebo MR v teritoriu stenotické karotidy. Tranzitorní ischemická ataka (TIA) se projevila prchavými cerebrálními nebo okulárními symptomy s negativním nálezem na zobrazovacích technikách. Do skupiny jiné byli zařazeni pacienti s příznaky vertebrobazilární insuficience, pokud nebyla a. cerebri posterior dominantně zásobena krví z povodí postižené karotidy.
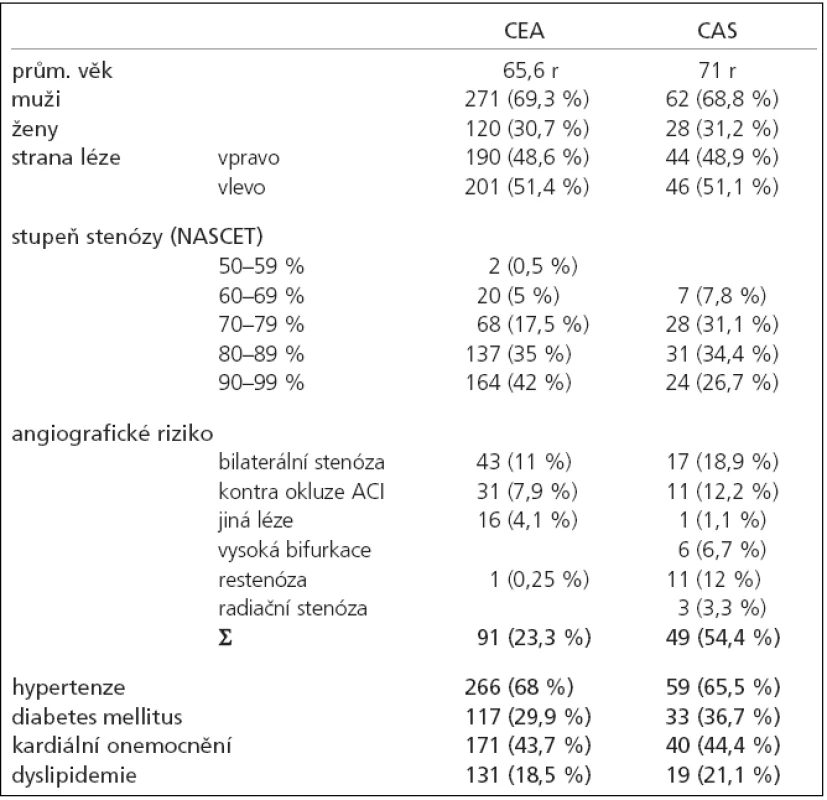
Vyšší věk pacientů se stenózou vnitřní karotidy byl nejčastějším důvodem, který při indikaci ošetření rozhodl ve prospěch CAS. V souboru stentovaných byl častěji přítomen výskyt diabetu a zejména angiografická rizika (tab. 2).
Metodika
Intervence byly bez výjimky provedeny plánovaně jako sekundární prevence ischemického iktu. Akutní výkony a kombinované výkony s paralelní operací koronární nebyly zahrnuty. Otevřené operace byly uskutečněny mikrochirurgickou technikou v regionální anestezii se selektivním použitím shuntu [6]. Nikdy nebyla před operací vysazena antiagregační léčba. Potenciální hrozba ischemie mozku nebo myokardu je větší než rizika vyplývající z vyšší četnosti hematomů v ráně.
Při operaci je standardně užit vertikální kožní řez podél m. sternocleidomastoideus. Po protětí platyzmatu a podvazu v. facialis je proniknuto ke karotické bifurkaci. Zevní krkavice (ACE) probíhá ventrálně a její rozlišení je relativně snadné, protože vydává na krku větve. Dorzomediálně jdoucí vnitřní krkavice (ACI) se větví až intrakraniálně. Sklerotický plát začíná typicky na společné karotidě (ACC) a přechází na vnitřní krkavici do různé vzdálenosti. Vyznačuje se žlutavou barvou cévní stěny a tuhostí při palpaci. Po preparaci karotických tepen je aplikován intravenózně heparin v dávce100 j/kg a v odstupu 3 minut nasazen turniket na ACC a aneuryzmatické svorky na ACE a ACI. V tento okamžik je hodnoceno vědomí a neurologický stav pacienta. Netolerance okluze karotidy je řídká a projeví se obvykle hemiplegií a bezvědomím typicky během několika sekund. V těchto případech je selektivně zaveden intraluminárně shunt. Vlastní dezobliterace a sutura tepny probíhá s použítím mikroskopu. Šetrnou mikrochirurgickou technikou provedená sutura stěny tepny snižuje potřebu užití záplaty. V situaci, kdy je stenóza ACI kombinována s kinkingem (zalomením) cévy, je vhodné užití everzní techniky. ACI je resekována na úrovni bifurkace. Po dezobliteraci a odstřižení nadbytku cévní stěny je tato všita pokračujícím stehem do ústí bifurkace.


Před radiointervenčním výkonem byla 3 dny podávána kombinovaná antiagregační léčba (anopyrin 100 mg a klopidogrel 75 mg). Periprocedurálně byl kontinuálně monitorován neurologický stav, arteriální krevní tlak, tepová frekvence a saturace hemoglobinu kyslíkem. Na počátku zákroku byl podán heparin v dávce 5 000 jednotek intravenózně. Vlastní procedura probíhá standardně. Nejprve je zaveden vodící katétr do distální ACC. Přes stenózu je protaženo filtrační protekční zařízení (Filter Wire, Boston Scientific), které je poté rozvinuto v distální ACI. To brání distální embolizaci uvolněných částí plátu během procedury dilatace a aplikace stentu. V souboru CAS byl protekční systém použit u všech pacientů. Stenóza může být předdilatována balonkem. Následně je zaveden a rozvinut stent (Wallstent, Boston Scientific). Pravidlem je dodilatování stentu balónkem. Po extrakci protekčního zařízení je provedena kontrolní angiografie. Pacient je následně 24 hodin monitorován na JIP a propuštěn obvykle za 48 hodin. V duální antiagregaci je pokračováno 30 dní, anopyrin je poté podáván trvale.

Výsledky
Výskyt komplikací v obou souborech shrnuje tab. 3.

Úmrtí jsme zaznamenali jedno – v CEA skupině. Šlo o 65letého asymptomatického pacienta s bilaterální významnou stenózou ACI. Vlevo bylo zúžení tepny výraznější, vpravo byla však navíc těsná stenóza intrakraniálně v oblasti sifonu. Po jistém váhání stran načasování výkonů byla nejprve operována bez komplikací levá karotida. Pacient byl objednán k výkonu vpravo s odstupem měsíce. Avšak týden před nástupem k druhé operaci došlo k uzávěru pravé (neoperované!) karotidy intrakraniálně, s následným rozvojem maligního infarktu.
Neurologická morbidita byla v obou souborech nízká. Zahrnuty jsou centrální komplikace ischemické i hemoragické s trvalým reziduem. Poranění hlavových nervů se vyskytla pouze v CEA skupině a měla převážně přechodný charakter. Jsou uvedena separátně. V CAS souboru jsme měli závažné komplikace ve dvou případech. U 81leté symptomatické pacientky došlo v odstupu 24 hodin po zavedení stentu k rozvoji ipsilaterálního ischemického iktu, s přetrvávajícím těžkým deficitem. Podkladem iktu byla embolizace do periferie. 61letá pacientka po prodělaném RIND s těsnou stenózou karotidy vlevo absolvovala angioplastiku bez komplikací. 5 hodin po výkonu došlo k náhle vzniklé těžké hemiparéze s afázií. Příčinou byl kapsulární hematom, velmi pravděpodobně na podkladě hyperperfuzního syndromu, vzhledem k těžko korigovatelé pooperační hypertenzi. Ve skupině CEA jsme měli neurologické komplikace 6x. U 65letého pacienta s asymptomatickou levostrannou subtotální okluzí došlo na základě technické operační chyby (vlající reziduální plát v společné karotidě) k trombóze tepny a následné distální embolizaci. Přes urgentní revizi a rekanalizaci rezultoval těžký deficit. U dvou dalších pacientů s těsnými stenózami ACI došlo 2. pooperační den ke vzniku intracerebrálního hematomu v bazálních gangliích ipsilaterálně k operované straně. Výsledkem byl těžký neurologický deficit. 67letý pacient se symptomatologií TIA prodělal peroperačně ischemický emboligenní iktus v povodí operované karotidy, s trvajícím těžkým reziduem. 61letý muž byl indikován k operaci pro crescendo TIA. Po operaci došlo k trombóze tepny a rozvoji deficitu. Následným akutním výkonem byla tepna zprůchodněna a pacient měl mírný neurologický deficit. 60letá pacientka se 70% stenózou pravostranné ACI v kombinaci s kinkingem prodělala peroperačně ischemický emboligenní iktus. Trvá mírné reziduum. Poranění nervů byla přítomna pouze v CEA souboru, celkem 14 pacientů. 6krát šlo o ramus marginalis n. facialis, 6krát o n. laryngeus reccurrens a 2krát o n. hypoglossus. Převážně se poruchy upravily, pouze ve 4 případech (1,0 % CEA) byla paréza trvalá (3krát r. marginalis, 1krát n. hypoglossus). Lokální hematomu jsme zaznamenali v CEA skupině v 23 případech, 2krát byla nutná revize (0,5 %). V CAS skupine jsme lokální hematom zaznamenali ve 4 případech, revize byla provedena 2krát (2,2 %). Pouze v CAS skupině byla pozorována 8krát přechodná zmatenost a agitovanost, která vyžadovala farmakoterapii. Vždy došlo ke kompletní úpravě s negativním nálezem při zobrazovacích vyšetřeních.
Komplikace postihly 2krát pacienty s asymptomatickou stenózou karotidy, což představuje 1,1% výskyt neurologické morbidity/mortality.V 7 zbylých případech šlo o pacienty symptomatické (3,3 % komplikací).
Diskuse
Karotická endarterektomie je prováděna od 50. let 20. století. Profit operace byl přesvědčivě potvrzen prospektivnímí multicentrickými studiemi z přelomu století pro symptomatické karotické stenózy [1,2]. U asymptomatických stenóz nejsou výsledky tak konzistentní a indikace jsou selektivní [3,4]. Podmínkou je dále nízká četnost chirurgických komplikací.
Karotická endarterektomie platí za zlatý standard sekundární prevence ischemického iktu u významných stenóz vnitřní karotidy. Třicet let po CEA provedl Mathias balonkovou angioplastiku karotidy [7]. Myšlenka doplnění plastiky stentem vznikla na základě experimentálních prací Rabkina z počátku 80. let [8]. Ke klinické aplikaci došlo o 10 let později [9,10]. Ve stejné době se uplatnila myšlenka distální protekce během výkonu [9,11]. Tato technická zdokonalení snížila četnost restenózy a distálních periprocedurálních emboligenních příhod. Díky tomu dochází na počátku 21. století k dynamickému nárůstu endovaskulárních intervencí na karotidách. Nicméně studie kalibru NASCET , které by jasně vymezily postavení CAS nejsou dosud uzavřeny.
Obecným problémem akceptování techniky stentingu je rozdílný mechanizmus ošetření cévní stěny. Zatímco při otevřené operaci odstraňujeme vlastní patologii - tedy plát, při endovaskulárním výkonu zůstává plát in situ, byť roztlačen do cévní stěny, která je následně podpořena stentem. I když se protekční zařízení jeví jako velmi efektivní, je četnost „klinicky němých“ distálních embolizací při CAS, prokazatelných transkraniálním dopplerem vyšší než při endarterektomii. Další nevyřešenou otázkou, která s předchozí úzce souvisí, je dlouhodobý efekt stentingu.
První prospektivní multicentrickou studií, porovnávající stenting a endarterektomii karotid (a vertebrálních tepen) byl CAVATAS [12]. Randomizováno bylo 504 symptomatických pacientů z 24 center. Nebyl shledán rozdíl v 30denní neurologické morbiditě a mortalitě mezi oběma technikami. Stenty byly užity v jedné čtvrtině případů, zbytek tvořily prosté angioplastiky. 10 % komplikací (v obou skupinách) však bylo nepřijatelně vysoké číslo ve srovnání karotickými studiemi [1-4]. Restenózy po roce byly relativně častější u angioplastik (14 %) než u operovaných pacientů (4 %). Studie SAPPHIRE [13] z roku 2003 je velmi často citována při argumentaci o srovnatelnosti výsledků obou metod. Studie byla provedena technikou stentu s distální protekcí u 334 asymptomatických i symptomatických pacientů s vysokým rizikem pro CEA ve 29 centrech. Četnost kardiovaskulárních příhod, iktů a úmrtí se v obou skupinách 30 denním itervalu nelišila (4,2 % u CAS a 4,8 % u CEA). Po roce bylo procento komplikací vyšší v CEA skupině (12,2 % vs 20,1 %). Výsledky studie jsou napadány z více důvodů. Za prvé 60 procent pacientů, kteří byli zařazeni do studie, bylo shledáno nezpůsobilými pro endarterektomii z důvodů rizika operace! 20 % zákroků tvořily restenózy ACI. Tito pacienti jsou vhodnější pro stenting z několika důvodů. Jednak otevřená operace restenóz je spojena s vyšší četností lokálních komplikací, zejména poraněním kraniálních nervů. Navíc stenting je u restenózy (často na podkladě intimální hyperplazie) spojen s menším rizikem distální embolizace než u primární stenózy na podkladě komplexního, nestabilního plátu. Poslední výhradou k SAPPHIRE studii je zahrnutí symptomatických a asymptomatických pacientů do jedné skupiny.
Francouzská studie EVA-3S [14] byla prezentována v roce 2006. Randomizováno bylo 527 symptomatických pacientů ve 30 centrech. Studie byla předčasně ukončena pro jednoznačně horší výsledky v CAS skupině. 30denní neurologická morbidita/mortalita byla v karotické skupině 3,9 %, zatímco u stentů 9,6 %. Závěry studie jsou kritizovány pro údajnou relativní nezkušenost intervenčních radiologů ve srovnání s chirurgy. Prakticky ve stejné době byla publikována studie SPACE [15]. Bylo zahrnuto 1 214 symptomatických pacientů z 37 center. 30denní neurologické morbidita/mortalita byla u CAS 6,84 % a u CEA 6,34 %.Výsledky za delší časové období 2 let jsou očekávány. Závěry obou těchto studií zní, že není v současné době oprávnění k širokému užití stentu k léčbě stenóz karotid (s vyjímkou prospektivnich studií). V současné době běží několik dalších studií. Zejména výsledky největší z nich - CREST [16], která byla zahájena v roce 2000 a měla by zahrnovat 2 500 pacientů, jsou očekávány s napětím.
Z doporučených indikačních kritérií vyplývá rozdílné zastoupení restenóz ACI v obou našich souborech. Zatímco v CAS souboru tvoří 12,2 %, v CEA skupině pouze 0,25 %. Vyšší věk pacientů, korelující se zvýšenou četností interních rizik, byl nejčastějším důvodem indikace CAS. Radiační stenózy ACI a anatomické indikace pro CAS nejsou v skupině CEA zastoupeny vůbec. Vícečetné stenózy tepen byly jedním z faktorů, které hrály roli při příklonu k CAS. Kontralaterální okluzi ACI jsme nicméně nepovažovali za absolutní indikaci CAS. V našem souboru otevřených operací z doby před zahájením neuointervencí jsme nezaznamenali vyšší výskyt komplikací.
Na druhou stranu existují situace, které upřednostňují CEA před CAS: nutnost současného výkonu na koronárních tepnách, trombendarterektomie pro akutní okluzi tepny, nutnost resekce ACI při kombinovaném výskytu stenózy + kinkingu a anatomické příčiny (výrazná vinutost ACC nebo ACI, těžká obvodová koncentrická kalcifikace, difuzní sklerotické změny ACC). Mezi stavy, které jsou přímo kontraindikací CAS, patří: nemožnost podávání antiagregačních léků pro alergii nebo netoleranci, nutnost velkého chirurgického zákroku v následných 3 týdnech, trombus ACI a těžká renální insuficience znemožňující podání kontrastní látky [17].
Na nehomogenitě souborů se podílí rozdílné zastoupení rizikových skupin. Podle Sundtova dělení existují 4 rizikové skupiny [18]. I. stupeň charakterizuje pacienty neurologicky stabilní, bez angiografických rizik s významnou stenózou ACI. Perioperační riziko iktu nebo smrti bylo v Sundtově souboru nižší než 1 %. II. stupeň zastupují pacienti neurologicky stabilní s přítomným angiografickým rizikem (kontralaterální okluze karotidy, vysoká bifurkace na úrovni C2, přítomnost trombu, tandemová stenóza sifonu). Riziko příhody bylo 1,8 %. III. stupeň rizika znamená přítomnost interních komorbidit (hypertenze, významné kardiální onemocnění - stav po infarktu myokardu, stav po koronárním bypassu resp. PTCA, nestabilní angina pectoris, závažná arytmie), věk nad 70 let. Riziko komplikací bylo již 4procentní. IV. stupeň charakterizuje neurologická instabilita, nejčastěji crescendo TIA. Zde bylo riziko komplikací téměř 10procentní. V naší sestavě bylo ve skupině CEA následující zastoupení dle Sundtovy stupnice: I - 113 (28,9 %), II - 74 (18,9 %), III - 180 (46 %), IV - 24 (6,2 %). Ve skupině CAS byli 4 pacient v I. stupni (4,4 %), 18 pacientů v II. stupni (20 %) a 68 pacientů v III. stupni (75,6 %). Procentuální shoda II. stupně v obou skupinách je klamná. Pacienti s angiografickými riziky jsou pochopitelně v CAS souboru zastoupeni významně častěji, nicméně vzhledem k věkové struktuře často spadají do III. stupně Sundtovy stupnice. V CAS skupině tedy dominuje III. stupeň, v CEA skupině je naopak přítomen stupeň IV, který je spojen s jednoznačně největším rizikem morbidity/mortality při intervenci. Komplikace ve skupině CEA byly zaznamenány 3krát ve II. stupni, 3krát ve III. stupni a lkrát ve IV. stupni Sundtovy škály. Obě komplikace ve skupině CAS spadaly do III. stupně škály.
Indikace karotického stentingu v naší sestavě byla omezena na restenózy, poiradiační stenózy a závažné přidružené interní choroby. Obtížná chirurgická dostupností byla další indikací CAS [5]. Tyto situace jsou obecně spojeny s vysokým rizikem při otevřených operacích. Lze předpokládat, že při zahrnutí těchto pacientů do CEA skupiny, by se významně zvýšil počet komplikací. Tito, pro CEA rizikoví pacienti, při selekci pro stent prokázali přijatelně nízkou četnost komplikací. Správný výběr pacientů pro jednotlivý typ metody považujeme za klíč k dobrým celkovým výsledkům. Vztah karotického stentingu k endarterektomii proto chápeme nikoliv jako kompetitivní, ale jako komplementární.
MUDr. V. Přibáň
neurochirurgické oddělení, Nemocnice České Budějovice a.s.
B. Němcové 54, 370 87 České Budějovice
E-mail: v.priban@centrum.cz
Přijato k recenzi: 14. 5. 2007
Přijato do tisku: 2. 10. 2007
Sources
1. North American Symptomatic Carotid Endarterectomy Trial Collaborators. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. N Eng J Med 1998; 339 : 1415-1425.
2. European Carotid Surgery Trialists Collaborative Group. European carotid surgery trial: interim results for symptomatic patients with severe (70-99%) or with mild (0-29%) carotid stenosis. Lancet 1991; 337 : 1235-1243.
3. Asymptomatic Carotid Artery Atherosclerosis Study Group. Endarterectomy for Asymptomatic Carotid Artery Stenosis. JAMA 1995; 273 : 1421-1428.
4. MRC Asymptomatic Carotid Surgery Trial (ACST) Collaborative Group. Prevention of disabling and fatal strokes by succesfull carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet 2004; 363 : 915 - 924.
5. AHA/ASA Guidelines. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack. Stroke 2006; 37 : 577-654.
6. Přibáň V, Tesařík R. Karotická mikroendarterektomie ve stáří. Rozhl Chir 2002; 1 : 30-33.
7. Mathias K. Ein neuartiges Kathetersystem zur perkutanen transluminalen Angioplastie von Karotisstenosen. Fortschr Med 1977; 95 : 1007-11.
8. Rabkin I, Germashev VG. Five-year experience with roentgenologically controlled endovascular nitinol prosthesis. Kardiologia 1990; 30 : 11-17 (v ruštině).
9.Théron JG, Payelle GG, Coskun O, Huet HF, Guimaraens L et al. Carotid artery stenosis: treatment with protected balloon angioplasty and stent placement. Radiology 1996; 201 : 627-36.
10 Yadav JS, Roubin GS, Iyer SS, Jains S, Blackwell W, Vitek JJ et al. Application of lessons learned from cardiac interventional techniques to carotid angioplasty. J Am Col Cardiol 1995; 25 : 380.
11. Henry M, Amor M, Henry I, Klonaris C, Chati Z, Masson I et al. Carotid stenting with cerebral protection: first clinical experience using Percu-Surge guard wire system. J Endovasc Surg 1999; 6 : 321-331.
12. CAVATAS investigators. Endovascular versus surgical treatment in patients with carotid stenosis in Carotid and Vertebral Artery Transluminar Angioplasty Study (CAVATAS): a randomised trial. Lancet 2001; 357 : 1729-1737.
13. Yadav JS, Wholey MH, Kuntz RE, Fayad P, Katzen BT, Mishkel GJ et al. Stenting and Angioplasty with Protection in Patients and High Risk for Endarterectomy (SAPPHIRE). N Eng J Med 2004; 351 : 1565-1567.
14 Mas JL, Chatellier G, Beyssen B, Branchereau A, Moulin T, Becquemin JP et al. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med 2006; 355 : 1726-1729.
15. SPACE Collaborative Group. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006; 368 : 1239-1247.
16. Hobson RW. Carotid Revascularization Endarterectomy versus Stent (CREST). Semin Vasc Surg 2000; 13 : 139-143.
17. Vítek JJ, Iyer SS, Roubin GS. Endovaskulární léčba karotických stenóz. In: Krajina A, Peregrin JH. Intervenční radiologie: miniinvazivní terapie. Hradec Králové: Auris; 2005 : 355-371.
18. Sundt TM, Piepgras DG, Ebersold MJ, Marsh WR, Fode NC. Risk factors and operative results. In: Sundt TM (ed). Occlusive cerebrovascular disease. Diagnosis and surgical management. Philadelphia: WB Saunders Company 1987 : 226-231.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2008 Issue 1
Most read in this issue
- Bezpečnosť MRI vyšetrenia u pacientov s kovovými implantátmi a implantovanými prístrojmi
- Difuzní gliomy mozkového kmene u dětí. Noční můra dětského onkologa.
- Myasténia gravis
- Klinické využití protilátek u roztroušené sklerózy



