Význam MR v indikaci systémové trombolýzy – analýza prvních 30 pacientů
The Importance of MRI for the Indication of Systemic Thrombolysis – Analysis of the First 30 Patients
Aim:
Magnetic resonance (MR) makes accurate the diagnosis of acute cerebral infarction as well as the indication of patients for thrombolytic therapy. The research aimed at demonstrating the benefits of applying MR in the indications of intravenous thrombolysis (IVT) using the analysis of our own set of patients examined with standardized MR protocol and treated with IVT. The authors have assessed their own experience with the use of routine MR.
Set and Methods:
A set consists of 30 patients with acute cerebral infarction treated by means of IVT. The initial size of infarct (VDWI-I) was quantified on the diffusion-weighed sequences. A neurological deficit was determined according to NIH Stroke Scale (N IHSS) at admission after 24 and 72 hours, and then on the 7th day after the ictus development. Resulting clinical state 90 days later was evaluated according to modified Rankin´s scale (mRS). The obtained results were compared to the data of large randomized multicentric studies. The mean2 test and Students´s t-test were used for assessing the statistical significance of results.
Results:
The mean VDWI-I was 21.2 ml, and initial NIHSS 12 ± 5 points. The regression of neurological deficit after 24 hours occurred in significantly higher number of patients (90%) if compared with the studies of NINDS (p < 0.0001) and ECASS I (p = 0.004). Excellent 90-days´ clinicalt result (mRS 0 – 1) was present in significantly higher number of patients (60%) if compared with the studies of NINDS (p = 0.0014), ECASS I (p = 0.001) and II (p = 0.023). In these patients the mean VDWI-I was 13.2ml, and the artery occlusion occurred in 17%.
Conclusion:
The use of MR makes accurate the identification of patients who have a greater probability of good clinical outcome after IVT. These are patients with a small, initial extent of infarction without the extracranial cervical artery occlusion.
Key words:
magnetic resonance, diffusion-weighed display, cerebral ischemia, intravenous thrombolysis
Authors:
D. Šaňák 1; A. Bártková 1; D. Horák 2; I. Vlachová 1; J. Bučil 2; R. Herzig 1; S. Buřval 2; B. Křupka 1; P. Hubáček 3; J. Zapletalová 4; M. Král 1; M. Köcher 2; M. Heřman 2; P. Kaňovský 1
Authors‘ workplace:
Iktové centrum, Neurologická klinika LF UP a FN Olomouc
1; Radiologická klinika LF UP a FN Olomouc
2; Oddělení urgentního příjmu, FN Olomouc
3; Ústav lékařské biofyziky, biometrie a statistiky LF UP Olomouc
4
Published in:
Cesk Slov Neurol N 2007; 70/103(2): 143-151
Category:
Original Paper
Overview
Východiska a cíle:
Magnetická rezonance (MR) zpřesňuje diagnostiku akutního mozkového infarktu, a tím i indikaci pacientů k léčbě trombolýzou. Cílem práce bylo prokázat benefit použití MR v indikaci intravenózní trombolýzy (IVT) analýzou vlastního souboru pacientů vyšetřených standardizovaným MR protokolem a léčených IVT. Formou diskuze autoři hodnotí vlastní zkušenosti z rutinního použití MR.
Soubor a metodika:
Soubor tvoří 30 pacientů s akutním mozkovým infarktem léčených IVT. Iniciální velikost infarktu (VDWI-I) byla kvantifikována na difuzí vážených sekvencích. Neurologický deficit byl stanoven dle NIH Stroke Scale (NIHSS) při přijetí, po 24 a 72 hodinách a dále 7. den po vzniku iktu. Výsledný klinický stav po 90 dnech byl hodnocen dle modifikované Rankinovy škály (mRS). Dosažené výsledky byly srovnány s daty velkých randomizovaných multicentrických studií. Ke zhodnocení statistické signifikance výsledků byly použity χ2 test a Studentův t test.
Výsledky:
Průměrný VDWI-I byl 21,2 ml a iniciální NIHSS 12 ± 5 bodů. K regresi neurologického deficitu po 24 hodinách došlo u signifikantně vyššího počtu pacientů (90 %) ve srovnání se studii NINDS (p < 0,0001) a ECASS I (p = 0,004). Výborný 90denní klinický výsledek (mRS 0-1) byl přítomen u signifikantně vyššího počtu pacientů (60 %) oproti studii NINDS (p = 0,0014) , ECASS I (p = 0,001) a II (p = 0,023). Tito pacienti měli průměrný VDWI-I 13,2 ml a 17 % z nich uzávěr tepny.
Závěr:
Použití MR zpřesňuje identifikaci pacientů, kteří mají větší pravděpodobnost dobrého klinického výsledku po IVT. Jsou to pacienti s malým iniciálním objemem infarktu a bez uzávěru magistrátní tepny.
Klíčová slova:
zobrazení magnetickou rezonancí, difuzí vážené zobrazení, ischemie mozku, intravenózní trombolýza
Úvod
Ischemické cévní mozkové příhody (iCMP) představují stále vážný medicínský a socioekonomický problém. Jsou třetí nejčastější příčinou úmrtí a jejich incidence v některých věkových skupinách nadále vzrůstá [1,2]. V současnosti představuje jedinou standardizovanou kauzální terapii akutního mozkového infarktu trombolýza, která je u indikovaných pacientů považována za bezpečnou a efektní léčebnou metodu. Na základě výsledků předchozích randomizovaných studií, které jednoznačně prokázaly snížení mortality a zlepšení kvality života pacientů po iktu [3-8], byla schválena intravenózní trombolýza (IVT) jako standardní metoda léčby akutního mozkového infarktu do 3 hodin od vzniku symptomů nejprve v USA (červen 1996), v říjnu 2000 pak ve členských státech Evropské unie [9] a nakonec také v České republice (duben 2003). Přísná vstupní kritéria však brání širšímu použití této léčby, takže jsou IVT v současné době léčeny přibližně 1-2 % všech pacientů s mozkovým infarktem [10, 11], přičemž některá specializovaná centra ve velkých městských aglomeracích léčí trombolýzou až 8 % pacientů s iCMP [12-14].
Ve většině předchozích studií a zejména v běžné klinické praxi je použita jako základní vyšetření výpočetní tomografie (CT) mozku, která je stále považována za zlatý standard zobrazení mozkové tkáně [15]. Mezi hlavní výhody CT patří bezpečné vyloučení intracerebrálního (ICH) a subarachnoidálního krvácení (SAH) a pak také jeho cena a dostupnost.
V poslední době nabývá v diagnostice akutní fáze mozkové ischemie na významu užití magnetické rezonance (MRI). MRI umožňuje přesnou diagnostiku infarktového ložiska (aktuální velikost, lokalizace), detekci uzávěru či hemodynamicky významné stenózy magistrální mozkové tepny. Umožňuje také posouzení kolaterálního oběhu a zobrazení reverzibilních ischemických změn. MRI tak poskytuje informace zpřesňující výběr těch pacientů, kteří mohou nejvíce profitovat z trombolytické léčby [16-20].
Hlavním cílem práce bylo prokázat význam MR v indikaci IVT posouzením efektivity a bezpečnosti IVT ve vlastním souboru léčených pacientů a srovnáním dosažených výsledků s daty velkých randomizovaných multicentrických studií, ve kterých bylo použito k zobrazení mozku pouze CT – NINDS (The National Institute of Neurological Disorders and rt-PA Stroke Study Group) [3], ECASS I, a II (European Cooperative Acute Stroke Study) [21,22] , studie ATLANTIS (Alteplase Thrombolysis for Acute Noninterventional Therapy in Ischemic Stroke,) [23] včetně podskupiny pacientů léčených systémovou trombolýzou do 3 hodin od vzniku iktu [24].
MR protokol jsme modifikovali na základě aktuálních literárních údajů a výsledků některých předchozích studií [18, 25-31].
Soubora metodika
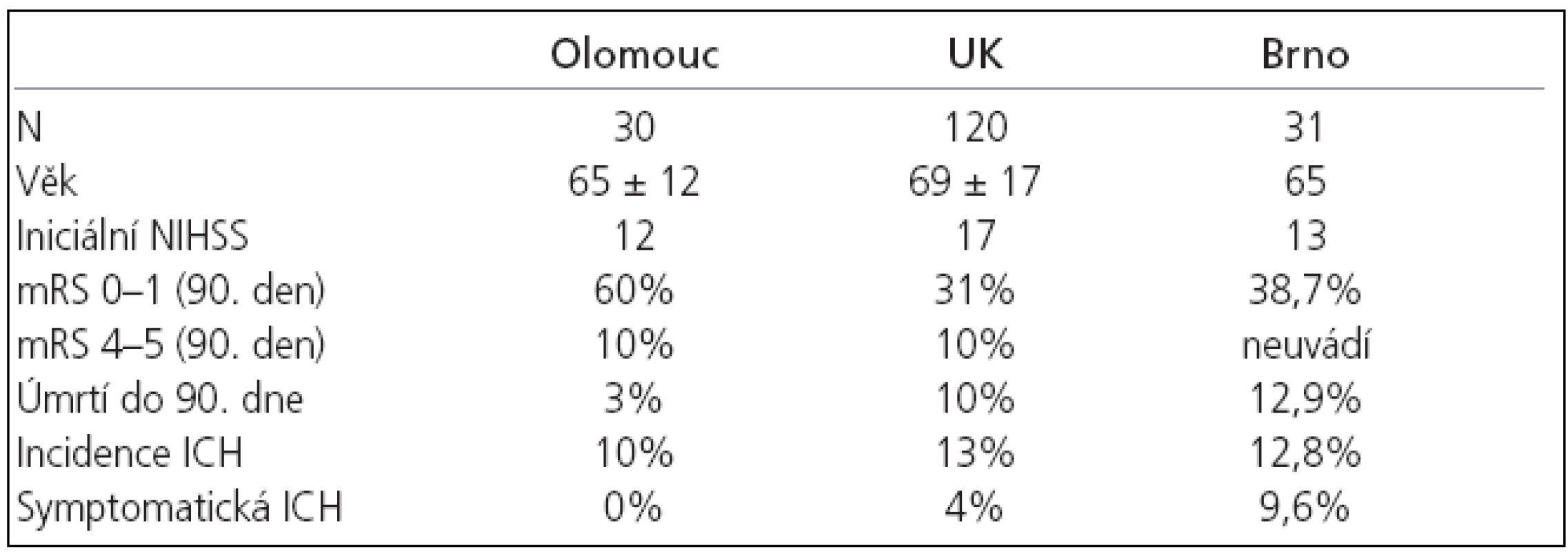
Soubor tvoří celkem 30 pacientů s akutní neurologickou symptomatikou, kteří byli na našem pracovišti od října 2004 do prosince 2005 vyšetřeni MRI a na základě nálezu pak léčeni IVT dle platných doporučení a standardů [32] . Základní charakteristiky souboru léčených pacientů jsou uvedeny v tab. 1.

U všech pacientů bylo provedeno vstupní klinické vyšetření se stanovením iniciálního stupně neurologického deficitu pomocí škály National Institute of Health Stroke Scale (NIHSS) atestovaným neurologem, změřen krevní tlak, natočen elektrokardiogram a odebrány krevní vzorky k laboratornímu vyšetření. Poté následovalo vyšetření standardním MR iktovým protokolem.
MR vyšetření byla provedena přístrojem Magnetom Symphony 1,5 T Maestro Class s gradienty Quantum (Siemens, Erlangen, Německo), vybaveným verzí softwaru VA21B a syngo2002B. Pro vyšetření mozku byla použita standardní hlavová cívka (CP Head Array Coil).
MRI iktový protokol obsahoval 5 sekvencí: 1. lokalizér (0:09 min); 2. T2TSE (Turbo Spin Echo) (1:34 min.); 3. FLAIR (Fluid-Attenuated Inversion Recovery) (2:26 min.); 4. DWI (Diffusion-weighted Imaging) (1:20 min.); 5. 3D TOF MRA (Time of Flight Magnetic Resonance Angiography) (5:59 min.). Celkový akviziční čas byl 11:28 min.
Sekvence 2-4 byly aplikovány ve stejné rovině, měly stejnou tloušťku řezu a totožný počet řezů. Tloušťkou řezu se rozumí vlastní tloušťka řezu (5 mm) + distanční faktor (30%). Standardní počet řezů byl 19. Standardní rovinou řezu byla modifikovaná rovina lební báze z důvodu minimalizace distorčních artefaktů echoplanární (Echo Planar Imaging - EPI) sekvence.
T2TSE: TR = 4000/TE = 99/ETL=9, FOV 230, FOV ph. 75 %, matrix 256x256, TA 1:34 min. (Důvodem aplikace této sekvence je posouzení krvácení a ložiskových demyelinizačních změn včetně ložisek ischemické demyelinizace).
FLAIR: 8050/112/ETL = 21/2 conc., FOV 230, FOV ph. 76,6 %, matrix 256x151, TA 2:26 min. (Důvodem aplikace této sekvence je posouzení krvácení a ložiskových demyelinizačních změn vč. ložisek ischemické demyelinizace).
EPI-DWI: 4200/139/EPI f.=96/6 av., FOV 230, FOV ph. 100 %, phase enc. direction A-P, matrix 128x96 s interpolací, phase partial Fourier 6/8, Bw = 1346 Hz/Px, echo spacing 0,83 ms, TA 1:20 min. DWI sekvence produkuje tři sady MR obrazů: a) T2*EPI b = 0, b) DWI b = 500, c) DWI b = 1000. Čtvrtým typem obrazu je automaticky vyhotovená ADC (Apparent Diffusion Coefficient) mapa (in-line postprocesing). Difuzně vážené obrazy typu „trace“ znázorňují střední (průměrnou) difuzivitu každého bodu vyšetřované mozkové tkáně při b value 500 a 1000. (Důvodem aplikace této sekvence je posouzení krvácení (T2*EPI, susceptibilitní sekvence) a ložisek snížené difuze (DWI, b = 500 a 1000)
3D-TOF MRA: 43/7,15/1 av., 3 slabs, 32 partitions/slab, šířka řezu 1mm, dist. f. –37,5 %, FOV 200, FOV ph. 75 %, matrix 512x192, slice res. 69 %, phase a slice partial Fourier 6/8, 3D eliptical scaning, MTC, TA 5:59 min. Nativní angiografická sekvence typu Time-Of-Flight v provedení 3D MOTSA (Multiple Overlapping Thin Slab Acquisition) s MTC (Magnetisation Transfer Contrast). Získané obrazy a jejich MIP (MIP – Maximum Intensity Projection) rekonstrukce prokáží uzávěr hlavních kmenů tepen Willisova okruhu nebo jejich větví.
Kvantifikace velikosti iniciálního infarktového ložiska byla provedena na DWI (sekvence b = 1000) a počítána jako celková plocha hypersignálního ložiska (součet měření v jednotlivých řezech) násobená tloušťkou řezu (vlastní vrstva + distanční faktor: 5+1,5 = 6,5 mm).
Po provedení MR vyšetření byla podána IVT u indikovaných pacientů s prokázaným akutním infarktem. Kontrolní MR byla provedena následující den u všech pacientů.
Klinický stav byl zhodnocen 24, 72 hodin a 7 dní po vzniku iktu pomocí NIHSS škály. Výsledný klinický stav všech pacientů byl zhodnocen 90. den pomocí modifikované Rankinovy škály (mRS) [33]. Za výborný klinický stav bylo považováno skóre mRS 0-1, tak jako ve studii NINDS, ECASS a ATLANTIS [3,21,23].
Dosažené výsledky byly následně srovnány s daty studií NINDS, ECASS I, II a ATLANTIS. Ke zhodnocení statistické signifikance výsledků byly použity χ2 test a Studentův t test.
Výsledky
Iniciální objem infarktu (VDWI-I) se pohyboval v intervalu od 1,7 ml do 98 ml, průměrný VDWI-I byl 21,2 ml (tab 1). U 10 (30 %) pacientů byl prokázán uzávěr arteria cerebri media (ACM) v úseku M1-2 a u 2 (6 %) uzávěr arteria cerebri posterior (ACP) v úseku P1. V 64 % případech se jednalo o uzávěry tepen malého kalibru (ACMM3-4, perforátory atd.), zejména v oblasti bazálních ganglií, capsula interna a v mozkovém kmeni, které již nejsou spolehlivě zobrazitelné metodou nativní 3D-TOF MRA.
K regresi neurologického deficitu po 24 hodinách došlo celkem u 27 (90 %) pacientů, a to v průměru o 6,5 bodů ve škále NIHSS (p < 0,0001), což je signifikantně více ve srovnání se studií NINDS (p < 0,0001) a ECASS I (p = 0,004). K progresi neurologického deficitu po 24 hodinách od vzniku iktu došlo v našem souboru pouze u 5,7 % pacientů, což je signifikantně méně než ve studii ECASS I 37,5 % pacientů [34] (p = 0,005). Rozdíl oproti studii NINDS (14 %) [5] není statisticky signifikantní (p = 0,389). U 3 (10 %) pacientů došlo naopak k progresi neurologického deficitu (v průměru o 3 body). Průměrné NIHSS skóre po 24 hodinách bylo 5,5 a 7. den 3,2 bodů (tab. 2).
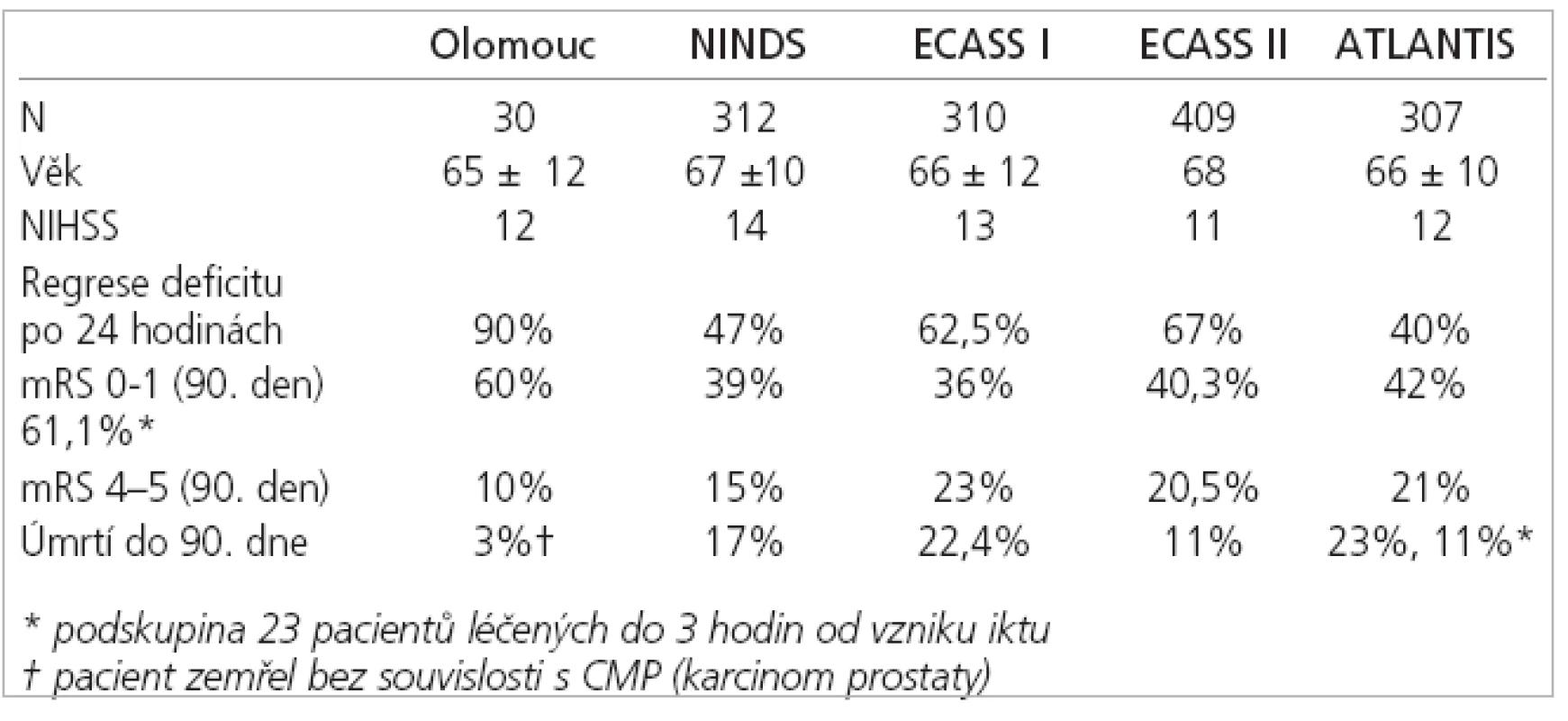
Průměrné mRS skóre po 90 dnech od vzniku iktu bylo 1,4 bodů. 13 (43 %) pacientů nemělo 90. den žádné symptomy a 5 (17 %) pacientů mělo jen minimální deficit (mRS 1) (tab. 3). Výborný klinický výsledek (mRS 0-1) byl při srovnání přítomen v signifikantně vyšším počtu v našem souboru oproti studii NINDS (p = 0,0014) , ECASS I (p = 0,001) a II (p = 0,023) a byl srovnatelný s výsledkem v podskupině pacientů trombolyzovaných do 3 hodin ve studii ATLANTIS (61,1%) [24].
2 (6 %) pacienti byli po 90 dnech závislí (mRS 5).
90 denní mortalita byla v našem souboru (3 %) signifikantně nižší ve srovnání se studií ECASS II (p = 0,025) [21] a se studií ATLANTIS [35] (p = 0,001). Ve srovnání se studií NINDS [3] nebyl rozdíl statisticky signifikantní (p = 0,098). Výše uvedenou 3% mortalitu představuje pouze jeden pacient, který navíc zemřel bez souvislosti s trombolýzou (karcinom prostaty).
Při kontrolním MR vyšetření byly zaznamenány celkem 3 hemoragické transformace infarktového ložiska (10 %). Žádné krvácení ale nebylo symptomatické. U žádného pacienta nedošlo k rozvoji maligního edému mozkové hemisféry a nebyla provedena žádná dekompresní kraniektomie.
K rekanalizaci uzávěru ACM došlo pouze u 3 (30 %) pacientů, přičemž jejich průměrné mRS 90. den po vzniku iktu bylo 0,3 bodu.
Průměrný (VDWI-I) u pacientů s výborným 90denním klinickým výsledkem (mRS 0-1) byla 13,2 ml (1,7; 29 ml); 3 (17 %) z těchto pacientů měli okluzi ACM (M1-2), která byla IVT úspěšně rekanalizována.
Diskuse
Zobrazovací možnosti magnetické rezonance
Za klíčové MR sekvence pro zobrazení akutní mozkové ischemie jsou považovány DWI sekvence. Při ischemickém poškození nervových buněk dochází k okamžitému selhání vysokoenergetického metabolizmu buněčné membrány a zániku membránové pumpy. To vede k poklesu difuze molekul vody v souvislosti se snížením permeability membrány anebo vazbou vody do buňky v rámci počínajícího cytotoxického edému.
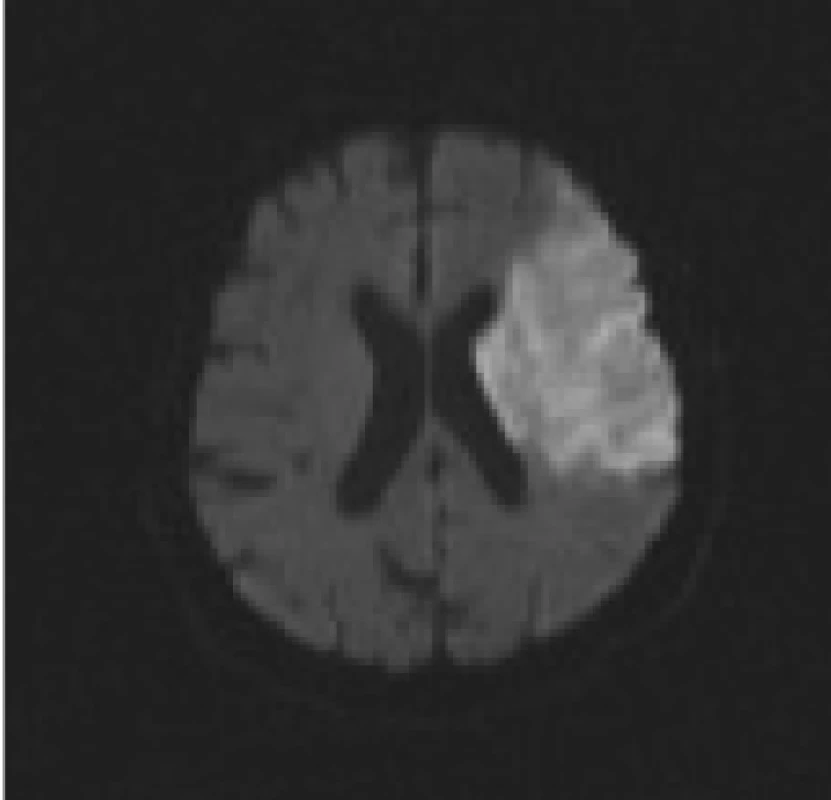
DWI sekvence jsou vysoce citlivé právě k zobrazení změn difuze molekul vody ve tkáni. (Pozn: Difuze je fyzikální jev charakterizovaný termickým pohybem molekul - tzv. Brownův volný pohyb molekul [36]). Pokles difuze molekul vody je kvantitativně vyjádřen změnou tzv. ADC - zjevného difuzního koeficientu, což se projeví v DWI obrazech zónou vysokého signálu. Tyto ložiskové hypersignální změny podle současných představ zachycují okamžitý rozsah ireverzibilního poškození mozkové tkáně [28,37-46] (obr. 1). V některých případech, pokud je velmi rychle restaurován mozkový krevní průtok, mohou být tyto změny potenciálně reverzibilní, např. u pacientů léčených trombolýzou [16,47-49]. Parametr b-value determinuje míru senzitivity při měření difuze, resp. míru difuzního vážení. Je počítán ze síly a trvání difuzních gradientů a z časového intervalu mezi jednotlivými gradientními pulzy.
Nejvýhodnější sekvencí pro zobrazení změn difuze v mozkové tkáni je ultrarychlá tzv. echo-planární sekvence (Echo Planar Imaging - EPI), která umožňuje provádět nejrychlejší změny (oscilaci) difuzních gradientů [50].
Sekvence FLAIR používá jako první tzv. preparační, inverzní 180° radiofrekvenční pulz a dlouhý inverzní čas, jehož smyslem je potlačení signálu mozkomíšního moku. Výsledkem jsou T2 vážené obrazy s hyposignálním likvorem, což usnadňuje detekci hypersignálních patologických ložisek, která jsou lokalizována periferně v blízkosti zevních likvorových prostor nebo v blízkosti komorového systému.
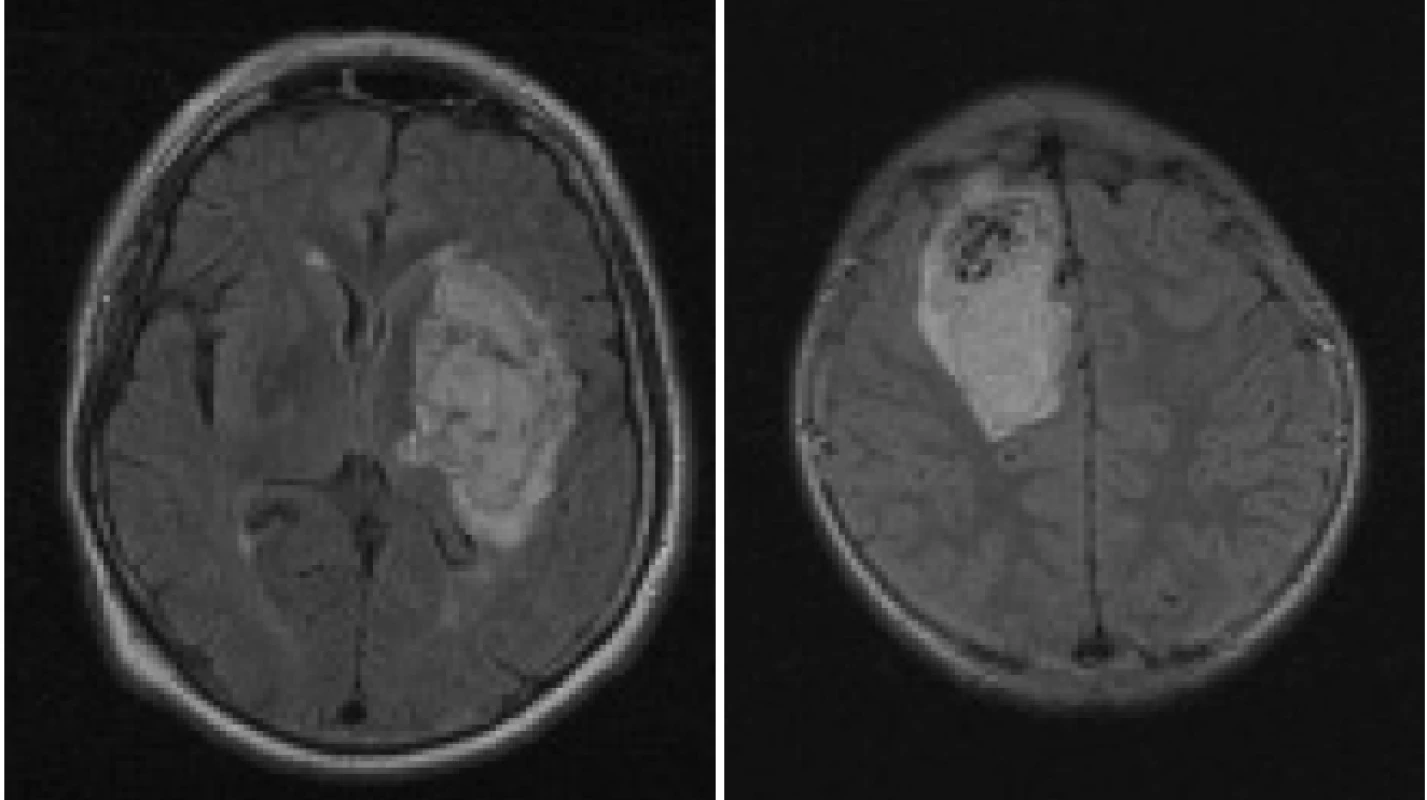
V těchto sekvencích se infarktové ložisko zobrazí jako hypersignální, a to nejdříve po 5-6 hodinách po začátku infarktu. Tento jev souvisí s rozvojem vazogenního edému, kdy se již významně zvětšuje obsah vody v postižené mozkové tkáni. Význam FLAIR sekvence při diagnostice akutní fáze mozkového infarktu tedy spočívá především ve schopnosti rozlišit subakutní a chronické ischemické změny a neischemickou etiologii patologického procesu (tumor, krvácení) (obr 2) [51-54]. Tedy pouze pacienti, u kterých je zobrazeno akutní ischemické ložisko na DWI sekvencích a zároveň nejsou tyto ložiskové změny přítomny na FLAIR sekvenci, mohou být trombolyzováni.
Důležitou sekvencí vyšetřovacího protokolu jsou T2* vážené obrazy. T2* (star) nebo-li. tzv. susceptibilní (přecitlivělostní) sekvenci používáme k zobrazení hemoragie. Degradační produkty hemoglobinu (deoxyhemoglobin a zejména hemosiderin) působí díky svým paramagnetickým vlastnostem lokální nehomogenitu magnetického pole, kterou zaznamenáme jako výpadek signálu (hyposignál) [55]. Výhodou této sekvence je rovněž možnost zobrazení tzv. mikrokrvácení (microbleeds) a časné hemoragické transformace infarktového ložiska [56,57]. Tyto nálezy samozřejmě vylučují pacienty z případné trombolytické léčby. Z praktických důvodů (zkrácení vyšetřovacího protokolu zhruba o 3-4 minuty) nepoužíváme klasickou T2* váženou sekvenci gradientního echa (GRE), neboť součástí naší EPI-DWI trace sekvence je sada T2* obrazů s b = 0, které sice mají nižší rozlišení, ale zato jsou vysoce citlivé k detekci akutního krvácení, resp. deoxyhemoglobinu (obr. 3).
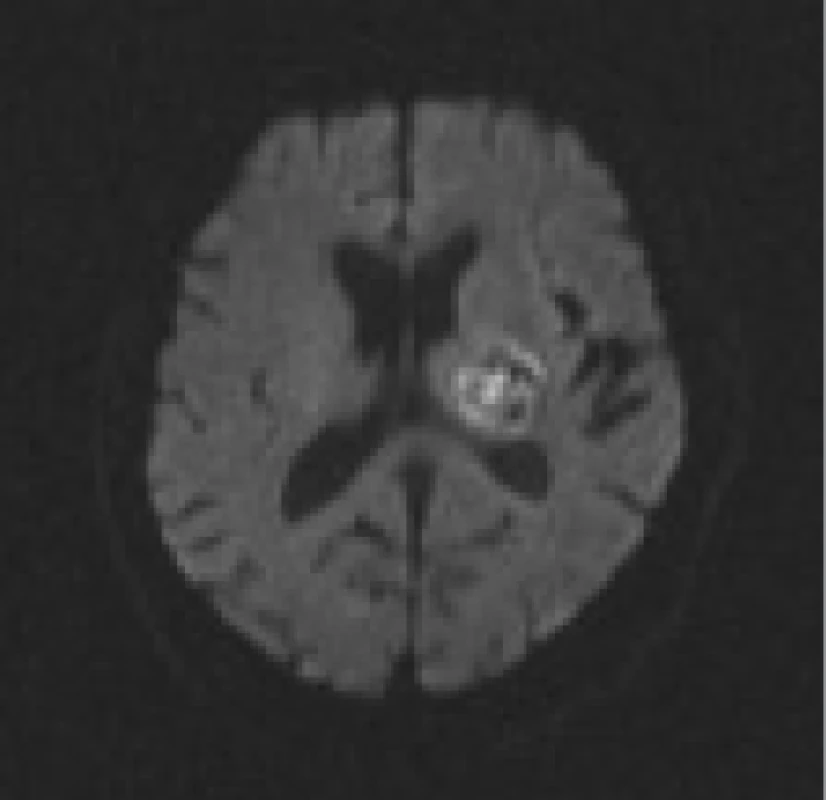
V řadě předchozích MR studií a na mnoha zahraničních pracovištích je součástí vyšetřovacího protokolu také perfuzí vážené zobrazení (perfusion-weighted imaging), a to především pro snahu zachytit tzv. ischemickou penumbru, která je definována jako dočasně reverzibilně funkčně porušená oblast kolem již nevratně poškozeného infarktového jádra. Penumbra se v čase mění individuálně pacient od pacienta, proto je při rozhodování o trombolytické léčbě výhodná její rychlá a přesná identifikace [58,59].
Při MR vyšetření jsme záměrně nepoužili k její identifikaci PWI s interpretací v tzv. PWI/DWI „mismatch“ (rozdíl mezi objemem poruchy perfuze na PWI skenech a hyperintenzním ložiskem na DWI sekvencích), byť je dosud nejčastěji užívaným indexem. Vedlo nás k tomu několik skutečností: 1) PWI/DWI mismatch je totiž nedokonalou aproximací skutečné ischemické penumbry [60-62]; 2) k určení velikosti PWI abnormalit jsou užívány kvalitativní indexy, protože kvantitativní kalkulace jsou časově náročné a používají diskutabilní matematické modely [63]; 3) konečná velikost infarktu je obvykle daleko menší než iniciální PWI/DWI mistmatch area [60-62]. Hesse et al provedli studii, ve které srovnali velikost penumbry zobrazené pomocí PWI/DWI mismatch s velikostí oblasti sníženého mozkového průtoku a zvýšené extrakce O2 (nad 150 %) pomocí pozitronové emisní tomografie (PET) u pacientů s akutním mozkovým infarktem. I přes dobrou korelaci perfuzního deficitu zobrazeného na PWI a PET ale objem mismatche nekorespondoval s velikostí oblasti zvýšené extrakce O2 v PET sekvencích a nezdá se být tedy spolehlivým korelátem penumbry [64]. Někteří autoři sledovali také změny hodnot ADC koeficientu a zjistili, že v oblasti oligemie (oblast porušené mozkové perfuze, ze které se nestává infarkt) jsou hodnoty koeficientu bez změn, ale v potenciální infarktové zóně (infarct growth region – IGR) mírně, ale signifikantně nižší, a to 6 %; resp. 9 % [65,66]. Tyto jemné změny ADC koeficientu při okraji viditelné DWI léze mohou trvat déle než klasické 3-6hodinové terapeutické okno. Distribuce ADC hodnot také silně koreluje s tíží deficitu perfuze [67]. Experimentální data podporují myšlenku, že mírné změny ADC by mohly odpovídat těžké tkáňové acidóze a kortikálně se šířící depresi v ischemické penumbře [67]. Deplece adenosintrifosfátu (ATP) s následující neuronální smrtí se objevuje pouze ve spojení s významnějším poklesem ADC (o více než 10 %) [68].
Srovnání dosažených výsledků se jinými studiemi
I přes nepoměr ve velikosti našeho souboru a výše uvedených velkých randomizovaných klinických studií se statisticky významně nelišil jak věk, tak tíže neurologického deficitu před trombolýzou (tab. 2, 4).
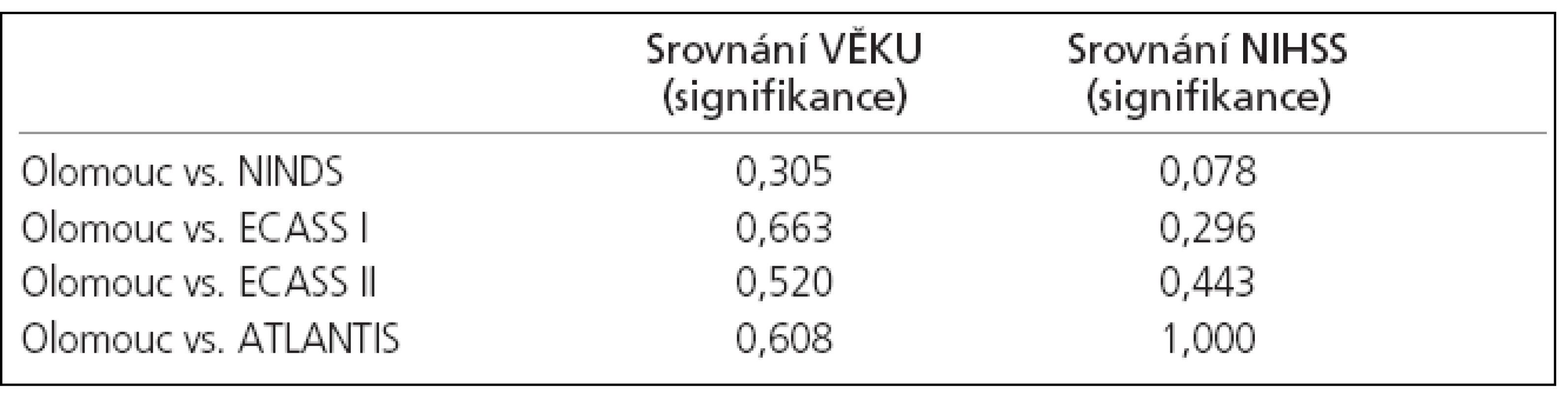
Signifikantně lepších výsledků ve srovnání s výše uvedenými studiemi bylo dosaženo v parametru klinického zlepšení (NIHSS) po 24 hodinách od podání IVT, a pak především při hodnocení výsledného klinického stavu 90. den, kdy byl přítomen výborný výsledek (mRS 0-1) u 60 % našich léčených pacientů. Rovněž 90denní mortalita byla signifikantně nižší (3 %), přičemž se jednalo o pacienta, který zemřel bez souvislosti s trombolýzou (karcinom prostaty).
Incidence intrakraniální hemoragie po trombolýze v našem souboru dosáhla 10 %, přičemž žádné krvácení nebylo symptomatické.Ve studii NINDS bylo symptomatických krvácení zaznamenáno celkem 6,4 % [5], ve studii ECASS II došlo k rozvoji intrakraniální hemoragie po trombolýze celkem u 48,4 % pacientů, přičemž u 8,8 % pacientů bylo krvácení symptomatické [22]. Ve studii ATLANTIS pak došlo k rozvoji symptomatického intrakraniálního krvácení v 11 % případů [23].
Walters et al referovali [11] v souboru 120 pacientů léčených IVT ve Velké Británii obdobnou incidenci ICH, úmrtí a špatného klinického výsledku po 3 měsících. Výborný klinický stav (mRS 0-1) byl naopak přítomen pouze u 1/3 pacientů oproti našim výsledkům. (tab. 3) Mikulík et al referovali v souboru 31 pacientů léčených IVT výborný klinický stav 90. den u 38,7% pacientů [70] (tab. 3). V četnosti ICH a 90denní mortality nebyl ve srovnání s naším souborem statisticky signifikantní rozdíl (p = 0,371, p = 0,248).
Lepší výsledky oproti srovnávaným studiím přikládáme několika skutečnostem:
- V prezentovaném souboru nebyl léčen žádný pacient s akutním uzávěrem ACI. Při použití IVT totiž dochází k rekanalizaci ACI jen asi u 1/3 pacientů [71] (8-10 % kompletní rekanalizace; 16 % parciální) [72-74]. Lepších výsledků lze dosáhnout při použití intra-arteriální trombolýzy [75] nebo perkutánní transluminální angioplastiky [76,77]. Nejvyššího počtu technicky úspěšné rekanalizace extrakraniální části ACI dosahuje chirugická karotická dezobliterace [78], kterou v těchto případech dosud preferujeme.
- V našem souboru bylo pouze 30 % pacientů s uzávěrem ACM (M1-2). K rekanalizaci uzávěru ACM (M1-2) dochází při použití IVT jen v cca 30-35 % případů [79] (v našem souboru 30 %) a při současném těžším neurologickém deficitu (NIHSS > 10) je pak IVT sdružena se špatným klinickým výsledkem a vyšší mortalitou [80].
V našich podmínkách preferujeme u pacientů s akutním uzávěrem ACM (M1, 2) intra-arteriální trombolýzu, přičemž vycházíme z výsledků multicentrických randomizovaných studií PROACT I, II [8] a z výsledků předchozích publikovaných souborů takto léčených pacientů [81-83], ve kterých se pohyboval počet kompletních a parciálních rekanalizací okludované tepny okolo 70%. Při IAT je možno navíc zhodnotit okamžitý stav tepenného řečiště, zejména mozkový kolaterální oběh, jehož přítomnost významně zvyšuje pravděpodobnost úspěšnosti trombolýzy [84] a současně posoudit i efekt vlastní lýzy trombu, což při standardní léčbě IVT možné není. - Průměrný iniciální objem infarktového ložiska trombolyzovaných pacientů dosáhl jen 21,5 ml (méně než 1/3 povodí ACM), přičemž ve skupině pacientů s mRS 0-1 90. den pouze 13,2 ml. Iniciální velikost infarktu (VDWI-I) považujeme za důležitý faktor pro indikaci trombolýzy, neboť je obecně považována za nezávislý prediktor pro rozvoj následné hemoragické transformace infarktu a také pro rozvoj ICH po trombolytické terapii [85], což dokládá počet ICH v našem souboru (10 %). 2 pacienti se stejnou tíží neurologického deficitu při přijetí a se stejným typem arteriální okluze (ACM, M1-2) mohou mít objem infarktu lišící se i několika desítkami ml. Tento rozdíl, způsobený především individuálním stavem mozkového kolaterálního oběhu, může mít pak významný vliv na výsledný klinický stav i přes úspěšnou rekanalizaci tepny [86].
Derex et al považují VDWI-I a rekanalizaci za nezávislý prediktor definitivní velikosti infarktu. V souboru 49 pacientů léčených IVT byl přítomen signifikantně horší klinický výsledek u pacientů s větším iniciálním objemem infarktu [87].
Kvantifikace VDWI-I může být považována také za přesnou metodu k určení rizika rozvoje maligní progrese infarktu u pacientů s uzávěrem ACM. Oppenheim et al ve svém souboru 28 pacientů identifikovali jako hranici objem 145 ml. U žádného pacienta s VDWI-I pod tuto mez nedošlo k rozvoji maligního infarktu postižené hemisféry i přes vysoké NIHSS skóre při přijetí (16.5 ± 4) [43].
Technické a materiální nároky MR vyšetření
K provedení DWI sekvencí v optimální kvalitě je nezbytné softwarové vybavení MRI přístroje EPI sekvencí. I když jsou tyto sekvence dnes k dispozici již u 1 Teslových (T) přístrojů, výhodnější je použití přístroje o síle magnetického pole minimálně 1,5 T. Moderní přístroje umožňují navíc různá nastavení parametrů vlastní DWI sekvence – např. hodnoty b-value, typy produkovaných obrazů (funkce trace) a automatický postprocessingový výpočet ADC map.
Během vyšetření jsou kladeny vyšší nároky na stabilizaci a spolupráci pacienta oproti klasickému nativnímu CT. Často se nevyhneme sedaci neklidných pacientů. Efektní je použití krátkodobě působícího midazolamu (Dormicum®, Roche, Fontenay-sous-Bois, Francie) anebo propofolu (Diprivan®, AstraZeneca UK Ltd., Macclesfield, Cheshire, Velká Británie) podaných intravenózně za monitorace vitálních funkcí (pulzní oxymetr, 1-nebo 4kanálové EKG, tonometr). Tyto léky však mohou i přes krátký poločas eliminace modifikovat neurologický nález, a proto je třeba pacienta pečlivě vyšetřit ještě před vlastní MRI.
Závěr
Použití MR zpřesňuje identifikaci pacientů, kteří mají větší pravděpodobnost dobrého klinického výsledku po IVT. Jsou to pacienti s malým iniciálním objemem infarktu a bez uzávěru magistrátní tepny.
Tato studie byla podpořena granty GAČR 309/05/0693 a IGA, NR8114.
Poděkování
Tato práce byla podpořena grantem IGA MZ České republiky NR/8579-3/2005. Autoři děkují všem zaměstnancům pracoviště magnetické rezonance Radiologické kliniky FN Olomouc za vstřícnost při realizaci MR vyšetření a Oddělení urgentního příjmu FN Olomouc za pomoc při péči o pacienty před a během trombolytické terapie.
MUDr. Daniel Šaňák
Iktové centrum, Neurologická klinika
Fakultní nemocnice, I.P.Pavlova 6,
775 20 Olomouc
e-mail: daniel.sanak@centrum.cz
Přijato k recenzi: 31. 3. 2006
Přijato do tisku: 1. 9. 2006
Sources
1. Tegos TJ, Kalodiki E, Daskalopoulou SS, Nicolaides AN. Stroke: epidemiology, clinical picture, and risk factors. Part I of III. Angiology 2000; 51: 793-808.
2. ÚZIS ČR. Hospitalizovaní a zemřelí na cévní nemoci mozku v ČR v letech 2001 – 2002. Praha: ÚZIS ČR 2004.
3. The National Institute of Neurological Disorders and stroke rt-PA stroke study group. Tissue plasminogen activator for acute ischemic stroke. New Eng J Med 1995; 333: 1581-87.
4. Hacke W, Kaste M, Fieschi C, von Kummer R, Davalos A, Meier D et al. Randomized double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischemic stroke (ECASS II). Lancet 1998; 352: 1245-51.
5. Grotta JC, Welch KMA, Fagan SC, Lu M, Frankel M, Brott T and NINDS rt-PA Stroke Study Group. Clinical deterioration following improvement in the NINIDS rt-PA stroke trial. Stroke 2001; 32: 661-8.
6. Schellinger PD, Fiebach JB, Mohr A, Ringleb PA, Jansen O, Hacke W. Thrombolytic therapy for ischemic stroke a review, part I: Intravenous thrombolysis. Crit Care Med 2001; 29: 1812-8.
7. Parson MW, Barber PA, Chalk J, Darby DG, Rose S, Desmond PM et al. Diffusion and perfusion-weighted MRI response to thrombolysis in stroke. Ann Neurol 2002; 51: 28-37.
8. Furlan A, Higashida R, Wechsler L, Gent M, Rowlery H, Kase C et al (for the PROACT investigators). Intra-arterial prourokinase for acute ischemic stroke: the PROACT II study: a randomized controlled trial: Prolyse in acute cerebral thromboembolism. JAMA 1999; 282: 2003-11.
9. Wahlgren NG (Ed). Consensus Statement on Thrombolysis, Karolinska Stroke Update 2000; 28-30.
10. Bateman BT, Schumacher HC, Boden-Albala B, Berman MF, Mohr JP, Sacco RL et al. Factors associated with in-hospital mortality after administration of thrombolysis in acute ischemic stroke patients: an analysis of the nationwide inpatient sample 1999 to 2002. Stroke 2006; 37: 440-6.
11. Walters MR, Muir KW, Harbison J, Lees KR, Ford GA. Intravenous thrombolysis for acute ischaemic stroke: preliminary experience with recombinant tissue plasminogen activator in the UK. Cerebrovasc Dis 2005; 20: 438-42.
12. Qureshi AI, Kirmani JF, Sayed MA, Safdar A, Ahmed S, Ferguson R et al. Buffalo Metropolitan Area and Erie County Stroke Study Group. Time to hospital arrival, use of thrombolytics, and in-hospital outcomes in ischemic stroke. Neurology 2005; 64: 2115-20.
13. Bravata DM. Intravenous thrombolysis in acute ischaemic stroke: optimising its use in routine clinical practice. CNS Drugs 2005; 19: 295-302.
14. Wojner AW, Morgenstern L, Alexandrov AV, Rodriguez D, Persse D, Grotta JC. Paramedic and emergency department care of stroke: baseline data from a citywide performance improvement study. Am J Crit Care 2003; 12: 411-7.
15. Jansen O, Knauth M, Sartor K. Advances in clinical neuroradiology. Akta Neurologie 1999; 26: 1-7.
16. Schellinger PD, Jansen O, Fiebach JB, Heiland S, Steiner T, Schwab S et al. Monitoring intravenous recombinant tissue plasminogen activator thrombolysis for acute ischemic stroke with diffusion and perfusion MRI stroke. Stroke 2000; 31: 1318-28.
17. Fiebach JB, Jansen O, Schellinger PD, Knauth M, Hartmann M, Heiland S et al. Comparison of CT with diffusion-weighted MRI in patients with hyperacute Stroke. Neuroradiology 2001; 43: 628-32.
18. Schellinger PD, Fiebach JB, Jansen O, Ringleb PA, Mohr A, Steiner T et al. Stroke magnetic resonance imaging within 6 hours after onset of hyperacute cerebral ischemia. Ann Neurol 2001; 49: 460-9.
19. Röther J, Schellinger PD, Gass A, Sieber M, Villringer A, Fiebach JB et al. Effect of intravenous thrombolysis on MRI parameters and functional outcome in acute stroke < 6 h. Stroke 2002; 33: 2438-45.
20. Dávalos A, Blanco M, Pedraza S, Leira B, Castellanos M, Pumar JM et al. The Clinical-DWI mismatch: A new diagnostic approach to the brain tissue risk of infarction. Neurology 2004; 62: 2187-92.
21. Hacke W, Kaste M, Fieschi C, Toni D, Lesaffre E, von Kummer R et al. Intravenous thrombolysis with recombinant tissue plasminogen activator for acute hemispheric stroke. The European Cooperative Acute Stroke Study (ECASS). JAMA 1995; 274: 1017-25.
22. Hacke W, Kaste M, Fieschi C, von Kummer R, Davalos A, Meier D et al. Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS II). Second European-Australasian Acute Stroke Study Investigators. Lancet 1998; 352: 1245-51.
23. Clark WM, Wissman S, Albers GW, Jhamandas JH, Madden KP, Hamilton S et al. Recombinant tissue-type plasminogen activator (Alteplase) for ischemic stroke 3 to 5 hours after symptom onset. The ATLANTIS Study: a randomized controlled trial. Alteplase Thrombolysis for Acute Noninterventional Therapy in Ischemic Stroke.
JAMA 1999; 21: 2019-26.
24. Albers GW, Clark WM, Madden KP, Hamilton SA. ATLANTIS trial: results for patients treated within 3 hours of stroke onset. Alteplase Thrombolysis for Acute Noninterventional Therapy in Ischemic Stroke. Stroke 2002; 33: 493-5.
25. Albers GW. Expanding the window for thrombolytic therapy in acute stroke – the potential role of acute MRI for patient selection. Stroke 1999; 30: 2230-1137.
26. Barber PA, Davis SM, Darby DG, Desmond PM, Gerraty RP, Yang Q et al. Absent middle cerebral artery flow predict the presence and evolution of the ischemic penumbra. Neurology 1999; 52: 1125-32.
27. Schellinger PD, Jansen O, Fiebach JB, Pohlers O, Ryssel H, Heiland S et al. Feasibility and practicality of MR Imaging of stroke in the management of hyperacute cerebral ischemia. AJNR Am J Neuroradiol 2000; 21: 1184-9.
28. Oppenheim C, Logak M, Dormont D, Lehericy S, Manai R, Samson Y et al. Diagnosis of acute ischemic stroke with Fluid Attenuated Inversion Recovery and diffusion-weighted MR sequences. Neuroradiology 2000; 42: 602-7.
29. Samson Y, Crozier S, Deltour S, Obadia M, Manai R, Oppenheim C et al. L´IRM en urgence avant la thrombolyse [abstract]. Revue Neurologique Paris 2002; 158: 1S20.
30. Röther J, Schellinger PD, Gass A, Sieber M, Villringer A, Fiebach JB et al. Effect of intravenous thrombolysis on MRI parameters and functional outcome in acute stroke < 6 h. Stroke 2002; 33: 2438-45.
31. Schellinger PD, Fiebach JB, Hacke W. Imaging-based decision making in thrombolytic therapy for ischemic stroke. Stroke 2003; 34: 575-83.
32. EUSI Recommendations For Stroke Management Update 2003. Cerebrovasc Dis 2003; 16: 311-37.
33. Van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJA, van Gijn J. Interobserver agreement for the assessment of handicap in stroke patients. Stroke 1988; 19: 604-7.
34. Davalos A, Toni D, Iweins F, Lesaffre E, Bastianello S, Castillo J for the ECASS Group. Neurological deterioration in acute ischemic stroke: potential predictors and associated factors in the European Cooperative Acute Stroke Study (ECASS) I. Stroke 1999; 30: 2631-6.
35. Clark WM, Albers GW, Madden KP, Hamilton S. The rtPA 0- to 6-hours acute stroke trial, part A (A0276g): results of a double-blind, placebo-controlled, multicenter study. Stroke 2000; 31: 811-6.
36. Stejskal EO, Tanner JE. Spin diffusion measurements: Spin echoes in the presence of a time-dependent field gradient. J Chem Phys 1965; 42: 288-92.
37. Warach S, Chien D, Li W, Ronthal M, Edelman RR. Fast magnetic resonance diffusion-weighted imaging of acute human stroke. Neurology 1992; 42: 1717-23.
38. Baird AE, Warach S. Magnetic resonance imaging of acute stroke. J Cereb Blood Flow Metab 1998; 18: 583-609.
39. Lovblad KO, Laubach HJ, Baird AE, Curtin F, Schlaug G, Edelman RR et al. Clinical experience with diffusion-weighted MR in patients with acute Stroke. Am J Neuroradiol 1998; 19: 1061-6.
40. Ay H, Buonanno FS, Rodorf G, Schaefer PW, Schwamm LH, Wu O et al. Normal diffusion-weighted MRI during stroke-like dificits. Neurology 1999; 52: 1784-92.
41. Gonzalez RG, Schaefer PW, Buonanno FS, Schwamm LH, Budzik RF, Rordorf G et al. Diffusion-weighted MR imaging: Diagnostic accuracy in patiens imaged within 6 houres of stroke symptom onset. Radiology 1999; 210: 155-62.
42. Neumann-Haefelin T, Moseley ME, Albers GW. New magnetic resonance imaging methods for cerebrovascular disease: Emerging clinical applications. Ann Neurol 2000; 47: 559-70.
43. Oppenheim C, Samson Y, Manai R, Laam T, Vandamme X, Crozier S et al. Prediction of malignant midcerebral artery infarction by diffusion-weighted imaging. Stroke 2000; 31: 2175-81.
44. Jansen O, Brückmann H. Ischemic Brain Diseases. In: Sartor K (Ed). Diagnostic and interventional neuroradiology. Stuttgart: Thieme 2002: 148.
45. Mullins ME, Schaefer PW, Sorensen AG, Halpern EF, Ay H, He J et al. CT and conventional and diffusion-weighted MR imaging in acute stroke: Study in 961 patients at presentation to the emergency departement. Radiology 2002; 224: 353-60.
46. Mullins ME, Lev MH, Schellingerhout D, Koroshetz Wj, Gonzales RG. Influence of availability of clinical history on detection of early stroke using unenhanced CT and diffusion-weighted MR imaging. AJR Am J Roentgenol 2002; 179: 223-8.
47. Miyabe M, Mori S, van Zilj PC, Kirsch JR, Eleff SM, Kochler RC et al. Correlation of the average water diffusion constant with cerebral blood flow and ischemic damage after transient middle cerebral artery occlusion in cats. J Cer Blood Flow Metab 1996; 16: 881-91.
48. Schaefer PW, Hassankhani A, Pulman C, Sorensen G, Schwamm L, Koroshetz W et al. Characterisation and evolution of diffusion MR imaging abnormalities in stroke patiens undergoing intra-arterial thrombolysis. AJNR Am J Neuroradiol 2004; 25: 951-957.
49. Crisostomo RA, Garcia MM, Tong DC. Detection of diffusion-weighted MRI abnormalities in patients with transient ischemic attack. Correlation with clinical
characteristics. Stroke 2003; 34: 932-7.
50. Le Bihan D, Turner R, Douek P, Patronas N. Diffusion MR Imaging: Clinical applications. ARJ Am J Roentgenol 1992; 159: 591-9
51. Noguchi K, Ogawa T, Inugami A, Toyoshima H, Sugawara S, Hatazawa J et al. Acute subarachnoid haemorrhage: MR Imaging with fluid attenuated inversion recovery pulse sequences. Radiology 1995; 196: 773-7.
52. Perkins CJ, Kahya E, Roque CT. Fluid attenuated inversion recovery and diffusion. Stroke 2001; 32: 2774-2781.
53. De Coene B, Hajnal JV, Gatehouse P, Longmore DB, White SJ, Oatridge A et al. MR of the brain using fluid attenuated inversion recovery (FLAIR) pulse sequences. AJNR Am J Neuroradiol 1992;13:1555-64.
54. Taoka T, Iwasaki S, Nakagawa H, Fukusumi A, Kitano S, Yoshioka T et al. Fast fluid attenuated inversion recovery (FAST-FLAIR) of ischemic lesions in the brain: comparision with T2-weighted turbo SE. Radiat Med 1996; 14: 127-31.
55. Linfante I, Llinas RH, Caplan LR, Warach S. MRI features of intracerebral hemorrhagie within 2 hours from symptom onset. Stroke 1999; 30: 2263-7.
56. Kidwell CS, Saver JL, Villablanca JP, Duckwiler G, Fredieu A, Gough K et al.
Magnetic resonance imaging detection of microbleeds before thrombolysis: an emerging application. Stroke 2002; 33: 95-8.
57. Nighoghossian N, Hermier M, Adeleine P, Blanc-Lasserre K, Derex L, Honnoral J et al. Old microbleeds are potential risk for cerebral bleeding after ischemic stroke: a gradient-echo T2*-weighted brain MRI study. Stroke 2002; 33: 735-42.
58. Liu Y, Karonen JO, Vanninen RL, Ostegaard L, Roivainen R, Nuutinen Jet al. Cerebral hemodynamics in human acute ischemic stroke: A study with diffusion and perfusion-weighted magnetic resonance imaging and SPECT. J Cereb Blood Flow Metab 2000; 20: 910-20.
59. Sunshine JL, Tarr RW, Lanzieri CF, Landis DM, Selman WR, Lewin JS. Hyperacute stroke: Ultrafast MR Imaging to triage patients prior to therapy. Radiology 1999; 212: 325-32.
60. Barber PA, Darby DG, Desmond PM, Yang Q, Gerraty RP, Jolley D et al. Prediction of strole outcome with echoplanar perfusion-and diffusion- weighted MRI. Neurology 1998; 51: 418-26.
61. Neumann-Haefelin T, Wttsack HJ, Wenserski F, Siebler M, Seitz RJ, Modder U et al. Diffusion and perfusion-weighted MRI: the DWI/PWI mismatch region in acute stroke. Stroke 1999; 30: 1591-7.
62. Grandin CB, Duprez TP, Smith AM, Mataigne F, Peeters A, Oppeinheim C et al. Usefulness magnetic resonance–derived quantitative measurements of cerebral blood flow and volume in prediction of infarct growth in hyperacute stroke. Stroke 2001; 32: 1147-53.
63. Sorensen AG, Copen WA, Ostergaard L, Buomanno FS, Gonzales RG, Rordorf G et al. Hyperacute stroke: simultaneous measurement of relative cerebral blood volume, relative cerebral blood flow, and mean tissue transit time. Radiology 1999; 210: 519-27.
64. Heiss WD, Sobesky J, Hesselmann V. Identifying thresholds for penumbra and irreversible tissue damage. Stroke 2004; 35(Suppl 1): 2671-4.
65. Oppenheim C, Grandin C, Samson Y, Smith A, Duprez T, Marsault C et al. Is there an apparent diffusion coeficient threshold in predicting tissue viability in hyperacute stroke? Stroke 2001; 32: 2486-91.
66. Schlaug G, Benfield A, Baird AE, Siewert B, Lovblad KO, Parker RA et al. The ischemic penumbra: operationally defined by diffusion and perfussion MRI. Neurology 1999; 53: 1528-37.
67. Fichler J, Knab R, Reichenbach JR, Fitzek C, Weiller C, Rother J. Apparent diffusion coeficient decreases and magnetic resonance imaging perfusion parameters are associated in ischemic tissue of acute stroke patients. J Cereb Blood Flow Metab 2001; 21: 577-84.
68. Röther J, de Crespigny AJ, D´Arceuil H, Iwai K, Moseley ME. Recovery of apparent diffusion coefficient after ischemia-induced spreading depression relates to cerebral perfusion gradient. Stroke 1996; 27: 980-6.
69. Back T, Hoehn-Berlage M, Kohno M, Hosssmann KA. Diffusion nuclear magnetic resonance imaging in experimental stroke: correlation with cerebral metabolites. Stroke 1994; 25: 494-500.
70. Mikulík R, Dufek M. Trombolytická léčba mozkového infarktu – prospektivní sledování souboru pacientů. Čes a Slov Neurol N 2002; 5: 328-33.
71. Bezerra DC, Reichhart M, Maulaz AB, Wintermark M, Michel P, Maedder P et al. Carotid occlusion reopening and subsequent outcome after IV-rtPA therapy within 3 hours of stroke. Neurology 2005; 64(Suppl 1): A263-4.
72. Christou I, Felberg RA, Demchuk AM, Burgin WS, Malkoff M, Grotta JC et al. Intravenous tissue plasminogen activator and flow improvement in acute ischemic stroke patients with internal carotid artery occlusion. J Neuroimaging 2002; 12: 119–23.
73. del Zoppo GJ, Poeck K, Pessin MS, Wolpert SM, Furlan AJ, Ferbert A et al. Recombinant tissue plasminogen activator in acute thrombotic and embolic stroke. Ann Neurol 1992; 32: 78–86.
74. Wolpert SM, Bruckmann H, Greenlee R, Wechsler L, Pepsin MS, del Zoppo GJ. Neuroradiologic evaluation of patients with acute stroke treated with recombinant tissue plasminogen activator: the rt-PA Acute Stroke Study Group. AJNR Am J Neuroradiol 1993;14:3–13.
75. Endo S, Kuwayama N, Hirashima Y, Akai T, Nishijima M, Takaku A. Results of urgent thrombolysis in patients with major stroke and atherothrombotic occlusion of the cervical internal carotid artery. AJNR Am J Neuroradiol 1998; 19: 1169-75.
76. Sugg RM, Malkoff MD, Shaltoni HM, Cacayorin ED, Grotta JC. Endovascular
recanalization of internal carotid occlusion in acute ischemic stroke. Neurology 2005; 64(Suppl 1): A111.
77. Nedeltchev K, Brekenfeld C, Remonda L, Ozdoba C, Do DD, Arnold M et al. Internal carotid artery stent implantation in 25 patients with acute stroke: preliminary results. Radiology 2005; 237: 1029-37.
78. Herzig R, Bar M, Vlachova I, Krupka B, Sanak D, Bachleda P et al. Ischaemic stroke due to the acute internal carotid artery occlusion: Results of the emergent carotid disobliteration versus conservative treatment. Cerebrovasc Dis 2003; 16(Suppl 4): 57-8.
79. Pepsin M, del Zoppo G, Furlan A. Thrombolytic treatment in Acute Stroke. In: Moskowitz M, Caplan LR (Eds). Cerebrovascular diseases: 19th Princeton Stroke Conference. Boston, Mass: Butterworth-Heinemann; 1995: 409-18.
80. Tomcik T, Brott T, Barsan W, Broderick J, Haley EC, Spilker J et al. Prognostic value of the hyperdense middle cerebral artery sign and stroke scale before ultra early thrombolytic therapy. AJNR Am J Neuroradiol 1996; 17: 79-85.
81. Lisboa RC, Jovanovic BD, Alberts MJ. Analysis of the safety and efficacy of intra-arterial thrombolytic therapy in ischemic stroke. Stroke 2002; 33: 2866-71.
82. Arnold M, Schroth G, Nedeltchev K, Loher T, Remonda L, Stepper F et al. Intra-arterial thrombolysis in 100 patients with acute stroke due to middle cerebral artery occlusion. Stroke 2002; 33: 1828-33.
83. Kim DJ, Kim DI, Kim SH, Lee KY, Heo JH, Han SW. Rescue localized intra-arterial thrombolysis for hyperacute MCA ischemic stroke patiens after early non-responsive intravenous tissue plasminogen activator therapy. Neuroradiology 2005; 47: 616-21.
84. Roberts HC, Dillon WP, Furlan AJ, Rowley HA, Fischbein NJ, Highasida RT et al. Angiographic collaterals in acute ischemic stroke: relationship to clinical presentation and outcome: the PROACT II, In: 26th International Stroke Conference, Fort Lauderable, Fla; 2001: 4.
85. Selim M, Fink JN, Kumar S, Caplan LR, Horkan C, Chen Y et al. Predictors of hemorrhagic transformation after intravenous recombinant tissue plasminogen activator. Stroke 2002; 33: 2047-52.
86. Šaňák D, Horák D, Nosál´ V, Bártková A, Zeleňák K, Herzig R et al. Impact of initial cerebral infarction volume measured in diffusion-weighted MRI on clinical outcome in acute stroke patiens with middle cerebral artery occlusion, who underwent thrombolysis. A pilot study. Neurology 2006; 66(Suppl 2): 108.
87. Derex L, Nighoghossian N, Hermier M, Adeleine P, Berthezène, Philippeau F et al. Influence of pretreatment MRI parameters on clinical outcome, recanalization and infarct size in 49 stroke patients treated by intravenous tissue plasminogen activator. Journal of the Neurological Sciences 2004; 225: 3-9.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2007 Issue 2
Most read in this issue
- Epilepsie a cyklus spánku a bdění
- Súčasný pohľad na diagnostiku a terapiu afázie
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
