Využitie umelej inteligencie pri hodnotení obrazu CT u pacientov s CMP – aktuálne možnosti
Use of artificial intelligence in CT image evaluation in stroke patients – current options
Artificial intelligence and its rapid development represent one of the most important technological advances of the current decade. It affects almost all aspects of life, including medicine. Artificial intelligence is widely applied in neuroradiology, particularly in stroke diagnosis. The primary purpose of its application in this area is to accelerate the interpretation process, increase diagnostic accuracy, and help to select the treatment strategy. Clinicians involved in the initial management of a stroke patient should be familiar with the technical principles and possible use of artificial intelligence in neuroimaging, and they should know the strengths and weaknesses of the technology. This article briefly presents methods of artificial intelligence used in visual data processing. The main goal of the publication is to present particular automated analyses used in the interpretation of diagnostic information taken from CT images. CT is the primary choice in stroke diagnostics for most medical departments. The presented analyses are a calculation of the ASPECT score and detection of a hyperdense artery sign from non-contrast CT scans, identification of large vessel occlusion and collateral score evaluation from CTA, and creation of perfusion maps from CT perfusion.
Keywords:
deep learning – machine learning – ischemic stroke – large vessel occlusion – artifi cial intelligence
Autoři:
Z. Trabalková 1,2; M. Števík 1; J. Sýkora 1,2; M. Vorčák 1; K. Zeleňák 1
Působiště autorů:
Rádiologická klinika JLF UK a UNM, Martin, SR
1; Rádiologická klinika LF UP a FN Olomouc, ČR
2
Vyšlo v časopise:
Cesk Slov Neurol N 2024; 87(1): 32-40
Kategorie:
Přehledný referát
doi:
https://doi.org/10.48095/cccsnn202432
Souhrn
Rýchly rozvoj umelej inteligencie patrí medzi najdôležitejšie technologické pokroky súčasného desaťročia a ovplyvňuje takmer všetky aspekty života, medicínu nevynímajúc. Široké uplatnenie umelá inteligencia zaznamenáva aj v neurorádiológii, osobitne v diagnostike CMP. K hlavným účelom jej použitia v tejto sfére patrí urýchlenie vyhodnocovacieho procesu, zvýšenie diagnostickej presnosti a pomoc pri voľbe liečebnej stratégie. Lekári zapojení do iniciálneho manažmentu pacienta s CMP by mali byť oboznámení s technickými princípmi a možnými aplikáciami nástrojov umelej inteligencie v neurozobrazovaní a poznať silné a slabé stránky tejto technológie. V článku sú v skratke predstavené metódy umelej inteligencie využívané pri spracovaní obrazových dát. Hlavným cieľom publikácie je prezentácia jednotlivých automatických analýz nápomocných v interpretácii diagnostických informácií získaných vyšetrením CT, ktoré je pre väčšinu pracovísk modalitou prvej voľby v diagnostike CMP. Patria tu kalkulácia skóre ASPECT a detekcia príznaku hyperdenznej cievy z natívneho vyšetrenia CT, identifikácia uzáveru veľkej cievy a určenie skóre kolaterál z CTA a vytvorenie perfúznych máp z perfúzneho vyšetrenia CT.
Klíčová slova:
ischemická cievna mozgová príhoda – uzáver veľkej tepny – umelá inteligencia – strojové učenie – hlboké učenie
Úvod
Cievna mozgová príhoda je celosvetovo druhá najčastejšia príčina mortality a vysoká je aj úroveň ňou podmienenej chronickej invalidity [1]. V Európe postihuje ročne 1,1 milióna ľudí a ekonomické náklady spojené so starostlivosťou o nich boli vyčíslené na 45 biliónov eur ročne [2]. Zobrazovacie modality sú kruciálnou súčasťou diagnostického procesu CMP, ich úloha spočíva v detekcii, charakteristike a v stanovení prognózy akútnej ischemickej aj hemoragickej CMP [1]. Na väčšine pracovísk sa ako metóda prvej voľby používa vyšetrenie CT, najmä pre svoju rýchlosť a širokú dostupnosť [3]. Natívne vyšetrenie CT je schopné odlíšiť podtypy CMP a lézie imitujúce CMP. V prípade ischemickej CMP je štandardom aj CTA karotického a vertebro-bazilárneho povodia. Celkovo 24–46 % ischemických CMP je spôsobených uzáverom veľkej tepny [4], ktorý sa predominantne vyskytuje v prednej cirkulácii. Randomizované kontrolované štúdie dokázali bezpečnosť a efektívnosť včasnej mechanickej trombektómie [5]. Za revolučné sú považované najmä štúdie DAWN a DEFUSE-3, na základe ktorých boli v roku 2018 aktualizované odporúčania American Heart Association/American Stroke Association. Podľa nich bolo časové okno na realizáciu trombektómie u vybraných pacientov predĺžené zo šiestich až na 24 h [4]. Z revaskularizačnej endovaskulárnej liečby (EVL) profitujú pacienti so stredne závažným až ťažkým klinickým deficitom, ktorí majú pri zobrazovacom vyšetrení detegované limitované jadro ischémie a rozsiahlu penumbru [6]. V rozhodovacom procese je teda časové okno nahrádzané tkanivovým oknom [4]. Na hodnotenie jadra a penumbry sú realizované pokročilé neurozobrazovacie metódy – perfúzne CT alebo vyšetrenie MR (fluid attenuated inversion recovery [FLAIR], difúziou vážené obrazy [diffusion weighted imaging; DWI], perfúzne vážené obrazy [perfusion weighted imaging; PWI) ] [7]. S rastúcou úlohou zobrazovacích vyšetrení v diagnostike CMP súvisia pokroky v spracovaní obrazu a rozvoj algoritmov umelej inteligencie (artificial intelligence; AI), ktoré sú schopné automaticky extrahovať diagnostické informácie. Algoritmy AI predstavujú dôležitý nástroj podpory rádiológov pri urýchlení diagnostiky CMP a pri stanovení správneho rozhodnutia o zvažovanej intervencii v kratšom čase [4]. Čím rýchlejšie je stanovená diagnóza a zahájená vhodná liečba, tým lepší je klinický efekt pre pacienta [8].
Umelá inteligencia
Umelá inteligencia je definovaná ako schopnosť strojov napodobňovať kognitívne funkcie ľudí – učenie a riešenie problémov. AI možno chápať ako súbor programov a nástrojov, ktoré činia softvér „múdrym“ do takej miery, že si nezávislý pozorovateľ myslí, že výstup bol produkovaný človekom [9]. Odvetvie AI je pokladané za najrevolučnejšiu oblasť v zdravotníckom priemysle za poslednú dekádu a najväčší podiel na tomto vývoji má diagnostické zobrazovanie [10]. Faktom je, že počet vyšetrení v rádiologickej praxi v posledných rokoch dramaticky vzrástol a pracovné zaťaženie v tomto segmente bude pravdepodobne narastať aj v blízkej budúcnosti [11]. S tým úzko súvisí aj rozmach metód AI. V septembri 2023 bolo dokumentovaných 237 medicínskych pomôcok využívajúcich AI v rádiológii schválených Food and Drug Administration (FDA) [12]. V analýze obrazových dát vykazujú prelomový výkon najmä strojové učenie a hlboké učenie [10], poskytujúce efektívny spôsob rýchlej zobrazovacej analýzy [1]. Neurorádiológia je jednou z popredných subšpecializácií v rádiológii z hľadiska počtu a rozmanitosti aplikácií AI [13]. Zvlášť medicína CMP je vhodná pre ich aplikovanie kvôli obrovskému množstvu dát a multidisciplinárnemu prístupu k liečbe. Zobrazenie mozgu, ktoré je kľúčovým faktorom v manažmente CMP a vytvára základ pre mnohé klinické rozhodnutia, je atraktívnym predmetom techník AI [14], vrátane nástrojov na triáž, kvantifikáciu, sledovanie a predikciu [1]. Chandrabhatla et al. v publikácii z mája 2023 uvádzajú až 20 FDA schválených technológií využívaných v zobrazovacej diagnostike CMP [15].
Strojové učenie
Strojové učenie je podmnožina AI využívajúca štatistické prístupy umožňujúce strojom optimalizovať predikciu výsledku po tom, čo sú vystavené údajom a trénované na rozpoznávanie vzorov [1]. Ide o oblasť, kde sa počítače učia z akumulácie dát bez toho, aby boli špecificky naprogramované [16]. Algoritmy strojového učenia (napr. lineárna regresia, logistická regresia, zhlukovanie, metóda podporných vektorov, náhodný les) sa s rastúcim vystavením údajom rozvíjajú, nepracujú výlučne na základe pravidiel, ale skúsenosťami sa zlepšujú, odpovedať na konkrétne otázky sa učia pomocou vyhodnocovania veľkého množstva vstupných údajov [9,17]. Pri strojovom učení sa premenné používané ako vstupné údaje všeobecne označujú ako vlastnosti a spravidla sú určené vedeckým tímom. Keďže výkon strojov je premenlivý v závislosti od zadaných vlastností, veľmi dôležitá je selekcia a extrakcia vhodných vlastností zo súboru dát. V rádiológii, pri obrazových dátach, sa na strojové učenie môžu využiť rôzne vlastnosti obrazu ako veľkosť, lokalizácia, tvar a denzita či signálová intenzita lézie. Stroje sú schopné rozlíšiť a použiť aj ďalšie vlastnosti obrazu, ako sú informácie o textúre – napr. gradient signálovej intenzity a zošikmenie, ktoré nie sú ľudským okom rozpoznateľné. Strojové učenie sa delí na učenie pod dohľadom a učenie bez dohľadu [17]. Tieto metódy je možné rozlíšiť na základe toho, či používajú ľudskú spätnú väzbu [14]. Pre obe je spoločné, že sú riadené dátami a samotný proces rozhodovania je uskutočnený s minimálnymi zásahmi človeka [18]. Učenie pod dohľadom (s učiteľom) na vykonanie stanovenej úlohy využíva tréningový súbor údajov, ktoré sú vopred označené človekom [14]. Keď je program vystavený vzorovým dátam rovnakého typu, využije charakteristiky tréningového súboru na predpovedanie konkrétneho výsledku alebo cieľa [16]. Proces označovania je pre povereného človeka prácny a časovo náročný [14]. Príkladom je súbor vyšetrení CT mozgu, ktoré rádiológ klasifikuje do rôznych skupín (napríklad intrakraniálna hemorágia prítomná/neprítomná) [17]. Na rozdiel od toho učenie bez dohľadu (bez učiteľa) nepoužíva človekom definované odpovede, ale snaží sa vo veľkých súboroch dát samostatne identifikovať prirodzene sa vyskytujúce skryté vzorce alebo zoskupenia, ktoré sú pre ľudí zvyčajne neviditeľné [14,16]. Patrí tu napríklad zhlukovanie – algoritmus, pri ktorom sú obrázky roztriedené do viacerých skupín na základe metriky podobností bez a priori známeho hnacieho momentu procesu separácie [14].
Hlboké učenie
Hlboké učenie je metóda strojového učenia využívajúca špecifickú architektúru, konkrétne niektorú z foriem neurónovej siete [17]. Toto odvetvie AI napodobňuje ľudský mozog používaním početných vrstiev umelých neurónových sietí. Tie sú zložené z uzlov a usporiadané do vzájomne prepojených vstupných, skrytých a výstupných vrstiev. Hlboké učenie sa označuje ako hlboké, lebo má viacero skrytých vrstiev [14,16], ktoré reprezentujú interneuróny [17]. Tieto vrstvy zhromažďujú údaje zo vstupov a poskytujú výstup, ktorý sa môže postupne meniť, keď sa systém z dát naučí nové vlastnosti [9]. Na rozdiel od iných tradičných metód strojového učenia vyžadujúcich ručnú extrakciu vlastností zo vstupov, techniky hlbokého učenia sa tieto vlastnosti učia nezávisle priamo z dát, bez potreby výberu [19]. Algoritmy hlbokého učenia poskytujú zvlášť výnimočný výkon v obrazovej analýze, rovnajúci sa alebo až prekonávajúci ľudský výkon. Preto je rádiológia považovaná za prirodzenú oblasť pre využitie hlbokého učenia [20] a hlboké učenie je základom väčšiny nástrojov AI na interpretáciu obrazu [9]. Najpopulárnejšou a najúspešnejšou podmnožinou hlbokého učenia v medicínskom zobrazovaní sú konvolučné neurónové siete [1], inšpirované vizuálnou mozgovou kôrou cicavcov [17]. Konvolučné neurónové siete majú na rozdiel od tradičných metód strojového učenia schopnosť automaticky identifikovať vzory v komplexných obrazových súboroch, čím dochádza ku kombinácii výberu vlastností a ich klasifikácii do jedného algoritmu [1]. Skryté vrstvy konvolučných neurónových sietí používajú operácie konvolúcie a podvzorkovania (priestorového zmenšenia) na rozloženie obrazu na vlastnosti obsahujúce najhodnotnejšie informácie [16]. Kľúčovým účelom konvolučných vrstiev je získanie rozlišujúcich vlastností (napr. hrany, línie, tvary) zo vstupnej obrazovej informácie [18]. Uzly konvolučných neurónových sietí sú spojené v geometrickej štruktúre, pričom každý uzol je napojený len na malú časť vstupu, čím sa odlišujú od bežných neurónových sietí, kde je každý uzol napojený na každú hodnotu zo vstupu [14,18]. Pri spracovaní obrazu sú uzly vstupnej vrstvy usporiadané tak, aby vytvorili konvolúciu malej časti obrazu (jadro), toto jadro sa následne pohybuje po obraze a vytvára výstupnú hodnotu, informácia prechádza od jednoduchých po pokročilejšie vrstvy [14]. V závere dochádza v plne prepojenej vrstve, reprezentujúcej tradičnú neurónovú sieť, k aplikácii uvažovania na vysokej úrovni a spojeniu všetkých vlastností z obrazu a výstupná vrstva poskytne predikcie. Táto štruktúra má v rámci rádiológie uplatnenie pri kategorizácii lézií alebo stavu zo zobrazovacích modalít a aj pri rozhodovaní, či konkrétny pixel patrí do pozadia alebo do cieľovej triedy [16,18].
Umelá inteligencia pri zobrazovaní ischemickej CMP
Techniky AI je možné aplikovať vo všetkých úrovniach manažmentu CMP – od prednemocničnej starostlivosti, vrátane transportu do centra EVL, cez rádiodiagnostiku, až po voľbu liečebnej stratégie a následnú rehabilitačnú starostlivosť [21]. V rámci zobrazovania môže AI skvalitniť technický aspekt akvizície obrazu. Prístupy strojového učenia sú schopné zlepšiť rýchlosť a kvalitu skenovania, rekonštrukciu obrazu, redukciu artefaktov, ktoré vznikajú počas skenovania a rekonštrukcie či redukciu kovových artefaktov [22]. Umožňujú tiež minimalizáciu dávky žiarenia aj redukciu dávky kontrastnej látky pri udržaní optimálnej kvality obrazu [16]. Ďalším prínosom sú algoritmy nápomocné pri interpretácii obrazu. Základné zobrazovacie otázky, ktoré je v prípade akútnej ischemickej CMP nutné čo najrýchlejšie zodpovedať sú vylúčenie intrakraniálnej hemorágie, rozsah akútnej ischémie, prítomnosť uzáveru veľkej cievy a rozsah tkaniva v riziku [4,23]. Každodenná prax však v rámci tohto procesu ukazuje viacero limitujúcich faktorov – hodnotenie a interpretácia obrazových dát sú časovo náročné, rádiológovia majú rôznu úroveň skúseností a expertízy v neurozobrazovaní a v prípade príjmu pacienta s CMP v komunitných, periférnych nemocniciach s menšou mierou skúseností v diagnostike CMP sú okrem menších skúseností navyše závažným problémom aj oklieštené ľudské zdroje [23]. Obmedzením kvalitatívneho hodnotenia CMP je tiež jeho subjektivita. Menované činitele podporujú zavedenie vysokorýchlostných automatických analýz, prekonávajúcich konvenčné metodológie a skracujúcich čas do liečby. Nástroje AI dokážu automaticky vyprodukovať kvantitatívne merania ako skóre ASPECT (Alberta Stroke Program Early CT Score) z natívneho vyšetrenia CT, detegovať uzáver veľkej cievy či stanoviť skóre kolaterál na CTA a spracovať perfúzne mapy z perfúzneho vyšetrenia CT k posúdeniu potenciálne zachrániteľného mozgového tkaniva [16]. Na kalkuláciu ASPECT skóre je najčastejšie používanou metóda náhodných lesov, na detekciu uzáveru veľkej tepny sú najvyužívanejšie konvolučné neurónové siete [24]. Zvlášť od objavu hlbokého učenia je hodnotenie medicínskeho zobrazovania pomocou AI považované za veľmi rýchlo expandujúci priemysel. V rámci Európskeho hospodárskeho priestoru je pred uvedením medicínskeho softvéru na trh nutné získanie certifikačnej značky, ktorá preukazuje zhodu s predpismi o zdravotníckych pomôckach schválenými Európskym parlamentom a Radou [8]. K najznámejším komerčným platformám používaným v diagnostickom procese CMP patria e-Stroke Suite (Brainomix, Oxford, Anglicko) v spolupráci s Olea Sphere (Olea Medical Solutions, La Ciotat, Francúzsko), Viz.ai (Viz.ai, SanFrancisco, CA, USA), RapidAI (iSchema View, MenloPark, CA, USA) [21]. Tieto softvéry sú prepojené s nemocničným systémom PACS (Picture Archiving and Communication System), do ktorého sa výsledky hodnotenia automaticky prenášajú. Dostupné sú v priebehu niekoľkých minút na obrazovkách pracovných konzol a v mobilných aplikáciách. Nástroje AI sú schopné odoslať notifikáciu pohotovostnému neurointervenčnému tímu, ten má týmto spôsobom obrazovú dokumentáciu dostupnú k prezretiu prakticky kdekoľvek. Aj tento krok dokázateľne urýchľuje zahájenie terapeutického procesu [23]. V štúdii autorov Elijovich et al. bol časový medián od realizácie CTA po odoslanie notifikácie pomocou AI kratší o 19 minút ako pri bežných podmienkach (7 vs. 26 min; p < 0,001) [25].
Skóre ASPECT
ASPECT je kvantitatívny skórovací systém implementovaný na objektívnejšie posúdenie včasných ischemických zmien u pacientov s uzáverom arteria cerebral media (ACM) na natívnom vyšetrení CT [26,27]. U pacientov v skorom časovom okne (do 6 h od začiatku príznakov) je skóre ASPECT na základe niekoľkých randomizovaných klinických štúdií rozhodujúcim nástrojom v selekcii pacientov na EVL. Podľa platných medzinárodných guidelinov je trombektómia indikovaná u pacientov so skóre ≥ 6 [26–28]. Recentne boli publikované aj výsledky multicentrickej randomizovanej nezaslepenej klinickej štúdie TENSION, v ktorej bol preukázaný priaznivý efekt endovaskulárnej trombekótmie aj u pacientov s preukázaným veľkým infarktom (ASPECT 3–5) a s predĺženým časovým oknom (do 12 h) [29]. Napriek koncepčnej jednoduchosti je detekcia skorých ischemických zmien a stanovenie skóre ASPECT v praxi výzvou, zvlášť pre menej skúsených a trénovaných hodnotiacich lekárov bez špecializácie v neurozobrazovaní. Nejasné hranice medzi jednotlivými oblasťami zahrnutými do skórovania, diskrétne zmeny denzity v skorom štádiu iktu ťažko rozpoznateľné voľným okom, časový stres, zaujatosť hodnotiaceho očakávanými zisteniami a rozdiely v technických činiteľoch vplývajúcich na kvalitu obrazu (energia RTG žiarenia, spracovanie obrazu, rekonštrukčné algoritmy) patria k hlavným faktorom, ktoré spôsobujú nekonzistentnosť hodnotenia medzi rádiológmi [3,30]. Stupeň zhody bol viacerými štúdiami stanovený na miernu až strednú úroveň [26–28]. To však môže mať klinické dôsledky [28]. Jedným zo spôsobov vedúcich k redukcii tejto variability a k zvýšeniu spoľahlivosti interpretácie skóre ASPECT je použitie AI (obr. 1), najmä techník hlbokého učenia [3,27]. Dostupné softvérové programy na kalkuláciu skóre ASPECT dosahujú sľubné výsledky v porovnaní s ľudským hodnotením. V štúdii autorov Nagel et al. bola porovnávaná schopnosť detekcie včasných ischemických zmien medzi komerčným systémom e-ASPECTS Brainomix, založenom na strojovom učení a tromi neurorádiológmi, pričom nebola zaznamenaná menejcennosť automatizovaného hodnotenia [31]. V ďalšej štúdii automatické hodnotenie tiež dosiahlo podobné výsledky ako konsenzuálne čítanie dvoch skúsených neurorádiológov [27]. Maegerlein et al. vo svojej publikácii dokonca prezentujú väčšiu, takmer úplnú zhodu (k = 0,90) automatického softvéru s vopred definovaným referenčným štandardom v porovnaní s dvomi osvedčenými neurorádiológmi [28]. Naopak, Li et al. na vzorke 61 pacientov detegovali nižšiu úspešnosť automatizovaného softvéru v porovnaní s dvoma skúsenými rádiológmi [32]. V práci autorov Maegerlein et al. bol skúmaný aj vzťah medzi časovým odstupom zobrazenia od nástupu príznakov a schopnosťou detekcie skorých ischemických zmien. Pri rozbore skenov CT získaných počas prvej hodiny od vzniku príznakov softvér aj rádiológ vykazovali slabú zhodu s konsenzuálnym skóre. V intervale 1–4 h od vzniku príznakov už analýza pomocou AI dosahovala vysokú zhodu s konsenzuálnym skóre (k = 0,78), zatiaľ čo ľudský výkon bol hodnotený ako slabý až uspokojivý. Pri zobrazení po viac ako 4 h už bol výkon analytického softvéru aj rádiológa porovnateľný [28]. Pri porovnaní jednotlivých komerčných platforiem (Syngo.via Frontier ASPECT Score Prototyp V2, Brainomix e-ASPECTS a RAPID ASPECTS, respektíve Frontier ASPECTS Prototype a e-ASPECT Brainomix) dosiahol najlepšie výsledky softvér e-ASPECTS Brainomix [33,34]. Automatizované hodnotenie ASPECT skóre môže byť menej presné v prípade preexistujúcich cerebrálnych zmien (v prípade leukoencefalopatie, v teréne zmien po starších infarktoch či iného poškodenia tkaniva) alebo v prípade prítomnosti špirál po koilingu aneuryzmy [1,23]. Taktiež je, rovnako ako hodnotenie rádiológom, ovplyvnené kvalitou obrazu, čo potvrdzujú aj výsledky štúdie posudzujúcej efekt rôznych rekonštrukčných algoritmov na hodnotenie ASPECT skóre štyrmi diagnostikmi a softvérom e-ASPECT Brainomix [26]. Dokumentovaný je aj vplyv hrúbky rezu na výkon softvéru. S narastajúcou hrúbkou rezu sa jeho výkon podstatne znižuje [35].
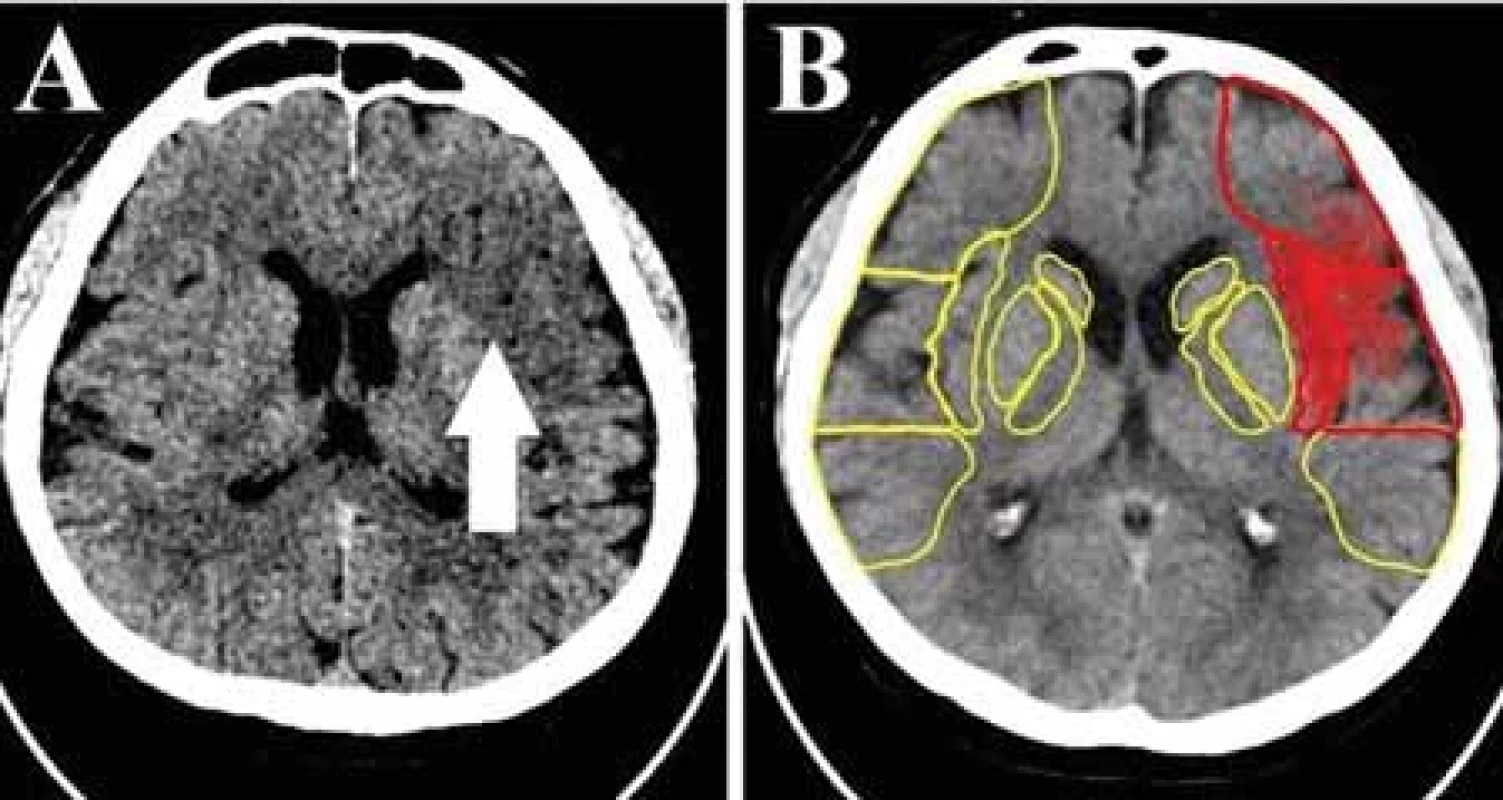
ASPECT – Alberta Stroke Program Early CT Score
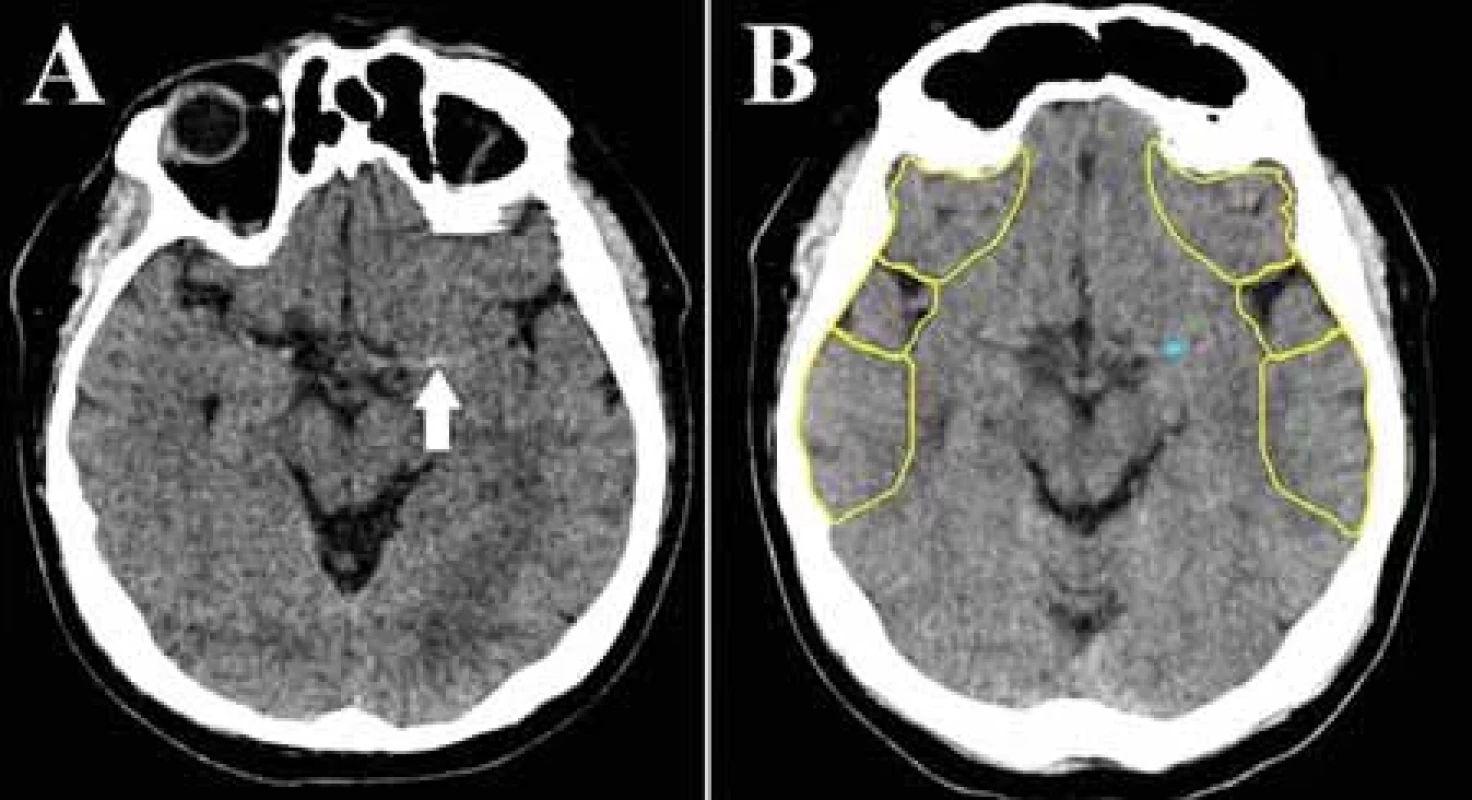
Detekcia uzáveru veľkej tepny
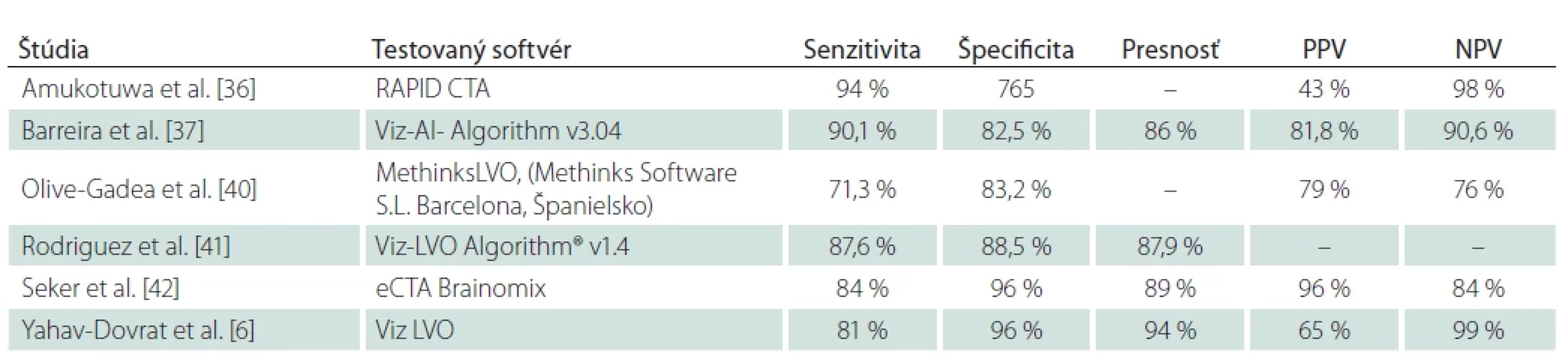
Uzáver veľkej tepny je príčinou približne tretiny ischemických CMP. Ak však nie je včas adekvátne liečená, spôsobuje závažné neurologické postihnutie a jej podiel na s ischemickým iktom asociovanej mortalite činí až 90 %. Vysokoúčinnou terapeutickou procedúrou u týchto pacientov je endovaskulárna trombektómia, obmedzená časovým oknom maximálne 24 h od nástupu príznakov. Z týchto dôvodov je nevyhnutná promptná a presná zobrazovacia diagnostika, zvlášť na periférnych pracoviskách kvôli zabezpečeniu čo najrýchlejšieho transportu do centra s možnosťou EVL [36,37]. Detekcia uzáveru veľkej tepny nepredstavuje pre experta v neurozobrazovaní diagnostickú výzvu, hlavný prínos technológií AI spočíva v zrýchlení diagnostického a rozhodovacieho procesu. Slúžia tiež ako podporný nástroj pre menej skúsených diagnostikov [8]. Uzáver artérie veľkého kalibru je možné detegovať už na natívnom CT zobrazení ako príznak hyperdenznej cievy (obr. 2). Príznak hyperdenznej cievy je prejavom na erytrocyty bohatého intraarteriálneho trombembolu [38,39]. Patrí k skorým markerom ischemickej CMP, rozpoznateľný je na rozdiel od ischemických zmien tkanivá už bezprostredne po uzávere tepny. Reprezentuje tak dokonalú diagnostickú podporu v časovo kritických prípadoch ischemickej CMP, zvlášť v malých periférnych nemocniciach, kde nie je zabezpečená dostupnosť CTA v režime 24/7 [8]. Pomáha k rýchlejšej identifikácii kandidátov na reperfúznu liečbu, bez nutnosti podania kontrastnej látky a ďalšieho ožiarenia. Niektoré platformy poskytujú aj informácie o dĺžke a objeme trombu, pričom objem trombu a jeho hustota sú prediktory neúspešnej rekanalizácie po podaní trombolýzy, čo predpovedá nutnosť intervenčného zákroku [40]. Komerčné softvéry na detekciu príznaku hyperdentnej cievy zaznamenali v štúdiách senzitivitu 70–97,5 % a špecificitu 71–96 %, štúdie dokumentujú aj výrazne kratší vyhodnocovací čas softvérov v porovnaní s rádiológmi [38–40]. Podľa aktuálnych odporúčaní má však prítomnosť uzáveru potvrdiť neinvazívne angiografické zobrazenie [40], štandardom je CTA. Aj pri jej vyhodnocovaní možno aplikovať algoritmy strojového učenia (obr. 3) [8]. V posledných rokoch bolo publikovaných niekoľko prác posudzujúcich spoľahlivosť viacerých komerčných softvérov v detekcii uzáveru veľkej tepny v prednej cirkulácii (M1 segment arteria cerebri media [ACM], rozsah detegovaného uzáveru ACM sa líši v závislosti od štúdie, niektoré zahàňali aj uzáver proximálneho M2 segmentu) z CTA na základe porovnania s hodnotením skúsených diagnostikov. Štúdie detegovali strednú až vysokú senzitivitu aj špecificitu v detekcii uzáveru veľkej tepny (tab. 1), zhodujú sa v nižšej schopnosti detekcie periférnejších oklúzií, ktoré sú tiež potenciálne endovaskulárne ošetriteľné. Výsledky týchto prác podporujú používanie programov AI ako doplnkového prostriedku pre urýchlenie diagnózy. Aktuálne ich diagnostická presnosť nie je dostatočná na to, aby nahradila odborné hodnotenie skúseným, certifikovaným neurodiagnostikom [6,36–42]. Seker et al. uvádzajú, že výkon e-CTA Brainomix programu je porovnateľný s hodnotením rádiológov v špecializačnej príprave [42]. Falošne pozitívne detegované uzávery sú spôsobené najmä asymetriou ciev, ktorú rádiológ vizuálnou kontrolou ľahko odlíši od uzáveru veľkej tepny. Falošne negatívne nálezy možno vysvetliť neschopnosťou algoritmu rozpoznať uzáver pri nedostatočnom znížení denzity cievy – pri nekompletnom uzávere alebo bohatom kolaterálnom obehu, v prípade petrózneho a klinoidného segmentu cerebri media, môže byť falošná negativita spôsobená aj neadekvátnym výkonom kostnej masky [36]. Do budúcna sú pre nástroje AI v tejto sfére výzvami hlavne optimalizácia detekcie distálnych uzáverov a uzáverov vo vertebro-bazilárnom povodí, oddiferencovanie uzáveru od aterosklerózy a akútneho a chronického uzáveru [22,40].
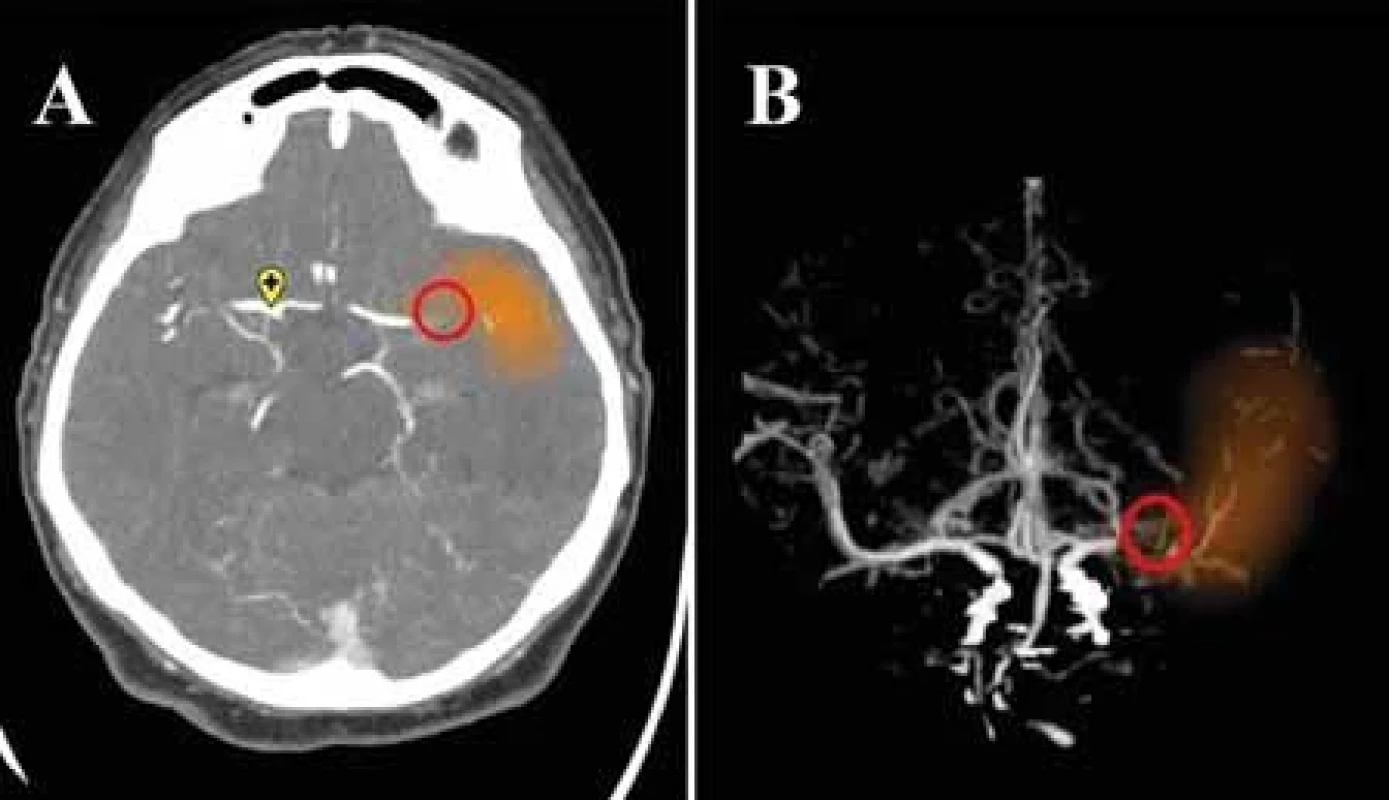
MIP – maximum intensity projection

AIF – arterial input function; ICA – arteria carotis interna; ACM – arteria cerebri media; VOF – venous output function
Zhodnotenie kolaterálneho obehu
Jedným z kľúčových faktorov, od ktorého závisí efekt trombektómie je stav kolaterálneho obehu [43]. Slabý kolaterálny obeh je asociovaný s rýchlou progresiou infarktu, u tejto skupiny pacientov je pre záchranu tkaniva nevyhnutná urgentná diagnostika a liečba. Naopak, bohaté kolaterály predikujú pomalý rozvoj infarktu, dlhšie časové okno a lepší funkčný výsledok rekanalizácie [36]. Pre optimálne hodnotenie kolaterálneho obehu by skenovanie malo byť realizované v neskorej arteriálnej alebo skorej venóznej fáze [8]. Na hodnotenie stavu kolaterál v povodí uzavretej ACM z CTA je najpoužívanejší štvorstupňový skórovací systém, Tan skóre – od 0 (bez prítomnosti kolaterál) po 3 (100% plnenie postihnutej oblasti) [44]. Ide o časovo náročný a často zložitý proces kvôli komplexnej neurovaskulatúre intrakránia [45]. Problémom vizuálneho bodovania kolaterálneho obehu rádiológmi je najmä nekonzistentnosť medzi jednotlivými hodnotiacimi, keďže ide o subjektívne hodnotenie. Jedným z riešení tejto variability je začlenenie softvéru strojového učenia do vyhodnocovacieho procesu (obr. 4) [46]. Objektívna, automatizovaná kalkulácia kolaterálneho skóre je predmetom skúmania niekoľkých štúdií. V práci autorov Grunwald et al. bol posudzovaný stupeň zhody medzi softvérom a referenčným štandardom určeným konsenzom medzi tromi skúsenými neurorádiológmi. Výsledkom bol 90% podiel zhody softvéru s referenčným štandardom [46]. V ďalšej štúdii bol porovnávaný výkon programu a 29 rádiológov s rôznou dĺžkou praxe voči referenčnému štandardu určenému dvomi, v prípade nejednoznačnej zhody tromi, nezávislými neurorádiológmi. Program AI dosiahol podobné výsledky ako rádiológovia. Zaujímavým poznatkom tejto štúdie bolo, že po 1 hodine tréningu nebol zaznamenaný rozdiel v presnosti hodnotenia v závislosti od skúseností hodnotiaceho [43]. Jabal et al. zaznamenali, že použitie softvéru viedlo k signifikantnému zvýšeniu presnosti bodovania a k redukcii variability medzi hodnotiacimi [47]. Tieto zistenia podporujú implementáciu metód AI pri posudzovaní kolaterálneho obehu do klinickej praxe ako užitočného prostriedku na zníženie zaujatosti a identifikáciu pacientov profitujúcich z trombektómie [45].
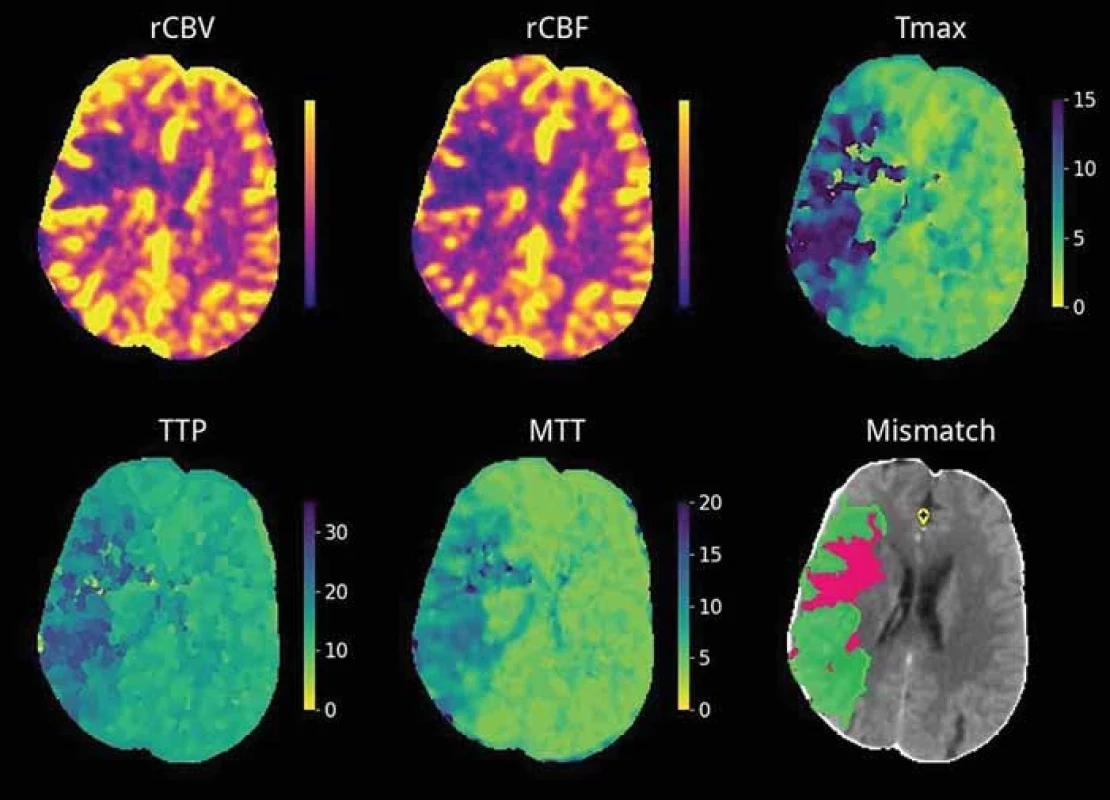
MTT – mean transit time; rCBF – relative cerebral blood fl ow; rCBV – relative cerebral blood volume; Tmax – time to maximum; TTP – time to peak
Perfúzne mapy
V prípade pacientov s neznámym časom vzniku ischemickej CMP alebo u pacientov v predĺženom časovom okne (po viac ako 6 h od vzniku príznakov) je v rámci procesu selekcie vhodných kandidátov pred zvažovanou EVL nutné realizovať zobrazenie mozgovej perfúzie k posúdeniu veľkosti jadra a penumbry [21,48]. Za najpresnejšiu metódu je považované zobrazenie MR. Na mnohých pracoviskách je však problém zabezpečiť jeho nepretržitú dostupnosť. V klinickej praxi sa preto rutinne využíva dostupnejšia alternatíva, perfúzne vyšetrenie CT [49]. Perfúzia CT je založená na dynamickom sledovaní prvého prechodu bolusu kontrastnej látky cerebrálnou cirkuláciou. Na následné spracovanie dát z perfúzneho CT bolo vyvinutých viacero komerčných softvérov. Prevažná časť aktuálne používaných programov automaticky generuje parametrické mapy (obr. 5) a identifikuje jadro, penumbru a ich vzájomný pomer pomocou dekonvolúcie tkanivových a arteriálnych signálov. Perfúzne parametre v postihnutej oblasti sú porovnávané s kontralaterálnou hemisférou, pričom rôzne aplikácie používajú odlišný kvantitatívny prah na definíciu jadra a produkujú tak odlišné výsledky aj pri rovnakých zdrojových dátach, čo môže mať potenciálny vplyv na rozhodnutie o liečbe [8]. Napr. v aplikáciách RAPID a Brainomix je ischemické jadro definované ako tkanivo s minimálne 70% redukciou prietoku krvi (rCBF < 30 %) v porovnaní s nepostihnutou hemisférou, Syngo.via CT Neuro Perfusion VB30 (Siemens Healthineers, Erlangen, Nemecko) používa ako prah 80% pokles prietoku (rCBF < 20 %). Všetky spomenuté softvéry za hypoperfúziu považujú predĺženie času k maximálnej denzite reziduálnej funkcie – T max (čas, za ktorý bolus kontrastnej látky prejde z proximálnej veľkej artérie do mozgového tkanivá) na viac ako 6 s [50]. Je nutné zdôrazniť, že väčšina súčasných techník priamo nevyužíva algoritmy AI. Ich mínusom je citlivosť na šum, nutnosť ľudského vstupu pri kontrole kvality kriviek nasýtenia bolusu kontrastnej látky v arteriálnom a venóznom riečisku a aj pri potrebe oddiferencovania artefaktov od skutočného perfúzneho deficitu. Aktuálnym predmetom výskumu je preto vylepšenie alebo náhrada terajších perfúznych algoritmov [48]. Z už FDA schválených a CE (Conformité Européenne) označených softvérov využíva na posúdenie perfúzie AI, konkrétne konvolučné neurónové siete, Icobrain-CTP (Icometrix Leuven, Belgicko). Týmto softvérom odhadnuté objemy jadra a penumbry v štúdiách vykazovali silnú zhodu s výsledkami vyhodnotenými rádiológmi [15]. Autormi Kasasbeh et al. bola navrhnutá umelá neurónová sieť, ktorá je schopná presne predpovedať veľkosť jadra ischémie na základe dát z perfúzneho CT a vstupných klinických dát (pohlavie, vek, National Institutes of Health Stroke Scale (NIHSS), čas od vzniku príznakov po zobrazovacie vyšetrenie). Testovaná bola na vzorke 128 pacientov a priemerná absolútna chyba medzi objemom jadra predpovedaným neurónovou sieťou a objemom jadra zisteným z MR-DWI bola 13,8 ml [51]. Použitie algoritmov hlbokého učenia na efektívne určenie jadra a penumbry na perfúznych mapách a ich porovnanie s aktuálne používanými metódami skúmali vo svojej práci Bhurwani et al. Trénované techniky hlbokého učenia boli presnejšie a prekonali súčasné metódy [52]. Wouters et al. predstavili hlbokú neurónovú sieť, ktorá je schopná nielen lepšie predpovedať finálny objem infarktu z perfúzneho CT v porovnaní s klasickým spracovaním (porovnávané so softvérom RAPID), dokáže tiež predikovať finálny objem infarktu pri rôznych scenároch úspešnosti rekanalizácie a rôznom časovom intervale do rekanalizácie. Bežne používané softvéry dokážu predpovedať konečnú veľkosť infarktu len pri dosiahnutí kompletnej rekanalizície alebo naopak, v prípade absencie rekanalizácie. Vytvorená neurónová sieť dokonca generuje modely predpovedajúce rýchlosť rastu infarktu, tzv. „tkanivové hodiny“. Táto funkcia môže byť nápomocná napríklad pri rozhodovaní o potrebe opakovaného neurozobrazenia u pacientov transportovaných do centra EVL [47].
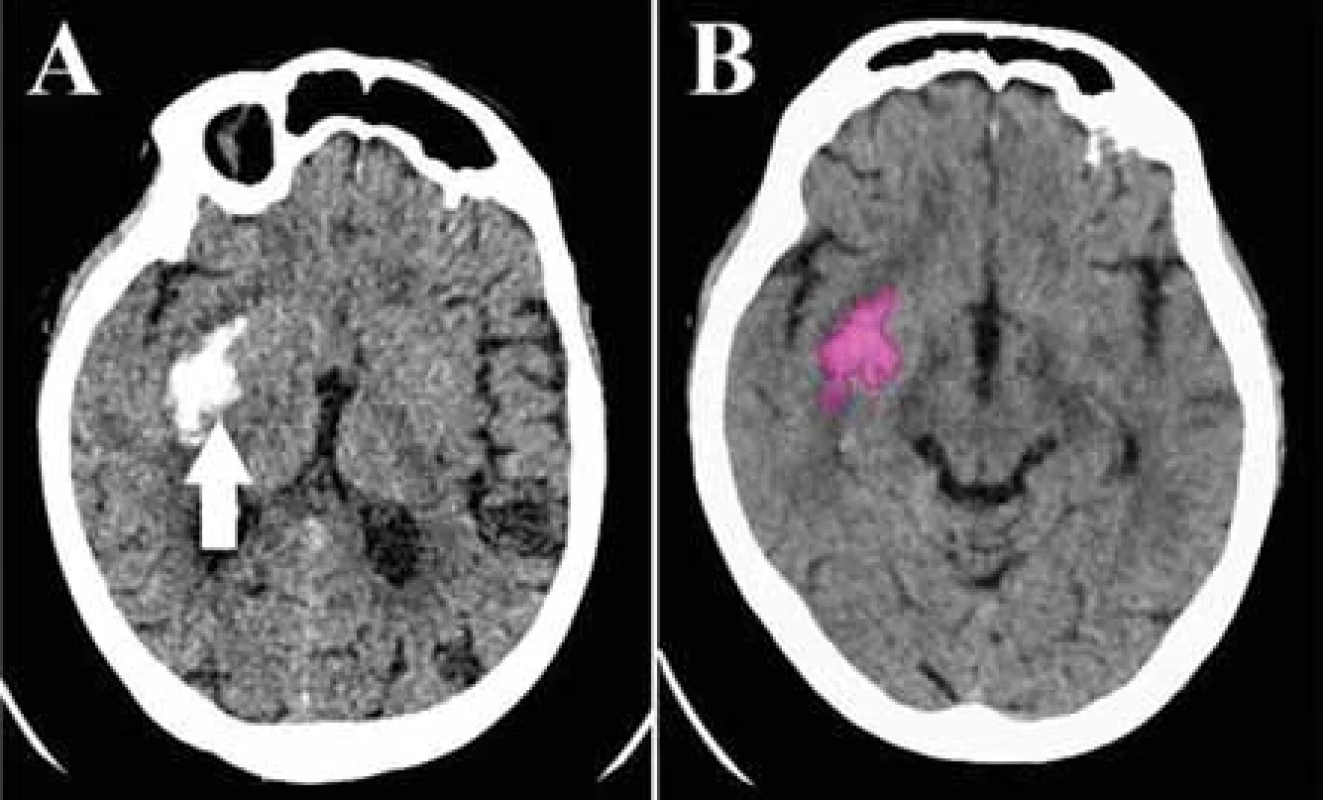
Hemorágia
U pacientov so suponovanou CMP je esenciálnou úlohou vstupne realizovaného natívneho vyšetrenia CT vylúčenie hemoragickej formy iktu pred podaním trombolytickej liečby. Aj v prípade prítomnosti intrakraniálnej hemorágie je jedným z dôležitých faktorov ovplyvňujúcich klinický výstup pacienta promptná interpretácia nálezu [53,54]. Na zefektívnenie diagnostického procesu boli vyvinuté softvéry schopné z natívneho vyšetrenia CT hemorágiu identifikovať (obr. 6), stanoviť jej objem a upozorniť na jej prítomnosť hodnotiaceho lekára [55]. Nedávne publikácie poukázali na ich technickú realizovateľnosť a priaznivý vplyv na reprioritizáciu pracovného zoznamu, rýchlosť vyhodnotenia nálezu a dĺžku nemocničného pobytu [56]. Vo viacerých súboroch bola zaznamenaná vysoká presnosť týchto algoritmov v detekcii hemorágie, s plochou pod krivkou (area under curve; AUC) dosahujúcou až 0,99, senzitivitou 98 % a špecificitou 99 % [54,57]. Ako príčinu falošnej negativity štúdie uvádzajú malý objem hemorágie (< 1,5 ml) a hemorágiu lokalizovanú v oblasti chronických patologických zmien (starší hematóm, area gliózy). Falošná pozitivita bola zaznamenaná v prípade kalcifikátov, meningeómu, hyperdenznej tumoróznej masy, koloidnej cysty, aneuryzmy, zhrubnutej dury, zobrazovacích artefaktov či v teréne postoperačných zmien [55,58,59]. Algoritmy dosahujú rozdielny level úspešnosti detekcie v závislosti od typu hemorágie – najvyššiu, 100% senzitivitu preukázali v prípade detekcie intraventrikulárnej hemorágie, za najťažšiu bola označená detekcia subarachnoidálneho, subdurálneho a epidurálneho krvácania [54,58]. Voter et al. pozorovali zníženú diagnostickú výkonnosť softvéru u pacientov len so solitárnym typom intrakraniálnej hemorágie pri porovnaní s výskytom viacerých typov hemorágie u jedného pacienta [59].
Budúcnosť umelej inteligencie
Význam AI v diagnostike CMP narastá. Za výzvy sú aktuálne považované najmä pokroky v oblasti kritického rozhodovania a výberu liečebnej stratégie pacientov. Žiaduce je napríklad vytvorenie algoritmu strojového učenia na identifikáciu pacientov, ktorí by viac profitovali z trombektómie pomocou stent-retrievera a tých, ktorí sú vhodnejšími kandidátmi na aspiráciu, prípadne algoritmu na rozpoznanie pacientov, ktorí majú po trombektómii vyššie riziko výskytu symptomatického intracerebrálneho krvácania. Hlavným cieľom aktuálnych perspektív AI je teda optimalizácia liečby – výber pacienta, predikcia výsledku a schopnosť selekcie ideálnej skupiny pacientov, ktorí by nielen vyhovovali inklúznym kritériám pre intervenčný výkon, ale mali by najmenší počet a závažnosť komplikácií [5]. Kredibilitu použitia produktov AI v klinickej praxi limituje fakt, že ich vedecké overenie je obmedzenejšie ako schválenie regulačnými orgánmi [13]. Do budúcna bude preto potrebné realizovať klinické štúdie na veľkých súboroch pre validáciu a porovnanie výkonu dostupných softvérových riešení, najmä s cieľom rozšíriť a zovšeobecniť kritériá pre výber liečby pacientov s CMP [8].
Záver
Techniky AI by mali byť v diagnostike CMP používané výlučne v súlade so schválením európskych a amerických orgánov, a teda len ako podporný nástroj pre kompetentných používateľov. Ich úlohou nie je rádiológa nahradiť, finálny verdikt o diagnóze je vždy rozhodnutím hodnotiaceho lekára [8,60]. Prínosné sú jednak kvôli rýchlemu spracovaniu veľkého množstva dát, zároveň však zvyšujú spoľahlivosť menej skúsených diagnostikov, čo je zvlášť nápomocné v menších, periférnych nemocniciach [26,36]. Zapojenie nástrojov AI do zobrazovacej diagnostiky CMP prináša obmedzenie variability medzi hodnotiacimi [15], zvýšenie efektivity, skrátenie času do liečby a redukciu chýb a pomáha tým zlepšiť kvalitu starostlivosti o pacienta [16]. Nevýhodou tohto konceptu je fakt, že vyhodnocovacie zručnosti rádiológa značne závisia od počtu vyhodnotených vyšetrení a presnosti vizuálnej analýzy obrazu. Výsledky niektorých štúdií naznačujú, že použitie softvéru AI pri interpretácii nálezu znižuje ostražitosť hodnotiaceho. Začínajúci rádiológ tak nemusí nadobudnúť adekvátne interpretačné schopnosti a hrozí mu „závislosť“ od AI [8,9].
Konflikt záujmov
Autori vyhlasujú, že nemajú žiadny potenciálny konflikt záujmov.
Zdroje
1. Soun JE, Chow DS, Nagamine M et al. Artificial intelligence and acute stroke imaging. AJNR Am J Neuroradiol 2021; 42 (1): 2–11. doi: 10.3174/ajnr.A6883.
2. Wafa HA, Wolfe CDA, Emmett E et al. Burden of stroke in Europe: thirty-year projections of incidence, prevalence, deaths, and disability-adjusted life years. Stroke 2020; 51 (8): 2418–2427. doi: 10.1161/STROKEAHA.120.029606.
3. Chen W, Wu J, Wei R et al. Improving the diagnosis of acute ischemic stroke on non-contrast CT using deep learning: a multicenter study. Insights Imaging 2022; 13 (1): 184. doi: 10.1186/s13244-022-01331-3.
4. Kundeti SR, Vaidyanathan MK, Shivashankar B et al. Systematic review protocol to assess artificial intelligence diagnostic accuracy performance in detecting acute ischaemic stroke and large-vessel occlusions on CT and MR medical imaging. BMJ Open 2021; 11 (3): e043665. doi: 10.1136/bmjopen-2020-043665.
5. Shlobin NA, Baig AA, Waqas M et al. Artificial intelligence for large-vessel occlusion stroke: a systematic review. World Neurosurg 2022; 159: 207–220.e1. doi: 10.1016/j.wneu.2021.12.004.
6. Yahav-Dovrat A, Saban M, Merhav G et al. Evaluation of artificial intelligence-powered identification of large-vessel occlusions in a comprehensive stroke center. AJNR Am J Neuroradiol 2021; 42 (2): 247–254. doi: 10.3174/ajnr.A6923.
7. Lotan E. Emerging artificial intelligence imaging applications for stroke interventions. AJNR Am J Neuroradiol 2021; 42 (2): 255–256. doi: 10.3174/ajnr.A6902.
8. Mokli Y, Pfaff J, Dos Santos DP et al. Computer-aided imaging analysis in acute ischemic stroke – background and clinical applications. Neurol Res Pract 2019; 1: 23. doi: 10.1186/s42466-019-0028-y.
9. European Society of Radiology (ESR). What the radiologist should know about artificial intelligence – an ESR white paper. Insights Imaging 2019; 10 (1): 44. doi: 10.1186/s13244-019-0738-2.
10. Moawad AW, Fuentes DT, ElBanan MG et al. Artificial intelligence in diagnostic radiology: where do we stand, challenges, and opportunities. J Comput Assist Tomogr 2022; 46 (1): 78–90. doi: 10.1097/RCT.0000000000001247.
11. Kasalak Ö, Alnahwi H, Toxopeus R et al. Work overload and diagnostic errors in radiology. Eur J Radiol 2023; 167: 111032. doi: 10.1016/j.ejrad.2023.111032.
12. Muehlematter UJ, Bluethgen C, Vokinger KN. FDA-cleared artificial intelligence and machine learning--based medical devices and their 510 (k) predicate networks. Lancet Digit Health 2023; 5 (9): e618–e626. doi: 10.1016/S2589-7500 (23) 00126-7.
13. Olthof AW, van Ooijen PMA, Rezazade Mehrizi MH. Promises of artificial intelligence in neuroradiology: a systematic technographic review. Neuroradiology 2020; 62 (10): 1265–1278. doi: 10.1007/s00234-020-02424-w.
14. Lee EJ, Kim YH, Kim N et al. Deep into the brain: artificial intelligence in stroke imaging. J Stroke 2017; 19 (3): 277–285. doi: 10.5853/jos.2017.02054.
15. Chandrabhatla AS, Kuo EA, Sokolowski JD et al. Artificial intelligence and machine learning in the diagnosis and management of stroke: a narrative review of United States food and drug administration-approved technologies. J Clin Med 2023; 12 (11): 3755. doi: 10.3390/jcm12113755.
16. Monsour R, Dutta M, Mohamed AZ et al. Neuroimaging in the era of artificial intelligence: current applications. Fed Pract 2022; 39 (Suppl 1): S14–S20. doi: 10.12788/fp.0231.
17. Zaharchuk G, Gong E, Wintermark M et al. Deep learning in neuroradiology. AJNR Am J Neuroradiol 2018; 39 (10): 1776–1784. doi: 10.3174/ajnr.A5543.
18. Lee JG, Jun S, Cho YW et al. Deep learning in medical imaging: general overview. Korean J Radiol 2017; 18 (4): 570–584. doi: 10.3348/kjr.2017.18.4.570.
19. Chartrand G, Cheng PM, Vorontsov E et al. Deep learning: a primer for radiologists. Radiographics 2017; 37 (7): 2113–2131. doi: 10.1148/rg.2017170077.
20. Mazurowski MA, Buda M, Saha A et al. Deep learning in radiology: an overview of the concepts and a survey of the state of the art with focus on MRI. J Magn Reson Imaging 2019; 49 (4): 939–954. doi: 10.1002/jmri.26534.
21. Zeleňák K, Krajina A, Meyer L et al. How to improve the management of acute ischemic stroke by modern technologies, artificial intelligence, and new treatment methods. Life (Basel) 2021; 11 (6): 488. doi: 10.3390/life11060488.
22. Singh NM, Harrod JB, Subramanian S et al. How machine learning is powering neuroimaging to improve brain health. Neuroinformatics 2022; 20 (4): 943–964. doi: 10.1007/s12021-022-09572-9.
23. Vagal A, Saba L. Artificial intelligence in „code stroke“ – a paradigm shift: do radiologists need to change their practice? Radiol Artif Intell 2022; 4 (2): e210204. doi: 10.1148/ryai.210204.
24. Murray NM, Unberath M, Hager GD et al. Artificial intelligence to diagnose ischemic stroke and identify large vessel occlusions: a systematic review. J Neurointerv Surg 2020; 12 (2): 156–164. doi: 10.1136/neurintsurg-2019-015135.
25. Elijovich L, Dornbos Iii D, Nickele C et al. Automated emergent large vessel occlusion detection by artificial intelligence improves stroke workflow in a hub and spoke stroke system of care. J Neurointerv Surg 2022; 14 (7): 704–708. doi: 10.1136/neurintsurg-2021-017714.
26. Seker F, Pfaff J, Nagel S et al. CT reconstruction levels affect automated and reader-based ASPECTS ratings in acute ischemic stroke. J Neuroimaging 2019; 29 (1): 62–64. doi: 10.1111/jon.12562.
27. Sundaram VK, Goldstein J, Wheelwright D et al. Automated ASPECTS in acute ischemic stroke: a comparative analysis with CT perfusion. AJNR Am J Neuroradiol 2019; 40 (12): 2033–2038. doi: 10.3174/ajnr.A6303.
28. Maegerlein C, Fischer J, Mönch S et al. Automated calculation of the Alberta stroke program early CT score: feasibility and reliability. Radiology 2019; 291 (1): 141–148. doi: 10.1148/radiol.2019181228.
29. Bendszus M, FIehler J, Subtil F et al. Endovascular thrombectomy for acute ischaemic stroke with established large infarct: multicentre, open-label, randomised trial. Lancet 2023; 402 (10414): 1753–1763. doi: 10.1016/S0140-6736 (23) 02032-9.
30. Kuang H, Najm M, Chakraborty D et al. Automated ASPECTS on noncontrast CT scans in patients with acute ischemic stroke using machine learning. AJNR Am J Neuroradiol 2019; 40 (1): 33–38. doi: 10.3174/ajnr.A5889.
31. Nagel S, Sinha D, Day D et al. e-ASPECTS software is non-inferior to neuroradiologists in applying the ASPECT score to computed tomography scans of acute ischemic stroke patients. Int J Stroke 2017; 12 (6): 615–622. doi: 10.1177/1747493016681020.
32. Li X, Zhen Y, Liu H et al. Automated ASPECTS in acute ischemic stroke: comparison of the overall scores and Hounsfield unit values of two software packages and radiologists with different levels of experience. Acta Radiol 2023; 64 (1): 328–335. doi: 10.1177/02841851221075789.
33. Goebel J, Stenzel E, Guberina N et al. Automated ASPECT rating: comparison between the Frontier ASPECT Score software and the Brainomix software. Neuroradiology 2018; 60 (12): 1267–1272. doi: 10.1007/s00234-018-2098-x.
34. Hoelter P, Muehlen I, Goelitz P et al. Automated ASPECT scoring in acute ischemic stroke: comparison of three software tools. Neuroradiology 2020; 62 (10): 1231–1238. doi: 10.1007/s00234-020-02439-3.
35. Neuberger U, Nagel S, Pfaff J et al. Impact of slice thickness on clinical utility of automated Alberta Stroke Program Early Computed Tomography Scores. Eur Radiol 2020; 30 (6): 3137–3145. doi: 10.1007/s00330-019-066 16-8.
36. Amukotuwa SA, Straka M, Smith H et al. Automated detection of intracranial large vessel occlusions on computed tomography angiography: a single center experience. Stroke 2019; 50 (10): 2790–2798. doi: 10.1161/STROKEAHA.119.026259.
37. Barreira C, Bouslama M, Lim J et al. E-108 Aladin study: automated large artery occlusion detection in stroke imaging study – a multicenter analysis. J Neurointervent Surg 2018; 10 (Suppl 2): A101.2–A102. doi: 10.1136/neurintsurg-2018-SNIS.184.
38. Chung CY, Rodrigues GM, Haussen DC et al. Abstract WP76: automated detection of hyperdense MCA sign and automated notification of large vessel occlusion using artificial intelligence. Stroke 2019; 50 (Suppl 1): AWP76. doi: 10.1161/str.50.suppl_1.WP76.
39. Takahashi N, Lee Y, Tsai DY et al. An automated detection method for the MCA dot sign of acute stroke in unenhanced CT. Radiol Phys Technol 2014; 7 (1): 79–88. doi: 10.1007/s12194-013-0234-1.
40. Olive-Gadea M, Crespo C, Granes C et al. Deep learning based software to identify large vessel occlusion on noncontrast computed tomography. Stroke 2020; 51 (10): 3133–3137. doi: 10.1161/STROKEAHA.120.030326.
41. Rodrigues G, Barreira CM, Bouslama M et al. Automated large artery occlusion detection in stroke: a single-center validation study of an artificial intelligence algorithm. Cerebrovasc Dis 2022; 51 (2): 259–264. doi: 10.1159/000519125.
42. Seker F, Pfaff JAR, Mokli Y et al. Diagnostic accuracy of automated occlusion detection in CT angiography using e-CTA. Int J Stroke 2022; 17 (1): 77–82. doi: 10.1177/1747493021992592.
43. Wolff L, Su J, Van Loon D et al. Inter-rater reliability for assessing intracranial collaterals in patients with acute ischemic stroke: comparing 29 raters and an artificial intelligence-based software. Neuroradiology 2022; 64 (12): 2277–2284. doi: 10.1007/s00234-022-02984-z.
44. Tan IY, Demchuk AM, Hopyan J et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct. AJNR Am J Neuroradiol 2009; 30 (3): 525–531. doi: 10.3174/ajnr.A1408.
45. Rava RA, Seymour SE, Snyder KV et al. Automated collateral flow assessment in patients with acute ischemic stroke using computed tomography with artificial intelligence algorithms. World Neurosurg 2021; 155: e748–e760. doi: 10.1016/j.wneu.2021.08.136.
46. Grunwald IQ, Kulikovski J, Reith W et al. Collateral automation for triage in stroke: evaluating automated scoring of collaterals in acute stroke on computed tomography scans. Cerebrovasc Dis 2019; 47 (5–6): 217–222. doi: 10.1159/000500076.
47. Jabal MS, Kallmes DF, Harston G et al. Automated CT angiography collateral scoring in anterior large vessel occlusion stroke: a multireader study. Interv Neuro- radiol 2023; 15910199221150470. doi: 10.1177/159101 99221150470.
48. Wouters A, Robben D, Christensen S et al. Prediction of stroke infarct growth rates by baseline perfusion imaging. Stroke 2022; 53 (2): 569–577. doi: 10.1161/STROKEAHA.121.034444.
49. Copen WA, Yoo AJ, Rost NS et al. In patients with suspected acute stroke, CT perfusion-based cerebral blood flow maps cannot substitute for DWI in measuring the ischemic core. PLoS One 2017; 12 (11): e0188891. doi: 10.1371/journal.pone.0188891.
50. Muehlen I, Borutta M, Siedler G et al. Prognostic accuracy of CTP summary maps in patients with large vessel occlusive stroke and poor revascularization after mechanical thrombectomy-comparison of three automated perfusion software applications. Tomography 2022; 8 (3): 1350–1362. doi: 10.3390/tomography8030109.
51. Kasasbeh AS, Christensen S, Parsons MW et al. Artificial neural network computer tomography perfusion prediction of ischemic core. Stroke 2019; 50 (6): 1578–1581. doi: 10.1161/STROKEAHA.118.022649.
52. Bhurwani MMS, Boutelier T, Davis A et al. Identification of infarct core and ischemic penumbra using computed tomography perfusion and deep learning. J Med Imaging (Bellingham) 2023; 10 (1): 014001. doi: 10.1117/1.JMI.10.1.014001.
53. Gibson E, Georgescu B, Ceccaldi P et al. Artificial intelligence with statistical confidence scores for detection of acute or subacute hemorrhage on noncontrast CT head scans. Radiol Artif Intell 2022; 4 (3): e210115. doi: 10.1148/ryai.210115.
54. Schmitt N, Mokli Y, Weyland CS et al. Automated detection and segmentation of intracranial hemorrhage suspect hyperdensities in non-contrast-enhanced CT scans of acute stroke patients. Eur Radiol 2022; 32 (4): 2246–2254. doi: 10.1007/s00330-021-08352-4.
55. Heit JJ, Coelho H, Lima FO et al. Automated cerebral hemorrhage detection using RAPID. AJNR Am J Neuroradiol 2021; 42 (2): 273–278. doi: 10.3174/ajnr.A6926.
56. Seyam M, Weikert T, Sauter A et al. Utilization of artificial intelligence-based intracranial hemorrhage detection on emergent noncontrast CT images in clinical workflow. Radiol Artif Intell 2022; 4 (2): e210168. doi: 10.1148/ryai.210168.
57. O‘Neill TJ, Xi Y, Stehel E et al. Active reprioritization of the reading worklist using artificial intelligence has a beneficial effect on the turnaround time for interpretation of head CT with intracranial hemorrhage. Radiol Artif Intell 2020; 3 (2): e200024. doi: 10.1148/ryai.2020200024.
58. McLouth J, Elstrott S, Chaibi Y et al. Validation of a deep learning tool in the detection of intracranial hemorrhage and large vessel occlusion. Front Neurol 2021; 12: 656112. doi: 10.3389/fneur.2021.656112.
59. Voter AF, Meram E, Garrett JW et al. Diagnostic accuracy and failure mode analysis of a deep learning algorithm for the detection of intracranial hemorrhage. J Am Coll Radiol 2021; 18 (8): 1143–1152. doi: 10.1016/ j.jacr.2021.03.005.
60. Mair G, White P, Bath PM et al. External validation of e-ASPECTS software for interpreting brain CT in stroke. Ann Neurol 2022; 92 (6): 943–957. doi: 10.1002/ana.26495.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2024 Číslo 1
Nejčtenější v tomto čísle
- Přehled difuzních gliomů dle klasifikace WHO 2021, 2. část – difuzní gliomy dětského typu
- Tonsilla cerebelli – anatomie, funkce a její význam pro neurochirurgii
- Využitie umelej inteligencie pri hodnotení obrazu CT u pacientov s CMP – aktuálne možnosti
- Standardizace využití MR v managementu roztroušené sklerózy 69 Konsenzus českého expertního radiologicko-neurologického panelu
