Použití dotazníků aktivit denního života u pacientů s Alzheimerovou nemocí
Questionnaires of Activities of Daily Living in Patients with Alzheimer Disease
The assessment of daily activities in patients with Alzheimer’s disease provides much valuable information. It may be used to distinguish between normal aging, mild cognitive impairment and dementia; to evaluate the efficacy of treatment effect or the progression of disease; for the assessment of the severity of the disease, and more. In a clinical setting, the use of structured questionnaires seems to be the best approach. To date, four scales have been translated into Czech (http://www.pcp.lf3.cuni.cz/adcentrum). The functional activities questionnaire (FAQ-CZ) is suitable for discriminating between normal aging and early dementia. The disability assessment for dementia (DAD-CZ) and the Bristol activities of daily living scale (BADLS-CZ) enable the assessment of daily activities in patients suffering from mild to severe degrees of dementia, as well the monitoring of disease progression and treatment effect. The Lawton IADL scale is widely used despite its numerous limitations, among them that it exists in several versions and its scoring can be ambiguous. We review the benefits of investigating activities of daily living and of questionnaires. We also outline certain practical recommendations tailored to suit our local conditions.
Key words:
Activities of daily living – ADL – Alzheimer’s disease – questionnaires –functional activities questionnaire –FAQ –disability assessment for dementia – DAD –Bristol activities of daily living scale – BADLS – practical recommendations – dementia
Autoři:
P. Martínek 1; A. Bartoš- 1 3
Působiště autorů:
AD Centrum
1; Psychiatrické centrum Praha
2; Univerzita Karlova v Praze, 3. LF a FN Královské Vinohrady, Neurologická klinika, Praha
3
Vyšlo v časopise:
Cesk Slov Neurol N 2011; 74/107(6): 632-640
Kategorie:
Přehledný referát
Souhrn
Hodnocení běžných aktivit pacientů s Alzheimerovou nemocí poskytuje důležité informace pro odlišení normálního stárnutí, mírné kognitivní poruchy a demence, posouzení účinku léčby nebo progrese onemocnění, pro posouzení tíže onemocnění a k dalším účelům. V klinické praxi je nejvhodnější metodou použití strukturovaného dotazníku. V českém prostředí jsou k dispozici čtyři nástroje (http://www.pcp.lf3.cuni.cz/adcentrum). Dotazník funkčního stavu FAQ-CZ je vhodný pro odlišení normálního stárnutí od časných stadií demence. Dotazník soběstačnosti DAD-CZ a Bristolská škála aktivit denního života BADLS-CZ slouží pro popis běžných činností v široké škále od mírné až po pokročilou demenci a hodí se pro monitorování progrese onemocnění a hodnocení účinku léčby. Lawtonova škála IADL je hojně používaná i přes svá četná omezení, mezi která patří nežádoucí modifikace a nejasnost v hodnocení. Přehled o přínosech zjišťování aktivit denního života a o dotaznících zakončujeme praktickým doporučením, jak vhodně používat dotazníky v našich podmínkách.
Klíčová slova:
Aktivity denního života – ADŽ – ADL – Alzheimerova nemoc – dotazníky – Dotazník funkčního stavu – FAQ – Dotazník soběstačnosti – DAD – Bristolská škála aktivit denního života – BADLS – doporučené postupy – demence
Úvod
Alzheimerova nemoc (AN) je v naší zemi nejčastější příčinou demence [1,2]. Prevalence AN u lidí nad 85 let je 20–30 % [1]. S pokračujícím stárnutím populace tedy Alzheimerova nemoc postihuje stále více lidí. Demence nebývají dostatečně diagnostikovány. Odhaduje se, že u 50–70 % pacientů není demence rozpoznána. Proto se v této souvislosti hovoří o „tiché epidemii“ [3]. Pokud demence není včas diagnostikována a léčena, mívá to závažné následky pro pacienta, jeho rodinu i pro společnost [4].
Hlavní příznaky demence lze názorně shrnout do takzvaného ABC konceptu: Activities of daily living – problémy s vykonáváním běžných činností (aktivit denního života, ADŽ, ADL), Behavioral symptoms – narušené chování, Cognition – zhoršení kognitivních funkcí (paměť, počítání, řeč, praxie...) [1,3]. Na pomezí mezi kognitivně zdravým stárnutím a demencí stojí mírná kognitivní porucha (MKP, Mild Cognitive Impairment, MCI). Výše jmenované příznaky jsou při ní méně výrazné. Mírná kognitivní porucha může progredovat do AN nebo jiných typů demence [2,6].
Aktivity denního života se dělí na tzv. instrumentální aktivity (iADŽ, instrumental ADL, iADL), kam patří například nakupování, používání telefonu, vaření, uklízení, užívání léků, cestování apod., a na základní aktivity (zADŽ, basic ADL, bADL), jako například jedení nebo oblékání. U pacientů s AN jsou iADŽ postiženy dříve a více, zatímco zADŽ zůstávají zachovány poměrně dlouho [7]. Standardním způsobem v ambulantní praxi je hodnocení pomocí strukturovaných dotazníků, které vyplňuje blízká osoba pacienta (pečovatel). Méně často je dotazník vyplňován hodnotitelem po rozhovoru s pečovatelem. Vyplnění dotazníku ADŽ samotným pacientem je omezeno skutečností, že lidé s demencí poměrně brzy v průběhu onemocnění ztrácejí náhled na svá omezení [8].
Hodnocení ADŽ může poskytovat odborníkům pečujícím o pacienty s demencí cenné informace, např. o tom, zda je přítomna demence, případně o její tíži či o odpovědi pacienta na léčbu. Přesto mu není dosud věnována dostatečná pozornost. V našem AD Centru se zabýváme ADŽ několik let [9–14]. V tomto přehledu podáváme ucelený obraz této tematiky. Nejdříve uvádíme, jak je možné využít informace o ADŽ pacientů v praxi. Zároveň představujeme na základě vlastních zkušeností dotazníky ADŽ, které jsou v České republice k dispozici. Teoretické i vlastní poznatky shrnujeme do praktických doporučení na závěr.
Přínosy hodnocení aktivit denního života
1. Rozlišení normálního stárnutí, mírné kognitivní poruchy a demence
K podpoře diagnóz a k rozlišení mezi normálním stárnutím, MKP a demencí lze použít hodnocení ADŽ. Podle obecně přijímaného názoru mají pacienti s MKP normální ADŽ, zatímco u pacientů s demencí jsou narušené [2]. Při bližším pohledu na MKP se však podle některých prací ukazuje, že pacienti i s MKP mají potíže s vykonáváním některých instrumentálních ADŽ [15]. Ke zhoršení běžných aktivit dostačuje zřejmě postižení jediné kognitivní domény [16]. Bylo prokázáno, že ADŽ jsou postiženy již více než dva roky před nástupem AN [17]. Dodnes se však v literatuře uvádí, že ADŽ u pacientů s MKP jsou v zásadě neporušené („esentially normal“) [6], což může být zavádějící. Velký význam má citlivost nástroje, který je ke zjištění použit. Nebylo jednoznačně stanoveno, jaký stupeň postižení ADŽ odděluje MKP od demence. Nová kritéria pro diagnózu MKP [18] zahrnují mírné problémy s komplexnějšími ADŽ, které začnou vykonávat pomalu, méně efektivně a s více chybami než dříve. Pacienti s MKP by si však podle těchto kritérií měli uchovat nezávislost v každodenním fungování s minimální asistencí druhých nebo pomůcek. Pro rozlišení normálního stárnutí, MKP a demence byly pro některé dotazníky stanoveny hraniční hodnoty, o čemž se zmíníme později. Hodnocení ADŽ také napoví odhad rizika progrese MKP do demence [19].
Pro vytipování pacientů s demencí či MKP lze mimo samotné ADŽ použít dotazník složený z položek týkajících se ADŽ i jiných oblastí (např. kognitivních funkcí). Příkladem takového kombinovaného přístupu je AD8 [20]. Dotazník AD8 je určen pro prvozáchyt demence.
2. Určování stupně demence
Stanovení ADŽ by mohlo být užitečné pro určování stupně postižení demencí. Podobně jako kognitivní funkce se i ADŽ plynule zhoršují s postupem onemocnění. Zhoršování iADŽ je na počátku nemoci rychlejší než v jejím dalším průběhu. Problémy se zADŽ mají pomalou, lineární progresi [21]. Nástup postižení jednotlivých aktivit je podle některých studií do určité míry zákonitý, a v ADŽ tedy existuje hierarchie (obr. 1a–c, 2) [9,22]. Ve prospěch použití ADŽ pro určení stupně postižení hovoří i to, že se jedná o aspekt důležitý pro pečovatele, s velkým významem pro jeho vlastní (a také pacientovu) kvalitu života.
![Obr. 1a. Nejvíce zachované aktivity pacientů s Alzheimerovou nemocí podle pečovatelů.
V levé části obrázku je hodnocení více kognitivně postižených pacientů (MMSE 0–17, tmavší barvou), v pravé části obrázku je hodnocení pacientů s lehčím kognitivním postižením (MMSE 18–25, světlejší barvou). V každé podskupině odpovídalo vždy 12 pečovatelů. Dolní měřítko ukazuje počet pečovatelů v každé podskupině, kteří označili položku jako nejvíce zachovanou. Celkový počet pečovatelů, kteří označili příslušnou aktivitu, je vždy uveden v pravé části pruhu. Převzato z [9].](https://pl-master.mdcdn.cz/media/image/7eb786663fa2a6c42fcd704bdd7c2742.jpeg?version=1537790321)


![Hierarchie ztráty schopností plnit jednotlivé aktivity denního života. Aktivity postavené výše podléhají postižení dříve než aktivity pod nimi. Modifikováno dle [21].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/9e255b463c25ed3e169dd2248c6affb7.jpeg)
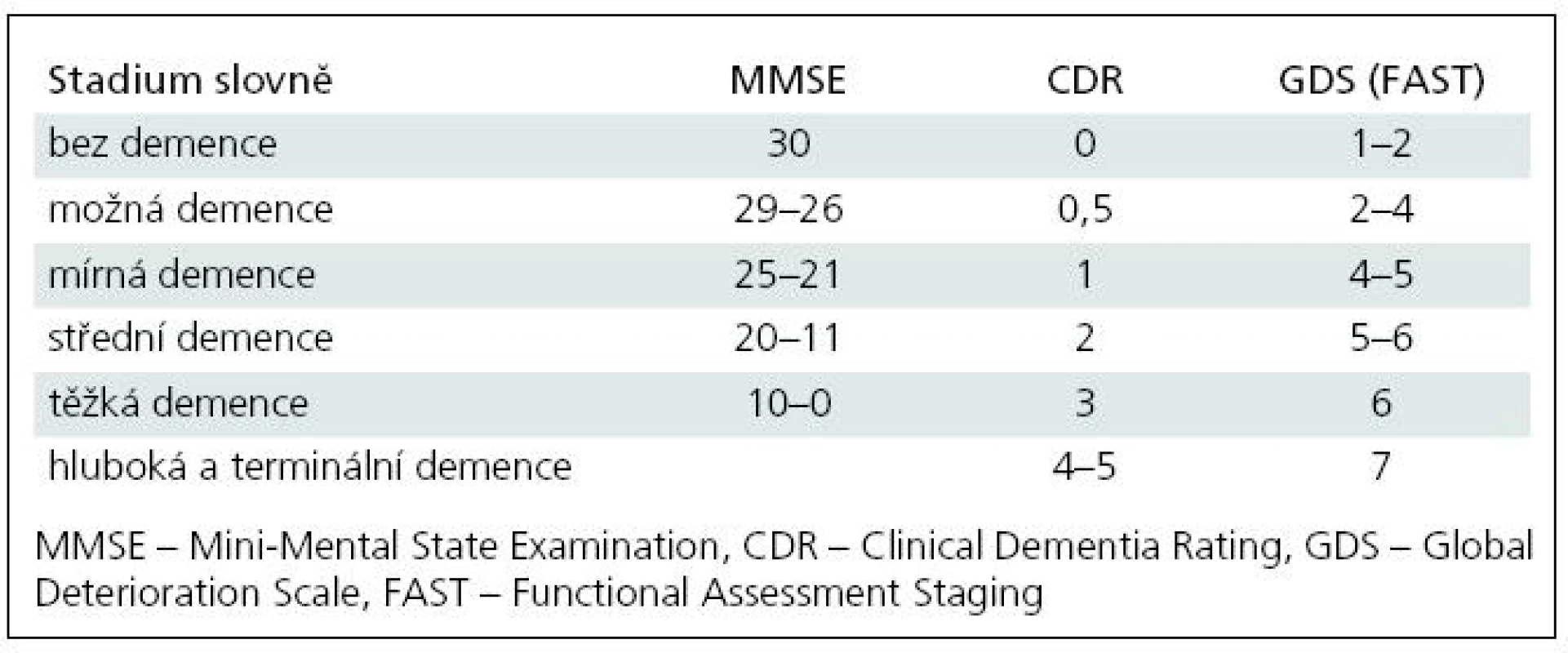
V České republice a většinou ani v zahraničí [43] se zatím k posuzování demence podle stupně postižení nepoužívá jednotná metodika. V zahraničí se používá Clinical Dementia Rating (CDR) [23], který je často standardem ve vědeckých pracích. Hodnotí šest oblastí (paměť, úsudek a řešení problémů, sociální záležitosti, domácnost a koníčky, sebeobsluhu). Jeho výstupem je škála od 0 (bez postižení) přes 0,5 do 3, resp. do 5 [24]. Jiným klasifikačním systémem je sedmistupňová škála Global Deterioration Scale (GDS) [25]. Z GDS vychází Functional Assessment Staging (FAST) [26], který má prakticky stejné stupně jako GDS. Stupně 6 a 7 se však dále dělí [24]. FAST je z velké části založen na ADŽ. Žádný z těchto nástrojů není ale široce používán v českém prostředí. Místo toho se orientačně používá ke stanovení stupně demence kognitivní test Mini-Mental State Examination (MMSE) [27]. Důvodem je především snadnost jeho administrace a vazba preskripce kognitiv na skór MMSE [28], takže je tato informace dostupná prakticky vždy. Skór MMSE může nabývat hodnot od 0 do 30, přičemž vyšší skór znamená lepší kognitivní schopnosti. Pro orientační převod mezi různými nástroji používanými k určování stupně demence uvádíme tab. 1, která vychází z práce o převodu mezi MMSE a CDR [29] a z práce o převodu mezi CDR a GDS [30]. Jemnější stupňování demence na větší škále od 0 do 100 bodů lze dosáhnout podle jiného kognitivního testu dostupného v ČR, a to Addenbrookského kognitivního testu (ACE) [31,32]. Určování míry demence podle ACE se použilo při studiu afázie a deliria u pacientů s demencemi a ikty [33,34].
Pro pečovatele jsou ADŽ důležitější než samotné kognitivní postižení. Zároveň jsme si však vědomi toho, že není možné posoudit celkovou tíži demence jen podle jediného aspektu (například pouze podle úrovně kognitivních funkcí nebo pouze dle ADŽ). Aby bylo možné získat kompletní obraz o celkové tíži demence, měl by být zhodnocen každý důležitý aspekt postižení [35]. Hodnocení ADŽ je k posouzení tíže demence zřejmě vhodnější než MMSE. Ještě lepší však jsou komplexní nástroje zahrnující více aspektů. Jejich problémem však bývá časová náročnost (např. CDR) nebo variabilita profilu pacienta s AN ne vždy respektující předdefinované hranice (např. GDS).
3. Diferenciální diagnostika
Přes značnou variabilitu v ADŽ u pacientů trpících stejným onemocněním existují významné rozdíly v porušení ADŽ pacientů s různými demencemi. Například u behaviorální formy frontotemporální demence jsou na rozdíl od AN již od začátku znatelně omezeny nejen instrumentální, ale také základní aktivity. U primární progresivní afázie je mnoho aktivit zachováno po léta, některé jsou časně ovlivněny afázií [36,37]. Pacienti s vaskulární demencí mají významně vyšší omezení v ADŽ než pacienti s AN [38].
4. Posouzení účinku léčby
Léčba AN v ČR je výhradně závislá na kognitivních schopnostech podle MMSE [28]. Přitom účinek léčby a rychlost progrese onemocnění se dá posuzovat podle změn v ADŽ. Pro pečovatele má toto měřítko větší význam než samotné kognitivní funkce. V dnešní době je sledování ADŽ závaznou součástí řady postupů pro klinické studie léků proti demenci [39]. Podle agentury EMEA (The European Medicines Agency) značí stabilizace ADŽ odpověď na léčbu, zejména v kontextu jinak progresivní nemoci [40]. Různí autoři shodně uvádějí, že hodnocení ADŽ blízkými pacienta jsou důležitým prvkem v hodnocení odpovědi na léčbu, a to i přesto, že vnímání pečovatele může být zkresleno jeho vlastními potřebami [41].
5. Posouzení zátěže pečovatele
Lidé pečující o pacienty s AN jsou vystaveni velké zátěži, která do značné míry souvisí s ADŽ pacienta. Jedná se zejména o potíže s dopravou, problémy s orientací a schopností zacházet s financemi [42]. V našem vlastním dotazníkovém průzkumu měli pečovatelé označit aktivity pacienta, jejichž postižení je nejvíce obtěžuje. Podle této studie pečovatele nejvíce obtěžuje časová dezorientace jejich pacientů, narušení komunikace a nerozhodnost pacientů, kterou činnost dělat. Nejvíce obtěžující aktivity se ne vždy kryly s těmi, jež byly podle pečovatelů postiženy u pacientů nejvíce (orientace v čase, starání se o finance) (obr. 1b, c) [9]. Přínos hodnocení ADŽ spočívá v možnosti odhadnout riziko pro zátěž pečovatele. Pokud pečovatel potřebuje pomoc, lze mu nabídnout služby specializovaných center. Jejich seznam je na stránkách České alzheimerovské společnosti www.alzheimer.cz, nebo při našem AD Centru existuje Poradna pro pečovatele (více na www.pcp.lf3.cuni.cz/adcentrum).
6. Další přínosy
Podle zákona o sociálních službách má pacient v ČR nárok na příspěvek na péči podle stupně postižení běžných aktivit podle zákona 108/2006 Sb. o sociálních službách [1]. Pro hodnocení existuje speciální dlouhá škála, která je uvedena ve vyhlášce 505/2006 nebo v dotazníkovém provedení jinde [14].
Při vyplňování dotazníku může pečovatel získat cennou reflexi a vidět, že existují oblasti, které pacient zvládá a ve kterých oblastech je jeho pomoc nezbytná. Opakovaně jsme zažili, že po předchozí návštěvě, jejíž součástí bylo vyplnění dotazníku ADŽ, se při další návštěvě pečovatelé sami vraceli k hodnocení pacientových ADŽ. Od předchozího vyšetření o pacientových schopnostech přemýšleli a teprve přitom si uvědomili, které položky posoudili nepřesně a jak je tomu ve skutečnosti.
Dotazníky k hodnocení běžných aktivit
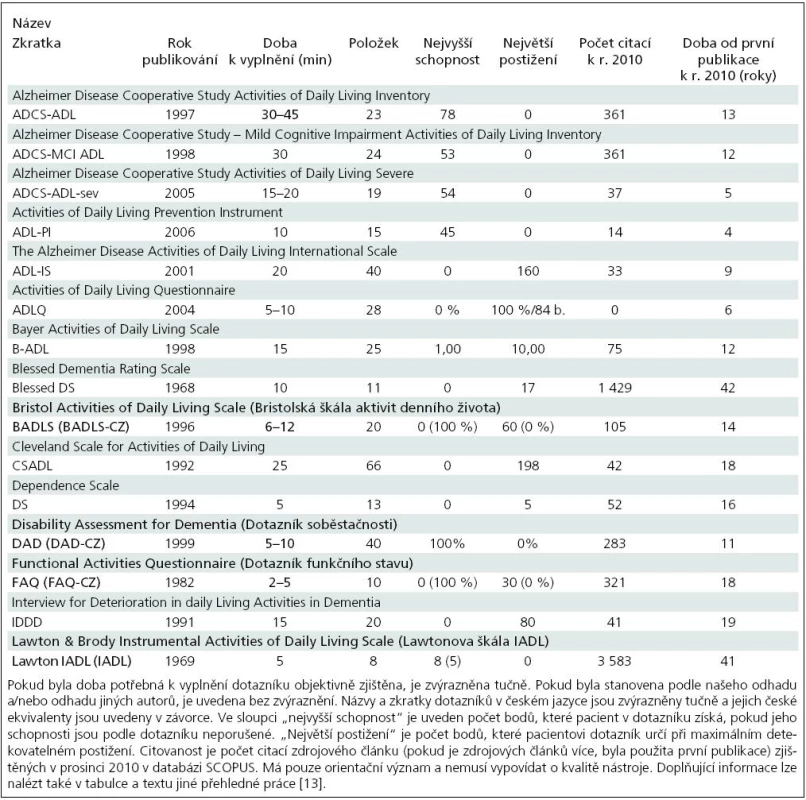
Přehled dotazníků ADŽ pro pacienty s AN přinášíme v tab. 2. Dotazníky a informace o nich byly vyhledány na základě přehledových článků [43–45] a sborníku škál [46]. Použili jsme i původní články k dotazníkům a vyhledávání v databázích. Některé vlastnosti dotazníků jsou uvedeny v tab. 2. Obecné zásady pro výběr vhodného dotazníku stejně jako odkazy na zdrojové články jednotlivých dotazníků jsou uvedeny v jiné práci [13].
V češtině jsou k dispozici pouze čtyři dotazníky ADŽ k hodnocení soběstačnosti pacientů s kognitivní poruchou či demencí. Jedná se o Dotazník funkčního stavu FAQ-CZ [4,10], Dotazník soběstačnosti DAD-CZ [11], Bristolskou škálu aktivit denního života BADLS-CZ [12] a o Lawtonovu škálu IADL [47]. Lawtonova škála IADL je jednou z nejstarších a částečně i proto jednou z nejcitovanějších prací v oblasti (tab. 2). Doznala velkého rozšíření a používá se i dnes, kdy existuje již množství nástrojů vyšší kvality. Jejím největším problémem je množství modifikací. Například originální škála má odlišné verze pro muže a ženy. Praxe pak inklinovala ke vzniku jedné verze pro obě pohlaví. Tato modifikace však vedla k závislosti modifikované škály na pohlaví. Zvláštní systém bodování byl zdrojem pro inovaci k praktičtějšímu skórování, což znamená nejen nežádoucí odchýlení od originálu, ale také složitost v přenositelnosti výsledků. Citlivost nástroje ke změně je rovněž malá [13]. Lawtonovu škálu IADL nepovažujeme za vhodnou pro pacienty s demencí. Další informace o ní lze nalézt v jiných pracích [47,48]. Dva ze zmiňovaných dotazníků (DAD-CZ a BADLS-CZ) mají při srovnání s dalšími podobnými instrumenty relativně kvalitnější psychometrické vlastnosti [43]. Dotazníky FAQ, DAD a BADLS jsme přeložili, vyzkoušeli v našem AD Centru a přibližujeme je dále v textu. Jsou zdarma k dispozici v přehledné grafické podobě ve zdrojových publikacích nebo na stránkách AD Centra (www.pcp.lf3.cuni.cz/adcentrum). Jejich použití pro různá stadia demence vystihuje obr. 3.
![Vhodnost použití jednotlivých dotazníků při různých stupních kognitivního postižení. Podle vlastních zkušeností s dotazníky [14].
MMSE – Mini-Mental State Examination, FAQ-CZ – Dotazník funkčního stavu, DAD-CZ – Dotazník soběstačnosti, BADLS-CZ – Bristolská škála aktivit denního života](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/366f32c52b1f59f12f02039cd8925e85.jpeg)
Dotazník funkčního stavu (FAQ-CZ)
Dotazník funkčního stavu je velmi krátký dotazník, jehož vyplnění trvá zpravidla 2–5 minut. Deset položek je v FAQ-CZ hodnoceno na čtyřbodové stupnici od 0 (vykonává správně) do 3 (je zcela závislý). Pokud pacient aktivitu nikdy nevykonával, ale byl by toho podle pečovatele nyní schopen, dostává pacient 0 bodů. Pokud by měl nyní potíže, je aktivita hodnocena 1 bodem. Tyto dvě poslední podmínky často nejsou v zahraničních verzích dotazníku FAQ dodržovány. Nepředpokládáme však, že tato skutečnost působí závažné rozdíly ve výsledcích. Maximální skóre FAQ je 30 bodů, což odpovídá nejvyššímu postižení. V české verzi jsme zavedli také hodnocení podle procentuálního zachování soběstačnosti [1,10]. Dotazník byl zařazen ke zjišťování funkčního stavu osob v projektu Dny paměti [49].
Dotazník je určen pro odlišení normálního stárnutí od demence. Validizační studie s dotazníkem FAQ-CZ na vzorku českých seniorů zjistila, že za ještě normální lze považovat při sebeposouzení 4 a méně bodů, při objektivním hodnocení pečovatelem 3 a méně bodů [50]. Při hraničním skóre 7/8 (kdy hodnota 8 již značí demenci) má 94% senzitivitu a 84% specificitu, pozitivní prediktivní hodnota je 50 % [51]. Rozlišení mezi MKP a mírnou AN určuje hraniční skóre 5/6 (kdy hodnota 6 již značí mírnou demenci) při 80% senzitivitě a 87% specificitě [52]. Protože obsahuje pouze iADŽ a hodnotí hlavně aktivity, které jsou postiženy již brzy v průběhu onemocnění, jeho použití je vhodné ve stadiu MKP a časné demence. S prohlubováním tíže demence počet bodů v dotazníku rychle stoupá k maximu. Přibližně ve středním stadiu postižení demencí je dosaženo maximálních hodnot, tj. nulového procenta uchování soběstačnosti, tedy podlahového efektu (obr. 3).
Pečovatelé dotazník většinou hodnotí jako velmi dobrý. Cení si ho pro jeho krátkost, jednoduchost a přehlednost [10,14]. Navíc jde o nástroj, který je poměrně rozšířený i v zahraničí. Jeho nevýhodou je sdružování více položek do jedné. Pečovatelé také mají někdy problém zařadit vykonávání aktivit do jednoho ze čtyř stupňů.
Dotazník soběstačnosti (DAD-CZ)
Dotazník byl vyvinut speciálně pro pacienty s AN. Jeho vyplnění trvá přibližně 5–10 minut. DAD-CZ je složen ze 40 otázek týkajících se zADŽ a iADŽ. V původní verzi hodnotitel pokládá tyto otázky pečovateli. V české verzi jsme se z praktických důvodů přiklonili k vyplnění pečovatelem a tomu jsme uzpůsobili i grafickou podobu dotazníkového formuláře [1,11,14]. Pečovatel je tázán, zda pacient během posledních dvou týdnů vykonal danou aktivitu bez pomoci a bez připomenutí alespoň jednou (1 bod) nebo nikoli (0 bodů). Míra soběstačnosti se pak vyjadřuje v procentech, vyšší hodnoty značí vyšší soběstačnost. Dotazník umožňuje pečovateli vybrat možnost „nelze určit“, přičemž se takto hodnocená aktivita nezapočítává do celkového procentuálního hodnocení. Každou z aktivit lze zařadit do jedné ze tří skupin – iniciace, plánování a organizace, provedení. V české verzi jsme toto rozdělení nakonec nevyznačili ve prospěch větší přehlednosti. Nepřipadalo nám to důležité pro rutinní použití v klinické praxi. V pokročilejších stadiích onemocnění demencí dosahují někteří pacienti nulového skóre, proto škála není dobře použitelná v těžkých stadiích demence (obr. 3) [14].
Určitou slabinou DAD-CZ je podmínka, že pečovatel má odpovědět „ano“ i tehdy, pokud pacient aktivitu provedl za poslední dva týdny bez pomoci či připomenutí pouze jednou. Tuto podmínku někteří pečovatelé kritizují. Domníváme se, že ji velká část pečovatelů při vyplňování nerespektuje, což může vést ke zkreslení výsledků. Dodržování této podmínky je v původní verzi zajištěno jejím opakováním při ústním dotazu na každou ze 40 aktivit. Převedením do formy vyplňované pečovatelem mohou tedy vznikat nepřesnosti. Všimli jsme si, že závažnější je jiný problém. Někteří pečovatelé volí často odpověď „nelze určit“ (v našem dotazníku „X“). Při diskuzi nad dotazníkem se však ukáže, že nepochopili významový rozdíl mezi odpovědí „ne“ a „nelze určit“. Domníváme se, že při ústním podání k tomuto zkreslení nedochází. Proto je tomu třeba čelit a u dotazníků s velkým počtem odpovědí „X“ si po vyplnění ujasnit tyto odpovědi s pečovatelem a event. je přehodnotit. Slovní administrace je však samozřejmě možná (otázka pak zní u každé ze 40 aktivit: „Během posledních 14 dnů udělal/a <jméno posuzovaného> bez pomoci či připomenutí <konkrétní aktivita>?“).
V porovnání s jinými dotazníky ADŽ v češtině je DAD-CZ o něco složitější na vyhodnocování míry soběstačnosti. U pacienta se musí nejdříve zjistit maximální možný počet bodů odečtením položek „X“ („nelze určit“) od počtu položek dotazníku (40). Celkový počet odpovědí „ano“, tedy bodů, které posuzovaný získal, se pak tímto výsledkem (maximálním možným počtem bodů) dělí a výsledek se násobí stem. Výstupem dotazníku je tedy přímo procentuální soběstačnost posuzovaného. Nelze však používat pomocné tabulky převádějící body na procentuální soběstačnost jako u dalších dvou dotazníků FAQ-CZ a BADLS-CZ [11,12].
Původní DAD má dobrou validitu a reliabilitu a je citlivý ke změně v ADŽ v průběhu 12 měsíců [43,53]. Je v zahraničí velmi rozšířený a používá se v mnoha lékových studiích. Není však vhodný pro pacienty s velmi časnými ani velmi pozdními stadii demence (obr. 3) [14].
Bristolská škála aktivit denního života (BADLS-CZ)
Dotazník BADLS-CZ je odlišný od obou předchozích tím, že nabízí pro hodnocení každé z 20 aktivit čtyři konkrétní odpovědi specifické pro danou aktivitu, hodnocené od 0 do 3 bodů. Vyšší skóre značí vyšší postižení, maximum je 60. V české verzi je tabulka pro přepočet na procenta zachování aktivit. Dotazník obsahuje devět zADŽ, sedm iADŽ a čtyři aktivity, které lze s výhradami zařadit rovněž do iADŽ. Nástroj nabízí také možnost odpovědět „nelze určit“ hodnocenou 0 body. V české verzi je pečovatel vybídnut, aby v případě výběru této možnosti uvedl důvod takového hodnocení. To by podle našeho názoru mělo omezit používání odpovědi „nelze určit“ a poskytnout hodnotícímu doplňující informace [12].
Autoři původní škály BADLS si dali záležet na metodickém postupu při její tvorbě. Dotazník byl tvořen v úzké spolupráci s pečovateli. Postup při tvorbě BADLS je zajímavý a je popsán ve zdrojovém článku [54]. Protože konkrétní formy vykonávání dané aktivity obsažené v dotazníku byly skutečně popsány pečovateli, má dotazník již sám o sobě velkou informační hodnotu.
Škála byla vyvinuta pro pacienty s mírným až těžkým postižením demencí (obr. 3) a je široce užívána. Není ale dostatečně citlivá na detekci jemných změn na počátku onemocnění. Proto se její autoři zabývali tvorbou revidované škály BADLS-R, která by tento nedostatek odstranila. Ta však nakonec publikována nebyla.
Dotazník BADLS je dostatečně citlivý ke změně, a proto vhodný pro měření účinnosti léčby [40]. Podle našich zkušeností se hodí i pro těžká stadia demence (obr. 3) a pečovatelé jej hodnotí ze všech tří dotazníků nejlépe, ačkoli je poněkud delší (vyplňování zabere asi 6–12 minut) [12]. Pečovatelé si ho cení zejména pro šíři, kterou zabírá problematiku pacientových aktivit, a také pro jednoznačnost a výstižnost položek v dotazníku.
Výhody a úskalí používání dotazníků
Někdy může vzniknout dojem, že použití dotazníků ADŽ je zbytečné či nežádoucí, protože rozhovor o pacientových aktivitách je stejně výtěžný a je přirozenější. Obáváme se však, že k podrobnější analýze aktivit pacientů většinou nedochází. Dotazníky tedy mohou přinést spíše zlepšení. Pomocí dotazníků lze ADŽ dobře dokumentovat a kvantifikovat. Navíc uspoří čas lékaře. Před kognitivním vyšetřováním dáme pečovateli za úkol vyplnit vhodný dotazník. Po testování nám ho pečovatel vrátí a podle dotazníku může následovat diskuze nad určitými tématy. Získáme tak komplexní zhodnocení jak po stránce kognitivní, tak po stránce ADŽ. Dotazníky poskytují ještě další nezanedbatelnou výhodu. Někdy není možné odděleně vyšetřovat pacienta a vést dialog s pečovatelem. Písemnou formou se dají zjistit ADŽ a zároveň se vyhneme delikátní diskuzi před pacientem. Dále lze podle ADŽ sledovat progresi onemocnění. V neposlední řadě toto ne zcela obvyklé a mírně nadstandardní zjišťování ADŽ nad rámec povinného MMSE můžeme vykazovat zdravotní pojišťovně (pro neurologii speciální vyšetřovací metody, kód 29111).
Zjišťování ADŽ by mělo být samozřejmou součástí klinického vyšetření pacienta s kognitivní poruchou nebo demencí. Podle doporučených postupů EFNS (European Federation of Neurological Societies) se mají zjišťovat ADŽ u všech pacientů s kognitivními poruchami. Na tento fakt se vztahuje nejvyšší stupeň podloženosti v kontextu medicíny založené na důkazech. Anamnéza by měla být vždy doplněna pečovatelem a u všech pacientů by měly být hodnoceny ADŽ, neboť jejich narušení, tedy nesoběstačnost pacientů, je jedním ze základních kritérií pro stanovení syndromu demence. Podle odborného konsenzu je pro hodnocení vhodná řada dostupných strukturovaných dotazníků. Hodnoceny by měly být jak základní ADL (koupání, hygiena, oblékání), tak zejména v časných stadiích narušené instrumentální ADL (nakupování, zacházení s financemi atd.). Z 12 škál byly jako nejpřínosnější hodnoceny DAD a BADLS. Hodnocení ADŽ je rovněž součástí škály Clinical Dementia Rating (CDR), která se používá pro stanovení tíže demence [55,56].
Při eventuálním vyplňování dotazníku samotným pacientem je třeba počítat se ztrátou náhledu (anozognózií) [8]. Přibližně do stadia GDS 3 (tab. 1) samotní pacienti udávají větší potíže s ADŽ než jejich pečovatelé, od tohoto stupně je tomu již obráceně. Pacienti s velmi mírným kognitivním postižením a zachovalým náhledem jsou zřejmě schopni postižení ADŽ posoudit citlivěji než pečovatelé. V klinické praxi tedy posouzení vlastních ADŽ u pacientů s mírným kognitivním postižením může být validní a užitečné. V mírnějších stadiích onemocnění je výhodná kombinace posouzení ADŽ od pacienta i pečovatele současně s použitím kognitivní škály [39].
Otázka validity dat získaných od pečovatelů je složitější a je o ní pojednáno jinde [14]. Ačkoli informace o pacientově stavu od pečovatele mohou být ovlivněny zátěží pečovatele, jeho osobností nebo potřebami, jsou ADŽ zřejmě poměrně objektivní proměnnou [14]. Důležité však je, aby použitý dotazník byl kvalitní a nepřipouštěl dvojí výklad otázek, nesdružoval více položek do jedné otázky a aby nabízel konkrétní odpovědi.
Asi polovina pečovatelů ambulantních pacientů s AN jsou partneři pacientů, kteří jsou zpravidla také v seniorském věku [14]. Proto se může samozřejmě stát, že i oni trpí kognitivním deficitem a lékař obdrží zkreslené informace. S touto možností je také třeba počítat a případně se pokusit ověřit i pečovatelovy kognitivní schopnosti.
Praktická doporučení pro hodnocení aktivit denního života pacientů s kognitivními poruchami a demencemi, zejména Alzheimerovou nemocí, v klinické praxi
Kromě posouzení kognitivních funkcí bychom u pacientů s kognitivní poruchou či demencí měli ve vybraných případech zjišťovat i úroveň ADŽ. Pokud má pacient normální výsledek v testu MMSE, může sám dotyčný vyplnit dotazník FAQ-CZ. Podle literárních údajů lze v tomto stadiu tímto způsobem věrně zachytit postižení ADŽ. Pokud MMSE odkryje postižení kognitivních funkcí, je potřeba získat informace o ADŽ od osoby doprovázející posuzovaného. Podmínkou je dobrá znalost doprovázející osoby o tom, jak si posuzovaný vede v běžném životě.
Pro pacienty s mírnými stadii AN je vhodný FAQ-CZ, pro ostatní pacienty BADLS-CZ nebo DAD-CZ podle preference pracoviště. Pro pacienty v nejtěžších stadiích nemoci se hodí pouze BADLS-CZ. Všechny tyto dotazníky je možné zdarma stáhnout na jednom místě, a to na stránkách AD Centra (www.pcp.lf3.cuni.cz/adcentrum, sekce Testy a dotazníky). Vyšetření ADŽ u pacienta s kognitivní poruchou lze řadit mezi speciální neurologické vyšetřovací metody (kód pojišťovny 29111). Zvolený dotazník ADŽ by měl při příští návštěvě ambulance být použit, když je k tomu nějaký důvod (podklady pro přiznání příspěvku na péči, zhodnocení efektu léčby apod.). Dotazník může pečovatel vyplnit v čekárně před vyšetřením nebo během kognitivního vyšetřování pacienta. Za jeden čas tak zjistíme kognitivní funkce pacienta i úroveň jeho soběstačnosti.
Vyplněný dotazník může být odrazovým můstkem pro rozhovor s pečovatelem o pacientovi. Lékař by se měl pečovatele zeptat, zda mu problémy vyjmenované dotazníkem nepůsobí nadměrnou zátěž, a případně mu nabídnout intervenci. Pacient i pečovatel by rovněž měli být poučeni o možnosti získat příspěvek na péči o pacienta. Dobrým podkladem bývá právě míra závislosti na pomoci druhé osoby podle ADŽ zjištěných některým z dotazníků.
doc. MUDr. Aleš Bartoš, Ph.D.
AD Centrum, Psychiatrické centrum Praha
Ústavní 91
181 03 Praha 8-Bohnice
e-mail: bartos@pcp.lf3.cuni.cz
Přijato k recenzi: 26. 4. 2011
Přijato do tisku: 1. 8. 2011
Zdroje
1. Bartoš A, Hasalíková M. Poznejte demenci správně a včas – příručka pro klinickou praxi. 1st ed. Praha: Mladá fronta 2010.
2. Rektorová I. Neurodegenerativní demence. Cesk Slov Neurol N 2009; 72/104(2): 97–109.
3. Topinková E. Zlepšení diagnózy demence v primární péči – role mezioborové spolupráce. Psychiat pro praxi 2001; 2(2): 78–83.
4. Topinková E. Jak správně a včas diagnostikovat demenci. Manuál pro klinickou praxi. Praha: UCB Pharma 1999.
5. Čechová L, Bartoš A, Doležil D, Řípová D. Alzheimerova nemoc a mírná kognitivní porucha: diagnostika a léčba. Neurologie pro praxi, 2011, 12(3): 175–180.
6. Petersen RC, Roberts RO, Knopman DS, Boeve BF, Geda YE, Ivnik RJ et al. Mild cognitive impairment: ten years later. Arch Neurol 2009; 66(12): 1447–1455.
7. Barberger-Gateau P, Fabrigoule C, Amieva H, Helmer C, Dartigues JF. The disablement process: a conceptual framework for dementia-associated disability. Dement Geriatr Cogn Disord 2002; 13(2): 60–66.
8. Aalten P, van Valen E, Clare L, Kenny G, Verhey F. Awareness in dementia: a review of clinical correlates. Aging Ment Health 2005; 9(5): 414–422.
9. Martínek P, Bartoš A. Aktivity denního života pacientů s Alzheimerovou nemocí očima jejich pečovatelů. Čes Ger Rev 2008; 6(3): 186–192.
10. Bartoš A, Martínek P, Bezdíček O, Buček A, Řípová D. Dotazník funkčního stavu FAQ-CZ – česká verze pro zhodnocení každodenních aktivit pacientů s Alzheimerovou nemocí. Psychiat pro praxi 2008; 9(1): 31–34.
11. Bartoš A, Martínek P, Buček A, Řípová D. Dotazník soběstačnosti DAD-CZ – česká verze pro hodnocení každodenních aktivit pacientů s Alzheimerovou nemocí. Neurol pro praxi 2009; 10(5): 320–323.
12. Bartoš A, Martínek P, Řípová D. Dotazník Bristolská škála aktivit denního života BADLS-CZ pro hodnocení pacientů s demencí. Cesk Slov Neurol N 2010; 73/106(6): 673–677.
13. Martínek P, Bartoš A. Dotazníky k hodnocení běžných činností u pacientů s Alzheimerovou nemocí. Psychiatrie 2010; 14(4): 175–180.
14. Martínek P. Stanovení běžných aktivit pacientů s Alzheimerovou nemocí v klinické praxi. Diplomová práce. Praha: UK 3. LF 2010.
15. Farias ST, Mungas D, Reed BR, Harvey D, Cahn--Weiner D, Decarli C. MCI is associated with deficits in everyday functioning. Alzheimer Dis Assoc Disord 2006; 20(4): 217–223.
16. Perneczky R, Pohl C, Sorg C, Hartmann J, Tosic N, Grimmer T et al. Impairment of activities of daily living requiring memory or complex reasoning as part of the MCI syndrome. Int J Geriatr Psychiatry 2006; 21(2): 158–162.
17. Amieva H, Le Goff M, Millet X, Orgogozo JM, Pérès K, Barberger-Gateau P et al. Prodromal Alzheimer‘s disease: successive emergence of the clinical symptoms. Ann Neurol 2008; 64(5): 492–498.
18. Albert MS, Dekosky ST, Dickson D, Dubois B, Feldman HH, Fox NC et al. The diagnosis of mild cognitive impairment due to Alzheimer‘s disease: recommendations from the National Institute on Aging-Alzheimer‘s Association workgroups on diagnostic guidelines for Alzheimer‘s disease. Alzheimers Dement 2011; 7(3): 270–279.
19. Tabert MH, Albert SM, Borukhova-Milov L, Camacho Y et al. Functional deficits in patients with mild cognitive impairment: prediction of AD. Neurology 2002; 58(5): 758–764.
20. Galvin JE, Roe CM, Powlishta KK, Coats MA, Muich SJ, Grant E et al. The AD8: a brief informant interview to detect dementia. Neurology 2005; 65(4): 559–564.
21. Stern Y, Albert SM, Sano M, Richards M, Miller L, Folstein M et al. Assessing patient dependence in Alzheimer‘s disease. J Gerontol 1994; 49(5): M216–M222.
22. Galasko D. An integrated approach to the management of Alzheimer‘s disease: Assessing cognition, function and behaviour. Eur J Neurol 1998; 5 (Suppl 4): S9–S17.
23. Berg L. Clinical dementia rating. Psychopharmacol Bull 1988; 24(4): 637–639.
24. McKeith IG, Cummings JL, Lovestone S, Harvey R, Wilkinson DP. Outcome measures in Alzheimer’s disease. London: Martin Dunitz 1999.
25. Reisberg B, Ferris SH, de Leon MJ, Crook T. The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry 1982; 139(9): 1136–1139.
26. Reisberg B. Functional Assessment Staging (FAST). Psychopharmacol Bull 1988; 24(4): 653–659.
27. Folstein MF, Folstein SE, McHugh PR. „Mini-Mental State“. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12(3): 189–198.
28. Sheardová K, Hort J, Rusina R, Bartoš A, Línek V, Ressner P, Rektorová I. Doporučené postupy pro léčbu Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2007; 70/103(5): 589–594.
29. Perneczky R, Wagenpfeil S, Komossa K, Grimmer T, Diehl J, Kurz A. Mapping scores onto stages: mini-mental state examination and clinical dementia rating. Am J Geriatr Psychiatry 2006; 14(2): 139–144.
30. Choi SH, Lee BH, Kim S, Hahm DS, Jeong JH, Yoon SJ et al. Interchanging scores between clinical dementia rating scale and global deterioration scale. Alzheimer Dis Assoc Disord 2003; 17(2): 98–105.
31. Hummelová-Fanfrdlová Z, Rektorová I, Sheardová K,Bartoš A, Línek V, Ressner P et al. Česká adaptace Addenbrookského kognitivního testu (Addenbrooke´s Cognitive Examination). Československá psychologie 2009, 4 : 376–388.
32. Bartoš A, Raisová M, Kopeček M. Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ). Cesk Slov Neurol N 2011; 74/107(6): 681–684.
33. Bartoš A. Zjevná afázie není přítomna ani ve středním stadiu Alzheimerovy nemoci. Cesk Slov Neurol N 2010; 73/106(3): 254–257.
34. Košťálová M, Bednařík J, Skutilová S, Mitášová A, Bártková E, Šajgalíková K et al. Afázie a její vztah k tíži kognitivního deficitu u demence. Cesk Slov Neurol N 2010; 73/106(3): 258–266
35. Teunisse S, Derix MM, van Crevel H. Assessing the severity of dementia. Patient and caregiver. Arch Neurol 1991; 48(3): 274–277.
36. Wicklund AH, Johnson N, Rademaker A, Weitner BB, Weintraub S. Profiles of decline in activities of daily living in non-Alzheimer dementia. Alzheimer Dis Assoc Disord 2007; 21(1): 8–13.
37. Mioshi E, Kipps CM, Dawson K, Mitchell J, Graham A, Hodges JR. Activities of daily living in frontotemporal dementia and Alzheimer disease. Neurology 2007; 68(24): 2077–2084.
38. Gure TR, Kabeto MU, Plassman BL, Piette JD, Langa KM. Differences in functional impairment across subtypes of dementia. J Gerontol A Biol Sci Med Sci 2010; 65(4): 434–441.
39. Lehfeld H, Erzigkeit H. Beeinträchtigungen der Alltags-aktivitäten (ADL) und der kognitiven Leistungsfähigkeit in unterschiedlichen Demenzstadien: Ein Vergleich von ADL-Fremdbeurteilungen, ADL-Selbsteinschätzungen und einem psychometrischen Leistungstest. Fortschritte der Neurologie – Psychiatrie 2000; 68(6): 262–269.
40. Bucks RS, Haworth J. Bristol Activities of Daily Living Scale: a critical evaluation. Expert Rev Neurother 2002; 2(5): 669–676.
41. Rabins PV. The caregiver‘s role in Alzheimer‘s disease. Dement Geriatr Cogn Disord 1998; 9 (Suppl 3): 25–28.
42. Razani J, Kakos B, Orieta-Barbalace C, Wong JT, Casas R, Lu P et al. Predicting caregiver burden from daily functional abilities of patients with mild dementia. J Am Geriatr Soc 2007; 55(9): 1415–1420.
43. Sikkes SA, de Lange-de Klerk ES, Pijnenburg YA, Scheltens P, Uitdehaag BM. A systematic review of Instrumental Activities of Daily Living scales in dementia: room for improvement. J Neurol Neurosurg Psychiatry 2009; 80(1): 7–12.
44. Demers L, Oremus M, Perrault A, Champoux N, Wolfson C. Review of outcome measurement instruments in Alzheimer‘s disease drug trials: psychometric properties of functional and quality of life scales. J Geriatr Psychiatry Neurol 2000; 13(4): 170–180.
45. Lindeboom R, Vermeulen M, Holman R, De Haan RJ. Activities of daily living instruments:optimizing scales for neurologic assessments. Neurology 2003; 60(5): 738–742.
46. Burns A, Lawlor B, Craig S. Assessment Scales in Old Age Psychiatry. 2nd ed. London: Martin Dunitz 2004.
47. Kalvach Z. Hodnocení soběstačnosti a výkonnosti. In: Kalvach Z et al (eds). Geriatrie a gerontologie. Praha: Grada Publishing 2004.
48. Sheardová K. Mírná kognitivní porucha v praxi. Psychiat pro praxi 2010; 11(2): 62–65.
49. Mátlová M, Holmerová I, Bartoš A. Dny paměti – jak na včasnou diagnózu Alzheimerovy choroby. Čes Ger Rev 2009; 7(3–4): 157–160.
50. Bezdíček O, Lukavský J, Preiss M. Validizační studie české verze dotazníku FAQ. Cesk Slov Neurol N 2011; 74/107(1): 36–42.
51. Juva K, Mäkelä M, Erkinjuntti T, Sulkava R, Ylikoski R, Valvanne J et al. Functional assessment scales in detecting dementia. Age Ageing 1997; 26(5): 393–400.
52. Teng E, Becker BW, Woo E, Knopman DS, Cummings JL, Lu PH. Utility of the Functional Activities Questionnaire for Distinguishing Mild Cognitive Impairment From Very Mild Alzheimer Disease. Alzheimer Dis Assoc Disord. In press 2010.
53. Feldman H, Sauter A, Donald A, Gélinas I, Gauthier S, Torfs K et al. The disability assessment for dementia scale: a 12-month study of functional ability in mild to moderate severity Alzheimer disease. Alzheimer Dis Assoc Disord 2001; 15(2): 89–95.
54. Bucks RS, Ashworth DL, Wilcock GK, Siegfried K. Assessment of activities of daily living in dementia: development of the Bristol Activities of Daily Living Scale. Age Ageing 1996; 25(2): 113–120.
55. Ressner P, Hort J, Rektorová I, Bartoš A, Rusina R, Línek V, Sheardová K. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2008; 71/104(4): 494–501.
56. Hort J, O‘Brien JT, Gainotti G, Pirttila T, Popescu BO, Rektorova I et al. EFNS guidelines for the diagnosis and management of Alzheimer‘s disease. Eur J Neurol 2010; 17(10): 1236–1248.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2011 Číslo 6
Nejčtenější v tomto čísle
- Miller Fisherův syndrom – čtyři vlastní pozorování a přehled současných poznatků
- Současný pohled na patofyziologii migrény
- Operační léčba poranění plexus brachialis
- Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ)
