Disekce všech čtyř přívodných mozkových tepen v terénu fibromuskulární dysplazie – kazuistika
Autoři:
J. Waishaupt 1; R. Herzig 1; D. Krajíčková 1; A. Krajina 2; V. Chovanec 2; L. Klzo 2; J. Žižka 2; M. Abuhajar 2; M. Vališ 1
Působiště autorů:
Komplexní cerebrovaskulární centrum, Neurologická klinika LF UK a FN Hradec Králové
1; Komplexní cerebrovaskulární centrum, Radiologická klinika LF UK a FN Hradec Králové
2
Vyšlo v časopise:
Cesk Slov Neurol N 2017; 80/113(4): 470-473
Kategorie:
Kazuistika
doi:
https://doi.org/10.14735/amcsnn2017csnn.eu2
Souhrn
Popisujeme raritní případ ženy, u které došlo mezi roky 2005 a 2015 k disekci obou karotických i obou vertebrálních tepen (poprvé ve věku 32 let). S výjimkou pravé vnitřní karotidy, která byla léčena pomocí angioplastiky a stentingu, se jednalo o okluzivní disekci. Navzdory tomu nedošlo u pacientky k rozvoji žádné cerebrální léze a neurologický deficit zůstal omezen na levostranný Hornerův syndrom v důsledku poškození krčního sympatiku. Digitální subtrakční angiografie zobrazila střídající se úseky zúžení a aneuryzmatického rozšíření tepen, tedy změny typické pro fibromuskulární dysplazii. U pacientky nebylo prokázáno postižení ani renálního, ani koronárního řečiště. Kazuistika dobře demonstruje širokou variabilitu klinické manifestace disekce krčních tepen.
Klíčová slova:
disekce – karotická tepna – vertebrální tepna – diagnostika – léčba – fibromuskulární dysplazie
Úvod
Disekce magistrálních mozkových tepen je častá příčina cerebrální ischemie u mladší populace (až 25 % ve věku < 45 let) [1,2]. Oproti obvykle zvažované traumatické etiologii převažuje spontánní vznik (60 %) [3], často v terénu fibromuskulární dysplazie (FMD). Roční incidence je 3– 5/ 100 000 [1,2]. Předpokládá se však, že onemocnění je poddiagnostikováno v důsledku velmi variabilního průběhu, kdy vedle případů s maligně probíhajícím mozkovým infarktem může být postižení tepny asymptomatické.
Popisujeme raritní případ ženy, u které došlo mezi roky 2005 a 2015 k disekci obou karotických i obou vertebrálních tepen.
Kazuistika
U pacientky došlo v roce 2005 (ve 32 letech věku) k rozvoji intenzivní retroaurikulární bolesti vpravo s nespecifickým pocitem nestability v prostoru a přechodnou dysfagií. Anamnesticky obtížím předcházela mobilizační léčba pro cervikokraniální syndrom, k rozvoji neurologických symptomů došlo s dvoudenním odstupem. Pomocí magneticko-rezonační angiografie (MRA) byla prokázána disekce pravé a. vertebralis (AV) s okluzí expandujícím trombem. Nebylo detekováno ischemické postižení mozkové tkáně, objektivní neurologický nález byl normální. Nemocná byla zajištěna antikoagulační terapií – Fraxiparine (Aspen, Notre Dame de Bondeville, Francie) 0,6 ml à 12 hod subkutánně, s odstupem 2 týdnů byla na 2 měsíce převedena na Warfarin (Orion Corporation, Espoo, Finsko) 7,5 mg/ den. Při plánované kontrole po 2 měsících byla na MRA patrna částečná rekanalizace tepny.
V dubnu 2006 byla u pacientky pro anamnézu měsíc trvající bolesti levé poloviny šíje s propagací do hlavy a přechodný pocit zalehnutí levého ucha opakována MRA s průkazem okluze levé AV v rozsahu od C2 po foramen magnum s kvalitním kolaterálním oběhem (intrakraniální toky byly normální).
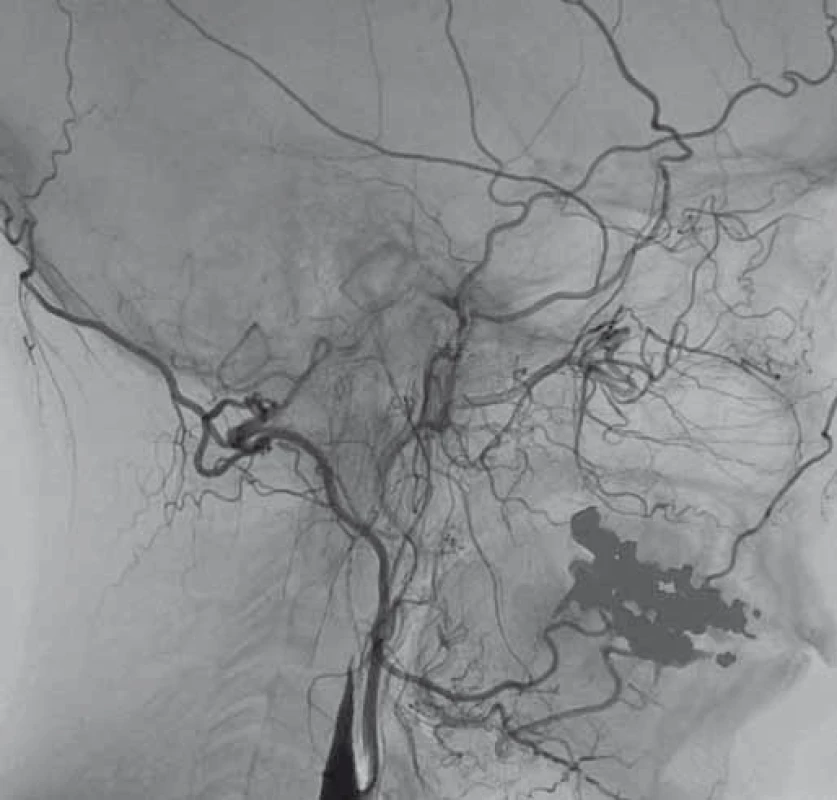
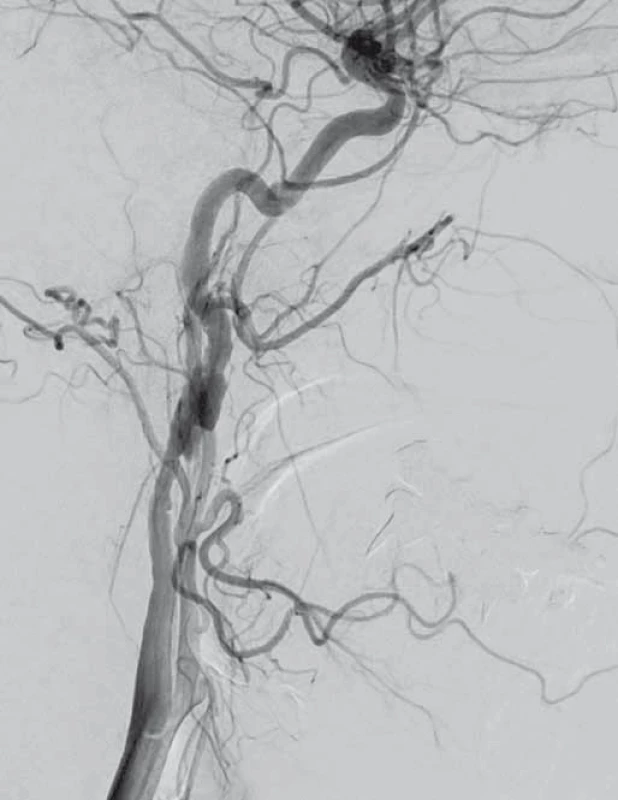
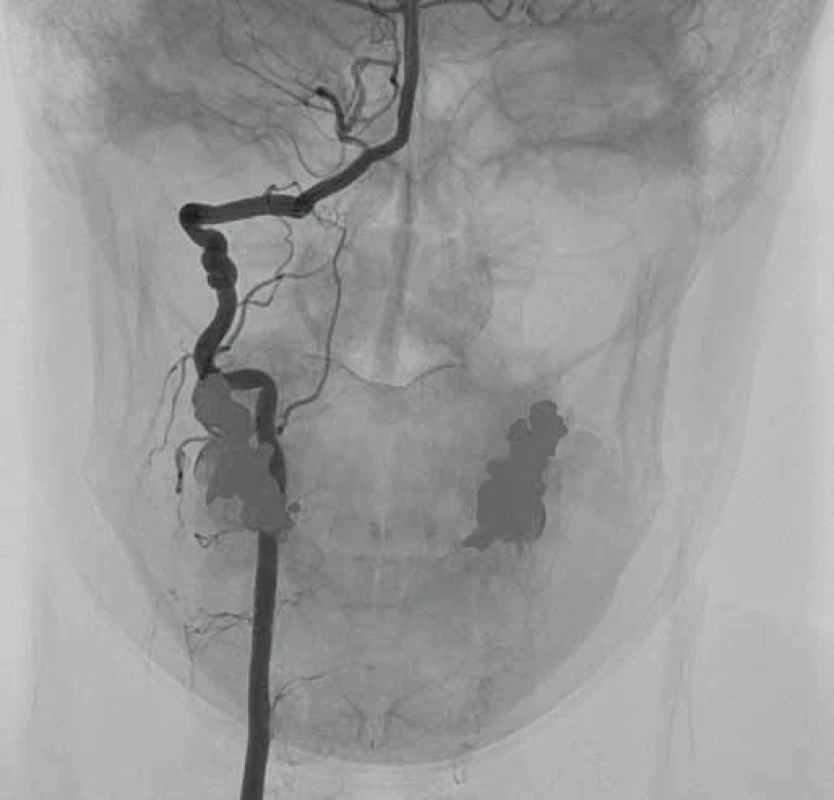
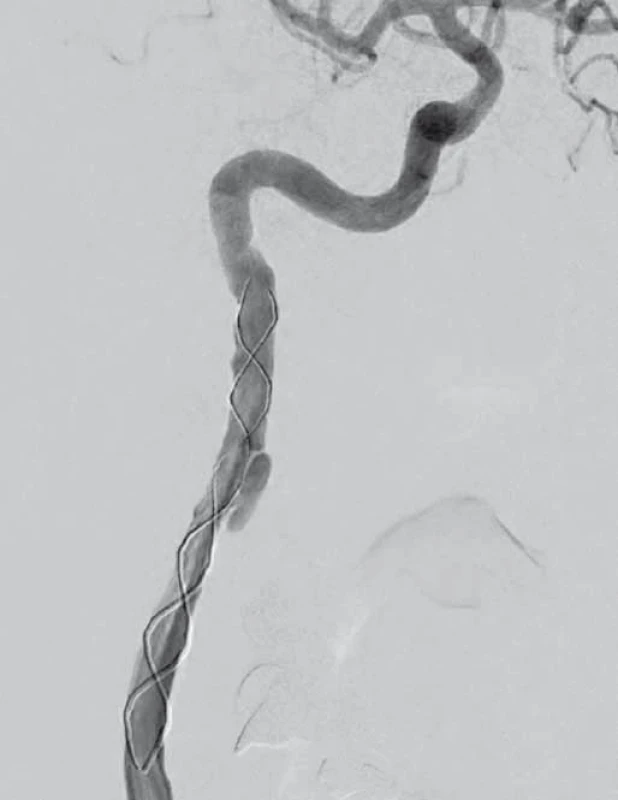
V dubnu 2015 byla pacientka v noci probuzena silnou bolestí v levé dolní čelisti, povšimla si nově pokleslého levého horního víčka. V objektivním nálezu byl patrný Hornerův syndrom vlevo, při výpočetně-tomografické angiografii (CTA) byla nově prokázána disekce levé a. carotis interna (ACI) s její okluzí. Nemocná byla zajištěna duální antiagregační terapií – Godasal (PRO.MED.CS Praha a.s., Praha, Česká republika) 100 mg/ den a Trombex (Sanofi Winthrop Industrie S.A., Ambarés, Francie) 75 mg/ den – a nízkomolekulárním heparinem v preventivní dávce (Fraxiparine 0,4 ml 1× denně). Digitální subtrakční angiografie (DSA) o 2 dny později potvrdila okluzi levé ACI (obr. 1) a počínající disekci pravé ACI (obr. 2). Byly přítomny známky FMD – střídající se úseky aneuryzmatického rozšíření a zúžení na všech přívodných mozkových tepnách (obr. 3). Následující den byla při kontrolní MRA zjištěna 80% stenóza pravé ACI, která byla týž den urgentně ošetřena metodou perkutánní transluminální angioplastiky a stentingem (PTAS) se zavedením stentu Leo 5,5 × 50 mm (Balt, Montmorency, Francie) (obr. 4). Po celou dobu hospitalizace byla nemocná bez příznaků cerebrální léze, která nebyla prokázána ani pomocí magnetické rezonance (MR). Při propuštění přetrvávalo postižení krčního sympatiku vlevo. V terapii byla ponechána duální protidestičková léčba v rámci obvyklé prevence trombotické komplikace po zavedení stentu. Skríningové vyšetření renálních a koronárních tepen FMD mimo mozkové řečiště neprokázalo.
Diskuze
Při disekci tepny dochází k natrhnutí její intimy s intramurálním krvácením a následným vytvořením koagula v cévní stěně. Případná ischemie zásobeného orgánu vzniká buď hemodynamickým mechanizmem při významné stenóze či okluzi postižené přívodné tepny nebo, častěji, distální embolizací trombu [4]. Patogeneze disekce není ve většině případů známa; obvyklé je dělení na spontánní a traumatickou etiologii, zvažována jsou především rizika chiropraktických zákroků. Přestože i naše pacientka podstoupila mobilizaci krční páteře před postižením pravé AV, mechanické poranění se anamnesticky i histologicky prokáže jen v menšině případů [2,5]. Problematická je i definice mechanického inzultu. Akceptovat lze jistě souvislost s úrazem krční páteře, ale naopak častou asociaci disekce s předcházejícím infektem [6] není možné vysvětlit jen přetížením cévní stěny během kašle nebo kýchnutí. Taková zátěž je běžnou součástí života a céva zdravého člověka ji musí bez následků snést. Etiopatogeneze je tak komplexnější a zahrnuje preexistující postižení cévy např. při arteritidě nebo hyperhomocysteinemii (na rozdíl od aterosklerózy byla souvislost vyššího výskytu disekce s hyperhomocysteinemií při mutaci genu pro metylen tetrahydrofolát reduktázu (MTHFR) prokázána [7]), významnější je ale vrozený či získaný defekt pojivové tkáně (např. Ehlers-Danlosův syndrom nebo FMD, která byla zjištěna i v případě naší pacientky).
Diagnostika disekce tepxny nečiní obvykle obtíže, pokud dojde k rozvoji symptomatické cerebrální ischemie. V případě karotického postižení se nejčastěji jedná o kontralaterální hemiparézu a/ nebo hemihypestezii či dysfázii. Amaurosis fugax je možná, ale méně častá. Podrobné vyšetření mozkové tkáně a tepenného zásobení je rutinní součást iktového skríningu.
Situace je složitější, pokud disekce k rozvoji symptomatické cerebrální ischemie nevede. Typické, bohužel zcela nespecifické, jsou bolesti šíje s propagací do čelisti nebo záhlaví, při postižení karotické tepny event. provázené ipsilaterálním Hornerovým syndromem. Disekce vertebrální tepny má ještě méně specifické projevy. Bolesti v záhlaví někdy dokonale imitují cervikokraniální syndrom, případné vertiginózní obtíže při mikroembolizaci do přívodných mozečkových tepen z obrazu uvedené benigní příčiny nutně vybočovat nemusí. Vodítkem bývá chudý lokální nález, tzn. absence krčního ústřelu. Při pochybnostech je indikováno neuroradiologické vyšetření, suverénní diagnostickou metodou je DSA, ta ale není pro svou invazivitu a nákladnost vhodná jako metoda první volby. Nejméně invazivní metoda je ultrazvuk (UZ), který má v případě postižení karotidy vysokou senzitivitu (75– 95 %) [8], méně specifický obraz má při okluzi tepny nebo distální lokalizaci disekce. Vyšší senzitivitu i specifitu má CTA, která je dobře dostupná, nevýhodou je radiační zátěž zvláště s přihlédnutím k faktu, že suspekce na disekci se týká mladších pacientů. Jako optimální se tak při podezření na disekci tepny jeví provedení MRA, která je sice nákladnější, ale jinak spojuje výhody ostatních diagnostických metod – je téměř neinvazivní, dostatečně citlivá i specifická, zobrazí i intrakraniální řečiště a nemocného nevystavuje radiační zátěži. Není však možné důsledně vyšetřovat všechny pacienty, kteří denně přicházejí do ambulance s bolestmi krční páteře nebo různými vágními stesky. Neexistuje bohužel žádný algoritmus, který by umožnil snadnou a rychlou selekci pacientů, u nichž je oprávněná indikace k provedení nákladné nebo zatěžující radiodiagnostiky. Nezbytná je tak zkušenost vyšetřujícího. V případě naší pacientky byla okluzivní disekce pravé AV diagnostikována metodou MRA, dobře patrná byla i při kontrolním UZ vyšetření. Chronický uzávěr levé AV byl zjištěn rovněž metodou MRA, UZ vyšetření provedené o 2 dny dříve bylo falešně negativní. Disekce levé ACI byla zjištěna metodou CTA, postižení pravé ACI bylo zřejmé až při DSA provedené o 2 dny později; v tomto případě byl však rozdílný nález způsoben spíše rychlou dynamikou onemocnění.
Léčba disekce spočívá především v prevenci distální embolizace [9,10]. V případě naší pacientky léčba kopíruje historický vývoj: od dříve preferované dlouhodobé antikoagulační léčby bylo téměř upuštěno, protože mezi antikoagulační a protidestičkovou léčbou nebyl v jejich účinnosti prokázán rozdíl [11– 13]. Antikoagulační léčba je přitom spojena s vyšším rizikem hemoragických komplikací. V případě rychlého vývoje stenózy s hemodynamickým mechanizmem cerebrální ischemie, hrozící okluze nebo recidivujících příznaků cerebrální ischemie i přes adekvátní farmakoterapii, je na zvážení PTAS [9]. Proto byla nemocná zajištěna s předstihem duální protidestičkovou terapií (nízká dávka nízkomolekulárního heparinu byla použita pouze jako prevence tromboembolické nemoci). Neexistuje jednoznačně definované kritérium, podle kterého by bylo možné nebo nutné indikovat endovaskulární ošetření, a tato indikace záleží na konkrétní situaci, především rychlosti vývoje stenózy a její lokalizaci.
Při DSA byla u naší pacientky současně diagnostikována FMD. Jde o onemocnění, při kterém dochází k deformaci tepny při abnormním vývoji její stěny. Důsledkem může být jak zúžení cévy, tak tvorba výdutí, případně obojího. Méněcenná cévní stěna je náchylnější k poranění a jde o typický preexistující faktor, který může vést ke vzniku disekce ať už spontánnímu nebo po banálním mechanickém inzultu. Nejčastěji jsou postiženy renální a mozkové tepny [14]. Přestože onemocnění bylo popsáno již v roce 1938 [15], příčina FMD není dosud známa. Pravděpodobně jde o kongenitální onemocnění – přibližně 10 % nemocných má postiženého příbuzného, ale sledování penetrace v rodině postižených jedinců běžným klinickým vyšetřením není možné, protože onemocnění je často asymptomatické. V jedné ze studií byl fenotyp posuzován podle postižení pojivové tkáně z kožní biopsie. Sestavený rodokmen tří rodin naznačoval autozomálně dominantní přenos, avšak konkrétní genová mutace nebyla určena, lokus je zřejmě heterogenní [16]. Postiženo je až 6 % populace [17]. Při dlouhodobé klinické studii, ve které byla zdravým dárcům ledviny prováděna renální angiografie, byl abnormní nález u 3,8 % (incidence je však vyšší, protože podobně jako u naší pacientky dochází i k izolovanému postižení jiných než renálních tepen) [18].
Klasifikace onemocnění není jednotná. Při postižení renálních tepen je možné onemocnění rozdělit do čtyř skupin [19]:
- Fibroplazie médie, nejčastější typ charakterizovaný tvorbou aneuryzmat s průměrem přesahujícím průsvit tepny a benigním, zpravidla asymptomatickým průběhem.
- Perimediální fibroplazie, pro kterou je rovněž typická tvorba aneuryzmat, ta ale svou velikostí nepřekračují průsvit postižené tepny. Obvyklá je rychlejší progrese, endovaskulární léčba je naštěstí efektivní.
- Hyperplazie médie charakterizovaná hladkým ohraničeným zúžením. I tento typ je dobře léčitelný angioplastikou.
- Fibroplazie intimy je charakteristická krátkými hladkými zúženími, která nelze při angioplastice dilatovat.
Pokud uvedenou klasifikaci srovnáme s nálezem DSA u naší nemocné, nejvíce se obraz podobá fibroplazii médie, odpovídající je i benigní průběh. K plánované biopsii, která by umožnila verifikaci postižení, se pacientka bohužel nedostavila.
Závěr
Disekce mozkových tepen je nejčastější příčina cerebrální ischemie u mladých pacientů. Samo o sobě však postižení tepny může probíhat benigně nebo zcela asymptomaticky i přes případný vývoj okluze. Na druhou stranu je v těchto případech obtížnější diagnostika, protože nelze jednoduchým způsobem odlišit rozsáhlou skupinu pacientů s cervikogenními bolestmi a různými vágními obtížemi. Přestože nelze vždy určit bezprostřední příčinu disekce, častá je souvislost s vrozeným onemocněním pojiva, např. FMD, jako v případě naší pacientky. Případné orgánové komplikace vznikají buď na podkladě mikroembolizace nebo hemodynamickým mechanizmem při vývoji stenózy či okluze tepny – riziko embolizace lze snížit antikoagulační nebo protidestičkovou léčbou, progredující stenózu lze však ošetřit pouze angioplastikou se zavedením stentu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Na http://www.csnn.eu naleznete anglickou verzi tohoto článku.
prof. MUDr. Roman Herzig, Ph.D., FESO, FEAN
Komplexní cerebrovaskulární centrum
Neurologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: herzig.roman@seznam.cz
Přijato k recenzi: 29. 11. 2016
Přijato do tisku: 8. 2. 2017
Zdroje
1. Schievink WI. Spontaneous dissection of the carotid and vertebral arteries. N Engl J Med 2001;344(12):898– 906. doi: 10.1056/ NEJM200103223441206.
2. Biller J, Sacco RL, Albuquerque FC, et al. Cervical arterial dissections and association with cervical manipulative therapy: a statement for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2014;45(10):3155– 74. doi: 10.1161/ STR.0000000000000016.
3. Olin JW, Froehlich J, Gu X, et al. The United States Registry for Fibromuscular Dysplasia: results in the first 447 patients. Circulation 2012;125(25):3182– 90. doi: 10.1161/ CIRCULATIONAHA.112.091223.
4. Kwon JY, Kim NY, Suh DC, et al. Intracranial and extracranial arterial dissection presenting with ischemic stroke: Lesion location and stroke mechanism. J Neurol Sci 2015;358(1– 2):371– 6. doi: 10.1016/ j.jns.2015.09.368.
5. Brandt T, Grond-Ginsbach C. Spontaneous cervical artery dissection: from risk factors toward pathogenesis. Stroke 2002;33(3):657– 8.
6. Grau AJ, Brandt T, Buggle F, et al. Association of cervical artery dissection with recent infection. Arch Neurol 1999;56(7):851– 6. doi: 10.1001/ archneur.56.7.851.
7. Pezzini A, Del Zotto E, Archetti S, et al. Plasma homocysteine concentration, C677T MTHFR genotype, and 844ins68bp CBS genotype in young adults with spontaneous cervical artery dissection and atherothrombotic stroke. Stroke 2002;33(3):664– 9. doi: 10.1161/ hs0302.103625.
8. Bar M, Školoudík D, Hradílek P, et al. Spontánní disekce vnitřní karotidy. Neurol Praxi 2002;3(2):97– 100.
9. Kernan WN, Ovbiagele B, Black HR, et al; American Heart Association Stroke Council, Council on Cardiovascular and Stroke Nursing, Council on Clinical Cardio-logy, and Council on Peripheral Vascular Disease. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/ /American Stroke Association. Stroke 2014;45(7):2160– 236. doi: 10.1161/ STR.0000000000000024.
10. Škoda O, Herzig R, Mikulík R, et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016;79/ 112(3):351– 63. doi: 10.14735/ amcsnn2016351.
11. CADISS trial investigators, Markus HS, Hayter E, Levi C, et al. Antiplatelet treatment compared with anticoagulation treatment for cervical artery dissection (CADISS): a randomised trial. Lancet Neurol 2015;14(4):361– 7. doi: 10.1016/ S1474-4422(15)70018-9.
12. Schwartz NE, Vertinsky AT, Hirsch KG, et al. Clinical and radiographic natural history of cervical artery dissections. J Stroke Cerebrovasc Dis 2009;18(6):416– 23. doi: 10.1016/ j.jstrokecerebrovasdis.2008.11.016.
13. Lyrer P, Engelter S. Antithrombotic drugs for carotid artery dissection. Cochrane Database Syst Rev 2010;(10):CD000255. doi: 10.1002/ 14651858.CD000255.pub2.
14. Poloskey SL, Olin JW, Mace P, et al. Fibromuscular dysplasia. Circulation 2012;125(18):e636– 9. doi: 10.1161/ CIRCULATIONAHA.111.090449.
15. Leadbetter WF, Burkland CE. Hypertension in unilateral renal disease. J Urol 1938;39:611– 26.
16. Wiest T, Hyrenbach S, Bambul P, et al. Genetic analysis of familial connective tissue alterations associated with cervical artery dissections suggests locus heterogeneity. Stroke 2006;37(7):1697– 702. doi: 10.1161/ 01.STR.0000226624.93519.78.
17. Blondin D, Lanzman R, Schellhammer F, et al. Fibromuscular dysplasia in living renal donors: still a challenge to computed tomographic angiography. Eur J Radiol 2010;75(1):67– 71. doi: 10.1016/ j.ejrad.2009.03.014.
18. Cragg AH, Smith TP, Thompson BH, et al. Incidental fibromuscular dysplasia in potential renal donors: long-term clinical follow-up. Radiology 1989;172(1):145– 7. doi: 10.1148/ radiology.172.1.2662248.
19. Peregrin J, Bürgelová M. Renovaskulární onemocnění – klinický obraz, diagnostika a terapie. Intern Med 2009;11(6):267– 71.
Štítky
Dětská neurologie Fyzioterapie Neurochirurgie Neurologie Rehabilitační a fyzikální medicína AlgeziologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2017 Číslo 4
Nejčtenější v tomto čísle
- Český národní registr Guillainova-Barrého syndromu
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
